서 론
해조류는 약 36,000여 종이 전 세계각지에 분포하고 있고 우리나라에는 약 1,000여 종의 해조류가 서식하고 있는 것으로 추정하고 있으며 동아시아 국가를 중심으로 생태학적 측면과 경제적 측면에서 중요한 해양생물 자원으로 인식되어 해조류에 대한 증식과 활용 방안에 관한 연구가 활발히 진행되고 있다. 해조류는 열량이 매우 낮으면서 다양한 무기질과 식이섬유 및 아미노산 등이 풍부하고 육상식물에는 없는 점질성 다당류를 다량 함유하고 있어(1) 한국과 일본에서는 식용으로 사용하고 있지만 미국과 유럽 등지에서는 주로 동물 사료로 사용되고 있다. 최근에는 해조류의 다양한 생리활성이 밝혀지면서 인체에 유용한 기능성 식품으로 개발하고자 하는 노력이 기울어지고 있다(2).
기능성 다당류의 일종인 푸코이단은 갈조류에서 1913년 Kylin에 의해 처음 분리된 후(3) 성게, 해삼과 같은 해양 유래 무척추동물에도 푸코이단이 함유되어 있는 것으로 밝혀졌다(4). 주로 갈조류에 함유되어 있는 푸코이단은 세포벽의 구성성분으로 열수나 산 용액에 용해되는 것으로 보고되었다(5). 푸코이단은 함황 다당류로서 L-fucose을 기본 구성당으로 α(1→2) 결합된 α-L-fucose- 4-sulfate의 기본 골격과(6), mannose, glucose, galactose, xylose, glucuronic acid, rhamnose 등이 결합된 구조이다. 일반적으로 푸코이단은 L-fucose의 에스테르화 황산을 주성분으로 glucuronic acid를 함유한 U-푸코이단, 황산 fucose로 구성된 F-푸코이단, 그리고 galactose를 함유한 G-푸코이단으로 구분되며(7) 종에 따라서 α(1→2) 대신 α(1→3) 결합 또는 α(1→3) 및 α(1→4) 결합이 복합적으로 존재하는 경우도 있다(8). 해조류 유래 푸코이단은 항염증, 항산화, 항균, 항응고, 항당뇨, 세포사멸 활성 등과 같은 다양한 생리활성이 있는 것으로 보고되고(9-12) 있는 반면, 푸코이단의 추출 조건 확립과 구조 및 이를 구성하는 단당류 조성에 관한 국내 연구는 미비한 실정이다. 푸코이단의 다양한 기능성에도 불구하고 해조류 유래 푸코이단의 구조 및 조성은 명확하게 규명되어 있지 않다. 푸코이단의 생리활성에 영향을 미치는 요인으로는 푸코이단의 단당류의 조성 구조, 구성성분 등이 있으며 최근 몇몇 연구들에 따르면, 푸코이단의 구성성분 중 황산기의 함량이 생리활성과 관련이 있는 것으로 제기되고 있는 수준에 불과하다. 이에 따라 해조류로부터 생산된 푸코이단에 대한 단당류 조성 등의 기본 정보를 제공할 수 있는 분석법과 이를 활용한 품질관리 기준 마련이 시급하다.
단당류는 매우 유사한 구조의 다수 동족체로 존재하고 다양한 형태의 올리고당과 다당류 및 당단백질 형태로 존재하기 때문에 단당류 분석은 필연적으로 고분해능의 분리 분석이 요구된다. 단당류는 화학구조적 특징으로 수십 ppm 이하의 농도 검출이 불가능하나 특정 시약과 단당류와 적정 조건에서 반응시켜 유도체화함으로서 검출감도 등의 분리분석 효율을 향상시킬 수 있다. Honda 등(13)은 비교적 낮은 온도 조건에서 3-methyl-1-phenyl-5-pyrazolone(PMP)이 단당류과 반응하여 250 nm에서 강한 자외선 흡수를 갖는 고감도의 유도체를 생성한다고 보고하였고 PMP를 이용한 유도체화 방법은 초기에 HPLC를 이용한 단당류 분석으로 적용되었으며 이후 모세관 전기영동에 성공적으로 적용 확대되기도 하였다(14,15).
한편, 갈조식물문(phaeophyta)의 모자반과(Sargassaceae) 모자반속(Sargassum)에 속하는 괭생이모자반(Sargassum horneri (Turner) C. Agardh)은 동아시아 지역에 폭넓게 분포되어 있는 식용 해조류이다. 괭생이모자반(S. horneri)은 한국, 일본 및 중국 연안에 폭넓게 분포하는 종으로 해류를 타고 이동하는 부유성 해조류로 알려져 있다(16,17). 최근 중국 저장성의 해양경제혁신발전구역 조성으로 괭생이모자반 양식증대사업이 추진되는 가운데 자연 조락 및 풍랑으로 인해 암반에서 탈락된 괭생이모자반이 해류와 북서계절풍의 기류를 따라 우리나라 남해안과 제주지역으로 대량 유입되고 있는 실정이다(18). 이에 괭생이모자반 유래 푸코이단에 대한 기능성 규명 등 식품 산업적 활용가치를 극대화하기 위한 노력이 추진되고 있다.
본 연구에서는 해조류 유래 푸코이단의 단당류 조성 분석을 위한 PMP 유도체화와 UPLC-DAD-TOF/MS 분석법 적용을 검토하였고 이를 바탕으로 괭생이모자반 유래 푸코이단의 구성 단당류 조성과 함량을 확인하였으며 향후 기능성 식품 소재 개발 등에 필요한 기초자료를 제공하고자 하였다.
재료 및 방법
시료는 2017년 5월 완도에서 수거한 괭생이모자반(S. horneri) 건조물을 구입하여 사용하였으며 5-10 cm로 절단한 후 건물 기준으로 40배수의 정제수를 이용하여 불린 후 30 min 동안 삶아 이물질 등을 제거한 다음 50℃에서 열풍건조하였다. 이때 수분 함량은 5% 이하로 확인하였고 건조된 시료는 분쇄기(Blender 8010S, Waring Conair Co., Ltd., Stamford, CT, USA)를 이용하여 분쇄 및 균질화 후 밀봉하여 상온의 진공 제습기에 보관하면서 사용하였다. 괭생이모자반 추출물은 Kim 등(19)과 Yoon 등(20)의 추출용매 및 온도조건을 참고하여 90℃에서 4시간 동안 열수추출하고, 고형분 함량이 20% Brix가 되도록 감압농축(Evaporator, CEP-LABO, Okawahara, Japan) 한 다음 분무건조(Spray dryer, HKC-100-DJ, Niro, Denmark)한 것을 열수추출물로 사용하였다.
본 연구에 사용한 PMP 등의 시약과 용매는 특급시약(extra pure grade)과 HPLC급으로 Sigma-Aldrich Co., Ltd.(St. Louis, MO, USA), Burdick and Jackson Laboratories(Muskegon, MI, USA)에서 구입하였으며, 정제수는 초순수k 제조장치(Arium comport I, Sartorius, Germany)에서 얻은 resistivity 18.2 MΩ·cm, TOC 2 ppb 이하의 ultrapure water grade를 사용하였다. 단당류의 확인 및 정량 분석은 mannose, rhamnose, glucuronic acid, glucose, galactose, xylose 및 fucose 표준물질을 혼합한 후 정제수로 용해하여 10,000 μg/mL의 표준원액을 조제하고 이를 10-500 μg/mL의 농도범위로 희석한 것을 혼합표준용액으로 사용하였다. PMP 유도체 시액은 유도체화 반응 전에 methanol로 용해하여 0.5 M PMP-MeOH로 조제하였다.
푸코이단의 가수분해는 Fu와 Oneill(14)의 방법에 따라 건조 괭생이모자반 0.1 g에 2 M trifluoroacetic acid(TFA) 10 mL를 가하여 밀봉하여 100℃에서 120 min 동안 가열한 후 실온에서 방냉하였다. 분해를 마친 시료는 0.45 μm PTFE membrane syringe filter(Whatman International, Maidstone, UK)으로 여과한 후 2 M sodium hydroxide(NaOH)를 이용하여 pH 7로 조정한 다음 시료 총량이 30 mL이 되도록 정용하였다.
가수분해된 단당류와 PMP 유도체 반응은 Honda 등(15)의 방법에 따라 가수분해 시료 2 mL를 취하여 0.5 M PMP-MeOH 용액과 0.3 M NaOH 용액 각 2 mL 씩 첨가하여 교반한 다음 70℃로 미리 가열된 수욕조에서 30 min 동안 반응시킨 후 실온에서 방냉하였다. 이후 0.3 M HCl 2 mL를 첨가하여 고형물이 형성될 때까지 약 1 min 동안 교반하고 chloroform 4 mL를 가하여 진탕한 다음 20℃, 1,500 rpm으로 15 min 동안 원심분리하여 PMP-유도체화물 이외 성분을 제거하였으며 수상의 상등액을 0.45 μm PTFE membrane syringe filter로 여과 후 UPLC-DAD로 분석하였다. Fucose 등의 혼합표준용액도 동일 방법으로 처리하여 괭생이모자반 유래 푸코이단의 단당류의 조성 및 함량을 확인하였다.
해조류 유래 다당류의 단당류 조성 및 함량 확인을 위해 가수분해 후 유도체화물(derivatives)인 PMP-sugars을 다중파장 검출기(photodiode array detector, PDA)가 장착된 UPLC(Nexera XR, Shimadzu, Kyoto, Japan)와 UPLC-ESI-TOF/MS(LCMS-IT-TOFⓇ, Shimadzu)를 이용하였다. 분석 컬럼은 Capcell Core C18(2.1 mm I.d.×150 mm L, 2,7 um, Shiseido, Tokyo, Japan)을 사용하였고 이동상은 100 mM ammonium acetate(A)와 acetonitrile(B)을 80:20% (v/v)의 등 용리 조건으로 설정하고 유량은 0.2 mL/min로 하였다. 이때 이동상의 pH는 4-7 범위의 조건에서 각 PMP-sugars의 분리 특성을 확인하여 최적의 조건을 검토하였다. 컬럼 온도는 35℃를 유지하고 시료는 5 μL를 주입하였다. 검출파장은 다중 파장으로 200-600 nm 범위로 설정하였고 분리분석된 PMP-sugars의 UV 스펙트럼를 확인하여 최대 흡수파장(wavelength of maximum absorption, λmax)으로 크로마토그램을 나타내었다. 질량 분석은 전기분무화 이온화(electrospray ionization, ESI)를 이용하였으며 positive ion mode로 분석하였다. ESI capillary의 전압은 4.5 kV, nebulizing gas(N2)와 drying gas는 각각 1.5 L/min과 150 kPa로 설정하였다. CDL과 block heater는 200℃로 설정하였고, 데이터 수집 시간은 0.3 min(event time 300 msec, repeat 3, ion accumulation 10 msec)으로 하였다. 질량분석 범위는 m/z 100-1,000으로 설정하였다. 질량 분석 결과는 shimadzu사의 LCMS solution(ver. 3.60)과 accurate mass calculator 전용 소프트웨어인 formula predictor(ver. 1.2)를 활용하여 해석하였으며, TOF(time of flight) 질량 분석기는 주기적인 tune 실행으로 ±0.005 Da 이하의 질량 정확도(mass accuracy)를 유지하면서 본 실험을 수행하였다.
본 연구에서는 유효성 검증을 위해 직선성(linearity), 정밀성(precision), 정확성(accuracy), 검출한계(limit of detection, LOD) 및 정량한계(limit of quantitation, LOQ)를 확인하였다. 특이성은 가수분해 및 유도체화의 과정을 거친 혼합표준용액과 괭생이모자반 추출물 시료를 대상으로 UPLC로 분석하여 각 성분이 선택적으로 분리되었는지 확인하였으며 크로마토그램상의 tR과 UV 및 mass spectrum의 일치 여부를 비교, 확인하였다. 직선성은 혼합표준용액을 단계적으로 일정농도로 희석하여 3회 반복 측정한 후 검량선을 작성하여 검량식과 상관계수(correlation coefficient, r2)를 산출하여 확인하였다. 정밀성은 일내(intra-day) 반복 분석을 통해 상대표준편차(relative standard deviation, % RSD)를 산출하여 확인하였고, 정확성은 공시료에 일정 농도로 조제된 혼합표준용액을 가하고 동일 전처리 과정를 거친 시료를 대상으로 회수율(recovery)을 확인하였다. 검출한계와 정량한계는 검량선의 기울기와 표준편차를 이용하여 다음 식과 같이 산출하였다.
결과 및 고찰
푸코이단은 전통적으로 Dische법으로도 알려져 있는 자외선-가시광선 분광광도계를 이용한 비색법(21)으로 정량 분석하였으나 정확성과 재현성 등에 한계가 있다. 푸코이단과 이를 구성하는 단당류는 화학구조상 전자전이와 발색단이 존재하지 않아 자외선을 흡수에 의한 저농도 분석이 불가능하여 HPLC의 시차 굴절율 검출기(differential refractive index detector, RID)나 휘발성 화합물로 유도체화한 기체 크로마토그래피법에 의해 분석(22)하였으나 낮은 감도와 유도체화물의 안정성이 떨어지는 문제가 있다. 이에 Honda 등(13)에 의해 고안된 PMP 유도체화법을 토대로 UPLC-DAD(-ESI)-TOF/MS 분석법을 적용하여 해조류 유래 푸코이단의 단당류 조성을 확인하기 위한 PMP-sugars 분리 특성을 검토하였다.
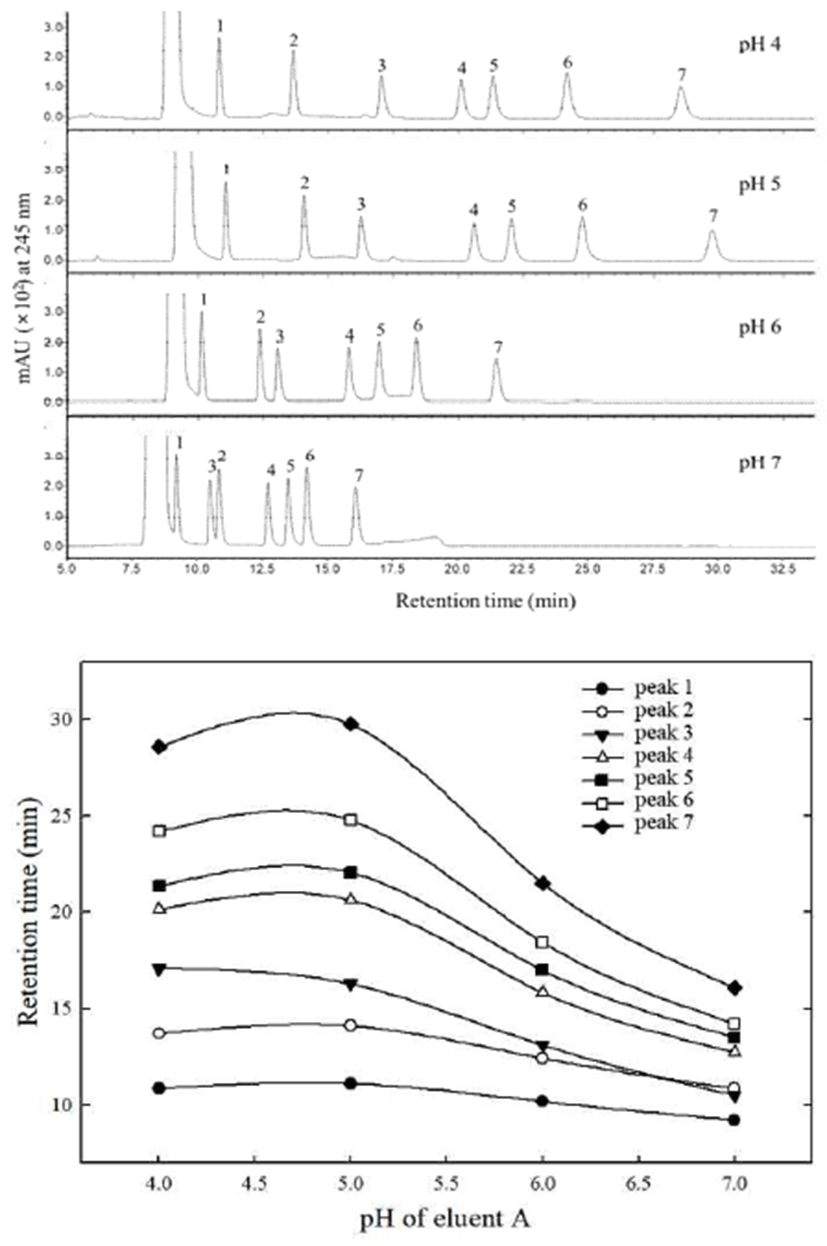
PMP 유도체화 방법은 desialylation 또는 desulfation이 일어나지 않는 비교적 낮은 온도 조건에서 단당류와 결합된 bis-PMP 유도체화물(PMP-sugars)이 염기성 수용액에서 약한 음이온의 성질을 띠고, 245 nm(ε=30,000 L·mol-1·cm-1)에서 최대 흡광이 일어나 전기화학적 검출이 가능한 것으로 보고되었다(23). 이에 본 연구에서는 가수분해된 괭생이모자반 원물과 혼합표준용액을 PMP 유도체화 반응 후 UPLC-DAD에 의해 분석하였으며, PMP-sugars로 각각 분리된 peak에 대해 200-600 nm 범위에서 UV 스펙트럼을 확인한 결과, λmax는 245 nm로 나타나 Suzuki와 Honda(23)의 결과와 일치하는 것으로 확인되었다. PMP-sugars에 대하여 UPLC를 이용한 분리조건을 Rao 등(24)의 방법을 적용하였으나 PMP-galactose(PMP-Gal), -xylose(-Xyl) 및 -fucose(-Fuc)가 분리되지 않았고 PMP-sugars의 꼬리끌림 현상(peak tailing)이 일어나 이동상의 조성과 용리 조건(elution mode)을 재설정하였다. 이동상으로 100 mM ammonium acetate(A)와 acetonitrile(B) 혼합용매의 비율을 달리하며 PMP-sugars의 머무름 시간(retention time, tR)을 비교하였다. 그 결과, 초기 10%(v/v) acetonitrile로 5 min 동안 유지한 후 20%(v/v) acetonitrile로 상승시켜 일정 시간 동안 유지하였을 때 잔류 PMP 피크의 간섭 영향을 받지 않고 PMP-sugars의 분리능(resolution)이 1.5 이상으로 나타났다(Fig. 1). 또한 PMP-sugars의 분리에 대한 이동상의 pH의 영향을 관찰하였는데 pH 증가에 따라 tR은 감소하는 경향으로 나타났고, pH 7 이상에서 PMP-rhamnose와 PMP-glucuronic acid의 용출 순서가 역전되는 것으로 확인되었다(Fig. 2).
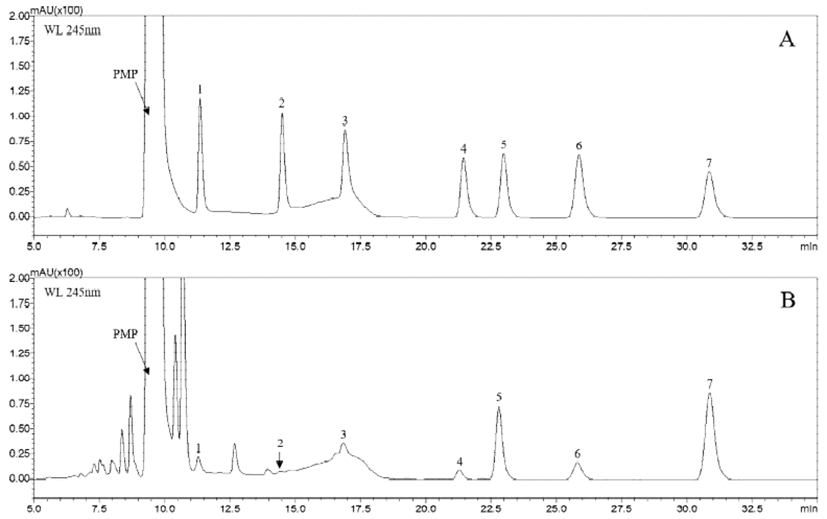
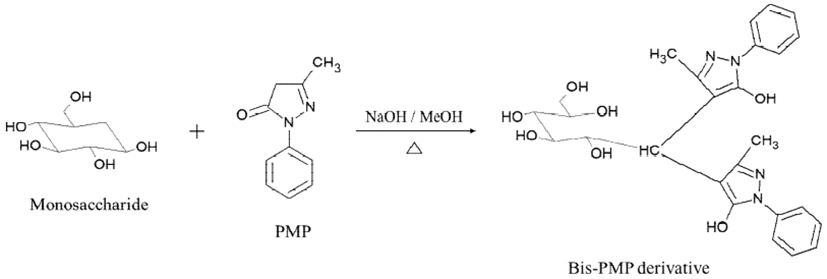
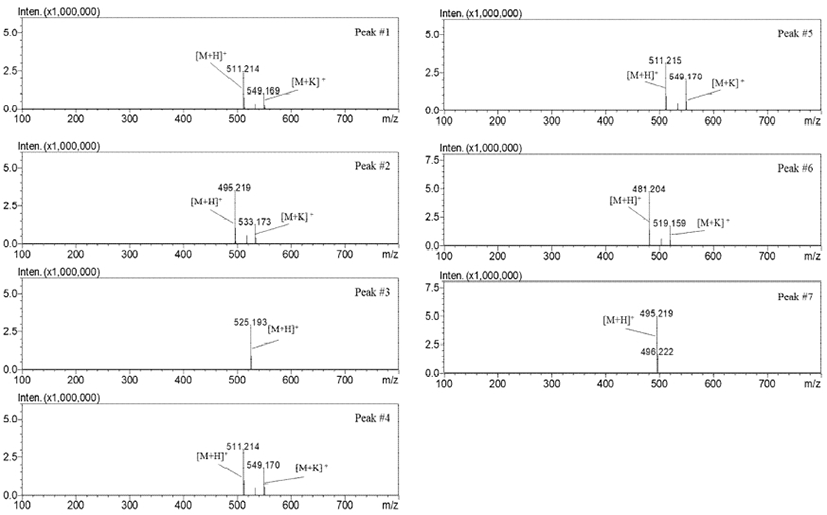
UPLC에 의해 분리된 개별 PMP-sugars 성분은 ESI-TOF/MS를 이용하여 positive ion mode에서 분석하였고 질량 스펙트럼(mass spectrum)의 molecular ion peak의 이온 패턴 특성을 고려하여 동정하였다(Table 1). PMP-sugars는 [M+H]+과 [M+K]+의 이온 형식으로 나타났으며 fucose 등의 aldose와 ketose 형식의 다당류 모두 carbodiimide(RN=C=NR)와 축합반응에 의해 결합된 bis-PMP 유도체화물(Fig. 3)(13)로 확인되어 PMP 유도체화 반응이 해리(dissociation)되지 않고 안정적으로 분석되는 것을 확인하였다. Peak 1, 4 및 5는 m/z 510.2187, [M+H]+과 m/z 549.1746, [M+K]+의 모분자 이온(molecular ion)이 동일하게 확인되었으며 구조적 차이에 따라 aldohexose인 mannose, glucose 및 galactose peak의 용출시간이 차이가 나는 것으로 나타났다. Peak 2, 7은 m/z 495.2238, [M+H]+의 molecular ion이 검출되어 methyl pentose로 rhamnose(6-deoxy-L-mannose)와 fucose(6-deoxy-L-galactose)로 확인하였다. Peak 3은 m/z 525.1980, [M+H]+이 검출되어 glucuronic acid로 동정되었다. 특히 glucuronic acid는 glucose에서 유도되는 당산(sugar acid)의 일종인 hexuronic acid으로서 해조류 등의 구조다당류의 구성성분으로 존재하는 것으로 알려져 있다. 또한 peak 6은 m/z 481.2028, [M+H]+와 m/z 519.1640, [M+K]+의 molecular ion이 검출되어 aldopentose 일종인 xylose으로 동정하였다(Fig. 4).
괭생이모자반 푸코이단의 구성 단당류의 조성 및 함량 확인을 위한 UPLC-DAD 분석법 유효성 검증 결과는 Table 2과 같이 나타났다. Mannose 등 6종의 당류의 혼합표준용액을 10-500 mg/L의 범위로 단계적으로 희석한 후 유도체화 후 UPLC로 분석하여 각 당류의 검량선을 작성하고 상관계수(r2)를 산출하여 직선성을 확인하였다. PMP-sugars으로서 mannose, rhamnose, glucuronic acid, glucose, galactose, xylose 및 fucose의 r2은 0.9999 이상으로 모두 우수한 직선성을 나타내었다. 정밀성은 괭생이모자반 열수추출물 시료를 대상으로 1일 5회 반복 분석하였고 그 결과, 각 피크 면적의 상대표준편차(% RSD)는 0.03-0.63%으로 나타나 AOAC 가이드라인(25) 기준인 1%이하에 충족하였다. 정확성은 회수율을 측정하여 나타내었다. 괭생이모자반 추출물 시료에 20, 50 100 mg/L의 혼합표준용액을 첨가하여 UPLC로 분석하고 검량선에 근거하여 회수되는 시료 양을 백분율로 계산하여 회수율을 산출하였다. 각 당류의 첨가된 표준농도에 따라 mannose의 회수율은 98.45-108.21%으로 나타났고 rhamnose 97.32-101.31%, glucuronic acid 89.21-97,87%, glucose 92.76-103.56%, galactose 98.56-106.21%, xylose 94.53-109.76% 그리고 fucose 97.11-105.21%로 확인되어 AOAC 가이드라인(25)인 70-125% 미만에 모두 충족하였다. 검출한계와 정량한계는 의약품 등 시험법 밸리데이션 가이드라인(26)의 반응의 표준편차와 검량선의 기울기에 근거하는 방법으로 계산하였다. 각 당류 검출한계는 0.76-2.13 mg/L였으며, 정량한계는 2.31-6.46 mg/L로 나타났다. 이와 같은 분석법의 유효성 검증을 통해 전처리 방법을 포함한 상기 UPLC 분석법을 이용한 해조류 유래 푸코이단의 당류 조성 확인 분석 결과의 신뢰성을 확보할 수 있었다. 일반적으로 유도체화 방법을 선택할 때 column 분리 전후 목적성분에 대한 추가적인 전처리, 최적의 반응시간, 고가의 시약 소모, 반응온도 및 반응 부산물 생성 등 분석에 영향을 미칠 수 있는 요소들을 고려하여야 한다. 또한 각 분석물질에 대한 유도체 화합물 형성여부와 함께 높은 수율, 재현성 및 안전성에 고려도 중요한 요소 중 하나이다(27). Honda 등(13)이 고안한 PMP 유도체화 반응을 적용한 UPLC-DAD-TOF/MS 분석법은 유도체화 시약의 분해와 반응 부산물 생성 등, 분석에 영향을 미칠 수 있는 요소가 거의 없어 안정적으로 해조류의 푸코이단의 당류 조성과 그 함량을 확인할 수 있었다.
괭생이모자반(S. horneri)은 한국, 일본 및 중국 연안에 폭넓게 분포하고 있으며, 바다숲 조성과 해양환경 복원에 있어 중요한 수산자원이며, 푸코이단 등 기능성 다당류가 풍부하여 식품 산업적으로 활용가치가 있다. 일본의 경우, 종묘생산 및 양식 기술개발이 활발하며 각종 조리과정의 식용재료로 사용되고 있다. 국내의 경우 2016년 5월 식약처에 괭생이모자반을 식품 원료로 등재하였고 최근 괭생이모자반을 활용한 기능성 식품 소재 개발에 관한 연구가 활발하다. 더불어 괭생이모자반의 기능성 규명과 함께 기능성 다당류인 푸코이단의 구조 결정과 분석법에 대한 연구도 대두되고 있으나 현재까지 해조류의 푸코이단의 추출 및 분석방법에 대한 공인분석법이 명확하지 않은 실정이다. 이에 괭생이모자반 유래 푸코이단의 구조 결정에 앞서 본 연구에서 분석법 유효성 검증에 의해 분석결과의 신뢰성을 확보하였고 PMP-유도체화와 UPLC 분석법을 이용하여 괭생이모자반 유래 푸코이단의 당류 조성과 각 함량을 분석하였다. 시료는 괭생이모자반 건조원물과 정제수를 이용하여 90℃에서 4시간 동안 열수추출 후 감압농축과 동결건조한 괭생이모자반 추출물을 조제하여 푸코이단의 구성 당류조성을 확인하였다. 본 실험에 앞서 가수분해하지 않는 괭생이모자반 건조원물과 추출물을 공시료로써 유도체화 후 UPLC로 분석한 결과 당류가 검출되지 않아 유리당 형태의 당류는 시료내 존재하지 않는 것을 확인하였다(data not shown). 괭생이모자반 건조원물과 추출물을 가수분해 및 유도체화 후 UPLC로 분석한 결과는 Table 3와 같이 나타났다. 괭생이모자반 유래 푸코이단의 함량은 구성 단당류를 합한 총량은 건조원물 54.63 mg/g, 열수추출물 172.31 mg/g으로 확인되었다. Fucose와 galactose 순으로 건조원물과 열수추출물 모두에서 가장 많은 함량을 보였으며, 이는 Percival 등(7)의 갈조류의 푸코이단이 fucose와 galactose가 주성분으로 결합된 구조인 것으로 보고된 내용과 일치한 결과를 보였다, 이외 fucose, galactose를 제외한 xylose외 단당류의 구성은 괭생이모자반 원물과 열수추출물 간의 푸코이단을 구성하는 단당류의 함량이 상이한 것으로 나타나 향후 이와 관련된 추가 연구가 필요할 것으로 사료된다. 모자반 종류에 따라 푸코이단의 구성 단당류인 fucose의 함량이 Ale 등(28)에는 26-76%, Duarte 등(29)에서는 35-67.8%으로 보고되었고 이외 단당류의 함량에 대한 연구가 미비한 실정이다. 본 연구에서 수행한 괭생이모자반 건조시료, 열수추출물에서는 fucose의 함량은 51.55%, 59.09%으로 나타났다.
1)Man, mannose; Rha, rhamnose; Glc A, glucuroic acid; Glc, glucose; Gal, galactose; Xyl, xylose; Fuc, fucose.
향후 명확한 괭생이모자반 푸코이단의 구조 해석에 관한연구가 필요 할 것으로 사료되며, 본 연구에 확립된 분석법이 해조류 활용한 기능성 식품 개발에 기여할 수 있을 것으로 기대된다.
요 약
본 연구는 국내 남해안 일대와 제주지역으로 대량 유입되고 있는 괭생이모자반(S. horneri)유래 푸코이단의 단당류 조성 분석을 위한 PMP 유도체화와 UPLC-DAD-TOF/MS 분석법 적용을 검토하고 구성 단당류의 조성 및 함량을 확인하였다. 괭생이모자반의 푸코이단을 2M TFA를 이용하여 가수분해하고 이를 3-methyl-1-phenyl-5-pyrazolone(PMP)과 반응시켜 유도체화 하였다. 유도체화물인 PMP-sugars를 분리하기 위한 분석 조건으로 octadecyldimethylsilyl(ODS) column을 사용하고, 이동상은 암모늄 아세테이트 완충액과 아세토니트릴 혼합용매로서 pH 5.0을 최적조건으로 설정하였다. PMP-sugars의 검출은 UV 스펙트럼과 질량 스펙트럼의 확인을 통해 동정할 수 있었으며 특히, 질량 스펙트럼 확인 결과, [M+H]+과 [M+K]+의 이온 형식으로 carbodiimide(RN=C=NR)와 축합반응에 의해 결합된 bis-PMP 유도체화물로서 유도체화 반응이 해리되지 않고 안정적으로 분석되는 것을 확인하였다. 본 분석방법을 검증하기 위해 mannose 등 단당류 7종의 혼합표준용액을 이용하여 직선성, 정밀성, 회수율을 각각 측정하였다. 검량선의 상관계수는 0.9999 이상으로 우수한 직선성을 보였으며 LOD와 LOQ는 각각 0.76-2.13 mg/L과 2.31-6.46 mg/L으로 나타났다. 회수율은 89.21-109.76%이고 반복 정밀성으로 상대표준편차(% RSD)는 0.03-0.63%으로 나타나 AOAC 등의 기준규격에 적합한 것을 확인하였다. 본 시험법에 따라 괭생이모자반(S. horneri) 유래 푸코이단의 당류 조성과 함량을 분석하였으며 mannose, glucose, galactose, xylose, glucuronic acid, rhamnose, fucose으로 구성되어 있는 것을 확인하였다. Fucose의 함량이 푸코이단 구성 단당으로 50% 이상 함유되어 있는 것으로 나타났고, 괭생이모자반 원물과 열수추출물 간의 푸코이단을 구성하는 단당류의 함량이 상이한 것으로 확인되었다. 향후 괭생이모자반를 활용한 기능성 원료 개발을 위한 표준화와 규격화를 위한 기초자료서 크게 활용될 것으로 기대된다.
