Article
오레가노 종자 에탄올 추출물의 항산화 특성 및 유지 산화안정성에 미치는 영향
한창희, 김민아, 김미자*

Antioxidant properties and oxidative stability of oregano seed ethanol extract
Chang Hee Han, Min-Ah Kim, Mi-Ja Kim*

Department of Food and Nutrition, Kangwon National University, Samcheok 25949Korea
Copyright ⓒ The Korean Society of Food Preservation. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Oct 02, 2018; Revised: Nov 30, 2018; Accepted: Jan 03, 2019
Abstract
This study aimed to evaluate the antioxidant ability and inhibitory effects of oregano seed ethanol extract (OSEE). In vitro antioxidant assays including DPPH radical scavenging and ABTS cation radical scavenging were conducted, and, ORAC, total phenolic content, and FRAP value were determined. In addition, headspace oxygen, conjugated dienoic acid (CDA) value, and ρ-anisidine value (ρ-AV) for exploring oxidative stability were examined in an oil system with 100 ppm OSEE. The radical scavenging activities of 125 μg/mL OSEE using DPPH and ABTS were 84.6% and 32.2%, respectively. ORAC was significantly higher at a concentration of 100 μg/mL of OSEE as compared with the control without OSEE (p<0.05). The antioxidant ability of the sample was concentration dependent manner. Additionally, the total phenolic content and FRAP value of OSEE were 264.64 μg/mL tannic acid equivalent/g extract and 339.78 μg/mL ascorbic acid equivalent/g extract, respectively. CDA and ρ-AV were significantly reduced to 56.3% and 76.5%, respectively, in 7 h of oil oxidation in OSEE, as compared with the control oil. OSEE exhibited excellent in vitro antioxidant ability and oxidative stability in the oil matrix. Furthermore, the major volatile compounds of OSEE were limonene, linalool, o-cymene, thymol, α-pinene, and γ-terpinene. Therefore, it is evident that oregano seed can be used as a functional ingredient in the natural antioxidant market.
Keywords: oregano seed; ethanol extract; antioxidant; oxidation stability
서 론
식품에 존재하는 성분들 중 지방은 쉽게 공기 중의 산소, 빛, 열, 금속 등에 의해 산화되어 식품 고유의 품질을 떨어뜨리는 경우가 많아 지방 성분을 다량 함유하는 있는 가공식품들 예를 들어 마가린, 식용유지, 마요네즈, 소스, 캔 제품의 경우 품질 저하를 막기 위해 식품 산화방지제를 첨가하여 제품을 개발하고 있다. 특히 이러한 유지 함유 가공식품은 제조 과정 시 고온 가열로 인한 과산화물, 알데하이드 및 케톤 등의 물질들이 쉽게 생성되며(1), 140-200℃ 온도에서의 지속적인 가열은 유지의 자동산화를 가속화시켜 과산화물의 생성을 촉진하게 된다. 그러므로 이러한 유지를 함유한 가공식품 제조 시 식품 산화방지제를 첨가하는데 주로 BHA, BHT 등의 합성 산화방지제가 많이 이용되고 있다. 그러나 장기간 이러한 합성 산화방지제의 다량 섭취가 지방 대사의 불균형과 인체의 내장 조직에 발암을 일으킬 가능이 조심스럽게 제기되고 있어(2), 식품에 첨가 시 산화 방지능 외에도 항균, 항암 등의 기능을 가지는 인체에 무해한 천연물질을 이용한 식품 산화방지제 개발에 대한 관심이 증가하고 있는 추세이다(3).
식품뿐만 아니라 일반적으로 인체에서 빈번하게 발생되는 활성산소종(reactive oxygen species, ROS)은 체내에서 산화적 스트레스에 의해 지질, 단백질, DNA 등 인체 구성 성분에 영향을 미친다(4). 이러한 체내에 발생된 활성산소는 체내 산화 방지 시스템에 의해 제거되지만 제거와 생성의 불균형에 의해 제거되지 않은 활성산소종이 지나치게 과량 존재하게 됨으로써 세포에 산화적 손상을 일으킨다. 그뿐만 아니라 인체 질병 중 약 90%가 활성산소와 관련이 있다고 하며, 알려진 질환에는 주로 암, 동맥경화, 당뇨병, 뇌졸중, 심근경색, 간염, 신장염, 아토피성 피부염, 파킨슨병 등 노화 관련 질병을 포함한 다양하게 영향을 미치는 것으로 알려져 있다(5-7).
향신료는 예로부터 항균, 산화 방지, 항암, 혈압 강하, 혈청 콜레스테롤 농도 저하, 당뇨병 예방 및 노화 방지 등의 생리작용이 있으며(8-10), 비타민, 무기질이 풍부하고 소화, 수렴, 이뇨, 항균작용 등이 있어 영양과 건강증진에 도움을 준다고 알려져 있다(11). 향신료의 우수한 생리 활성은 alcohol, aldehyde, ester, terpene 및 유기산, 폴리페놀 화합물 등에서 기인하며, 이러한 생리활성물질은 추출 용매에 따라 추출 수율이 다를 뿐 아니라 항균효과, 산화 방지 활성 또한 달라지는 것으로 보고 되었다(12).
오레가노는 꿀풀과(Lamiaceae)에 속하는 허브식물로 독특한 향과 맛으로 관상용으로 재배될 뿐 아니라 요리에 향신료로 이용되고 있다. 오레가노로부터 추출한 essential oil은 항 미생물, 항종양 활성을 나타낼 뿐 아니라 에탄올 추출물을 경구투여 시 스트레스성 위염을 억제하는 항염증 효능을 나타내며(13), 항균, 항 돌연변이, 항산화 및 생리활성 효과가 있음이 밝혀졌다(14). 또한 오레가노 에탄올 추출물은 자유라디칼 산화 억제 및 지방질 과산화 억제 등에 강력한 산화 방지 효과를 나타낸다고 보고되었는데(15), carvacrol, tymol, pinterpinene 및 linalool이 오레가노에 함유되어 있어 강력한 항산화능을 가진다고 보고하고 있다(16).
이에 본 연구에서는 오레가노 종자 에탄올 추출물의 천연 산화방지제로서 사용 가능성을 탐색하기 위하여 산화 방지 활성 및 유지 산화 안정성 개선 효과를 in vitro 시스템과 식품 모델에서 평가하였다.
재료 및 방법
오레가노 종자 에탄올 추출물 제조
오레가노 종자는 터키산으로 100 g 당 10배의 80% 에탄올을 첨가하여 실온에서 진탕기(RS-1, JEIO TECH, Daejeon, Korea)를 이용하여 274 rpm 속도로 1시간 진탕한 후, 거름종이(Whatman No.4, Maidstone, England)로 여과한 후, 여액을 60℃ 수욕상에서 rotary vacuum evaporator(EYELA, Tokyo, Japan)로 용매를 제거하고 감압, 농축한 후 동결 건조하여 -20℃ 이하로 냉동 보관하면서 시료로 사용하였다.
2,2-Diphenyl-1-picrylhydrazyl(DPPH) 라디칼 소거활성
DPPH 라디칼 소거 활성은 Blois(17)의 방법에 따라 0.1 mM의 DPPH(Sigma-Aldrich Co., St. Louis, MO, USA) 용액 0.75 mL에 추출물을 31.25, 62.50, 125.00 μg/mL의 농도로 증류수에 희석한 시료를 각 0.25 mL씩 넣고 10초간 혼합하여 30분간 암실에서 반응시킨 후 UV/VIS spectrophotometer(Mega- U6000, Scinco, Seoul, Korea)를 이용하여 517 nm에서 흡광도를 측정하였다. DPPH 라디칼 소거 활성은 시료의 첨가 전과 후의 차이를 아래와 같이 백분율로 나타내었다.
Ac : 대조군의 흡광도
As : 시료의 흡광도
2,2'-Azino-bis(3-ethylbenzothiazoline-6-sulphonic acid)(ABTS) 양이온 라디칼 소거활성
ABTS 양이온 라디칼 소거 활성은 Re 등(18)의 방법에 따라 7 mM의 ABTS(Sigma-Aldrich Co.) 수용액과 2.45 mM potassium persulfate(Sigma-Aldrich Co.)를 1:1로 혼합하여 상온 암실에서 12시간 방치하여 ABTS 라디칼 양이온을 형성한 후 734 nm에서 UV/VIS spectrophotometer(Mega-U6000, Scinco)를 이용하여 흡광도가 0.700(±0.050)이 되도록 에탄올로 희석하여 사용하였다. 희석된 ABTS 용액 1.9 mL과 농도별 추출물 시료 0.05 mL를 가하여 혼합한 후 6분간 상온 암실에서 정치한 후 734 nm에서 흡광도를 측정하였다.
Ac : 대조군의 흡광도
As : 시료의 흡광도
Oxygen radical absorbance capacity(ORAC) 측정
ORAC 법은 Prior 등(19)의 방법에 의해 실험하였다. 시료 및 대조군의 희석과 시약의 제조는 75 mM phosphate buffer(pH 7.0)을 이용하였다. 2,2’azo-bis(2-amidino-propane) dihydrochloride(AAPH)(FUJIFILM Wako Pure Chemical Corporation, Osaka, Japan) 300 mM과 fluorescein 용액 0.1 mM, 시료를 각 2.5, 5, 10 μg/mL 농도로 75 mM phosphate buffer에 희석하여 사용하였다. 추출물의 농도별 시료, fluorescein 용액, AAPH를 5:15:5(v/v/v)의 비율로 96-well plate에 넣어 fluorescence microplate reader(GeminiXPS, Moleculardevice, Sanjose, CA, USA)를 이용하여 excitation 493 nm, emission 515 nm에서 40분간 매분 측정하였으며 대조군으로는 trolox(Sigma-Aldrich Co.)를 사용하였다. 결과는 시료 첨가군과 무첨가군의 커브면적(area under curve, AUC)을 측정한 후 μg/mL trolox equivalent/g으로 표기하였다.
Ferric reducing antioxidant power(FRAP) 환원력
FRAP 환원력은 Benzie와 Strain(20)의 방법을 변형하여 300 mM sodium acetate buffer(pH 3.6), 40mM HCl에 용해한 10 mM 2,4,6-tripyridyl-S-triazine(TPTZ)용액 및 20 mM FeCl3를 각각 10:1:1(v/v/v)의 비율로 혼합하여 37℃ 수조에서 10-15분간 평형시켜 FRAP 시약을 제조하였다. 농도를 다르게 만든 시료 각 0.03 mL와 FRAP 시약 0.9 mL를 혼합하여 30분간 반응시킨 후 593 nm에서 UV/VIS spectrophotometer(Mega-U6000, Scinco)를 이용하여 흡광도를 측정하였다. 시료의 FRAP 환원력은 ascorbic acid(Sigma-Aldrich Co.) 표준곡선으로부터 계산하였다.
총 페놀 함량 측정
총 페놀 함량(TPC)은 Folin과 Denis(21)법에 따라 농도 별로 희석한 시료 0.25 mL와 증류수 4 mL, 증류수와 1:1로 희석한 Folin-Denis 시약(Sigma-Aldrich Co.) 0.25 mL을 가한 용액을 3초간 혼합한 후 5분간 정치하였다. 혼합한 용액에 sodium carbonate(Sigma-Aldrich Co.) 0.5 mL을 가하여 혼합한 후 상온에서 30분간 정치하여 UV/VIS spectrophotometer(Mega-U6000, Scinco)를 이용하여 725 nm에서 흡광도를 측정하였다. 표준물질 tannic acid(Sigma-Aldrich Co.)를 이용하여 작성한 표준곡선으로부터 총 페놀 함량을 계산하였다.
휘발성 물질 추출 분리
불꽃이온화 검출기(flame ionization detector, FID)를 설치한 GC(Hewlett-Packard 6890, Agilent Technology, Palo Alto, CA, USA)를 이용하여 SPME fiber로 휘발성 물질을 분리하였다. SPME fiber는 65 μm polydimethylsiloxane/divinylbenzene(PDMS/DVB, Supelco, Bellefonte, PA, USA)을 사용하였으며, 고정상으로는 HP-5(30 m×0.32 m ID, 0.25 mm film, Agilent Technology) 칼럼을 사용하였다. 온도 조건은 초기에 40℃에서 2분간 방치하고 분당 6℃씩 최종 160℃로 증가시켰다. 주입기의 온도는 250℃, 검출기는 300℃로 설정하였으며, 운반 가스로는 질소를 이용하여 유속은 1.0 mL/min으로 설정하였다.
휘발성 성분 분석
GC-mass spectrometry(5971A, Agilent Technology)를 사용하여 휘발성 물질을 동정하였으며, 추출 조건은 GC-FID와 동일한 조건으로 사용하였다. 이동상으로는 헬륨가스를 사용하여 1.0 mL/min의 유속으로 흘려주었다. MS의 분석 조건은 70 ev, 220 ion source 온도를 사용하였으며, NIST 질량스펙트럼 라이브러리(mass spectra library)와 대조군의 머무름 시간(retention time)을 이용하여 휘발성분을 동정하였다.
오레가노 종자 에탄올 추출물 첨가 유지 제조
유지 시료는 오레가노 종자 에탄올 추출물의 고른 분산을 위해 dimethyl sulfoxide(DMSO)에 녹여 옥수수기름(Ottogi, Anyang, Korea)과 혼합하여 사용하였으며, DMSO가 산화 안정성에 영향을 미칠 수 있어 대조군 또한 DMSO를 첨가하여 실험하였다. 제조된 시료는 유지의 산화를 방지하기 위해 -20℃에서 보관하며 실험하였다.
Headspace oxygen 함량
Headspace oxygen 함량은 Kim 등(22) 방법에 따라 GC-TCD(Agilent Technology Inc., Santa Clara, CA, USA)를 사용하였다. 시료가 포함된 유지 1 g을 gas-tight vial에 취하여 100℃ 오븐(GISICO, Seoul, Korea)에서 6시간, 12시간, 18시간 산화시켜 사용하였다. Air-tight syringe로 20 μL의 headspace gas를 60/80 packed column(3.0 m×2 mm ID; Restek Ltd., Bellefonte, PA, USA)과 thermal conductivity detector(TCD)가 장착되어 있는 Hewlett-Packard 7890 gas chromatograph(Agilent Technology)에 주입하였다. 이동상인 헬륨 가스는 20 mL/min의 속도로 주입되었고, GC의 오븐, 주입구, 검출기의 온도는 각각 60, 180, 180℃로 설정하여 산소 함량 %로 나타내었다.
Conjugated dienoic acid(CDA) 가
추출물을 각 농도 별로 혼합하여 산화시킨 유지 시료 100 mg을 25 mL isooctane(Sigma-Aldrich Co.)으로 분산 및 적정 농도로 희석한 후 UV/VIS spectrophotometer(Mega-U6000, Scinco)를 이용하여 AOCS 법(23)에 의해 233 nm에서 흡광도를 측정하였다.
K0 : acid의 흡광도 계수(0.03)
A233 : 233 nm에서의 흡광도
b : cell의 길이(cm)
c : L당 시료의 무게(g)
ρ-Anisidine value(ρ-AV)
ρ-AV는 AOCS 법(24)에 의해 실시하였다. 시료를 4,000 ppm의 농도로 isooctane(Sigma-Aldrich Co.)에 분산시킨 시료 1 mL와 0.25% ρ-anisidine(Sigma-Aldrich Co.) 용액 0.2 mL를 넣고 혼합하여 15분간 암실에서 반응시킨 후 UV/VIS spectrophotometer (Mega-U6000, Scinco)를 이용하여 350 nm에서 흡광도를 측정하여 ρ-AV로 환산하였다.
통계처리
3회 반복 실험하여 얻은 결과는 SPSS program(SPSS Inc., Chicago, IL, USA)을 이용하여 평균±표준편차로 나타내었다. 유의성 검정은 t-test 및 one-way ANOVA로 분석하여 p<0.05 수준에서 Duncan’s multiple range test로 사후 검증하였으며, 상관관계지수는 피어슨 상관계수(Pearson correlation coefficient)를 이용하여 유의성 검정을 실시하였다.
결과 및 고찰
오레가노 에탄올 추출물의 DPPH 라디칼 및 ABTS 양이온 라디칼 소거 활성
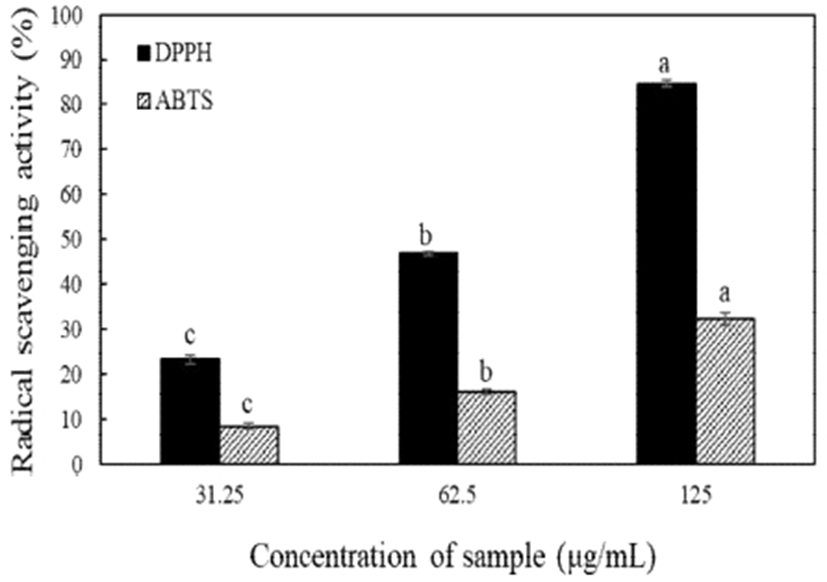
오레가노 종자 에탄올 추출물의 라디칼 소거 활성은 Fig. 1과 같다. 31.25, 62.50, 125 μg/mL의 농도로 제조하여 실험한 결과 DPPH 라디칼 소거활성은 각 23.3, 46.9, 84.6%로 측정되었으며, ABTS 양이온 라디칼 소거 활성의 경우 각각 8.4, 16.1, 32.2%의 라디칼 소거능을 나타내어 농도 의존적으로 증가한 양상을 보였다(p<0.05).
Fig. 1.
Radical scavenging activities of oregano seed ethanol extract.
Different letters are significantly different at p<0.05 among different treatment concentration in each group.
Download Original Figure
Rhim과 Choi(25)의 연구에서 오레가노 에탄올 추출물이 125 μg/mL 농도에서 82.7%의 라디칼 소거능을 보고하여 본 연구와 유사한 경향을 나타내었다. Cha 등(26)의 연구에 따르면 오레가노의 추출 용매에 따른 DPPH 라디칼 소거 활성과 ABTS 라디칼 소거능을 비교한 결과 DPPH 라디칼 소거능은 물 추출이 높았으나 ABTS 라디칼 소거 활성은 유의적 차이가 나타나지 않는 것으로 보고하였으며 향신료의 일종인 thyme의 열수 추출물이 알코올 추출물보다 산화 방지능이 높은 것으로 보고(27) 하여 향신료마다 추출 조건에 따라 추출 성분이 달라져 라디칼 소거 활성에 차이가 있는 것으로 나타났다. 이외에도 다른 식용식물들의 라디칼 소거 활성에 대한 연구를 보면 에탄올로 추출한 고려엉겅퀴는 12.5 mg/mL의 농도에서 31.25-81.93%(28), 씀바귀는 1 mg/mL의 농도에서 24.62%의 라디칼 소거능을 가진다고 보고(29) 하여 식용식물들이 다양한 라디칼 소거 활성을 보이는 것으로 사료된다.
오레가노 에탄올 추출물의 ORAC 가에 미치는 영향
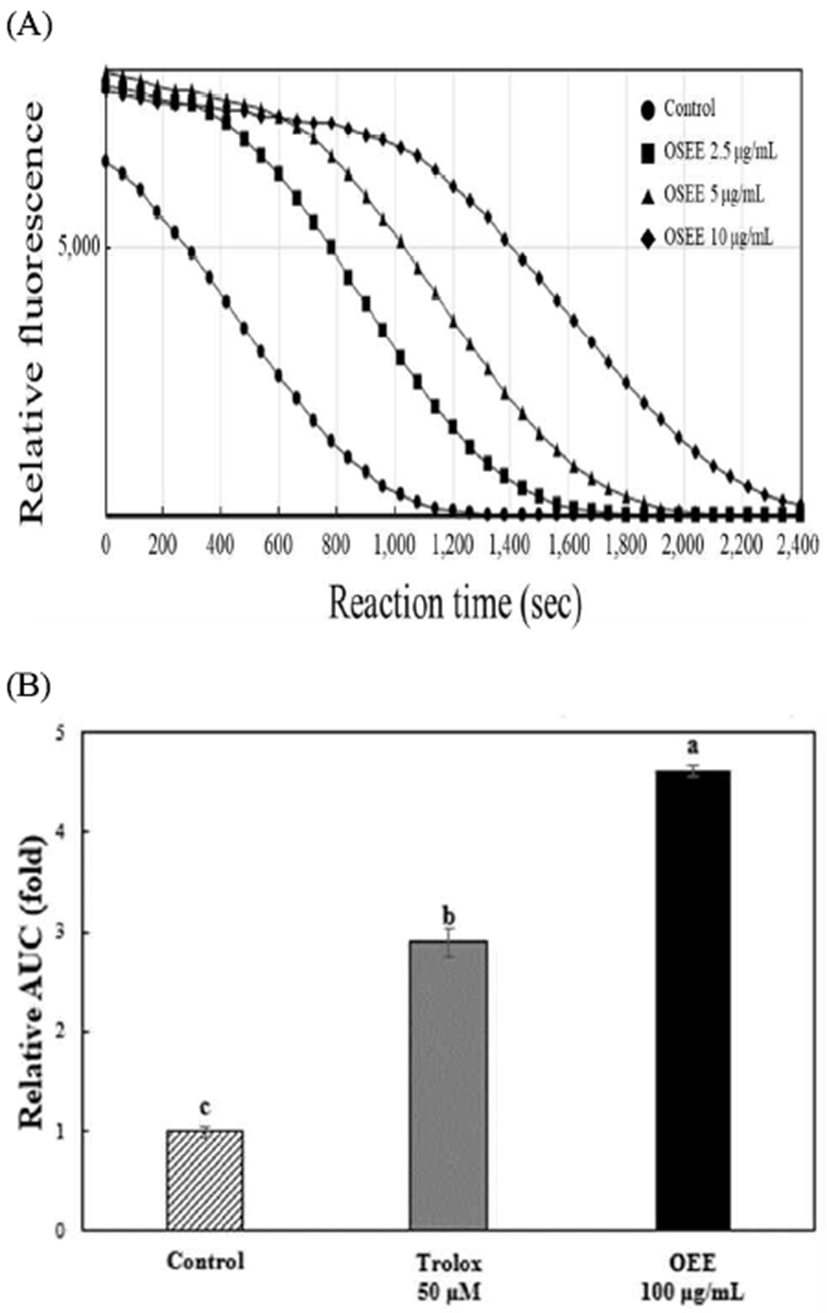
ORAC법은 peroxy radical에 의해 fluorescence 감소를 측정하여 산화 방지능을 평가하는 방법이다. Fig. 2A는 오레가노 종자 에탄올 추출물을 2.5, 5, 10 μg/mL 농도로 희석하여 나타낸 것으로 농도 의존적인 경향을 보였다. Fig. 2B는 대조군에 비해 trolox 6.26 μg/mL 처리 군에서 2.1배, 오레가노 종자 에탄올 추출물 10 μg/mL 농도에서 대조군에 비해 약 1.9배 높게 나타나(p<0.05) 천연 항산화제로서 합성 항산화제를 대체할 수 있을 것으로 생각된다. Kratchanova 등(30)은 25가지 불가리아의 약용작물을 서로 다른 극성을 가진 용매인 물과 아세톤으로 추출하여 ORAC 가를 서로 비교한 결과 아세톤 추출물이 물 추출물 보다 산화 방지 활성이 우수하였고, 아세톤 추출물 중에서는 peppermint 가 2,917 μmol trolox equivalent/g dry weight로 나타나 가장 우수하였으며 총 페놀 함량도 가장 우수한 것으로 나타났고, 물 추출물 중에는 thyme이 1,434 μmol trolox equivalent/g dry weight로 나타나 본 연구와 같이 향신료들이 우수한 ORAC 가를 보이는 것으로 나타났다.
Fig. 2.
Effect of oregano seed ethanol extract on fluorescein elimination induced by AAPH.
A, Time course of the reaction of fluorescein with AAPH in the absence and in the presence of oregano ethanol extract at different; B, Values represent the mean±SD (n=3).
Different letters above a bar are significantly different at p<0.05.
OSEE, oregano seed ethanol extract.
Download Original Figure
오레가노 종자 에탄올 추출물의 총 페놀 함량 및 FRAP 환원력
오레가노 종자 에탄올 추출물의 총 페놀 함량 및 FRAP 환원력의 결과는 Table 1과 같다. 총 페놀 함량은 264.64 μg/mL tannic acid equivalent/g extract로 나타났으며, FRAP 환원력은 339.78 μg/mL ascorbic acid equivalent/g extract로 나타났다. Su 등(31)에 의하면 오레가노 잎 50% 아세톤 추출물을 표준물질 gallic acid로 환산한 총 페놀 함량은 5.48 mg/g 로 보고하였으며, Ahn(32)은 오레가노 잎의 추출 용매에 따른 총 페놀 함량을 비교한 결과 메탄올 추출물이 11,471 mg%, 에틸 아세테이트 추출물이 13,893 mg%, 헥산 추출물은 1,483 mg%로 나타나 에틸 아세테이트 추출조건이 가장 다량의 총 페놀 화합물을 추출할 수 있는 조건으로 보고한 바 있다.
Table 1.
Total phenolics and FRAP value of oregano seed ethanol extract
|
|
TPC1)
(μg/mL tannic acid equivalent/g extract) |
FRAP2)
(μg/mL ascorbic acid equivalent/g extract) |
|
OSEE3)
|
264.64±15.23 |
339.78±12.81 |
Download Excel Table
오레가노 종자 에탄올 추출물의 총 페놀 함량과 산화 방지 분석법과의 상관관계
오레가노 종자 에탄올 추출물의 산화 방지 측정법과 총 페놀 함량의 상관관계 분석 결과는 Table 2와 같다. TPC와 DPPH 라디칼 소거 활성은 r=1.000(p<0.01), ABTS 양이온 라디칼 소거 활성은 r=0.994(p<0.01), FRAP 환원력은 r=0.995(p<0.01), ORAC assay는 r=0.972(p<0.01)로 모두 유의적 상관관계를 나타내어 총 페놀 함량이 증가할수록 산화 방지에 효과가 있는 것으로 나타났다. Surveswaran 등(33)의 연구에 따르면 인도산 약용식물 113종의 산화 방지 활성과 총 페놀 함량과의 상관관계를 비교하였을 때, DPPH 산화 방지 활성과의 상관성은 r=0.9378(p<0.001), ABTS 양이온 라디칼 소거 활성은 r=0.9690(p<0.001), FRAP 환원력은 r=0.8941(p<0.001)로 양의 상관관계를 나타내었다. Zheng과 Wang(34)의 연구에 따르면 오레가노를 포함하여 thyme, dill, peppermint, sage, basil, fennel등 39종의 신선한 허브와 조리한 허브의 산화 방지 효과에 대한 연구로 총 페놀 함량과 ORAC 가의 상관관계는 r=0.984로 허브의 페놀 화합물이 산화 방지 효과에 큰 기여를 했다고 보고하였다. 따라서 본 연구에서도 총 페놀 함량과 DPPH 라디칼 소거 활성, ABTS 양이온 라디칼 소거 활성, FRAP 환원력 및 ORAC 법이 양의 상관관계를 나타내어 오레가노 종자 에탄올 추출물의 산화 방지 활성은 총 페놀 함량의 증가에 의한 것으로 생각된다.
Table 2.
Correlation of oregano seed ethanol extract among total phenolic content and antioxidant activity
|
|
DPPH radical scavenging activity |
ABTS cation radical scavenging activity |
FRAP |
ORAC |
Total phenolic content |
|
DPPH radical scavenging activity |
1 |
|
|
|
|
|
ABTS cation radical scavenging activity |
0.994**1)
|
1 |
|
|
|
|
FRAP |
0.998**
|
0.991**
|
1 |
|
|
|
ORAC |
0.975**
|
0.959**
|
0.981**
|
1 |
|
|
Total phenolic content |
1.000**
|
0.944**
|
0.997**
|
0.972**
|
1 |
Download Excel Table
향기성분분석
오레가노 종자 에탄올 추출물의 휘발성 물질은 Table 3과 같이 주요 휘발성 물질은 limonene, linalool, ο-cymene, thymol, α-pinene, γ-terpinene 등이 검출되었다. Lopez 등(35)은 정유성분에서 carvacrol, ρ-cimeme, linalool, γ-terpinene 등이 검출되었다고 보고하여 유사한 결과를 보였다. 오레가노 종자 에탄올 추출물에서 limonene, linalool, O-cymene, thymol, thymol, α-pinene, γ-terpinene은 (21.56±2.82, 16.5±0.14, 12.56±1.62, 7.81±0.04, 4.47±0.21, 4.24±0.52)×106 peak area를 보였으며 각각의 peak는 24.9%, 19.1%, 14.5%, 9.0%, 5.2%, 4.9%의 함량을 갖고 있는 것으로 나타났다.
Table 3.
The volatile compounds of oregano seed ethanol extract analyzed by GC-MS
|
Volatile compounds |
Peak area (×106) (%)1)
|
|
1-Methyl-4-(1-methylethenyl) cyclohexene (limonene) |
21.56±2.82 (24.9) |
|
3,7-Dimethylocta-1,6-dien-3-ol (linalool) |
16.5±0.14 (19.1) |
|
1-Methyl-2-Isopropylbenzene (ο-cymene) |
12.56±1.62 (14.5) |
|
2-Isopropyl-5-methyl-phenol (thymol) |
7.81±0.04 (9.0) |
|
2,6, 6-Trimetylbicyclo[3.1.1]-2-hept-2-ene (α-pinene) |
4.47±0.21 (5.2) |
|
1-Isopropyl-4-methyl-1,4-cyclohexadiene (γ-terpinene) |
4.24±0.52 (4.9) |
|
Trans-2-methyl-2-butenal (tiglaldehyde) |
3.75±0.19 (4.3) |
|
Hexanal |
3.66±0.24 (4.2) |
|
1-Isopropyl-4-methylenbicyclo[3.1.0]hexane ((+)-sabinene) |
3.57±0.11 (4.1) |
|
5-Isopropyl-2-methlbicyclo[3.1.0]hex-2-ene((-)-α-thujene) |
3.32±0.43 (3.8) |
|
1-Phenylethanone (acetophenone) |
1.75±0.09 (2.0) |
|
7-Methyl-3-methylene-octa-1,6-diene (seocalcitol) |
1.58±0.09 (1.8) |
|
Decane |
0.92±0.01 (1.0) |
|
1-Isopropyl-4-methyl-1,3-cyclohexadiene (α-terpinene) |
0.81±0.03 (0.9) |
|
Total volatiles |
86.48±5.43 (100) |
Download Excel Table
Baratta 등(36)은 오레가노 외 5종의 오일을 Acinetobacter calcoaceticus 외 24 종의 박테리아와 곰팡이를 이용하여 항균 및 항진균을 분석한 결과 오레가노의 효능이 가장 우수하다고 보고하였다. 또한 Shin 등(37)의 보고에 따르면 테르펜류는 산화 방지효과를 갖는 물질로 알려져 있어 테르펜류 성분에 의해 산화 방지 등의 효과를 보이는 것으로 사료된다. Farag 등(14)의 연구에 따르면 ο-cymene 및 thymol과 같은 페놀성 화합물이 활성산소종 형성을 억제한다고 보고하였으며, Li와 Liu(38)의 연구는 γ-terpinene과 α-pinene, limonene 등의 정유의 terpene계 성분이 높은 항산화 활성을 보인다고 보고한 바 있어 오레가노 종자 추출물의 항산화 활성은 phenol 화합물등의 phytochemical 물질 및 테르펜류 물질에서 기인한 것으로 사료된다.
오레가노 종자 에탄올 추출물의 headspace oxygen 함량
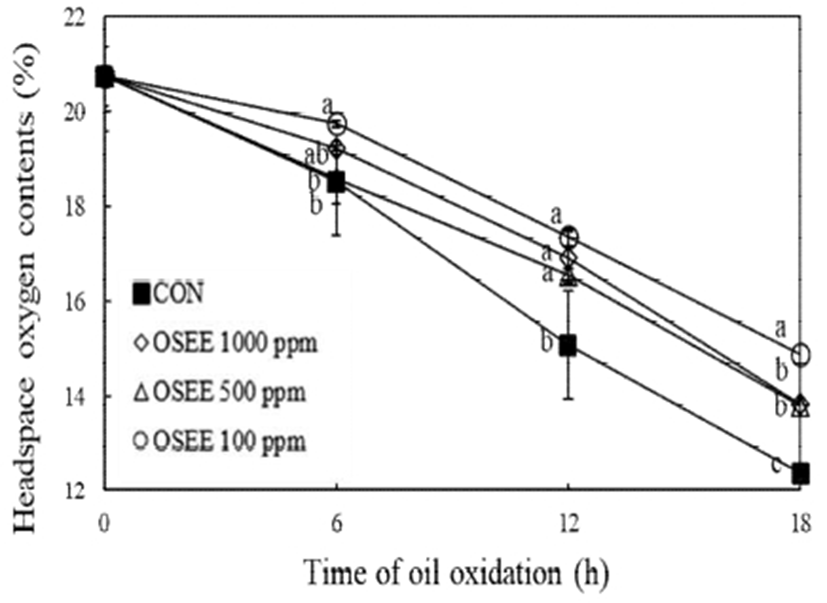
오레가노 종자 에탄올 추출물의 유지 내 산화 안정성을 알아보기 위해 headspace oxygen 함량을 측정한 결과를 Fig. 3에 나타내었다. 오레가노 종자 에탄올 추출물을 첨가하지 않은 대조군에 비해 소모되는 산소의 비율이 유의적으로 감소하며(p<0.001) 오레가노 종자 에탄올 추출물이 유지산화에 영향을 미치는 것으로 나타났다. 6, 12, 18시간의 열산화로 대조군의 headspace oxygen 함량은 18.5, 15.1, 12.4%로 나타나 유의적으로 잔존 산소량이 감소(p<0.05) 하는데 비해 오레가노 종자 에탄올 추출물 0.1 mg/mL 농도에서 6, 12, 18시간 열 산화 시 각각 19.7, 17.4, 14.9%, 0.5 mg/mL 농도에서 각각 18.6, 16.6, 13.8%, 1 mg/mL 농도에서 각각 19.2, 16.9, 13.8%로 관찰되어 오레가노 종자 에탄올 추출물 0.1 mg/mL 농도 첨가가 열 산화 시간이 증가함에 따라 나타나는 산소소모량을 감소시켜 적은 용량에서도 유지산화 안정성을 보이는 것으로 관찰되었다(p<0.001). Asensio 등(39)의 연구에 따르면 올리브오일에 오레가노 잎 추출물을 첨가하였을 때 지질 산화 과정을 지연시켜 저장 기간을 증가시킨다고 보고하였으며, Lolos 등(40) 연구에서도 대두유를 이용한 튀김 시 오레가노 잎 추출물을 첨가할 경우 튀김에 흡수된 기름의 산화를 지연시켜 튀김의 신선도를 늘린다는 결과를 보고하였다. 따라서 본 연구에서도 유지산화 시 산소 소모를 줄이는 효과를 관찰할 수 있어 오레가노 종자 에탄올 추출물이 연속적인 유지산화를 지연시키는 효과가 있는 것을 확인할 수 있었다.
Fig. 3.
Change of headspace oxygen content in corn oil added with oregano seed ethanol extract.
OSEE, oregano seed ethanol extract.
Different letters are significantly different at p<0.001 among different treatment concentration each group.
Download Original Figure
오레가노 종자 에탄올 추출물의 CDA가 및 ρ-AV
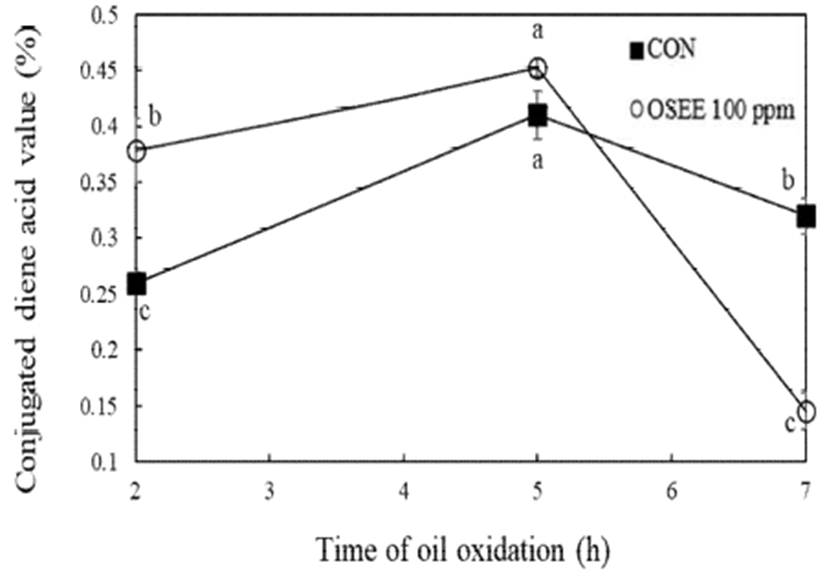
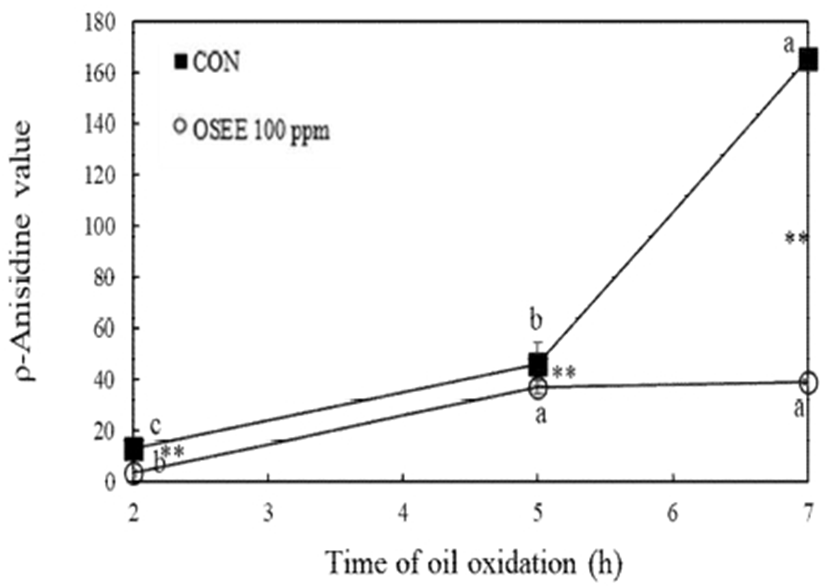
유지가 산화되면서 형성하는 공액 이중결합을 측정하는 CDA가 결과는 Fig. 4와 같다. 2, 5, 7시간 산화시킨 결과 시료가 첨가되지 않은 대조군의 CDA 양은 각각 0.26, 0.41, 0.32%로 측정되었다. 오레가노 종자 에탄올 추출물 100 ppm 첨가 군에서는 0.38, 0.45, 0.14%로 측정되었다. 대조군과 비교하여 100 ppm 농도의 오레가노 종자 에탄올 추출물 첨가 군의 CDA 양이 7시간 이상 유지산화 시 발생되는 CDA 양을 유의적으로 2.3배 감소하는 것으로 관찰되었다(p<0.05). 그뿐만 아니라 유지의 산화 과정에서 만들어진 이차 산화 생성물을 측정한 ρ-AV의 결과는 Fig. 5와 같다. 유지 산화를 2, 5, 7시간 진행하였을 때 대조군의 ρ-AV는 각각 12.63, 50.35, 165.37로 측정되었으며, 오레가노 종자 에탄올 추출물을 100 ppm 첨가 시 각각 3.19, 36.90, 38.83으로 측정되어 이차 산화 생성물에 대한 생성 억제가 우수한 것으로 나타났다.
Fig. 4.
Change of conjugated dienoic acid value in 100℃ corn oil added with oregano seed ethanol extract.
OSEE, oregano seed ethanol extract.
Different letters are significantly different at p<0.05 among different treatment time each group. * are significantly different at p<0.05 between control and oregano seed ethanol extract.
Download Original Figure
Fig. 5.
Change of ρ-anisidine value in 100℃ corn oil added with oregano seed ethanol extract.
OSEE, oregano seed ethanol extract.
Different letters are significantly different at p<0.05 among different treatment time each group. ** are significantly different at p<0.01 between control and oregano seed ethanol extract.
Download Original Figure
이러한 식품 모델에서 유지산화 안정성에 관한 연구를 보면, 유제품에 오레가노 잎 추출물 첨가 시 conjugated diene의 함량이 유의적으로 감소함을 관찰하여 오레가노 잎 추출물 이 유제품의 보관 중에 산화를 효과적으로 방지할 수 있다고 보고하였다(41). 다른 향신료 관련 산화 안정성에 관한 연구로 샐러리 종자 80% 에탄올 추출물을 첨가한 수중유적형 유화계의 광산화 시 대조군에 비해 생성되는 conjugated dienoic acid의 양이 유의적으로 감소하였다고 보고한 바 있다(41). 본 연구결과, 유지산화 시에 생성되는 산화물 중 이차 산화 생성물에 대한 생성 억제가 대조군에 비하여 오레가노 종자 추출물 첨가 군이 유의적으로 우수한 것으로 관찰되어, 유지산화 시간이 증가될수록 효과를 보이는 것으로 관찰되었다.
요 약
합성 산화방지제에 대한 불안함으로 인해 천연에서 추출한 식품 산화방지제에 대한 관심이 커지고 있으나 그 종류가 한정적이므로 본 연구에서는 80% 에탄올을 용매로 하여 추출한 오레가노 종자의 산화 방지 활성과 유지 산화 안정성을 in vitro assay와 실제 유지산화 시스템에서 평가해 보고자 하였다. 산화 방지를 측정하고자 실시한 DPPH 라디칼 소거활성 결과 125 μg/mL에서 84.62% 소거 활성을 보였고 ABTS 양이온 라디칼 소거 활성 결과 125 μg/mL에서 32.22% 소거 활성을 보였으며 이는 농도 의존적인 라디칼 소거활성을 나타내었다. 총 페놀 함량은 264.64 μg/mL tannic acid equivalent/g extract, FRAP 환원력은 339.78 μg/mL ascorbic acid equivalent/g extract로 관찰되어 오레가노 종자 에탄올 추출물의 산화 방지 측정법들과 총 페놀 함량은 유의적인 상관관계를 보였으며, ORAC가 결과 농도의존적으로 상승하는 산화 방지능을 보였다. 유지 산화 안정성 측정을 위해 옥수수기름에 오레가노 종자 에탄올 추출물을 첨가하여 18시간 열 산화 시켰을 때 headspace oxygen은 0.1 mg/mL 농도에서 14.9%로 대조군보다 2.5% 높게 나타났고, 100℃에서 7시간 산화시킨 결과 CDA의 양은 대조군 보다 56.3% 낮았다. 이차 산화물을 측정하는 ρ-AV는 대조군에 비해 76.5% 적게 생성되었다. 또한 향기성분을 분석한 결과 주요 휘발성 물질은 limonene, linalool, ο-cymene, thymol, α-pinene, γ-terpinene 등으로 분석되었다. 본 연구 결과 오레가노 종자 에탄올 추출물이 산화 방지 활성, 유지 산화 안정성 등에 우수한 효과를 나타낸 것으로 판단되며 향후 유지 식품 혹은 유지가 다량 함유된 가공식품의 제조 시 산화를 방지하기 위한 목적으로서 합성 산화방지제의 역할을 대체할 수 있을 것으로 사료된다.
Acknowledgements
본 연구는 2017년도 강원대학교 대학회계 학술연구조성비(관리번호-620170125)에 의해 수행되었습니다.
References
ChoeEO, LeeJY. 1998; Thermooxidative stability of soybean oil, beef tallow and palm oil during frying of steamed noodles. Korean J Food Sci Technol. 30:288-292.

TakahashiO, SakamotoY, HiragaK. 1985; Lung hemorrhagic toxicity of butylated hydroxyanisole in the rat. Toxicol Lett. 27:15-25


BranenAL. 1975; Toxicology and biochemistry of butylated hydroxyanisole and butylated hydroxytoluene. J Am Oil Chem Soc. 52:59-63


LeibovitzBE, SiegelBV. 1980; Aspects of free radical reactions in biological systems: aging. J Gerontol. 35:45-56


FreemanBA, CrapoJD. 1982; Biology of disease: free radicals and tissue injury. Lab Invest. 47:412-426.

FridovichI. 1978; The biology of oxygen radicals. Science. 201:875-880.

LynchRE, FridovichI. 1978; Effects of superoxide on the erythrocyte membrane. J Biol Chem. 253:1838-1845.

HitokotoH, MorozumiS, WaukeT, SakaiS, KurataH. 1980; Inhibitory effects of spices on growth and toxin production of toxigenic fungi. Appl Environ Microbiol. 39:818-822.

KarapinarM, AktugSE. 1987; Inhibition of foodborne pathogens by thymol, eugenol, menthol and anethole. Int J Food Microbiol. 4:161-166


KuritaN, MiyajiM, KuraneR, TakaharaY. 1981; Antifungal activity of components of essential oils. Agric Biol Chem. 45:945-952


ShahidiF, AmbigaipalanP. 2015; Phenolics and polyphenolics in foods, beverages and spices: Antioxidant activity and health effects–A review. J Funct Foods. 18:820-897


Chaibi A, Ababouch LH, Belasri K, Boucetta S, Busta FF (1997) Inhibition of germination and vegetative growth of Bacillus cereus T and Clostridium botulinum 62A spores by essential oils. Food Microbiol, 14, 161-174
ChaibiA, AbabouchLH, BelasriK, BoucettaS, BustaFF. 1997; Inhibition of germination and vegetative growth of
Bacillus cereus T and
Clostridium botulinum 62A spores by essential oils. Food Microbiol. 14:161-174.

DormanHJD, DeansSG. 2000; Antimicrobial agents from plants: antibacterial activity of plant volatile oils. J Appl Microbiol. 88:308-316


FaragRS, BadeiAZMA, HewediFM, El‐BarotyGSA. 1989; Antioxidant activity of some spice essential oils on linoleic acid oxidation in aqueous media. J Am Oil Chem Soc. 66:792-799


Almeida-DoriaRF, Regitano-d’arceMAB. 2000; Antioxidant activity of rosemary and oregano ethanol extracts in soybean oil under thermal oxidation. Food Sci Technol. 20:197-203


Deleanu M, Popa EE, Popa ME (2018) Chemical composition and active properties evaluation of wild oregano (Origanum Vulgare) and ginger (Zingiber Officinale-Roscoe) essential oils. Rev Chim Bucharest, 69, 1927-1933
DeleanuM, PopaEE, PopaME. 2018; Chemical composition and active properties evaluation of wild oregano (
Origanum Vulgare) and ginger (
Zingiber Officinale-Roscoe) essential oils. Rev Chim Bucharest. 69:1927-1933.

BloisMS. 1958; Antioxidant determinations by the use of a stable free radical. Nature. 181:1199-1200


ReR, PellegriniN, ProteggenteA, PannalaA, YangM, Rice-EvansC. 1999; Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Biol Med. 26:1231-1237


Prior RL, Hoang H, Gu L, Wu X, Bacchiocca M, Howard L, Hampsch-Woodill M, Huang D, Ou B, Jacob R (2003) Assays for hydrophilic and lipophilic antioxidant capacity (oxygen radical absorbance capacity (ORACFL)) of plasma and other biological and food samples. J Agric Food Chem, 51, 3273-3279
PriorRL, HoangH, GuL, WuX, BacchioccaM, HowardL, Hampsch-WoodillM, HuangD, OuB, JacobR. 2003; Assays for hydrophilic and lipophilic antioxidant capacity (oxygen radical absorbance capacity (ORAC
FL)) of plasma and other biological and food samples. J Agric Food Chem. 51:3273-3279


BenzieIFF, StrainJJ. 1996; The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”: the FRAP assay. Anal biochem. 239:70-76


FolinO, DenisW. 1912; A new colorimetric method for the determination of vanillin in flavoring extracts. Ind Eng Chem. 4:670-672


Kim MA, Han CH, Lee JC, Kim MJ (2017) Antioxidant properties and oxidative stability of celery seeds ethanol extract using in vitro assays and oil-in-water emulsion. Korean J Food Sci Technol, 49, 480-485
KimMA, HanCH, LeeJC, KimMJ. 2017; Antioxidant properties and oxidative stability of celery seeds ethanol extract using
in vitro assays and oil-in-water emulsion. Korean J Food Sci Technol. 49:480-485.

AOCS (1980) Official and tentative methods of the AOCS. 3rd ed, American oil chemists’ society press, Champaign, IL, USA, Method Cd 18-90
AOCS 1980 Official and tentative methods of the AOCS. 3rd edAmerican oil chemists’ society press. Champaign, IL, USA: Method Cd 18-90.

AOCS (1990) Official and tentative methods of the AOCS. 4th ed, American oil chemists’ society press, Champaign, IL, USA, Method Ti la-64
AOCS 1990 Official and tentative methods of the AOCS. 4th edAmerican oil chemists’ society press. Champaign, IL, USA: Method Ti la-64.

Rhim TJ, Choi MY (2009) The antioxidative effects of oregano (Origanum majorana L.) extracts. Korean J Plant Res, 22, 425-430
RhimTJ, ChoiMY. 2009; The antioxidative effects of oregano (
Origanum majorana L.) extracts. Korean J Plant Res. 22:425-430.

Cha WS, Kim JH, Lee KH, Kwon HJ, Yoon SJ, Chun SS, Choi UK, Cho YJ (2006) Antioxidative and inhibition activities on Helicobacter pylori of spice extracts. J Korean Soc Food Sci Nutr, 35, 315-320
ChaWS, KimJH, LeeKH, KwonHJ, YoonSJ, ChunSS, ChoiUK, ChoYJ. 2006; Antioxidative and inhibition activities on
Helicobacter pylori of spice extracts. J Korean Soc Food Sci Nutr. 35:315-320.

Kim JH, Kwon JH, Lee KH, Chun SS, Kwon OJ, Woo HS, Cho YJ, Cha WS (2006) Inhibitory effect against Helicobacter pylori and biological activity of thyme (Thymus vulgaris L.) extracts. J Korean Soc Appl Biol Chem, 49, 243-247
KimJH, KwonJH, LeeKH, ChunSS, KwonOJ, WooHS, ChoYJ, ChaWS. 2006; Inhibitory effect against Helicobacter pylori and biological activity of thyme (
Thymus vulgaris L.) extracts. J Korean Soc Appl Biol Chem. 49:243-247.

Cho BY, Lee JH, Ra MJ, Kim SY, Kang IJ, Han KC, Lee OH (2016) Analysis of pectolinarin content and antioxidant activity in Cirsium setidens Nakai by cultivars. J Food Hyg Saf, 31, 210-215
ChoBY, LeeJH, RaMJ, KimSY, KangIJ, HanKC, LeeOH. 2016; Analysis of pectolinarin content and antioxidant activity in
Cirsium setidens Nakai by cultivars. J Food Hyg Saf. 31:210-215


Park SJ (2014) Antioxidant and anti-adipogenic effects of ethanolic extracts from Ixeris dentata Nakai. Korean J Culinary, 20, 133-142
ParkSJ. 2014; Antioxidant and anti-adipogenic effects of ethanolic extracts from
Ixeris dentata Nakai. Korean J Culinary. 20:133-142.

KratchanovaM, DenevP, CizM, LojekA, MihailovA. 2010; Evaluation of antioxidant activity of medicinal plants containing polyphenol compounds. Comparison of two extraction systems. Acta Biochim Pol. 57:229-234


SuL, YinJJ, CharlesD, ZhouK, MooreJ, YuLL. 2007; Total phenolic contents, chelating capacities, and radical-scavenging properties of black peppercorn, nutmeg, rosehip, cinnamon, and oregano leaf. Food Chem. 100:990-997


AhnCK, LeeYC, YeomCA. 2000; Antioxidant and mixture effects of curry spices extracts obtained by solvent extraction. Korean J Food Sci Technol. 32:491-499.

SurveswaranS, CaiYZ, CorkeH, SunM. 2007; Systematic evaluation of natural phenolic antioxidants from 133 Indian medicinal plants. Food Chem. 102:938-953


ZhengW, WangSY. 2001; Antioxidant activity and phenolic compounds in selected herbs. J Agric Food Chem. 49:5165-5170


LopezP, SanchezC, BatlleR, NerinC. 2007; Vapor-phase activities of cinnamon, thyme, and oregano essential oils and key constituents against foodborne microorganisms. J Agric Food Chem. 55:4348-4356.

BarattaMT, DormanHJD, DeansSG, BiondiDM, RubertoG. 1998; Chemical composition, antimicrobial and antioxidative activity of laurel, sage, rosemary, oregano and coriander essential oils. J Essent Oil Res. 10:618-627


ShinYH, KimHJ, LeeJY, ChoYJ, AnBJ. 2012; Major compound analysis and assessment of natural essential oil on anti-oxidative and anti-microbial effects. J Life Sci. 22:1344-1351


LiGX, LiuZQ. 2009; Unusual antioxidant behavior of α- and γ-terpinene in protecting methyl linoleate, DNA, and erythrocyte. J Agric Food Chem. 57:3943-3948


AsensioCM, NepoteV, GrossoNR. 2011; Chemical stability of extra‐virgin olive oil added with oregano essential oil. J Food Sci. 76:S445-S450


LolosM, OreopoulouV, TziaC. 1999; Oxidative stability of potato chips: effect of frying oil type, temperature and antioxidants. J Sci Food Agric. 79:1524-1528


BoroskiM, GirouxHJ, SabikH, PetitHV, VisentainerJV, Matumoto-PintroPT, BrittenM. 2012; Use of oregano extract and oregano essential oil as antioxidants in functional dairy beverage formulations. LWT-Food Sci Technol. 47:167-174