Article
산양삼의 년근별 진세노사이드 함량 및 항산화 활성
정범균1
,2, 정길락3, 김민식1, 문현규1, 박수진1, 천지연1
,*

Ginsenoside contents and antioxidant activities of cultivated mountain ginseng (Panax ginseng C.A. Meyer) with different ages
Beom-Gyun Jeong1
,2, Gil-Rak Jung3, Min Sik Kim1, Hyun-Gyu Moon1, Su-Jin Park1, Jiyeon Chun1
,*

1Department of Food Science and Technology, Sunchon National University, Suncheon 57922Korea
2Department of Food Science and Technology, University of Georgia, Athens, GA 30602USA
3Agricultural Technology Center, Tongyeong 53021Korea
Copyright ⓒ The Korean Society of Food Preservation. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Nov 06, 2018; Revised: Dec 26, 2018; Accepted: Dec 27, 2018
Abstract
The morphological, nutritional, and functional characteristics of cultivated mountain ginseng (Panax ginseng C.A. Meyer, CMG) with different ages (3, 5, 7, and 9 years old) were investigated. Three-year-old CMG (3-CMG) was significantly smaller, shorter, and lighter than 5-CMG while there is no significant difference in length, thickness, and weight among 5-, 7-, and 9-CMGs. On the other hand, functional properties of CMG highly varied with the cultivation age. Moisture content of CMGs with different ages decreased with age except for 9-CMG whereas crude fat and protein contents increased with age. DPPH and ABTS radical scavenging activities were highest in 9-CMG (82.4 μg GAE/g and 723.6 μg AAE/g, respectively) while reducing poser was highest in 3-CMG (411.7 GAE/g). Xanthine oxidase inhibition activity of 9-CMG (17.24 μg AAE/g) was 1.5 times higher than that of 3-CMG. Acidic polysaccharide content was highest in 7-CMG (3,298 mg GAAE/g) but lowest in 3-CMG. Total polyphenol and flavonoid contents were highest in 5- and 7-CMG, respectively, and decreased with the cultivation period. Total ginsenoside content of CMG increased with the cultivation period. Rb1 and Re were predominant ginsenosides for all CMGs, accounting for about 50% of total ginsenoside content. Rb1 of 9-CMG was about four times higher than that of 3-CMG. Compound K was found in all CMGs, but it took less than 0.1% of total ginsenoside content.
Keywords: cultivated mountain ginseng; age; ginsenoside; antioxidant activity; xanthine oxidase inhibition activity
서 론
인삼류는 전통적으로 잘 알려진 약용 식물 중 하나로 30종 이상의 사포닌(ginsenoside), 산성다당체, 폴리아세틸렌, 알칼로이드, 페놀성화합물, 고미신(gomisin-A, -N) 등 다양한 기능성 성분들이 존재하며, 이에 따라 기억력 감퇴 개선 및 공간인지능력 향상, 암 예방 및 항암활성, 항당뇨, 간기능 항진, 혈압조절, 항스트레스, 항산화 등 우수한 기능성을 나타내는 것으로 알려져 있다(1-9). 이러한 건강 우수성으로 인하여 재배된 인삼과 이를 이용하여 증숙 및 건조해 만든 홍삼은 건강보조식품으로 널리 이용되고 있을 뿐만 아니라(10) 일반 가공식품 산업에서 다양한 식품류로의 활용을 통하여 부가가치를 창출하고 있다(11). 인삼의 이러한 넓은 활용으로 인하여 인삼의 재배조건 및 생육특성에 관한 많은 연구가 수행되어 왔고 이에 따른 품질지표 및 재배기간에 따른 등급 체계등도 이미 설정되어 산업화에 활용되고 있다(12,13).
산양삼(cultivated mountain ginseng 또는 wild-simulated ginseng)은 인삼을 야생에서 발아하여 성장한 종자나 어린 뿌리를 인위적으로 산에 파종하여 야생상태로 재배한 삼을 가리키며 학명은 Panax ginseng C.A. Meyer로 인삼의 학명과 같다(14,15). 산양삼은 형태학적으로 산삼에 비해 줄기에서 뿌리가 시작하는 뇌두 부분이 길어 장뇌삼으로도 불리며, 인삼에 비해서는 몸통이 가늘고 길며 강한 향을 가지는 특징을 보인다(16,17). 또한, 산양삼은 재배 인삼에 비하여 인삼 사포닌인 ginsenoside 함량이 높은 것으로 알려져 건강적 효능이 뛰어남을 인정받고 있지만(15,18), 인삼에 비하여 재배가 어렵고 가격이 비싸기 때문에 그 동안 대부분 약재에 국한하여 사용되어 왔을 뿐 가공을 통한 일반식품류나 건강식품류로의 산업화는 거의 시도되지 못하였기 때문에 국내외 적으로 산양삼에 관한 기초 및 가공 연구 자료가 거의 전무한 실정이다. 최근, 산양삼이 자연친화적으로 재배된 기능성 식물자원이란 인식으로 인하여 국내에서 생산량이 2014년에 비하여 2016년에 13% 증가하였으며 이로 인한 생산 단가의 하락은 산양삼 자원에 대한 가공 산업화 및 6차 산업화로의 요구가 확산되고 있어 이를 위한 과학적 데이터베이스 구축 및 연구 자료의 축적이 시급한 실정이다(19-21).
인삼류의 대표 기능성 성분인 진세노사이드는 섭취 후 장내 미생물에 의해 분해되어 다양한 대사체로 변화되는데 체내 흡수와 대사과정은 사포닌의 종류에 따라 달라진다. Rb1, Rb2, Rh2, Rc, Rd 등의 경우, 위액 중에서 20번 탄소 위치의 당쇄가 절단되면 Rg3로 변환되어 흡수되는 것으로 알려져 있으며, Rb1, Rb2, Rb3, Rc, Rd 등이 Rg3의 전구체인 것으로 보고되어 있고, Rb1은 Rd가 F2로 전환된 후 compound K로 전환되는 것으로 알려져 있다(22,23). 특히 Rb1, Rb2, Rc, Rd 등의 대사산물인 compound K는 종양 형성을 막고 암세포의 침입을 억제함으로써 악성 종양의 생성이나 암의 전이를 막는다(24). 인삼류의 진세노사이드의 구조에 따라 다양한 약리적 효능을 보이는 것으로 알려져 있는데 이들의 조성과 함량은 인삼의 종류, 부위, 재배기간, 재배지 등에 따라서 차이가 있는 것으로 알려져 있다(25). 인삼류의 특성에 따른 다양한 연구가 진행되어 온 것과 달리 산양삼에 대한 기초 자료는 거의 이루어지지 못한 실정이며, 항당뇨, 혈압강화, 항산화, 비만 등에 대한 효능에 관한 연구도 아직 초기 단계이다. 재배 인삼에 비해 인지도가 낮고 가치가 저평가 되어 있는 산양삼을 고부가 산업화하기 위해서는 원료의 특성, 가공 적성, 건강 기능적 가치 등에 대한 기초적 선행 연구를 통한 기초 데이터베이스를 구축하는 것이 선행되어야 하며 이는 다양한 가공 산업화를 위한 확대 연구를 가속화할 수 있을 것으로 보인다.
본 연구에서는 함양산 산양삼을 생육기간별로 수집하고 이들의 이화학적, 영양적 및 기능적 특성을 비교 분석하여 산양삼 고차 산업화를 위한 기초 데이터베이스를 구축하고자 하였다.
재료 및 방법
시 약
분석에 사용된 ginsenoside 표준품(Rb1, Rb2, Rc, Rd, Re, Rf, Rg1, Rg2, Rh2, 및 Rg3), quercetin, galacturonic acid, gallic acid, L-ascorbic acid 표준품과 Folin-Ciocalteu’s phenol reagent와 1,1-diphenyl-2-picrylhydrazyl(DPPH)은 Sigma-Aldrich Chemical Co.(St. Louis, MO, USA)에서 구입하였으며, ginsenoside F2와 compound K 표준품은 앰보연구소(AMBO Institute, Daejeon, Korea)에서 구입하였다. 기타 사용된 시약은 특급 및 HPLC 등급을 사용하였다.
산양삼 시료
산양삼은 경남 함양군 서하면에서 재배 후 국내산 특별관리임산물 품질검사를 통과한 3, 5, 7, 9년근을 구입하여 사용하였다. 구입한 시료는 흐르는 물에 세척 후 표면의 수분이 제거될 때까지 실온에서 자연 음건하였으며 시료의 형태학적 특성을 관찰하고 수분 함량을 측정한 다음 -70℃에서 동결 보관하였다. 분석을 위한 시료는 동결건조기(FDT-12012, Operon, Kimpo, Korea)에서 건조시킨 후 분쇄기(HGBSSSS6, Waring, Torrington, CT, USA)로 분쇄한 다음 80 mesh standard sieve(Chunggye Co., Seoul, Korea)를 통과한 분말을 -70℃에서 보관하며 분석 시료로 사용하였다.
산양삼의 형태 관찰 및 수분함량 측정
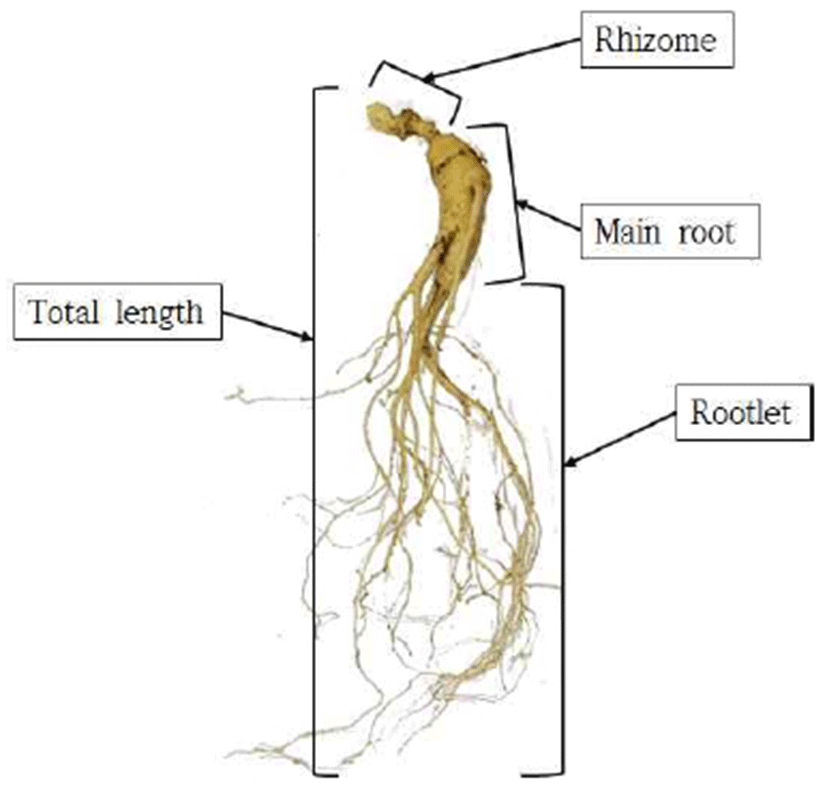
산양삼 원물은 무작위로 뿌리 10개를 선정하여 Fig. 1과 같이 총 길이, 원뿌리, 뇌두를 구분한 다음 각각의 길이와 두께를 측정하였다. 총길이는 50 cm 줄자를 이용하여 측정하였으며, 원뿌리 및 뇌두의 길이와 두께는 캘리퍼스(530-101, Mitutoyo, Kawasaki, Japan)를 이용하여 측정하였다. 무게는 전자저울을 이용하여 소수점 두 번째 자리까지 측정하였다. 수분함량은 시료를 5 mm 두께로 잘게 세절한 뒤, 1 g을 적외선수분함량측정기(MB45, OHAUS, Parsippany, NJ, USA)를 이용하여 3회 반복하여 측정하였다.
일반성분 분석
일반성분은 AOAC법(26)에 따라 분석하였다. 조회분은 직접 회화법, 조단백은 Kjeldahl법에 따라 측정된 질소량에 질소 계수 6.25를 곱하여 산출하였으며, 조지방 함량은 Soxhlet 추출법으로 분석하였다.
Ginsenoside 함량 분석
Ginsenoside 성분의 추출은 Lee 등(27)의 방법을 일부 변형하여 추출하였다. 동결건조 시료 0.2 g에 70% methanol 2 mL을 가한 후 50℃에서 30분간 초음파 추출하였다. 추출액은 19,872.5 ×g에서 3분간 원심분리하였으며 상층액을 0.45 μm membrane filter로 여과하여 HPLC(Agilent 1200 series, Santa Clara, CA, USA)로 분석하였다. 총 12종의 ginsenoside(Rg1, Re, Rf, Rg2, Rb1, Rc, Rb2, Rd, F2, Rg3, CK, Rh2)를 분석하였으며 HPLC 분석조건은 다음과 같다. 컬럼은 Prodigy ODS-2 column(3.2×250 mm, 5 μm, Phenomenex, Torrance, CA, USA)였으며, 검출기는 photodiode array detector를 사용하여 202 nm에서 측정하였다. 유속은 분당 1 mL, 시료 주입량은 20 μL이었다. 이동상은 acetonitrile과 water를 이용하여 Table 1과 같은 gradient 조건에서 분석한 다음 ginsenoside 표준용액과의 retention time, 200-600 nm 범위에서의 spectrum pattern과 peak area를 비교하여 정성 및 정량 분석하였다.
Table 1.
Gradient condition of HPLC mobile phases for ginsenoside analysis
|
Time (min) |
0 |
20 |
23 |
42 |
55 |
64 |
73 |
75 |
78 |
83 |
89 |
|
A1) (%) |
17.5 |
21.0 |
26.0 |
26.0 |
36.0 |
50.0 |
68.0 |
80.0 |
80.0 |
17.5 |
17.5 |
|
B2) (%) |
82.5 |
79.0 |
74.0 |
74.0 |
64.0 |
50.0 |
32.0 |
20.0 |
20.0 |
82.5 |
82.5 |
Download Excel Table
항산화능 측정
DPPH radical 소거능은 Blois(28)의 방법, ABTS radical 소거능은 Arts 등(29)의 방법, 환원력(reducing power)은 Oyaizu(30)의 방법을 변형하여 측정하였다. 동결건조 시료를 1.5 g 취하여 50% ethanol 15 mL를 가한 뒤 50℃ shaking incubator(HB-201SF, Han-Baek Scientific Co., Bucheon, Korea)에서 100 rpm으로 1시간 동안 추출한 다음 여과하여 시험용액으로 사용하였다.
DPPH radical 소거능은 시험용액 60 μL에 0.2 mM DPPH용액 240 μL를 가하여 잘 혼합한 후 암실에서 30분간 방치한 뒤 분광광도계(Eon, BioTek Instruments, Inc., Winooski, VT, USA)를 이용하여 517 nm에서 흡광도를 측정하였다. Gallic acid를 표준용액으로 이용하여 동일한 방법으로 분석한 다음 DPPH radical 소거능을 μg of gallic acid equivalent GAE)/g로 나타내었다.
2,2’-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)(ABTS) radical은 2.4 mM potassium persulfate에 7 mM ABTS 용액을 가한 후 냉장고에 12시간 이상 방치하여 ABTS radical cation(ABTS+)을 제조하고, 734 nm에서 흡광도 값이 0.70±0.02가 되도록 ethanol로 희석하여 사용하였다. 희석한 ABTS+ 용액 950 μL와 시료 시험용액 50 μL를 혼합하여 7분간 반응시킨 다음 다시 흡광도를 측정하여 μg of ascorbic acid equivalent(AAE)/g로 나타내었다.
환원력은 시험용액 200 μL에 0.2 M sodium phosphate buffer(pH 6.6) 200 μL와 1% potassium ferricyanide 용액 200 μL를 차례로 가하여 50℃ shaking incubator에서 20분간 반응시켰다. 반응액에 10% trichloroacetic acid 200 μL를 가하여 반응을 중지시킨 후 100 μL씩 취하여 증류수 100 μL와 0.1% ferric chloride 20 μL를 차례로 가하여 혼합한 다음 700 nm에서 흡광도를 측정하였다. 환원력은 gallic acid를 표준용액으로 사용하여 μg of GAE/mL로 나타내었다.
총 폴리페놀 함량 분석
총 폴리페놀 함량은 Singleton 등(31)의 방법으로 분석하였다. 동결 건조 분말 시료 1.5 g을 취하여 50% ethanol 15 mL를 가한 뒤 50℃ shaking incubator에서 100 rpm으로 1시간 동안 추출하고 Whatman No.1(Whatman International Ltd., Maidstone, England)으로 여과한 추출액을 시험용액으로 사용하였다. 시험용액 40 μL를 취하고 증류수 200 μL, 50% Folin-Ciocalteu's phenol reagent 20 μL를 차례로 혼합한 다음 5% Na2CO3 용액 40 μL를 넣어 잘 혼합하였다. 혼합액을 1시간 동안 암실에 방치시킨 후 분광광도계를 이용하여 750 nm에서 흡광도를 측정하였다. 총 폴리페놀 함량은 gallic acid를 표준용액으로 사용하여 μg GAE/g으로 나타내었다.
총 플라보노이드 함량 분석
총 플라보노이드 함량은 Zhishen 등(32)의 방법을 이용하여 측정하였다. 동결건조 시료를 1.5 g 취하여 50% ethanol을 15 mL 가한 뒤 50℃ shaking incubator에서 100 rpm으로 1시간 동안 추출하여 여과한 추출액을 시험용액으로 사용하였다. 시험용액 100 μL에 80% ethanol 400 μL, 5% sodium nitrite 30 μL를 차례로 가하여 혼합한 뒤 실온에서 5분간 반응시켰다. 10% aluminium chloride 30 μL와 1 M sodium hydroxide 200 μL를 가하여 혼합한 후 1분간 정치한 뒤, 반응액에 증류수 200 μL를 가하고 분광광도계로 420 nm에서 흡광도를 측정하였다. 총 플라보노이드 함량은 mg of quercetin equivalent(QE)/g로 나타내었다.
산성다당체 함량 분석
산성다당체는 galacturonic acid의 polymer로 pectin과 분자구조가 유사한 물질로 pectin 정량에 사용되는 carbazoleulfuric acid의 방법(33)으로 측정하였다. 동결건조 시료 0.1 g에 증류수 10 mL을 가하여 80℃ shaking water bath에서 1시간 동안 추출한 후 냉각시켰다. 추출액을 1,413.2 ×g에서 10분간 원심분리시켰다. 상층액 0.2 mL에 무수에탄올 0.8 mL을 가하여 잘 혼합한 뒤 1,413.2 ×g에서 5분간 원심분리하여 상층액을 제거하였다. 침전물을 증류수 1.8 mL에 녹이고 10배 희석한 액 50 μL에 0.1% carbazole-ethanol 용액 25 μL와 진한 황산 300 μL를 가하고 잘 혼합한 뒤, 85℃ 항온수조에서 3분간 반응시켜 냉각시킨 후 525 nm에서 흡광도를 측정하였다. 산성다당체 함량은 mg of galacturonic acid equivalent(GAAE)/g로 나타내었다.
Xanthine oxidase 저해활성 측정
Xanthine oxidase 저해활성은 Noro 등(34)의 방법에 따라 측정하였다. 동결건조 시료를 1.5 g 취하여 증류수 15 mL을 가한 뒤 50℃ shaking incubator에서 100 rpm으로 1시간 동안 추출하여 여과한(Whatman No.1, Whatman International Ltd.) 추출액을 시험용액으로 사용하였다. 시험용액 100 μL과 0.1 M potassium phosphate 완충용액(pH 7.5) 600 μL을 혼합한 뒤 2 mM xanthine/0.1 M potassium phosphate buffer 200 μL를 첨가하였다. Xanthine을 첨가한 용액에 xanthine oxidase/water(0.2 unit/mL) 100 μL를 가하여 잘 혼합한 후, 37℃에서 30분간 반응시켰다. 반응액의 흡광도를 분광광도계를 이용하여 292 nm에서 측정하고 xanthine oxidase inhibitory activity(%)으로 나타내었다.
통계 분석
각 실험은 모두 3회 이상 반복실험을 통해 결과를 얻었으며, SPSS(Statistical Package for the Social Science Inc., Chicago, IL, USA) program version 25.0을 이용하여 통계 분석하였다. 각 항목의 평균값의 차이는 유의수준 p<0.05에서 일원분산분석법(one-way ANOVA test)을 이용하여 검증하였고, 시료 간의 유의성은 Duncan's multiple range test로 검정하여 분석 평가하였다.
결과 및 고찰
산양삼의 형태학적 특성
산양삼은 Fig. 1과 같이 뇌두(Rhizome), 원뿌리(Main root), 및 지근(rootlet)으로 구분할 수 있으며 뇌두로부터 가장 긴 부분의 길이를 산양심의 총 길이로 측정하였으며, 뇌두와 원뿌리의 두께, 산양삼 뿌리의 총 무게를 년근별로 측정하여 비교한 결과는 Table 2와 같다. 뇌두의 길이는 생육기간이 증가할수록 유의적으로 증가하였으나(p<0.05), 7년근과 9년근 산양삼에서는 뇌두 길이의 유의적인 차이가 관찰되지 않았다. 또한, 산양삼의 원뿌리의 길이와 총 길이의 경우 재배 연수가 3, 5, 7년근으로 증가하면서 길이의 평균값이 높아졌으나 이러한 차이가 유의적이지 않은 것으로 나타났는데 이는 같은 년근이라 하더라도 산양삼의 뿌리별 특성에 따라 총 길이의 편차가 크게 나타나기 때문에 유의성이 없게 나타난 것으로 보인다. 한편, 산양삼 뇌두의 두께, 원뿌리 두께, 및 총 무게는 3년근보다 5년근이 약 2-3배 정도 증가하는 유의적인 차이를 나타났으나(p<0.05), 5년근 이후부터는 재배 기간의 증가에 따른 형태학적 특성 변화가 유의적이지 않은 것으로 나타났다. 최적의 환경으로 관리 재배되는 인삼과 달리 씨를 산에 방사하여 재배하는 산양삼의 경우 환경 변화에 더욱 민감하여 일교차가 적은 지역과 직사광선에 덜 노출되는 지역 등 뿌려지는 부분적 자연환경에 따른 영향이 보다 크게 나타날 것으로 보이며(35) 산에서 생육되는 경우 인삼보다 생육이 더디며 모양이 곧지 않고, 지근 및 세근이 발달하는 과정에서 자연의 영향을 더 많이 받기 때문에 뿌리의 길이나 무게와 같은 형태학적 특성에서 편차가 크게 나타나는 것으로 보인다(36).
Table 2.
Physical characteristics of cultivated mountain ginseng with different ages
|
Parameters |
Parts |
Cultivated mountain ginseng |
|
3-years |
5-years |
7-years |
9-years |
|
Length |
Rhizome (cm) |
1.42±0.421)b2)
|
1.72±0.55b
|
2.47±0.37a
|
2.53±0.62a
|
|
Main root (cm) |
3.89±1.38NS3)
|
4.75±1.40 |
5.20±2.47 |
4.44±1.71 |
|
Rootlet (cm) |
8.66±2.32b
|
13.95±3.63a
|
14.85±5.54a
|
12.18±5.28ab
|
|
Total (cm) |
13.96±2.45b
|
20.42±2.98a
|
22.53±6.02a
|
19.15±4.01a
|
|
Thickness |
Rhizome (cm) |
0.39±0.09b
|
0.61±0.11a
|
0.63±0.16a
|
0.67±0.08a
|
|
Main root (cm) |
0.68±0.07b
|
1.02±0.15a
|
1.00±0.19a
|
1.01±0.16a
|
|
Weight (g) |
1.00±0.15b
|
3.68±0.85a
|
3.92±0.78a
|
3.39±0.77a
|
Download Excel Table
산양삼의 일반성분 함량
연근별 산양삼의 일반성분 함량을 측정한 결과는 Table 3과 같다. 3, 5, 7, 9년근 산양삼의 수분 함량은 생육 기간에 따라 59.2-66.7%의 범위를 보였는데, 생육 기간이 증가할수록 수분함량이 감소하다가 9년근에서 증가하여 66.72%로 가장 높은 수분함량을 보였다. 이는 3, 5, 7년근 산양삼에서 연근이 증가함에 따라 수분함량이 낮아진다는 Lee 등(36)의 연구 결과와 일치한다. 단백질 함량은 산양삼의 생육 기간이 증가할수록 그 함량이 증가하는 것으로 나타났으나 95% 신뢰도 수준에서는 그 차이가 유의적이지 못한 것으로 나타났다. 한편, 조지방 함량도 생육기간 7년까지 회분 함량은 생육 기간 5년까지 수치상으로는 증가하다가 이후 감소하는 것으로 나타났으나 이러한 변화정도 또한 95% 신뢰도 수준에서는 유의적이지 않은 것으로 나타났다. 인삼의 경우 다양한 재배 지역과 재배 연수에 따라 조단백질 함량이 달라지는 것으로 보고되었는데(37) 본 연구의 산양삼도 이와 유사한 특성을 보이는 것으로 나타났다.
Table 3.
Proximate composition of cultivated mountain ginseng with different ages
|
Cultivated mountain ginseng |
Crude ash (%) |
Moisture (%) |
Crude protein (%) |
Crude fat (%) |
|
3-years |
3.86±0.401)
|
65.99±1.43b2)
|
5.83±0.35 |
0.39±0.00 |
|
5-years |
6.86±0.53 |
65.01±1.48b
|
6.26±0.11 |
0.67±0.18 |
|
7-years |
5.13±0.08 |
59.19±3.75c
|
7.97±0.46 |
1.18±0.43 |
|
9-years |
4.21±0.01 |
66.72±0.18ab
|
8.97±1.36 |
0.91±0.23 |
Download Excel Table
산양삼의 진세노사이드 함량
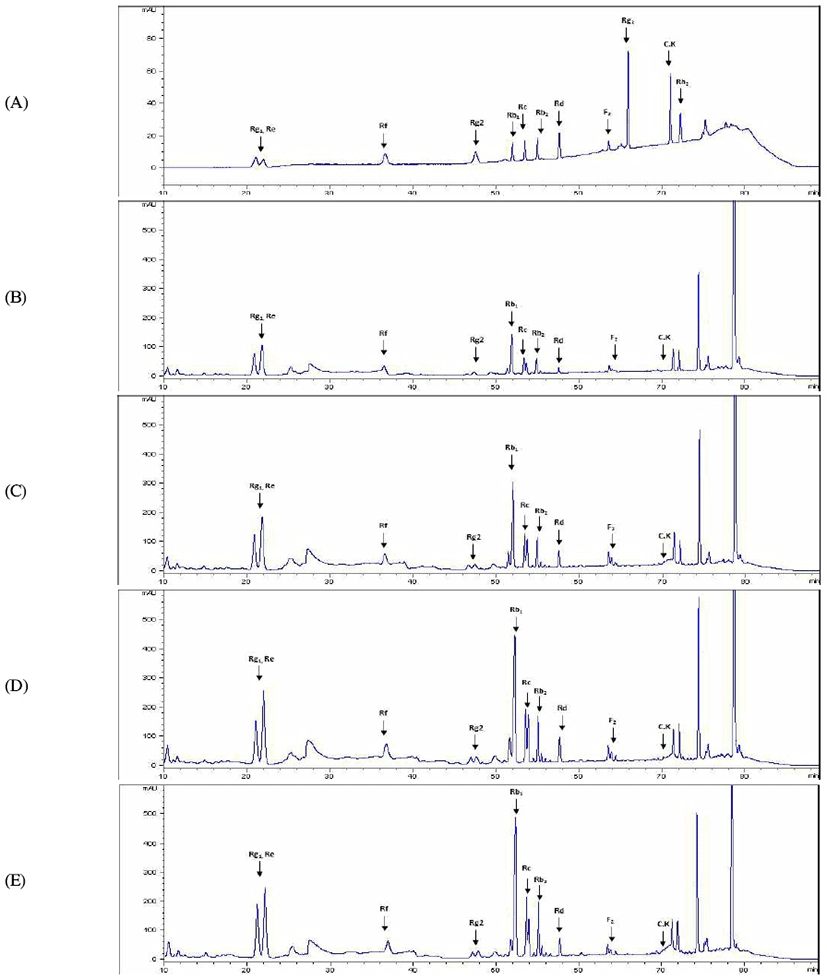
생육기간에 따른 산양삼의 진세노사이드 함량을 분석한 HPLC 크로마토그램은 Fig. 2와 같으며 각각의 함량을 분석한 결과는 Table 6과 같다. 진세노사이드(ginsenoside)는 당(glycone)과 비당(aglycone)이 결합한 형태인 배당체 형태로 존재하는데, 당과 결합한 형태에 따라 Rb1, Rb2, Rc, Rd, F2, Rg3, Rh2, compound K인 protopanaxadiol(PPD) 그룹과 Re, Rf, Rg1, Rg2가 속하는 protopanaxatriol(PPT) 그룹으로 나누어진다.
Fig. 2.
HPLC chromatograms of ginsenosides in cultivated mountain ginseng.
(A): ginsenosdie standard (Rg1, Re, Rf, Rg2, Rb1, Rc Rb2, Rd, F2, Rg3, compound K, Rh2). (B), (C), (D), and (E) indicate 3-, 5-, 7-, and 9-years-old cultivated mountain ginseng samples, respectively.
Download Original Figure
총 진세노사이드 함량은 연근이 증가함에 따라 유의적인 증가를 보여, 9년근은(37.12 mg/g) 3년근(13.22 mg/g)에 비해 약 2.8배 높은 총 함량을 보였다. PPD 그룹에서는 Rb1이 연근에 따라 20-29% 함유율의 범위를 보이며 가장 높은 함량을 차지하였고, PPT 그룹에서는 Re가 23-33%를 구성하는 것으로 나타나 함유율이 가장 높았다. 다음으로는 Rg1이 10-13%를 차지하며 높은 함유율을 보였다. Rg3는 모든 시료에서 검출되지 않았으며, Lee 등(36)의 산양삼 연구에서도 Rg3는 검출되지 않았다고 보고되어 본 연구 결과와 일치하였다. 한편, compound K는 인삼에서는 발견되지 않고 산삼에서만 미량 검출되는 진세노사이드로 알려져 있는데, 본 연구 결과 모든 산양삼 연근에서 0.01-0.03 mg/g범위로 미량 검출되었다. 인삼 채집시기에 따른 진세노사이드 성분의 함량을 조사한 Chang(38)은 Re, Rd, Rg1이 전체 진세노사이드 중 70%를 차지한다고 하였으며, Nam(39)의 보고에서는 인삼 재배조건에 따라서 조성의 차이는 있으나 Rg1, Rb1, Rb2, Rc, 및 Re가 주로 함유되어 있다고 보고하였다. Jeong 등(40)의 연구 결과에 따르면 동일한 조건에서 산양삼은 재배 인삼에 비하여 총사포닌 함량과 Rd와 Re와 같은 ginsenoside 함량이 높게 나타났다고 보고하였다. 경북 영주에서 채취한 산양삼에서는 Rb1의 함유율이 전체 진세노사이드 중 약 75%를 차지하며 가장 높은 함량으로 보고되었는데(41) 이는 본 연구에서 Rb1이 20-29%를 차지한 것과는 다른 경향이라 하겠다.
한편, 지역별로 채취한 산양삼의 진세노사이드 함량을 조사한 Moon(42)의 연구에서도 각 진세노사이드의 함량이 지역별로 4-5배 정도로 큰 차이를 나타냈으며, Rb1도 지역에 따라 화순은 1.03 mg/100 g의 함량을 보였지만 안동은 0.22 mg/100 g 수준으로 약 4.7배의 차이를 보인다고 하였다. 인삼류의 진세노사이드 함량은 계절이나 수확시기, 부위별에 따라 차이가 있으며(43), 품종과 뿌리의 부위(44), 재배 지역과 년근에 따라서도 차이를 보이는 것으로 알려져 있다(45). 이 외에도, Lee 등(36)은 높은 온도에서 장시간 실행된 환류추출 방법이 상온 추출 방법보다 더 높은 진세노사이드 수율을 보인 반면, compound K는 상온 추출에서 보다 높은 함량을 보였다고 보고하여, 같은 원료라도 추출방법에 따라 추출되는 진세노사이드 종류와 함량에 차이가 날 수 있음을 보여주었다.
산양삼의 총 진세노사이드 함량은 연근수가 증가함에 따라 증가하였는데, 이와 함께 Rd, compound K, Rg2를 제외한 개별 진세노사이드 함량도 대체적으로 연근수에 따라 증가하는 것으로 나타났으며 총 진세노사이드 함량에서 각 진세노사이드 함량이 차지하고 있는 구성 비율은 큰 차이를 보이지 않아 비교적 일정하게 유지되는 것으로 보여진다. 이와 달리, Re는 어린 3년근에서 33%로 가장 높은 비율을 보였으나 이후 연근수가 증가하면서 유의적으로 낮아져(p<0.05) 9년근에서는 23%로 가장 낮은 구성비를 나타냈다. 이와 달리 강원도 평창산 산양삼을 3, 5, 7년근별로 진세노사이드 함량을 분석한 Lee 등(36)은 시료 중 7년근이 진세노사이드 함량이 가장 높았으나 5년근에서 가장 낮은 진세노사이드 함량을 보였다고 하여 지역별로 차이가 있는 것으로 보여진다.
산양삼의 항산화능 및 xanthine oxidase 저해활성
산양삼의 항산화능은 DPPH radical 소거능, ABTS radical 소거능, 환원력(reducing power)을 측정하였으며 결과는 다음과 같다(Table 4). 산양삼의 DPPH radical 소거능의 경우 9년근이 82.37 μg GAE/mL로 가장 높게 나타났으며 이후 3년근 > 7년근 > 5년근 순으로 높은 수치를 보였다. ABTS radical 소거능에서도 9년근이 723.63 μg AAE/mL으로 가장 높은 항산화능을 보였으나 이후 5년근 > 3년근 > 7년근 순으로 나타나 DPPH radical 소거능과는 다소 다른 결과를 보였다. Lee 등(36)은 3, 5, 7년근 산양삼의 항산화능 측정 결과에서 3년근이 DPPH 및 ABTS radical 소거능이 가장 높았으며 5년근과 7년근은 유의적인 차이가 없었다고 보고하여, 본 실험과는 다른 결과를 보였다. 한편, 산양삼의 환원력은 3년근이 411.69 μg GAE/mL로 가장 높게 나타났으며 5년근이 가장 낮게 나타났다. DPPH radical과 ABTS radical 소거능 측정은 모두 시험관에서 인위적으로 radical을 생성시킨 후 시료와 혼합하여 시료 중의 항산화 물질에 의해 소거되는 radical에 의한 색의 변화를 측정한다는 점에서 유사하나 DPPH는 음이온 라디컬을 ABTS는 양이온 라디컬을 소거하는 원리로 측정되기 때문에 기질에 따라 반응하는 페놀성 물질의 종류에 차이가 나타나게 된다(46).
Table 4.
Antioxidant and xanthine oxidase inhibition activities of cultivated mountain ginseng with different ages
|
Activities |
Cultivated mountain ginseng |
|
3-years |
5-years |
7-years |
9-years |
|
DPPH radical scavenging (μg GAE/g)1)
|
69.65±2.493)b4)
|
52.09±1.97d
|
64.14±1.48c
|
82.37±2.44a
|
|
ABTS radical scavenging (μg AAE/g)2)
|
609.13±16.13c
|
667.90±8.36b
|
606.92±14.92c
|
723.63±3.06a
|
|
Reducing power (μg GAE/g) |
411.69±19.09a
|
347.25±4.09c
|
365.87±10.27b
|
365.76±10.81b
|
|
Xanthine oxidase inhibition (μg AAE/g) |
12.60±0.51db
|
13.21±0.45b
|
11.70±0.40c
|
17.24±0.15a
|
Download Excel Table
산양삼의 xanthine oxidase 저해활성은 3, 5, 7년근에서는 11.7-13.2% 범위를 보이다가 9년근에서 17.2%로 유의적으로 가장 높은 저해활성을 나타냈다. Xanthine oxidase는 생체 내 퓨린 대사에 관여하는 효소로, xanthine 혹은 hypoxanthine 으로부터 urate를 형성한다. 혈장 내 urate 농도가 증가되어 골절에 축적되면 심한 통증을 유발하기 때문에, xanthine oxidase 저해 활성은 통풍과 관련한 질환에서 중요한 역할을 하는 것으로 알려져 있다(47).
산양삼의 총 폴리페놀 및 총 플라보노이드 함량
연근별 산양삼의 총 폴리페놀, 총 플라보노이드 함량을 분석한 결과는 Table 5와 같다. 산양삼의 총 폴리페놀 함량은 3년근에서 가장 낮은 함량을 보인 후 5년근으로 생육기간이 증가함에 따라 큰 폭으로 증가하여 995.94 μg GAE/g으로 가장 높은 함량을 나타냈으며, 이후 7년근 및 9년근으로 재배기간이 길어지면서 유의적으로 감소하는 것으로 나타났다. Lee 등(36)의 연구에서는 산양삼 3년근이 가장 높은 폴리페놀 함량을 보인 후 연근수가 증가함에 따라 총 폴리페놀 함량이 점차 감소하였다고 보고하였다. 한편, Jang 등(46)의 연구에서 인삼 추출물 1 mg이 11.96 nmol gallic acid의 폴리페놀 함량을 보인 반면 산양삼 추출물은 이보다 약 3배 높은 34.81 nmol gallic acid 함량을 나타냈다고 하였다.
Table 5.
The contents of total polyphenol, total flavonoid, and acidic polysaccharide of cultivated mountain ginseng with different ages
|
Parameters |
Cultivated mountain ginseng |
|
3-years |
5-years |
7-years |
9-years |
|
Total polyphenol content (μg GAE/g) |
807.43±39.993)d4)
|
995.94±21.50a
|
934.91±6.27b
|
880.25±39.14c
|
|
Total flavonoid content (mg QE/g)1)
|
3.78±0.16a
|
3.80±0.13a
|
3.89±0.13a
|
3.44±0.25b
|
|
Acidic polysaccharide content (mg GAAE/g)2)
|
2,569.15±99.38c
|
3,173.75±22.75b
|
3,297.99±30.82a
|
3,177.76±74.11b
|
Download Excel Table
연근별 산양삼의 총 플라보노이드 함량은 3년근에서 7년근까지 3.78-3.89 mg QE/g으로 유의적인 함량 차이가 없었으나 9년근에서 3.44 mg QE/mL로 유의적인 감소를 보였다. 산양삼 3, 5, 7년근의 총 플라보노이드 함량을 연구 보고한 Lee 등(36)에 따르면, 3년근이 가장 높은 플라보노이드 함량을 보인 후 생육기간이 지남에 따라 함량이 감소한다고 보고하여 대체적으로 재배 기간이 짧은 어린 연근일수록 항산화 성분의 함량이 높지만 재배 연수가 길어지면서 이러한 성분들이 차츰 감소하는 것으로 보여진다.
폴리페놀과 플라보노이드는 식물에 존재하는 대표적인 항산화 물질로 산화-환원 반응에서 기질로 작용하며, 다양한 생리활성을 가지는 것으로 알려져 있는데(46,48), 인삼류의 경우 salicylic acid, p-benzoxy-benzic acid, gentisic acid, vanillic acid 등을 포함한 10여종 이상의 페놀성 화합물이 존재하는 것으로 보고되어 있다(49,50). Ok 등(51)은 에탄올로 추출한 산양삼 추출물이 열수추출보다 약 2배 높은 총 플라보노이드 함량을 나타냈다고 보고하였으며, Yoo 등(52)은 인삼의 서식지 및 재배 방법에 따라서도 페놀성 성분 및 함량에 차이를 보인다고 하였다. 이와 같이 폴리페놀과 플라보노이드 함량은 추출법에 따라 같은 시료라도 다르게 나타날 수 있으며, 재배 지역에 따라서도 다르게 나타날 수 있다. 이는 Moon(42)의 안동, 화순, 서천, 홍천의 지역별 산양삼의 특성 연구에서 서식지에 따라 페놀성 화합물 개체의 검출 여부 및 함량에 큰 차이가 나타났다고 보고한 것과 일치한다.
산양삼의 산성다당체 함량
산양삼의 년근별 산성다당체 함량을 분석한 결과는 Table 5과 같다. 본 연구에서 산양삼의 연근별 산성다당체 함량은 생육기간이 증가할수록 유의적으로 증가하는 경향을 보였는데, 7년근이 3,297.99 mg GAAE/g로 가장 높은 함량을 보였고, 9년근은 다소 감소하는 것으로 나타났다. 산성다당체는 galacturonic acid, glucuronic acid, mannuronic acid 등의 산성당이 다량 함유된 분자량 10,000-15,000 이상의 다당체를 말하며 중성다당체에 비해 면역 증진 효과가 크다고 알려져 있다(53). 한편, Lee 등(35)은 평창산 3, 5, 7년근 산양삼에서는 산성다당체 함량이 3년근에서 2,419 mg GAAE/g으로 가장 높은 함량을 보였고 재배 연수가 증가할수록 유의적으로 감소한다고 보고하여 본 연구와는 상반된 결과를 보여주었다. Lee 등(35)은 낮은 연령근일수록 건조중량 당 산성다당체의 양이 많은 것은 산성다당체 생합성량이 부피 성장보다 커서 단위 중량당 산성다당체의 함량이 많다고 하였으며 이는 연령이 높아질수록 산성다당체 함량이 감소한다고 보고하였다.
Table 6.
Ginsenoside contents of cultivated mountain ginseng with different ages
|
Ginsenosides |
Ginsenoside contents of cultivated mountain ginseng (mg/g) |
|
3-years |
5-years |
7-years |
9-years |
|
PPD |
Rb1
|
2.75±0.381)Db2)
|
8.34±0.47Cb
|
9.09±0.18Ba
|
11.12±0.47Aa
|
|
Rb2
|
1.15±0.18Cd
|
2.83±0.17Bc
|
2.93±0.03Be
|
3.90±0.19Ad
|
|
Rc |
1.21±0.18Dd
|
2.86±0.14Cc
|
3.26±0.03Bd
|
4.15±0.19Ad
|
|
Rd |
0.30±0.04Def
|
1.13±0.08Af
|
1.01±0.02Bh
|
0.81±0.04Cg
|
|
Rg3
|
ND3)NS4)f
|
NDh
|
NDj
|
NDh
|
|
F2
|
0.13±0.03Cf
|
0.27±0.15Ag
|
0.35±0.01Ai
|
0.21±0.01Bh
|
|
Compound K |
0.01±0.00Cf
|
0.02±0.00Bh
|
0.03±0.00Aj
|
0.02±0.00Bh
|
|
Rh2
|
NDNSf
|
NDh
|
NDj
|
NDh
|
|
PPT |
Re |
4.37±0.39Ca
|
8.71±0.23Aa
|
8.07±0.10Bb
|
8.63±0.34Ab
|
|
Rf |
1.09±0.11Bd
|
2.03±0.16Ad
|
2.27±0.06Af
|
2.40±0.55Ae
|
|
Rg1
|
1.74±0.21Dc
|
3.05±0.10Cc
|
3.75±0.16Bc
|
4.81±0.12Ac
|
|
Rg2
|
0.59±0.05Ce
|
1.46±0.09Ae
|
1.28±0.02Bg
|
1.29±0.09Bf
|
|
Total |
13.36±1.57C
|
30.80±1.06B
|
32.03±0.40B
|
37.34±1.97A
|
Download Excel Table
요 약
본 연구는 경상남도 함양산 산양삼의 생육기간(3, 5, 7, 9년근)에 따른 형태학적 차이, 영양성 및 기능성을 비교 분석하여 산양삼의 가공식품 산업화를 위한 기초자료로 활용하고자 하였다. 산양삼의 길이와 두께에서는 3년근이 유의적으로 짧고 가늘었으나, 5, 7, 9년근 사이에서는 유의적인 차이를 보이지 않았다. 총 페놀함량은 5년근이 가장 높은 함량을 보이다가 이후 감소하는 경향을 보였지만, 가장 낮은 함량은 3년근에서 관찰되었다. 총 플라보노이드 함량의 경우, 년근수와 함께 유의적으로 감소하여 9년근이 가장 낮은 함량을 나타내었다. 산성다당체 함량은 3년근이 유의적으로 가장 낮았으며 연근수가 증가할수록 증가하였다. DPPH 및 ABTS 라디칼 소거능에서는 9년근에서 가장 높은 항산화능을 보인 반면 환원력에서는 3년근이 가장 높게 나타났다. 총 진세노사이드 함량에서는 연근수가 증가할수록 증가하는 경향을 보여, 9년근이 가장 높은 함량을 보였다. Rb1과 Re가 전체 진세노사이드에서 비교적 높은 비율을 차지하였고, 인삼에서 발견되지 않고 산삼에서만 검출되는 compound K와 같은 진세노사이드가 0.05-0.10%의 낮은 비율로 검출되었다. 본 연구에서 산양삼은 서식지 및 재배 조건에 따라 진세노사이드를 포함한 기능성 성분들의 함량에 차이를 크게 보이므로, 향후 산양삼 산업화를 위해서는 보다 다양한 지역의 산양삼의 연근별 형태학적 특성, 영양성 및 기능성에 대한 비교 연구의 축적이 필요할 것으로 생각된다.
Acknowledgements
본 연구는 2017년도 중소기업청의 첫걸음과제 연구비 지원(C0532814)으로 수행되었으며 이에 감사드립니다.
References
ParkJK, NamKY, HyunHC, JinSH, ChepurnovSA, ChepurnovaNE. 1994; Effect of red ginseng triol saponin fractions on the spatial memory function studied with 12-arm radial maze. Korean J Ginseng Sci. 18:32-38.

LiuWK, XuSX, CheCT. 2000; Anti-proliferative effect of ginseng saponins on human prostate cancer cell line. Life Sci. 67:1297-1306


Li C, Cai J, Geng J, Li Y, Wang Z, Li R (2012) Purification, characterization and anticancer activity of a polysaccharide from Panax ginseng. Int J Biol Macromol, 51, 968-973
LiC, CaiJ, GengJ, LiY, WangZ, LiR. 2012; Purification, characterization and anticancer activity of a polysaccharide from
Panax ginseng. Int J Biol Macromol. 51:968-973


LaiDM, TuYK, LiuIM, ChenPF, ChengJT. 2006; Mediation of β-endorphin by ginsenoside Rh2 to lower plasma glucose in streptozotocin-induced diabetic rats. Planta Med. 72:9-13


Song JH, Park MJ, Kim E, Kim YC (1990) Effects of Panax ginseng on galactosamine-induced cytotoxicity in primary cultured rat hepatocytes. J Pharm Soc Korea, 34, 341-347
SongJH, ParkMJ, KimE, KimYC. 1990; Effects of
Panax ginseng on galactosamine-induced cytotoxicity in primary cultured rat hepatocytes. J Pharm Soc Korea. 34:341-347.

KangSY, Schini-KerthVB, KimND. 1995; Ginsenosides of the protopananaxatriol group cause endothelium-dependent relaxation in the rat aorta. Life Sci. 56:1577-1586


Kim CC (1979) Influence of Panax ginseng on the response of stressful stimuli in the experimental animal exposed to various stress. Korean J Ginseng Sci, 3, 168-186
KimCC. 1979; Influence of
Panax ginseng on the response of stressful stimuli in the experimental animal exposed to various stress. Korean J Ginseng Sci. 3:168-186.

KimYK, GuoQ, PackerL. 2002; Free radical scavenging activity of red ginseng aqueous extracts. Toxicol. 172:149-156


Abdel-Wahhab MA, Ahmed HH (2004) Protective effect of Korean Panax ginseng against chromium Ⅵ toxicity and free radicals generation in rats. J Ginseng Res, 28, 11-17
Abdel-WahhabMA, AhmedHH. 2004; Protective effect of Korean
Panax ginseng against chromium Ⅵ toxicity and free radicals generation in rats. J Ginseng Res. 28:11-17


ParkCK, KwakYS, HwangMS, KimSC, DoJH. 2007; Current status of ginseng (red ginseng) products in market of health functional food. The Korean Ginseng Research and Industry. 1:9-16.

HongHD, ParkHJ, JeongJK, JangDJ. 2008; Surveys of domestic and foreign patents for process food related ginseng. J Ginseng Res. 32:135-149


Hyun DY, Hyeon GS, Yeon BY, Kang SW, Kim YC, Lee KW, Kim SM (2009) A guideline to land suitability used soil physical characteristics and yield potential in Panax ginseng C.A. Mayer. Korean J Medicinal Crop Sci, 17, 421-426
HyunDY, HyeonGS, YeonBY, KangSW, KimYC, LeeKW, KimSM. 2009; A guideline to land suitability used soil physical characteristics and yield potential in
Panax ginseng C.A. Mayer. Korean J Medicinal Crop Sci. 17:421-426.

LiX, KangSJ, HanJS, KimJS, ChoiJE. 2010; Comparison of growth increment and ginsenoside content in different parts of ginseng cultivated by direct seeding and transplanting. Korean J Medicinal Crop Sci. 18:70-73.

AhnYM, ParkHS, KwonKR. 2007; Anti-cancer and anti-oxidant efficacies of wild ginseng and cultivated wild ginseng of Korea and China. J Pharmacopuncture. 10:5-16


Hong JY, Shin SR, Bae MJ, Bae JS, Lee IC, Kwon OJ, Jung JW, Kim YH, Kim TH (2010) Pancreatic lipase inhibitors isolated from the leaves of cultivated mountain ginseng (Panax ginseng). Korean J Food Preserv, 17, 727-732
HongJY, ShinSR, BaeMJ, BaeJS, LeeIC, KwonOJ, JungJW, KimYH, KimTH. 2010; Pancreatic lipase inhibitors isolated from the leaves of cultivated mountain ginseng (
Panax ginseng). Korean J Food Preserv. 17:727-732.

BaeMJ, KimSJ, YeEJ, NamHS, ParkEM. 2009; Antioxidant activity of tea made from Korean mountain-cultivated ginseng leaves and its influence on lipid metabolism. Korean J Food Culture. 24:77-83.

National Institute of Forest Science 2016; Manual for Analysis of Cultivated Mountain Ginseng Pharmaceutical Components. National Institute of Forest Science. Daejeon, Korea: p. 510.

LuiJH, StabaEJ. 1980; The ginsenosides of various ginseng plants and selected products. J Nat Prod. 43:340-346


Korea Forest Service (2015) Statistical yearbook of forestry. 45th ed, Korea Forest Service, Daejeon, Korea, p 239
Korea Forest Service 2015; Statistical yearbook of forestry. 45th edKorea Forest Service. Daejeon, Korea: p. 239.

Korea Forest Service (2017) Statistical yearbook of forestry. 47th ed, Korea Forest Service, Daejeon, Korea, p 241
Korea Forest Service 2017; Statistical yearbook of forestry. 47th edKorea Forest Service. Daejeon, Korea: p. 241.

GilJ, UmY, ByunJK, ChungJW, LeeY, ChungCM. 2017; Genetic diversity analysis of wood-cultivated ginseng using simple sequence repeat markers. Korean J Medicinal Crop Sci. 25:389-396.

AkaoT, KanaokaM, KobashiK. 1998; Appearance of compound K, a major metabolite of ginsenoside Rb1 by intestinal bacteria, in rat plasma after oral administration: measurement of compound K by enzyme immunoassay. Biol Pharm Bull. 21:245-249


Quan LH, Liang Z, Kim HB, Kim SH, Kim SY, Noh YD, Yang DC (2008) Conversion of ginsenoside Rd to compound K by crude enzymes extracted from Lactobacillus brevis LH8. J Ginseng Res, 32, 226-231
QuanLH, LiangZ, KimHB, KimSH, KimSY, NohYD, YangDC. 2008; Conversion of ginsenoside Rd to compound K by crude enzymes extracted from
Lactobacillus brevis LH8. J Ginseng Res. 32:226-231


ZhouW, FengMQ, LiJY, ZhouP. 2006; Studies on the preparation, crystal structure and bioactivity of ginsenoside compound K. J Asian Nat Prod Res. 8:519-527


ParkCK, JeonBS, YangJW. 2003; The chemical components of Korean ginseng. Food Industry and Nutrition. 8:10-23.

AOAC (2000) Offical Methods of Analysis. 17th ed, Association of official Analutical Chemists, Gaithersburg, MD, USA, p 1-26
AOAC 2000; Offical Methods of Analysis. 17th edAssociation of official Analutical Chemists. Gaithersburg, MD, USA: p. 1-26.

Lee KH, Lee DY, Lee SE, Nam KY, Hwang GB, Kim HD, Lee JW, Choi JH, Ahn YS, Kim SY, Kim GS (2016) Evaluation on extraction conditions and HPLC analysis method for ginsenosides in Panax ginseng. Korean J Medicinal Crop Sci, 24, 47-54
LeeKH, LeeDY, LeeSE, NamKY, HwangGB, KimHD, LeeJW, ChoiJH, AhnYS, KimSY, KimGS. 2016; Evaluation on extraction conditions and HPLC analysis method for ginsenosides in
Panax ginseng. Korean J Medicinal Crop Sci. 24:47-54


BloisMS. 1958; Antioxidant determinations by the use of a stable free radical. Nature. 181:1199-1200


ArtsMJTJ, HaenenGRMM, VossHP, BastA. 2004; Antioxidant capacity of reaction products limits the applicability of the trolox equivalent antioxidant capacity (TEAC) assay. Food Chem Toxicol. 42:45-49


OyaizuM. 1986; Studies on products of browning reaction: Antioxidative activity of products of browning reaction prepared from glucosamine. Jpn J Nutr. 44:307-315


SingletonVL, OrthoferR, Lamuela-RaventosRM. 1999; Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteu reagent. Methods Enzymol. 299:152-178


ZhishenJ, MengchengT, JianmingW. 1999; The determination of flavonoid contents in mulberry and their scavenging effects on superoxide radicals. Food Chem. 64:555-559


Do JH, Lee HO, Lee SK, Jang JK, Lee SD, Sung HS (1993) Colorimetric determination of acidic polysaccharide from Panax ginseng, its extraction condition and stability. Korean J Ginseng Sci, 17, 139-144
DoJH, LeeHO, LeeSK, JangJK, LeeSD, SungHS. 1993; Colorimetric determination of acidic polysaccharide from
Panax ginseng, its extraction condition and stability. Korean J Ginseng Sci. 17:139-144.

Noro T, Oda Y, Miyase T, Ueno A, Fukushima S (1983) Inhibitors of xanthine oxidase from the flowers and buds of Daphne genkwa. Chem Pharm Bull, 31, 3984-3987
NoroT, OdaY, MiyaseT, UenoA, FukushimaS. 1983; Inhibitors of xanthine oxidase from the flowers and buds of
Daphne genkwa. Chem Pharm Bull. 31:3984-3987


JungCH, SeogHM, ChoiIW, ParkMW, ChoHY. 2006; Antioxidant properties of various solvent extracts from wild ginseng leaves. LWT-Food Sci Technol. 39:266-274


Lee G, Choi GS, Lee JY, Yun SJ, Kim W, L H, Baik MY, Hwang JK (2017) Proximate analysis and antioxidant activity of cultivated wild Panax ginseng. Food Eng Prog, 21, 208-214
LeeG, ChoiGS, LeeJY, YunSJ, KimW, L H, BaikMY, HwangJK. 2017; Proximate analysis and antioxidant activity of cultivated wild
Panax ginseng. Food Eng Prog. 21:208-214


YangBW, ImBO, KoSK. 2006; Comparison of non-saponin composition and contents in fresh ginseng roots cultivated in different areas and at various ages. J Pharm Soc Korea. 50:215-219.

Chang HK (1998) Changes of saponin contents in Panax ginseng leaves by different harvesting months. Korean J Food Nutr, 11, 82-86
ChangHK. 1998; Changes of saponin contents in
Panax ginseng leaves by different harvesting months. Korean J Food Nutr. 11:82-86.

NamKY. 1996; The new Korean ginseng (constituent and its pharmacological efficacy). Korea Ginseng and Tabacco Research Institute. Daejeon, Korea: p. 1-10.

JeongHS, LimCS, ChaBC, ChoiSH, KwonKR. 2010; Component analysis of cultivated ginseng, cultivated wild ginseng, and wild ginseng and the change of ginsenoside components in the process of red ginseng. J Pharmacopuncture. 13:63-77


KangKM, LeeJY, KimMU, LeeSH. 2016; Effects of quality characteristics and antioxidant activity of Korean cultivated wild gnseng extract. J Korean Soc Food Sci Nutr. 45:1740-1746


Moon HK (2015) Quality characteristics and anti-diabetic effect of mountain-cultivated ginseng (Sanyangsam). Ph D Thesis, Kyungpook National University, Korea, p 56-57
MoonHK. 2015; Quality characteristics and anti-diabetic effect of mountain-cultivated ginseng (Sanyangsam). et al.Kyungpook National University. Korea: p. 56-57.

HanYJ, KwonKR, ChaBC, KwonOM. 2007; Component analysis of cultivated ginseng, cultivated wild ginseng, and natural wild ginseng by structural parts using HPLC method. J Pharmacopuncture. 10:37-53


Ahn IO, Lee SS, Lee JH, Lee MJ, Jo BG (2008) Comparison of ginsenoside contents and pattern similarity between root parts of new cultivars in Panax ginseng C.A. Meyer. J Ginseng Res, 32, 15-18
AhnIO, LeeSS, LeeJH, LeeMJ, JoBG. 2008; Comparison of ginsenoside contents and pattern similarity between root parts of new cultivars in
Panax ginseng C.A. Meyer. J Ginseng Res. 32:15-18


LeeCR, WhangWK, ShinCG, LeeHS, HanST, ImBO, KoSK. 2004; Comparison of ginsenoside composition and contents in fresh ginseng roots cultivated in Korea, Japan and China at various ages. Korean J Food Sci Technol. 36:847-850.

JangHY, ParkHS, KwonKR, RhimTJ. 2008; A study on the comparison of antioxidant effects among wild ginseng, cultivated wild ginseng, and cultivated ginseng extracts. J Pharmacopuncture. 11:67-78


YagiK. 1987; Lipid peroxides and human disease. Chem Phys Lipids. 45:337-351


BeecherGR. 2003; Overview of dietary flavonoids: nomenclature, occurrence and intake. J Nutr. 133:3248S-3254S


HanBH, ParkMH, HanYN. 1981; Studies on the antioxidant components of Korean ginseng (Ⅲ)-Identification of phenolic acids. Arch Pharm Res. 4:53-58


Wee JJ, Park JD, Kim MW, Lee HJ (1989) Identification of phenolic antioxidant components isolated from Panax ginseng. J Korean Agric Chem Soc, 32, 50-56
WeeJJ, ParkJD, KimMW, LeeHJ. 1989; Identification of phenolic antioxidant components isolated from
Panax ginseng. J Korean Agric Chem Soc. 32:50-56.

OkS, KangJS, KimKM. 2016; Simultaneous analysis method for polar and non-polar ginsenosides in cultivated wild ginseng by reversed-phase HPLC-CAD. J Life Sci. 26:247-252


YooBS, LeeHJ, ByunSY. 2000; Differences in phenolic compounds between Korean ginseng and mountain ginseng. Korean J Biotechnol Bioeng. 15:120-124.

SrivastavaR, KulshreshthaDK. 1989; Bioactive polysaccharides from plants. Phytochemistry. 28:2877-2883