Article
시설 및 노지재배 곰취의 수확시기에 따른 식품학적 특성 분석
조자용1, 김수환2, 조인경3, 정재희4, 박준기4, 김도우4, 김용두4, 허창기4,*
Analysis of quality characteristics of Ligularia fischeri cultivated in a greenhouse and an open field based on the harvest time
Ja-Yong Cho1, Su-Hwan Kim2, In-Kyung Cho3, Jae-Hee Jeong4, Jun-Ki Park4, Do-Woo Gim4, Yong-Doo Kim4, Chang-Ki Huh4,*
1Department of Food Science and Biotechnology, Jeonnam State University, Damyang 57337Korea
2Imsil Cheese and Food Research Institute, Imsil 55918Korea
3Department of Food and Nutrition, Nambu University, Gwangju 62271Korea
4Department of Food Science and Technology, Sunchon National University, Suncheon 57922Korea
Copyright ⓒ The Korean Society of Food Preservation. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Oct 05, 2018; Revised: Dec 19, 2018; Accepted: Dec 24, 2018
Abstract
This study was conducted to enhance the utilization of Ligularia fischeri as a food ingredient. The effects of the location of cultivation and the harvest time on the components were examined. The crude fats and proteins in greenhouse samples (GL) were 2% higher than those in open field samples (OL). The fat content was found to increase from 4.31% to 5.27% as the harvest time was delayed. The Na contents were more than two times higher in GL than in OL. Moreover, the amount of free sugars in leaves differed slightly according to the harvest time but decreased overall as the harvest time was delayed. The total polyphenols increased from 202.53 to 389.16 mg% in OL and 293.57 to 439.40 mg% in GL as the harvest time was delayed. The levels of total flavonoids in OL and GL ranged from 105.58 to 202.79 mg% and 135.84 to 216.96 mg%, respectively. These increased from 0.3 to 2 times upon delaying the harvest time. The samples were also analyzed for the presence of five catechin compounds, namely, (-)-epigallocatechin (EGC), (+)-catechin (CE), (-)-epigallocatechin gallate (EGCG), (-)-epicatechin gallate (ECG), and (-)-gallocatechin gallate (GCG). EGC and CE were detected in both OL and GL, while EGCG, ECG, and GCG were detected only in OL at low concentrations. The 4-Ο-caffeoylquinic acid content in GL was higher than that in OL, except in the early stages of harvesting.
Keywords: Ligularia fischeri; cultivated method; catechin; 4-Ο-caffeoylquinic acid; food quality characteristics
서 론
산채류인 곰취(Gomchwi, Ligularia fischeri, LF)는 다년생 국화과 식물로서 중국, 한국, 일본 및 러시아 등의 극동아시아에서 표고 1,000 m 고지대(1)와 주로 개울과 경사지 주변의 습지고 그늘진 음지에서 잘 자란다(2,3). 우리나라에서는 잎을 쌈이나 무침 등의 신선채소류(fresh vegetable)와 묵나물 등으로 식용하기 위하여 오랫동안 재배되었다(2,4,5). 곰취는 다 자라면 높이가 1-2 m 정도이고, 꽃은 황색으로 7-9월에 피며, 열매는 수과로 길이가 6-10 mm 정도이다(6). 곰취 종자의 최적 발아온도는 15℃ 정도이고, 휴면기간은 15-30일 정도 소요되며, 발아율은 6.9-75.5% 정도인데, 발아율을 높이기 위해서 저온 습윤처리와 GA3 100 ppm 침지처리, BA 처리 등을 종자처리하기도 한다(2,7-9). 곰취는 광포화도가 낮은 음지식물이기 때문에 하계에는 차광처리나 임간재배로 생산성을 높일 수 있고, 비교적 습윤한 지하부 환경이 생육에 적합한 산채류이다(4,10-14). 곰취의 최적 생산시기는 4월 중순에서 5월말 정도이며, 여름에는 병해충의 발생이 많아져서 가공용으로 출하시 이에 대한 대책이 필요하다(13,15).
최근에는 시설내 수경재배를 이용한 연중생산에 대한 연구가 이루어지고 있으며, 비교적 수익성이 높은 재배작물이다(16,17). 최근에 곰취잎에서 생리활성을 높이는 caffeoylqunic acid와 CQA 유도체 등의 주요 폴리페놀 성분들이 조사되어 곰취잎은 항산화작용이 높은 고부가가치 기능성 식품으로 여겨지고 있다(18-22). 또한, 곰취 뿌리 및 뿌리줄기는 호로칠(胡虜七)이라는 한약재로 사용되어 이기, 활혈, 지통, 지해, 거담 등의 효능으로 타박상, 요통, 가래, 기침, 객혈, 백일해 등을 치료한다(23). 곰취 뿌리에는 isopentenic acid, ligularone, liguloxide, liguloxidol, liguloxidol acetate 등의 유용성분이 함유되어 있다(6). 우리나라에서 곰취를 이용한 식품개발 연구를 보면 김치(24), 국수(25), 혼합양조간강(26), 설기떡(27), 인절미(28), 두부(29) 등이 있으며, 밀가루에 곰취분말을 첨가 시 곰취 분말량이 증가할수록 대조군보다 높은 온도에서 호화가 개시되고(25), 일반성분과 당도는 첨가량이 증가할수록 유의적으로 증가한다고 보고되어 있다(30). 이상과 같이 곰취는 영양성과 기능성이 뛰어나 식품의 소재로의 활용가치가 높으며 국내에서 생산량과 생산면적이 점차 증가하고 있으며, 소비 역시 증가하는 현황을 보이고 있다. 그러나 현재 곰취는 강원도 및 고산지대를 중심으로 자생지에서 직접 채취하거나 노지에서 보통재배의 형태로 주로 생산되고 있는 실정이다. 따라서 다양한 재배환경조절이 가능한 시설재배로 생산성을 높이고 연중생산과 더불어 영양성과 기능성을 높일 수 있는 수경재배 등 첨단시설재배로의 전환이 필요하다. 곰취 시설재배는 자생지 수확 및 노지재배에 비해 생력적이며, 소규모 면적에서 집약적 생산이 가능하고, 최적의 재배환경조절로 곰취의 생산성 및 품질과 기능성을 향상시킬 수 있는 장점이 있다. 하지만 현재까지 곰취의 육묘, 온실 및 노지재배에 따른 기능성분과 영양성분 차이에 대한 연구가 없다. 따라서 본 연구는 곰취의 노지와 하우스재배의 생육환경에 따른 기능성분과 영양성분 차이에 대한 연구를 통해 식품학적 및 가공적 특성에 대한 기초자료를 제공함으로써 곰취의 시설재배를 통한 대량생산과 대중화를 위한 기반을 마련하고자 하였다.
재료 및 방법
실험재료 및 시약
본 실험에 사용된 곰취(Ligularia fischeri)는 노지(전남 화순군 북면 노기리 산 1)와 하우스(전남 담양군 고서면 성월리 349-1)에서 시기별로 채취한 시료를 사용하였다. 2017년 5월부터 2017년 6월까지 4회에 걸쳐 수확하였으며 동결 건조하여 분쇄한 다음 -20℃에서 보관하면서 시료로 사용 하였다. 본 실험에서 사용된 분석 및 추출, chromatography 사용 용매인 ethanol(HPLC용), acetonitrile (HPLC용) 및 methanol(HPLC용)은 J.T.Baker사(NJ, USA) 시약을 사용하였고, Folin-Ciocalteu’s reagent는 Millipore사(Darmstadt, Germany)의 것을 구입하여 사용하였다.
일반성분 분석
일반성분 분석은 AOAC 표준분석법(31)에 따라 실시하였다. 수분은 105℃ 상압가열건조법, 회분은 550℃ 회화처리, 조단백질의 함량은 Kjeldahl법, 조지방은 Soxhlet 추출법으로 측정하였다.
무기성분 분석
무기성분은 건식분해법(32)으로 전처리하여 분석하였다. 곰취 시료 0.5 g을 칭량하여 550-600℃로 회화시킨 후 증류수 1 mL와 질산 0.5 mL를 가하여 heating plate에서 백연현상이 일어날 때 까지 가열 시킨 다음 질산 0.5 mL를 가한 후 증류수 100 mL로 정용하여 검액으로 하였다. 각 무기성분의 정량은 원자흡광비색계(Perkin Elmer Analyst 300, Perkin Elmer Co., Norwalk, CT, USA)로 각 원소(K; 766.5 nm, Mg; 285.2 nm, Na; 589.0 nm, Ca; 422.7 nm, Fe; 248.3 nm, Zn; 214.9 nm)의 표준용액 농도를 1, 3 및 5 ppm으로 조제하여 표준검량 곡선을 작성하여 분석하였다.
유리당 분석
유리당 성분은 Gancedo와 Luh(33)의 방법에 따라 분석하였다. 시료 2 g에 증류수를 가하고 homogenizer(OGAWA SEIKI Co., Ltd., Tokyo, Japan)로 마쇄하여 교반, 침출시킨 후 10 mL로 정용한 다음 원심분리(3,000 ×g, 30 min)한 후 원심 분리한 상등액을 취하여 여과(Whatman No.2, Toyo Roshi Kaishi Ltd., Tokyo, Japan)하고 Sep-pak C18으로 정제시킨 다음 0.45 μm membrane filter (Millipore Co., Billerica, MA, USA)로 여과한 여액으로 HPLC를 이용하여 분석하였다. Column은 Prevail Carbohydrate ES 5 μ(ID 4.6×250 mm, Grace Co., Deerfield, IL, USA)를 사용하였으며, mobile phase는 75% acetonitrile, flow rate는 0.6 mL/min, detector는 Evaporative Light Scattering Detector 2000ES(Alltech Co., Deerfield, IL, USA)를 사용하여 분석하였으며, 함량은 외부표준법으로 나타내었다
유기산 분석
유기산 분석은 각각의 시료 10 g에 증류수를 가해 추출시킨 후 100 mL로 정용한 다음 3,000 rpm에서 30분간 원심 분리 후 상징액을 취하여 여과(Whatman No.2, Toyo Roshi Kaishi Ltd.)하고, Sep-pak C18으로 정제시킨 다음 0.45 μm membrane filter(Millipore Co., Billerica, MA USA)로 여과한 여액 HPLC(Waters M510, Waters Co., Milford, MA, USA)로 분석하였고, column은 organic acid column(ID 4.6×250 mm, Grace Co., Waukegan, IL, USA)를 사용하였으며, mobile phase는 0.2 mM potassium dihydrogen phosphate buffer KH2PO4, flow rate는 1.0 mL/min, detector는 diode array detector(1100 Series, Agilent Co., Oceanside, CA, USA)를 사용하여 함량은 외부표준법으로 나타내었다.
Total polyphenol 분석
Total polyphenol 함량은 시료 5 g을 취해 70% ethanol 50 mL로 80℃에서 환류 추출한 후 Folin-Denis법(34)법에 따라 총 폴리페놀 함량을 정량하였다. 즉, 추출물 1 mL에 Folin시약 1 mL을 첨가하고 3분후에 5% Na2CO3 2.5 mL을 가하여 혼합하여 실온에서 1시간 반응시켰다. UV-spectrometer (Epoch. Biotek., VT 05404, Winooski, VT, USA)를 사용하여 660 nm에서 흡광도를 측정하였으며 표준물질 garlic acid를 기준으로 환산하여 나타내었다.
Total flavonoid 분석
Total flavonoids 함량측정은 Moreno 등(35)의 방법에 따라 변형하여 측정하였다. 시료 0.2 mL에 10% aluminiun nitrate 0.1 mL, 1 M potassium acetate 0.1 mL, 80% ethanol 4.6 mL를 가한 후 실온에서 40분간 반응 시킨 후 UV-spectrometer(Epoch. Biotek., VT 05404)를 사용하여, 415 nm에서 흡광도 측정하였다. 표준물질 quercetin을 기준으로 환산하여 나타내었다.
Catechins 분석
시료용액의 제조는 곰취 10 g을 200 mL의 플라스크에 취하여 증류수는 100 mL를 가한 후 80℃의 열탕 속에서 10분간 가온 추출하였다. 실온에서 냉각한 후 증류수를 가하여 100 mL로 정용하고 여과지로 여과한 여과액 50 mL에 50 mL의 클로로포롬을 가해 카페인을 제거하였다. 카페인을 제거한 추출액을 ethaylacetate 50 mL를 가하여 catechin류를 추출하여 감압 농축 후 다시 ethylacetate 5 mL로 정용하여 0.45 μm의 membrane filter를 통과 시켜 정제한 후 HPLC를 이용하여 catechin 함량을 분석하였다(36,37). Column은 Capcell pak C18 column(250 mm L×4.6 mm I.D, Shiseido Co., Tokyo, Japan)를 사용하였고, mobile phase는 acetonitrile:ethyl acetate:0.1% H3PO4=12:2:86(v/v/v), flow rate는 1.0 mL/min, detector는 Waters 2489 UV detector 280 nm(Waters Co., Milford, MA, USA)를 사용하여 함량은 외부표준법으로 나타내었다.
4-Ο-Caffeoylquinic acid 분석
4-Ο-Caffeoylquinic acid 분석은 Ganzon 등(38)의 방법으로 분석하였다. 즉, 시료 1 g에 50% methanol을 10 mL 가한 후 초음파 세척기에서 30분간 추출하였으며, 이 과정을 3반복하여 50 mL로 정용하여 시료 용액으로 사용하였다. 이 시료용액을 0.45 μm membrane filter(Millipore Co.,)로 여과하여 HPLC를 이용하여 분석하였다. 분석조건은 Table 1과 같으며, 함량은 외부표준법으로 계산하였다.
Table 1.
HPLC condition for the analysis of 4-Ο-caffeoylquinic acid
|
Item |
Condition |
|
Instrument |
Waters Alliance e2695
(Waters Co.) |
|
Detector |
Waters 2489 UV detector 280 nm
(Waters Co.) |
|
Column |
Capcell pac C18 column
(Shiseido Co., 250 mm L×4.6 mm I.D) |
|
Solvent |
|
0.05% TFA (A), Acetonitrile (B) |
|
|
|
Time |
A |
B |
|
|
|
0 |
99 |
1 |
|
|
10 |
92 |
8 |
|
20 |
92 |
8 |
|
25 |
88 |
12 |
|
35 |
88 |
12 |
|
40 |
84 |
16 |
|
50 |
84 |
16 |
|
55 |
80 |
20 |
|
65 |
80 |
20 |
|
|
|
|
|
Column temp. |
40℃ |
|
Flow rate |
1.0 mL/min |
|
Injection volume |
10 μL |
Download Excel Table
통계분석
실험결과는 3회 반복 측정하여 SPSS 버전 program을 사용하였고, mean±SD을 구하였으며 Duncan’s multiple range test로 시료간의 유의차를 다중 비교법으로 분석하였다.
결과 및 고찰
일반성분 함량
곰취의 생육환경 및 채취시기에 따른 일반성분 분석결과는 Table 2와 같다. 5월 10일에 채취한 노지재배 곰취의 일반성분 함량은 수분 1.21%, 조단백질 15.65%, 조지방 4.62%, 조회분 14.25%이며, 5월 17일에 채취한 노지재배 곰취는 수분 1.42%, 조단백질 15.31%, 조지방 4.19%, 조회분 14.63%, 6월 2일에 채취한 노지재배 곰취의 수분 함량은 1.28%, 조단백질 15.98%, 조지방 4.37%, 조회분 14.76%이었으며, 6월 19일에 채취한 노지재배 곰취의 조수분 함량은 1.18%, 조단백질 15.68%, 조지방 4.31%, 조회분 14.58%로 노지재배 곰취의 채취시기별 일반성분 함량은 유의적인 차이가 나타나지 않았다. 하우스에서 재배한 곰취의 일반성분 함량은 5월 10일에 채취한 곰취의 경우 수분 함량 1.20%, 조단백질 16.85%, 조지방 5.24%, 조회분 14.47%이며, 5월 17일에 채취한 곰취의 수분 함량은 1.52%, 조단백질 16.47%, 조지방 5.13%, 조회분 14.82% 함량이었다. 6월 2일에 채취한 하우스 곰취의 수분 함량은 1.35%, 조단백질 16.83%, 조지방 5.10%, 조회분 14.35%이었고, 6월 19일에 채취한 곰취의 수분 함량은 1.71%, 조단백질 15.97%, 조지방 5.27%, 조회분 13.87%로 하우스 곰취 또한 채취시기별 일반성분 함량은 유의적인 차이를 보이지 않았다. 생육 환경에 따른 일반성분 함량 차이를 보면 하우스재배 곰취가 노지재배 곰취의 수분 함량에 비해 약간 높게 나타났고, 조단백질 함량과 조지방 함량 또한 하우스재배 곰취가 노지 재배 곰취보다 약 2% 정도 높게 나타났다. 조회분의 경우 생육환경별 유의적인 차이를 보이지 않았다. 곰취에서 일반 성분의 경우 노지재배와 하우스재배 등의 생육환경에 따라 다소 차이를 보인다고 여러 연구에서 보고되어 있다(39). 이러한 함량 차이는 생육 환경이 하우스와 노지가 다른 환경을 갖고 있기 때문에 나타나는 결과로 판단된다.
Table 2.
Proximate composition of Ligularia fischeri according to growing place and harvest time
(unit: %)
|
Sample1)
|
Harvest time |
Moisture |
Crude protein |
Crude fat |
Crude ash |
|
OL |
May 10th
|
1.21±0.422)e3)
|
15.65±0.42d
|
4.62±0.34c
|
14.26±0.51f
|
|
May 17th
|
1.42±0.11c
|
15.31±0.27e
|
4.19±0.24d
|
14.36±0.50e
|
|
June 2nd
|
1.28±0.51e
|
15.98±1.36c
|
4.37±0.14d
|
14.76±0.52b
|
|
June 19th
|
1.18±0.23f
|
15.68±0.21d
|
4.31±0.05d
|
14.58±0.41c
|
|
GL |
May 10th
|
1.20±0.08f
|
16.85±0.81a
|
5.24±0.10ab
|
14.47±0.23d
|
|
May 17th
|
1.52±0.12b
|
16.47±1.05b
|
5.13±0.14b
|
14.82±0.57a
|
|
June 2nd
|
1.35±0.33d
|
16.83±1.17a
|
5.10±0.18b
|
14.35±0.88e
|
|
June 19th
|
1.71±0.19a
|
15.97±2.33c
|
5.27±0.18a
|
13.87±0.69g
|
Download Excel Table
무기 성분 함량
곰취의 생육환경 및 채취시기에 따른 무기성분 분석결과는 Table 3과 같다. 노지 곰취의 경우 5월 10일 채취 시료는 potassium 506.05 mg%, calcium 213.75 mg%, sodium 66.76 mg%, magnesium 161.61 mg%, zinc 7.89 mg% 및 iron 0.37 mg%였고, 5월 17일 채취시료는 potassium 590.52 mg%, calcium 225.98 mg%, sodium 66.23 mg%, magnesium 161.97 mg%, zinc 8.11 mg% 및 iron 0.38%이었다. 6월 2일 채취시료는 potassium 550.11 mg%, calcium 238.71 mg%, sodium 60.30 mg%, magnesium 178.96 mg%, zinc 7.23 mg% 및 iron 0.36%로 나타났고, 6월 19일 채취시료는 potassium 628.95 mg%, calcium 208.89 mg%, sodium 54.67 mg%, magnesium 160.83 mg%, zinc 7.32 mg% 및 iron 0.31 mg%로 나타났다. 검출된 무기성분 중 주요 무기성분은 potassium과 calcium으로 확인이 되었다. 채취시기에 따른 무기 성분 함량 변화를 보면 potassium의 함량은 채취시기가 경과할수록 높아지는 경향을 보였고, sodium 함량은 감소하는 경향을 보였으며, 그 외 성분은 유의적인 차이를 보이지 않았다. 하우스재배 곰취의 무기성분 함량은 5월 10일 채취시료는 potassium 598.86 mg%, calcium 287.71 mg%, sodium 131.60 mg%, magnesium 212.01 mg%, zinc 9.47 mg% 및 iron 0.49 mg%였고, 5월 17일 채취시료는 potassium 660.84 mg%, calcium 290.33 mg%, sodium 131.71 mg%, magnesium 209.71 mg%, zinc 8.31 mg% 및 iron 0.49 mg%이었다. 6월 2일 채취시료는 potassium 611.28 mg%, calcium 292.03 mg%, sodium 121.34 mg%, magnesium 198.51 mg%, zinc 8.57 mg% 및 iron 0.46 mg%였고, 6월 19일 채취시료는 potassium 662.47 mg%, calcium 289.84 mg%, sodium 119.94 mg%, magnesium 202.25 mg%, zinc 8.45 mg%, iron 0.51 mg%로 나타났다. 하우스재배 곰취 또한 주요 무기성분은 potassium과 calcium으로 확인이 되었고, 노지재배 곰취와 비교해 potassium, calcium, sodium, magnesium, zinc 및 iron 성분 모두 하우스재배 곰취가 높게 나타났다. 특히 sodium 함량은 하우스재배 곰취가 노지재배 곰취에 비해 2배 이상으로 나타났다. Hwang 등(40)이 조사한 약초중의 무기성분 함량 중 국화의 경우 potassium이 가장 많은 함량을 나타내었으며, 다음으로 calcium이 높게 함유되어 있는 것으로 보고하여 본 연구와 같은 경향을 나타내었다.
Table 3.
The contents of minerals in Ligularia fischeri according to growing place and harvest time
(unit: mg%)
|
Sample1)
|
Harvest time |
Component |
|
K |
Ca |
Na |
Mg |
Zn |
Fe |
|
OL |
May 10th
|
506.05±76.952)h3)
|
213.75±35.86c
|
66.76±10.80c
|
161.61±14.22d
|
7.89±1.34c
|
0.37±0.01b
|
|
May 17th
|
590.52±57.48f
|
225.98±25.44bc
|
66.23±6.26c
|
161.97±4.72d
|
8.11±0.08bc
|
0.38±0.01b
|
|
June 2nd
|
550.11±46.41g
|
238.71±26.21b
|
60.30±4.49cd
|
178.96±25.67c
|
7.23±0.14c
|
0.36±0.04b
|
|
June 19th
|
628.95±62.43c
|
208.89±31.72c
|
54.67±0.51d
|
160.83±10.47d
|
7.32±0.21c
|
0.31±0.01c
|
|
GL |
May 10th
|
598.86±30.60e
|
287.71±17.84a
|
131.60±2.28a
|
212.01±18.05a
|
9.47±0.21a
|
0.49±0.02a
|
|
May 17th
|
660.84±98.53b
|
290.33±28.12a
|
131.71±7.79a
|
209.71±29.15a
|
8.31±1.13b
|
0.49±0.01a
|
|
June 2nd
|
611.28±73.45d
|
292.03±13.16a
|
121.34±5.49b
|
198.51±16.72b
|
8.57±0.63b
|
0.46±0.00a
|
|
June 19th
|
662.47±37.19a
|
289.84±16.24a
|
119.94±6.51b
|
202.25±9.99ab
|
8.45±1.41b
|
0.51±0.02a
|
Download Excel Table
유리당 함량
식물은 광합성을 통해 포도당을 생성하고, 생성된 포도당을 녹말 및 셀롤로오스 등의 형태로 저장하며, 우리 인간에게 매우 중요한 에너지 공급원으로 활용된다(41). 이러한 이유로 곰취의 생육환경 및 채취시기에 따른 유리당 함량을 측정 결과는 Table 4와 같다. 곰취에서 검출된 유리당은 fructose, glucose 및 sucrose 3종의 유리당이 검출되었으며, 그 중 glucose의 함량이 fructose와 sucrose 함량에 비해 큰 차이를 보이며 높게 나타났다. 이는 앞서 설명한 바와 같이 광합성을 통해 1차 포도당을 생성하는 과정에서 나타난 결과라고 판단된다. 채취 시기별 총 유리당 함량을 보면 최초 채취 시기인 5월 10일 곰취의 채취 시기가 늦은 시료구에 비해 35-90배 이상 높은 함량을 보였다. 특히 곰취의 주요 유리당으로 확인된 glucose의 함량 차이가 크게 나타났다. 이러한 결과는 생육 초기에 광합성 작용이 활발히 일어나 glucose가 많이 생성되어 나타난 결과로 판단된다. 생육 환경에 따른 총 유리당 함량은 5월 10일 채취 시료구의 경우 노지재배 곰취가 3,513.87 mg%로 하우스재배 곰취의 2,243.73 mg%에 비해 높은 함량을 보였다. 이러한 결과는 앞서 일반성분을 분석한 결과와 연계해서 볼 때 하우스재배 곰취가 수분 함량은 차이를 보이지 않았지만 조단백질, 조지방 및 조회분 함량은 노지재배 곰취에 비해 모두 약간씩 높았기 때문에 가용성 무기 질소물의 함량이 낮아져 나타난 결과로 판단된다. 6월 2일 이후 채취된 시료구부터는 노지재배 곰취와 하우스재배 곰취의 총 유리당 함량 차이가 크지 않았다. Kim(11)은 곰취의 생육환경에 따른 광합성율을 조사한 결과 광도가 증가함에 따라 광합성율이 높아짐을 보고하였으며, 차광처리에 의한 곰취 또한 같은 경향을 나타내었음을 보고였다. 본 연구의 하우스재배 곰취의 경우 차광처리에 의한 영향으로 노지재배 곰취보다 낮은 광합성율을 나타낼 것으로 사료되어 노지재배 곰취보다 낮은 유리당 함량을 나타낸 것으로 판단된다.
Table 4.
The content of free sugars in Ligularia fischeri according to growing place and harvest time
(unit: mg%)
|
Sample1)
|
Harvest time |
Fructose |
Glucose |
Sucrose |
Total free sugars |
|
OL |
May 10th
|
20.38±5.702)b3)
|
3,395.09±924.85a
|
98.40±6.01a
|
3,513.87 |
|
May 17th
|
7.56±1.27g
|
901.37±36.23c
|
46.99±0.27c
|
955.92 |
|
June 2nd
|
11.28±0.15f
|
557.40±34.69d
|
21.61±0.40d
|
590.29 |
|
June 19th
|
11.12±0.21f
|
375.00±6.60e
|
22.45±0.14d
|
408.57 |
|
GL |
May 10th
|
188.72±0.85a
|
1,968.80±119.17b
|
86.21±0.64ab
|
2,243.73 |
|
May 17th
|
13.72±0.14e
|
286.32±22.27f
|
95.56±0.96a
|
395.60 |
|
June 2nd
|
14.89±1.08d
|
389.16±0.40e
|
70.27±0.82b
|
474.32 |
|
June 19th
|
15.61±0.08c
|
360.33±12.83e
|
29.82±0.57d
|
405.76 |
Download Excel Table
유기산 함량
곰취의 생육환경 및 채취시기에 따른 유기산 함량을 측정한 결과는 Table 5와 같으며, citric acid를 비롯한 5종의 유기산이 함유되어 있었다. 검출된 유기산의 종류별 조성을 보면 노지재배 곰취의 경우 succinic acid와 citric acid 주요 유기산으로 확인 되었고, 하우스재배 곰취의 경우 oxalic acid와 tartaric acid가 주요 유기산으로 확인되어 생육 환경에 따른 주요 유기산이 차이가 있었다. 유기산의 조성이 본 연구 결과와 같이 현저히 차이가 나는 이유를 설명하기 위해선 여러 가지 요인 분석을 통해 결과를 분석해야 할 것으로 판단된다. 그러한 요인으로는 품종의 차이, 재배 환경에 따른 대사 과정의 차이, 시비 및 토양의 질 차이 등의 여러 요인이 있을 것으로 판단되며, 향후 이러한 요인을 파악하는데 추가 연구가 필요할 것으로 판단된다. 채취 시기별 곰취의 유기산 함량 변화는 oxalic acid, tartaric acid, succinic acid, acetic acid, citric acid 모두 유의적 차이를 보이지 않았다. 본 연구를 통해 곰취에는 여러 종류의 유기산이 다량 함유 되어 있었으며 이러한 유기산 함량이 여러 가지 다양한 맛에 관여할 것으로 사료 된다.
Table 5.
The content of organic acid in Ligularia fischeri according to growing place and harvest time
(unit: mg%)
|
Sample1)
|
Harvest time |
Oxalic acid |
Tartaric acid |
Acetic acid |
Citric acid |
Succinic acid |
Total organic acids |
|
OL |
May 10th
|
191.70±3.222)b3)
|
70.51±0.87d
|
13.83±0.53d
|
283.49±10.30b
|
795.65±59.31b
|
1,365.18 |
|
May 17th
|
185.85±4.63bc
|
69.86±2.79d
|
16.18±1.21d
|
375.40±27.41a
|
775.74±16.71bc
|
1,440.03 |
|
June 2nd
|
191.08±1.92b
|
103.42±8.63c
|
7.21±1.27e
|
346.37±21.03a
|
847.43±25.62a
|
1,497.51 |
|
June 19th
|
188.55±6.64bc
|
103.36±15.37c
|
7.32±0.48e
|
330.62±16.08ab
|
768.21±38.28c
|
1,417.06 |
|
GL |
May 10th
|
225.64±11.02a
|
145.47±8.89ab
|
32.01±6.91c
|
31.20±8.20d
|
92.25± 9.72e
|
536.57 |
|
May 17th
|
199.48±2.60b
|
147.42±4.19ab
|
43.74±3.78b
|
17.86±1.07e
|
98.69± 4.64de
|
524.19 |
|
June 2nd
|
198.47±3.22b
|
168.30±9.58a
|
42.06±5.57b
|
32.93±1.05d
|
85.02± 6.19e
|
528.78 |
|
June 19th
|
216.86±10.63a
|
132.82±11.53b
|
53.06±1.34a
|
30.92±2.59d
|
85.60± 5.44e
|
538.26 |
Download Excel Table
Total polyphenol과 total flavonoid 함량
Polyphenol 화합물은 대표적인 항산화 물질로서 식물계에 다수 존재하며, 항산화 및 항암 등 다양한 생리활성 기능을 가지게 된다(42). 곰취의 생육환경 및 채취시기에 따른 total polyphenol 함량 측정 결과는 Table 6과 같다. 채취 시기에 따른 total polyphenol 함량은 노지재배의 경우 5월 10일에 채취한 곰취는 202.53 mg%, 5월 17일 340.96 mg%, 6월 2일 332.17 mg%, 6월 19일 389.16 mg%로 채취시기가 지날수록 높아지는 경향을 보였으며, 하우스재배 곰취 또한 5월 10일 293.57 mg%, 5월 17일 384.44 mg%, 6월 2일 407.97 mg%, 6월 19일에 439.40 mg%로 채취시기가 지날수록 total polyphenol 함량이 높아졌다. 다양한 기능성을 갖는 total polyphenol 함량을 분석한 본 연구의 결과는 곰취의 채취 시기를 결정할 때 중요한 자료로 사용될 수 있는 결과로 판단된다. 생육 환경에 따른 total polyphenol 함량은 하우스재배 곰취가 동일한 채취일 기준으로 대부분의 시료구에서 높은 함량을 보였다. 식물에 널리 분포되어 있는 flavonoid는 polyphenol에 속하는 노란색 계열의 물질로 여러 생리활성 기능을 가진 물질이다(43). 곰취의 생육환경 및 채취시기에 따른 total flavonoid 함량 측정 결과는 Table 6과 같다. 채취시기별 노지재배 곰취의 total flavonoid 함량은 5월 10일에 채취한 곰취는 105.58 mg%, 5월 17일 168.36 mg%, 6월 2일 194.07 mg%, 6월 19일에 채취한 곰취는 202.79 mg%로 수확시기가 늦어질수록 함량이 높아지는 경향을 보였다. 하우스재배 곰취의 total flavonoid 함량 또한 5월 10일에 채취한 곰취 135.84 mg%, 5월 17일 147.77 mg%, 6월 2일 166.43 mg%, 6월 19일 216.96 mg%로 수확시기가 늦어질수록 함량이 높아졌다. Total polyphenol 화합물과 total flavonoid 화합물은 앞서 설명 한 바와 같이 밀접한 관련이 있는 화합물이며 기능성 물질로 알려져 있다. 본 연구에서의 채취 시기별 함량 변화를 측정한 결과 두 화합물의 함량 변화가 유의성 있게 나타난 결과 또한 밀접한 관련이 있을 것으로 판단된다. 생육 환경별 곰취의 total polypheonl 함량은 하우스재배 곰취 함량이 노지재배 곰취에 비해 높은 함량을 보인 반면 total flavonoids 함량의 경우 5월 17일, 6월 2일 노지재배에서 채취한 곰취 함량이 높게 나타났다. 이는 Suh 등(44)이 연구한 곰취의 수확시기별 생리활성 비교 연구 결과 수확시기에 따른 곰취의 total polyphenol과 total flavonoid 함량이 수확시기가 늦어짐에 따라 증가하는 경향을 나타내었으며, total polyphenol이 total flavonoid보다 높은 함량을 나타내는 경향을 나타내어 본 연구와 일치하는 경향을 나타내었다. Chon(45)의 차광처리에 따른 시설하우스재배 고들빼기의 생육 및 생리활성 변화 결과 차광정도가 클수록 높은 total polyphenol과 total flavonoid 함량을 보였으며, 본 연구에서 차광처리 재배한 하우스 곰취가 노지재배의 곰취보다 높은 함량을 보여 같은 경향을 나타냈다. 식물의 생리활성물질은 생육환경 스트레스에 대한 식물의 방어기작 중 하나인 것으로 알려져 있어(46), 재배환경에 따른 결과로 판단된다. 따라서 채취 시기 결정과 생육 환경을 선택할 때 total polyphenol 함량과 total flavonoid 함량을 분석한 본 자료는 유용한 자료가 될 것이다.
Table 6.
The content of total polyphenols and total flavonoids in Ligularia fischeri according to growing place and harvest time
(unit: mg%)
|
Sample1)
|
Harvest time |
Total polyphenol |
Total flavonoids |
|
OL |
May 10th
|
202.53±3.922)e3)
|
105.58±6.86d
|
|
May 17th
|
340.96±3.45c
|
168.36±0.72b
|
|
June 2nd
|
332.17±4.14cd
|
194.07±4.06a
|
|
June 19th
|
389.16±3.43c
|
202.79±2.61a
|
|
GL |
May 10th
|
293.57±2.27d
|
135.84±0.13c
|
|
May 17th
|
384.44±1.76c
|
147.77±3.45c
|
|
June 2nd
|
407.97±4.80b
|
166.43±0.60b
|
|
June 19th
|
439.40±3.32a
|
216.96±2.60a
|
Download Excel Table
Catechin 함량
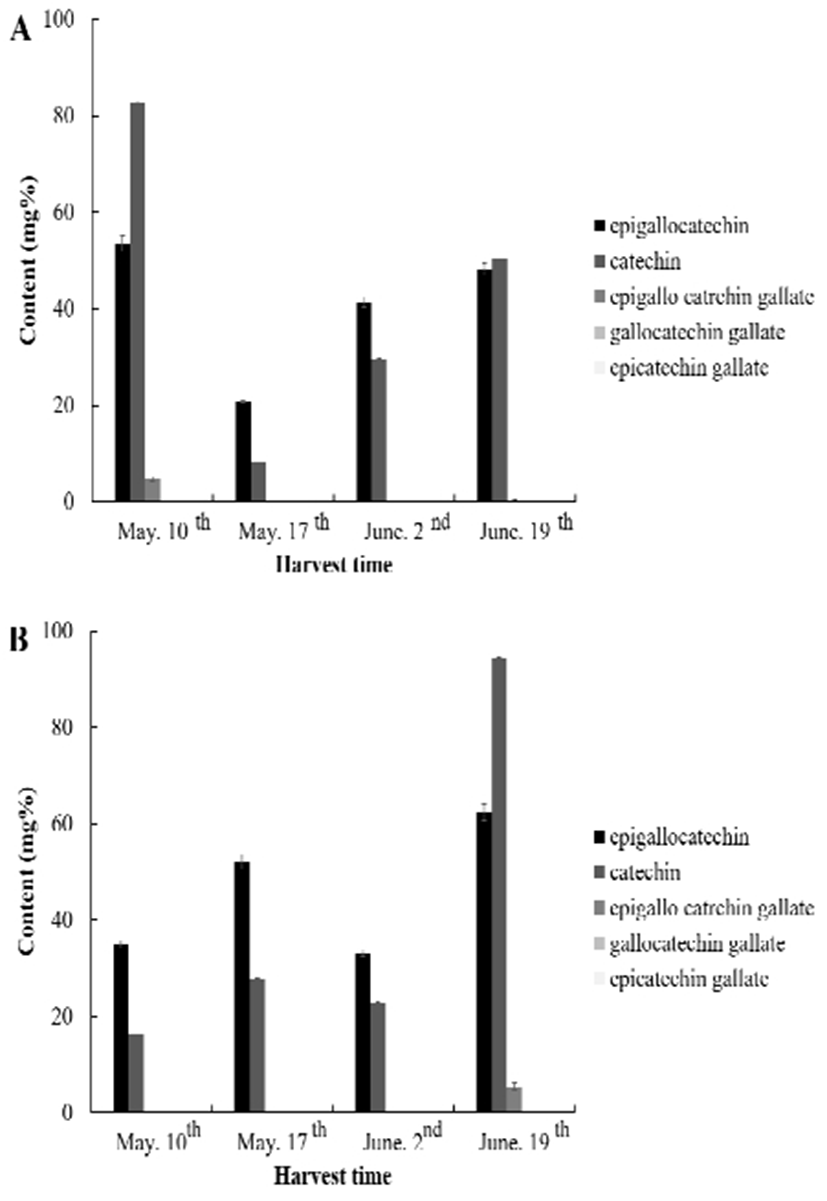
생육환경 및 채취시기에 따른 catechin 함량을 분석한 결과는 아래 Fig. 1과 같다. 5종의 catechin 중 (-)epigallocatechin (EGC)과 (+)catechin(CE)이 주로 검출되었으며, (-)epigallo catechin gallate(EGCG), (-)epicatechin gallate(ECG) 및 (-)gallocatechin gallate(GCG)는 미량 검출 되었거나 검출되지 않았다. 하우스재배 곰취의 경우 5월 10일 채취시료는 CE 함량이 82.80 mg%로 EGC 함량 53.53 mg%보다 높았으나 채취시기가 늦어짐에 따라 더 낮거나 비슷한 수준을 나타내었다. 노지재배의 경우 5월 10일 채취시료의 EGC 함량이 34.96 mg%로 CE 함량 16.20 mg% 보다 높았으나 채취시기가 늦어짐에 따라 CE의 함량이 급격하게 증가하여 EGC보다 높은 함량을 나타내었다. 따라서 하우스재배의 경우 5월 10일 채취시료가 노지재배의 경우 6월 19일 채취시료가 가장 높은 catechin 함량을 나타내었다. 생육 환경에 따른 catechin 함량은 5월 10일과 6월 2일에 수확한 곰취는 하우스 재배 환경에서 높은 catechin 함량을 보였으나, 5월 17일과 6월 19일 채취시료는 하우스 재배 시료 보다 노지 재배 시료가 높은 catechin 함량을 나타내었다. Xiong 등(47)은 Camellia sinensis L.에서 카테킨 수준과 카테킨 생합성에 관한 변화를 조사한 결과 잎이 성숙함에 따라 카테킨의 함량이 증가함을 나타내어 본 연구의 노지배재 곰취와 일치하는 경향을 나타내었으나, 하우스재배의 경우 5월 10일 채취가 높은 가장 높은 함량을 낸 후 5월 17일 채취 시료에서 급격한 감소를 나타내었으며, 이후 완만한 증가를 나타내어 노지재배 시료와 일치하는 경향을 나타내었다. 이는 시설재배의 장점인 생육속도조절에 의한 결과로 판단되며, 최적 생산시기가 4월 중순-5월말로 알려진 곰취가 시설재배로 다양한 시기에 생산 될 수 있을 것으로 판단된다.
Fig. 1.
The content of catechins in Ligularia fischeri according to growing place and harvest time.
A, Ligularia fischeri grown at greenhouse; B, Ligularia fischeri grown at open field.
All values are mean±SD.
Download Original Figure
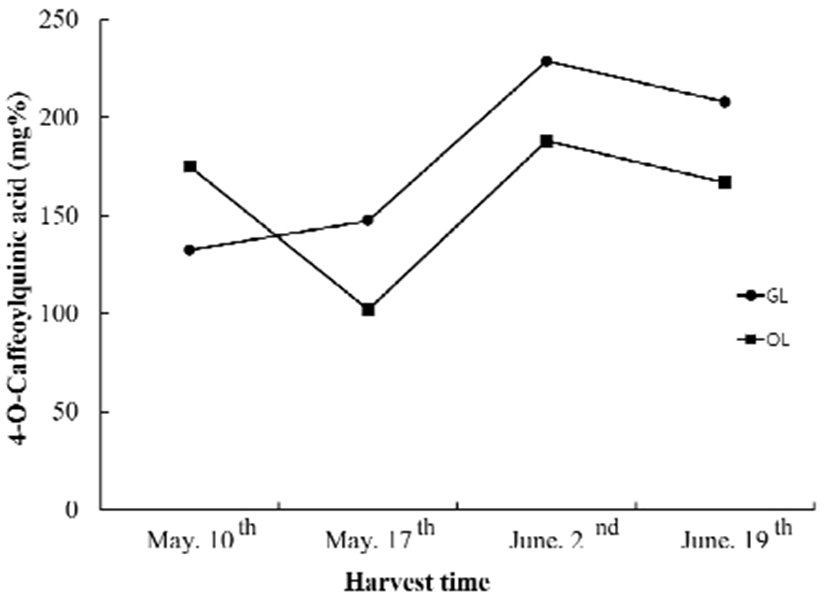
4-Ο-Caffeoylquinic acid 함량
근래에 들어 국내에서 자생하는 산채류에 함유되어 있는 caffeoylquinic acid 유도체들에 관한 연구가 증가하고 있으며 특히 국화과 산채류에는 caffoylquinic acid 유도체들이 풍부하게 함유되어 있으며 항산화, 간보호, 면역증진, 항균, 항바이러스 등 다양한 생리활성이 있음이 밝혀져 있다(48). 곰취의 생육환경과 채취시기에 따른 표준물질 4-Ο-caffeoylquinic acid 함량 측정결과는 Fig. 2와 같다. 생육환경에 따른 4-Ο-caffeoylquinic acid함량은 재배초기를 제외한 모든 시료구에서 노지의 생육환경 보다 하우스 생육환경이 높은 함량을 나타내었다. 채취시기에 따른 함량은 6월 2일 채취 시료구가 노지재배와 하우스재배 모두 다른 시료구에 비해 높게 나타났다. 5월 10일 노지재배 곰취가 하우스재배 곰취보다 높은 함량을 나타내었으나, 이후 5월 17일, 6월 2일 그리고 6월 19일 채취 시료구는 노지재배 보다 하우스재배 시료구에서 높은 함량을 나타내었다. Ganzon 등(38)은 뽕나무(Morus alba L.) 잎의 채취시기에 따른 4-Ο-caffeoylquinic acid의 함량을 분석한 결과 총 채취 12개월 중 채취 7개월째 급격한 증가를 나타내었으며, 이후 감소하는 경향을 나타내어 본 연구와 유사한 경향을 나타내었다.
Fig. 2.
The content of 4-Ο-caffeoylquinic acid in Ligularia fischeri according to growing place and harvest time.
GL, Ligularia fischeri grown at greenhouse; OL, Ligularia fischeri grown at open field.
Download Original Figure
요 약
본 연구는 곰취의 노지와 하우스재배의 생육환경에 따른 식품학적 특성과 가공적 특성의 기초 자료 제공을 목적으로 수행하였다. 생육환경에 따른 곰취의 조단백질 함량과 조지방 함량은 하우스재배 곰취가 노지재배 곰취 보다 약 2% 정도 높게 나타났다. 무기성분에서 Na 함량은 하우스재배 곰취가 노지재배 곰취에 비해 2배 이상 높게 나타났다. 곰취의 주요 유리당은 곰취의 채취시기에 따라 각 차이는 있었으나, 전체적으로 노지재배에 비하여 하우스재배 곰취에서 감소하는 경향을 나타내었다. 유리당의 함량은 glucose > sucrose > fructose 순으로 나타났다. 주요 유기산은 노지재배 곰취의 경우 succinic acid와 citric acid 등의 주요 유기산으로 확인되었고, 하우스재배 곰취의 경우 oxalic acid와 tartaric acid가 주요 유기산으로 확인되어 생육환경에 따른 주요 유기산이 차이가 있었다. 곰취의 총 폴리페놀 함량 변화를 보면 전체적으로 채취시기의 경과에 따라 증가하는 경향을 보였는데, 노지재배의 경우 202.53-389.16 mg%, 하우스재배의 경우 293.57-439.40 mg% 순으로 수확시기가 늦어질수록 약 1.5-2배 정도 증가하는 것으로 나타났다. 총 플라보노이드 함량 변화는 노지재배의 경우 105.58-202.79 mg%, 하우스재배의 경우 135.84-216.96 mg% 순으로 수확시기가 늦어질수록 0.3-2배 정도 증가하는 것으로 나타났다. 곰취의 생육환경에 따른 카테킨 함량 변화는 노지재배와 하우스재배에서 5종의 catechin 중 (-)epigallocatechin(EGC)과 (+)catechin(CE)가 주로 검출되었으며, (-)epigallo catechin gallate(EGCG), (-)epicatechin gallate(ECG) 및 (-)gallocatechin gallate(GCG)는 노지재배 곰취에서 미량 검출 되었다. 생육환경에 따른 4-Ο-caffeoylquinic acid 함량은 재배초기를 제외한 모든 시료구에서 노지재배보다 하우스재배에서 높은 함량을 나타내었다.
Acknowledgements
이 논문은 2018년 순천대학교 학술연구비 Ⅲ로 연구되었습니다. 이에 감사드립니다.
References
AhnSY. 2014; Studies on botanical characteristics and functional materials of Korean native plant resources in Gangwon Baekdudaegan. et al.Kangwon National University. Korea: p. 35.

Choi EM (2007) Ligularia fischeri leaf extract prevents the oxidative stress in DBA/1J mice with type II collagen-induced arthritis. J Appl Toxicol, 27, 176-182
ChoiEM. 2007;
Ligularia fischeri leaf extract prevents the oxidative stress in DBA/1J mice with type II collagen-induced arthritis. J Appl Toxicol. 27:176-182


Xie WD, Weng CW, Li X, Row KH (2010) Eremophilane sesquiterpenoids from Ligularia fischeri. Helv Chim Acta, 93, 1983-1989
XieWD, WengCW, LiX, RowKH. 2010; Eremophilane sesquiterpenoids from
Ligularia fischeri. Helv Chim Acta. 93:1983-1989


KwonKW, KimGN, ChoMS. 2009; Physiological responses of the three wild vegetables under different shading treatment. J Korean For Soc. 98:106-114.

An SJ, Park HS, Kim GH (2014) Evaluation of the antioxidant activity of cooked Gomchwi (Ligularia fischeri) using the myoglobin methods. Prev Nutr Food Sci, 19, 34-39
AnSJ, ParkHS, KimGH. 2014; Evaluation of the antioxidant activity of cooked
Gomchwi (
Ligularia fischeri) using the myoglobin methods. Prev Nutr Food Sci. 19:34-39


BaeKH. 2000; The medical plants of Korea. Gyohaksa. Seoul, Korea: p. 510.

YooKO, AhnSD, ChunIJ, HongJK, YooCY, KimJH, KimSC, LimHT. 1996; Comparative studies of the five edible mountain vegetables by DNA marker fingerprinting. Korean J Plant Res. 9:305-310.

Lee KC, Lee SG, Lee U, Noh HS, Lee JH (2016) Several factors affecting seed emergence, seedling quality and survival of potted seedling on Ligularia fischeri. J Korean For Soc, 105, 63-72
LeeKC, LeeSG, LeeU, NohHS, LeeJH. 2016; Several factors affecting seed emergence, seedling quality and survival of potted seedling on
Ligularia fischeri. J Korean For Soc. 105:63-72


ChoDH, ParkCH, ParkBJ, ShinSE, LeeKC, YuCY, AhnSD. 1997; Effects of growth regulators, temperature, and light on the germination in wild vegetable (Chwinamul) seeds. Korean J Plant Res. 10:39-44.

Han SS, Jeon SR, Sa JY, Lee GC (2008) Characteristics of physiological responses of Ligularia fischeri, Ligularia stenocephala, Ligularia fischeri (Ledebour) Turczaninow var. spiciformis Nakai leaves. Paper presented at summer academic presentation of Korean Forestry Society, August 21th, Jeonbuk, p 249-252
HanSS, JeonSR, SaJY, LeeGC. 2008; Characteristics of physiological responses of Ligularia fischeri, Ligularia stenocephala, Ligularia fischeri (Ledebour) Turczaninow var. spiciformis Nakai leaves. In: Paper presented at summer academic presentation of Korean Forestry SocietyAugust 21
th,, Jeonbuk p. 249-252
Kim GT (2003) A study on the growth, photosynthetic rate and chlorophyll contents of Ligularia fischeri by the growing sites. J Korean For Soc, 92, 4, 374-379
KimGT. 2003; A study on the growth, photosynthetic rate and chlorophyll contents of
Ligularia fischeri by the growing sites. J Korean For Soc. 92(4):374-379.

Cho MS, Kim GN, Park GS, Lee SW (2010) Physiological responses of Allium victorialis var. platyphyllum, Ligularia fischeri and Ligularia stenocephala growing at different fertilizing schemes. J Bio-environement Control, 19, 97-108
ChoMS, KimGN, ParkGS, LeeSW. 2010; Physiological responses of
Allium victorialis var.
platyphyllum, Ligularia fischeri and
Ligularia stenocephala growing at different fertilizing schemes. J Bio-environement Control. 19:97-108.

Lee HS, Ahn CH, Kim CW, Lee JS (2009) Cultivation of Ligularia fischeri, Ligularia stenocephala, and Allium vitorialis var. platyphyllum in broad-leaved deciduous forest. Paper presented at summer academic presentation of Korean Forestry Society, August 19, Seoul, p 111-113
LeeHS, AhnCH, KimCW, LeeJS. 2009; Cultivation of Ligularia fischeri, Ligularia stenocephala, and Allium vitorialis var. platyphyllum in broad-leaved deciduous forest. In: Paper presented at summer academic presentation of Korean Forestry Society; August 19, Seoul p. 111-113
Han SS, Lee KC, Jeon SR (2010) Studies on the agroforestry methods of wild edible greens (IV): Water relations parameters of three Ligularia species leaves obtained from P-V curves. J Korea For Soc, 99, 131-135
HanSS, LeeKC, JeonSR. 2010; Studies on the agroforestry methods of wild edible greens (IV): Water relations parameters of three
Ligularia species leaves obtained from P-V curves. J Korea For Soc. 99:131-135.

Moon YG, Kim SW, Choi JK, Kwon SB, Shim HS, Ju HJ, Choi IY (2015) Stem rot on Ligularia fischeri caused by Sclerotium rolfsii in Korea. Res Plant Dis, 21, 36-39
MoonYG, KimSW, ChoiJK, KwonSB, ShimHS, JuHJ, ChoiIY. 2015; Stem rot on
Ligularia fischeri caused by
Sclerotium rolfsii in Korea. Res Plant Dis. 21:36-39


Hong CK, Bang SB, Kwon SB, Kim SC, Mo YM (1997) Studies on the nutri-culture of major wild vegetable Ligularia fischeri Turcz.: I. Growth and yield of Ligularia fischeri Turcz. by media, amount of media and planting density in nutri-culture. Korean J plant Res, 10, 401-410
HongCK, BangSB, KwonSB, KimSC, MoYM. 1997; Studies on the nutri-culture of major wild vegetable
Ligularia fischeri Turcz.: I. Growth and yield of
Ligularia fischeri Turcz. by media, amount of media and planting density in nutri-culture. Korean J plant Res. 10:401-410.

Park SB, Kim MJ, Park YM, Hwang SI, Kim EG (2012) Profitability analysis for Ligularia fischeri forest farming. J Korean For Soc, 101, 426-433
ParkSB, KimMJ, ParkYM, HwangSI, KimEG. 2012; Profitability analysis for
Ligularia fischeri forest farming. J Korean For Soc. 101:426-433.

Bae JH, Yu SO, Kim YM, Chon SU, Kim BW, Heo BG (2009) Physiological activity of methanol extracts from Ligularia fischeri and their hyperplasia inhibition activity of cancer cell. J Bio-Environment Control, 18, 67-73
BaeJH, YuSO, KimYM, ChonSU, KimBW, HeoBG. 2009; Physiological activity of methanol extracts from
Ligularia fischeri and their hyperplasia inhibition activity of cancer cell. J Bio-Environment Control. 18:67-73.

Shang YF, Kim SM, Song DG, Pan CH, Lee WJ, Um BH (2010) Isolation and identification of antioxidant compounds from Ligularia fischeri. J Food Sci, 75, 530-535
ShangYF, KimSM, SongDG, PanCH, LeeWJ, UmBH. 2010; Isolation and identification of antioxidant compounds from
Ligularia fischeri. J Food Sci. 75:530-535


Kim SM, Jeon JS, Kang SW, Jung YJ, Ly LN, Um BH (2012) Content of antioxidative caffeoylquinic acid derivatives in field-grown Ligularia fischeri (Ledeb.) Turcz and responses to sunlight. J Agric Food Chem, 60, 5597-5603
KimSM, JeonJS, KangSW, JungYJ, LyLN, UmBH. 2012; Content of antioxidative caffeoylquinic acid derivatives in field-grown
Ligularia fischeri (Ledeb.) Turcz and responses to sunlight. J Agric Food Chem. 60:5597-5603


Kim GN, Cho MS, Kwon KW (2010) Analysis of growth performance and ascorbic acid contents of Allium victorialis var. platyphyllum, Ligularia fischeri, and L. stenocephala under changing light intensity. J Korean For Soc, 99, 1, 68-74
KimGN, ChoMS, KwonKW. 2010; Analysis of growth performance and ascorbic acid contents of
Allium victorialis var.
platyphyllum, Ligularia fischeri, and
L. stenocephala under changing light intensity. J Korean For Soc, 99. 1:68-74.

Choi EM, Ding Y, Nguyen HT, Park SH, Kim YH (2007) Antioxidant activity of Gomchi (Ligularia fischeri) leaves. Food Sci Biotechnol, 16, 710-714
ChoiEM, DingY, NguyenHT, ParkSH, KimYH. 2007; Antioxidant activity of
Gomchi (
Ligularia fischeri) leaves. Food Sci Biotechnol. 16:710-714.

LeeCB. 2003; An illustrated guide to Korea flora. Hyung MunSa Pubilshing Co Inc. Seoul, Korea: p. 910.

Lee SY (2010) Fermentative characteristics, health functional activity, and quality evaluation of Ligularia fischeri and Spinacia oleracea kimchis. MS Thesis, The Catholic University of Korea, Korea
LeeSY. 2010 Fermentative characteristics, health functional activity, and quality evaluation of Ligularia fischeri and Spinacia oleracea kimchis. et al.The Catholic University of Korea. Korea: .

Park BH, Joo HM, Cho HS (2014) Quality characteristics of dried noodles added with Ligularia fischeri powder. Korean J Food Culture, 29, 205-211
ParkBH, JooHM, ChoHS. 2014; Quality characteristics of dried noodles added with
Ligularia fischeri powder. Korean J Food Culture. 29:205-211


KangIJ, HamSS, ChungCK, LeeSY, OhDH, DoJJ. 1999; Production and characteristics of fermented soy sauce from mountain herbs. Korean J Food Sci Technol. 31:1203-1210.

Kang YS, Kim JS (2011) Quality characteristics of Sulgidduk supplemented with Ligularia fischeri powder. J East Asian Soc Dietary Life, 21, 277-283
KangYS, KimJS. 2011; Quality characteristics of
Sulgidduk supplemented with
Ligularia fischeri powder. J East Asian Soc Dietary Life. 21:277-283.

Choi SR (2014) Physicochemical properties of Chwi-namul and quality characteristics of Injeulmi containing different ratio of Chwi-namul (Aster scaber, Ligularia fischeri, Synurus deltoids). Ph D Thesis, Sejong University, Korea
ChoiSR. 2014 Physicochemical properties of Chwi-namul and quality characteristics of Injeulmi containing different ratio of Chwi-namul (Aster scaber, Ligularia fischeri, Synurus deltoids). et al.Sejong University. Korea: .

Park BH, Kim M, Jeon ER (2013) Quality characteristics of tofu added Ligularia fischeri powder. Korean J Food Culture 28, 495-501
ParkBH, KimM, JeonER. 2013; Quality characteristics of tofu added
Ligularia fischeri powder. Korean J Food Culture. 28:495-501


Sun YP, Jeong YJ, Han YS (2016) Antioxidative activities and quality characteristics of steamed roll with added Ligularia fischeri (Ledeb.) Turcz. powder. Korean J Food Cook Sci, 32, 147-156
SunYP, JeongYJ, HanYS. 2016; Antioxidative activities and quality characteristics of steamed roll with added
Ligularia fischeri (Ledeb.) Turcz. powder. Korean J Food Cook Sci. 32:147-156


AOAC 2000; Official Methods of Analysis. 17th edAssociation of Official Analytical Chemists. Gaithersburg, MD, USA: p. 1-26.

KFDA 2007; Test method in general. Int'l Food code (separate volume). Korea food and drug administration. Cheongju, Korea: p. 1267.

GancedoMC, LuhBS. 1986; HPLC analysis of organic acids and sugars in tomato juice. J Food Sci. 51:571-573


FolinO, DenisW. 1912; On phosphotungastic- phosphomolybdic compounds as color reagents. J Biol Chem. 12:239-243.

MorenoMI, IslaMI, SampietroAR, VattuoneMA. 2000; Comparison of the free radical-scavenging activity of propolis from several regions of Argentina. J Ethnopharmacol, 71. 1:109-114


ChoiSH, LeeBH, ChoiHD. 1992; Analysis of catechin contents in commercial green tea by HPLC. J Korean Soc Food Nutr. 21:386-389.

FriedmanM, JurgensHS. 2000; Effect of pH on the stability of plant phenolic compounds. J Agric Food Chem. 48:2101-2110


GanzonJG, ChenLG, WangCC. 2018; 4-O-Caffeoylquinic acid as an antioxidant marker for mulberry leaves rich in phenolic compounds. J Food Drug Anal. 26:985-993


Hyun KW, Koo KC, Jang JH, Lee JG, Kim MR, Lee JS (2004) Quality characteristics and flavor compounds of Geumsan perilla leaves cultivated in greenhouse and field. Korean J Food Preserv, 11, 28-33
HyunKW, KooKC, JangJH, LeeJG, KimMR, LeeJS. 2004; Quality characteristics and flavor compounds of
Geumsan perilla leaves cultivated in greenhouse and field. Korean J Food Preserv. 11:28-33.

HwangJB, YangMO, ShinHK. 1997; Survey for approximate composition and mineral content of medicinal herbs. Korean J Food Sci Technol. 29:671-679.

Lee KC, Noh HS, Kim JW, Ahn SY, Han SS (2012) Changes of characteristics related to photosynthesis in Synurus deltoides under different shading treatments. Korean J Medicinal Crop Sci, 20, 320-330
LeeKC, NohHS, KimJW, AhnSY, HanSS. 2012; Changes of characteristics related to photosynthesis in
Synurus deltoides under different shading treatments. Korean J Medicinal Crop Sci. 20:320-330


ParkHJ, LeeKY. 2013; Evaluations on antioxidant effect of methanol extract from immature cotton boll. Korean J Plant Res, 26. 4:426-432


SunJ, ChuYF, WuX, LiuRH. 2002; Antioxidant and antiproliferative activities of common fruits. J Agric Food Chem. 50:7449-7454


SuhJT, ChoiEY, YooDL, KimKD, LeeJN, HongSY, KimSJ, NamJH, HanHM, KimMJ. 2015; Comparative study of biological activities at different harvesting times and new varieties for highland culture of Gom-chwi. Korean J Plant Res. 28:391-399


Chon SU (2010) Shading effect on plant growth and physiological activity of Youngia sonchifolia grown in plastic house. Korean J Weed Sci, 30, 215-224
ChonSU. 2010; Shading effect on plant growth and physiological activity of
Youngia sonchifolia grown in plastic house. Korean J Weed Sci. 30:215-224


BellAA. 1981; Biochemical mechanisms of disease resistance. Ann Rev Plant Physiol. 32:21-81


Xiong LG, Li JA, Li YH, Yuan L, Liu SQ, Huang JA, Liu ZH (2013) Dynamic changes in catechin levels and catechin biosynthesis-related gene expression in albino tea plants (Camellia sinensis L.). Plant Physiol Biochem, 71, 132-143
XiongLG, LiJA, LiYH, YuanL, LiuSQ, HuangJA, LiuZH. 2013; Dynamic changes in catechin levels and catechin biosynthesis-related gene expression in albino tea plants (
Camellia sinensis L.). Plant Physiol Biochem. 71:132-143


ParkHJ. 2010; Chemistry and pharmacological action of caffeoylquinic acid derivatives and pharmaceutical utilization of Chwinamul(Korea mountainous vegetable). Arch Pharmacal Res. 33:1703-1720