Article
3T3-L1 지방전구세포에서 1-O-feruloyl-β-D-glucose의 지방생성억제효과
곽상희1, 김윤희1
,2
,3
,*

Anti-adipogenic effect of 1-O-feruloyl-β-D-glucose on 3T3-L1 preadipocytes
Sang Hee Kwak1, Yoon Hee Kim1
,2
,3
,*

1Department of Food and Nutrition, College of Engineering, Daegu University, Gyeongsan 38453Korea
2Research Institute of Anti-aging, Daegu University, Gyeongsan 38453Korea
3Institute of Industrial and Technology, Daegu University, Gyeongsan 38453Korea
Copyright © The Korean Society of Food Preservation. . This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Jul 31, 2018; Revised: Sep 21, 2018; Accepted: Sep 24, 2018
요약
천연물 유래 단일 성분의 지방세포로의 분화 및 지방 축적 억제효과에 대한 잠재성을 탐색하기 위해 본 연구에서는 화살나무의 껍질에서 분리 정제한 FG가 3T3-L1 지방전구세포에 있어서 지방세포로의 분화 및 지방구 축적에 미치는 영향에 대해 평가하고, 관련 메카니즘에 대해 검토하였다.
Abstract
Obesity is the most common metabolic disease and is caused by an excess accumulation of body fat. 1-O-Feruloyl-β-D-glucose (FG) is a phenolic compound isolated from the corks of Euonymus alatus (Thunb.) Sieb. This study was designed to investigate the effect of FG on adipogenesis using 3T3-L1 preadipocyte. First, we evaluated the effects of FG on cell proliferation and cytotoxicity. Up to 5 μM, FG did not affect the proliferation of or cause cytotoxicity in 3T3-L1 preadipocytes. Therefore, we used FG at 0-5 μM for subsequent experiments. FG inhibited the accumulation of lipid droplets in differentiated 3T3-L1 adipocytes in a concentration-dependent manner. To understand the mechanism underlying the anti-adipogenic effect of FG, western blot analyses were performed. We found that FG suppressed peroxisome proliferator-activated receptor (PPAR) γ protein expression, a representative adipogenesis-related transcription factor. In addition, FG inhibited aP2/fatty acid binding protein 4 (FABP4) protein expression, a target gene of PPARγ. In conclusion, these data suggest that FG inhibits adipogenesis in 3T3-L1 adipocytes by inhibiting the expression of PPARγ and FABP4.
Keywords: feruloyl-glucose; 3T3-L1 preadipocyte; adipogenesis; peroxisome proliferator-activated receptor γ; differentiation
서론
비만은 체질량지수(Body Mass Index, BMI)가 25 kg/m2이상으로(세계보건기구 아시아태평양지부, 대한비만학회 진단 기준) 국민건강영양조사(제7기 1차년도 2016)의 결과에 따르면, 만 19세 이상 성인 비만 유병률은 2016년 남자 42.3%, 여자 26.4%로 남자가 여자보다 15.9%로 높았다. 남자는 1998년 이후 지속적으로 증가하여 2016년 40%를 초과하였고, 여자는 1998년 이후 23-28%를 유지하고 있다. 또한, 소아청소년 비만 유병률(만6-18세)은 2016년 남자 15.3%, 여자 11.1%이며, 남녀 모두 2010년 이후 증가하였다. 6-11세의 경우 남자 9.7%, 여자 6.7%, 12-18세의 경우 남자 19.1%, 여자 14.3%로 남자가 여자보다 높았다(1). 과도한 지방 축적은 특히 식도 선암, 대장암, 소장암, 췌장암, 간암, 담낭암, 위암과 같은 위장계의 암 발생 위험을 증가시키는 것으로 알려져 있다(2). 또한 높은 BMI는 심혈관계질환(3), 뇌졸중(4), 제2형 당뇨병(5)의 주요한 위험 인자로 알려져 있다. 이처럼 비만의 증가는 암, 심혈관계질환 및 당뇨병 등의 발생 위험을 증가시키므로, 비만에 대한 예방 및 치료가 중요하다.
최근에는 천연물로부터 새로운 항비만 인자를 탐색하기 위한 다양한 연구가 진행되어 왔고(6,7), 본 연구팀에서도 천연물에서 분리한 다양한 화합물의 항비만 효과를 세포수준에서 검토하였다. 이 중 화살나무(귀전우(鬼箭羽), Euonymus alatus(Thunb.) Sieb)로부터 분리한 1-O-feruloyl-β-D-glucose(FG)가 3T3-L1 지방전구세포의 분화 및 지방축적 억제효과를 확인하였기에 보고하고자 한다.
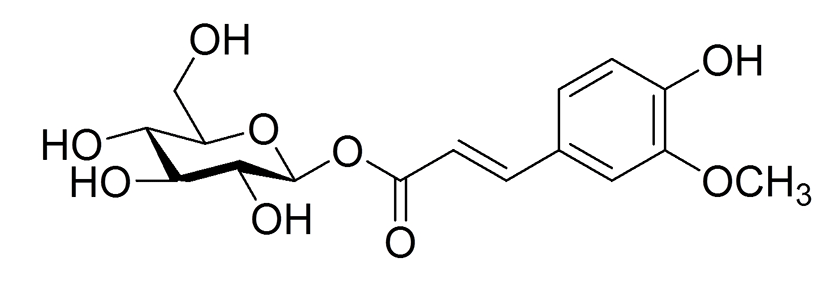
FG(Fig. 1)는 화살나무(귀전우(鬼箭羽), Euonymus alatus (Thunb.) Sieb)의 껍질에서 분리 정제한 phenol 화합물이다(8). Jeong 등의 선행연구에 따르면 FG는 인슐린 신호전달의 negative regulator로 작용하는 protein tyrosine phosphatases (PTPs)에 대해 저해 효과를 가지는 것으로 나타났다(IC50 18.4±0.3 μM)(8). 한편, PTP의 한 종류인 PTP1B는 비만한 사람과 설취류의 지방조직과 근육에서 발현이 증가하는 것으로 나타났으며(9), PTP1B를 제거한 마우스에서 비만과 당뇨가 억제되는 것으로 나타났다(10). 특히 3T3-L1 지방세포에서 PTP1B의 과발현은 인슐린 민감성 glucose transporter type 4(GLUT4)의 이동을 감소시켰고(11), 인슐린 수용체와 insulin receptor substrate(IRS)-1의 인산화를 억제시켰다(12). 따라서 PTP1B의 활성을 억제시키는 FG는 제2형 당뇨병이나 비만에 효과가 있을 가능성이 높다고 생각되어지며, 실제로 본 연구팀이 실시한 실험에서도 3T3-L1 지방전구세포의 분화를 억제하였으므로 이에 대한 추가 실험을 진행하였다.
따라서 본 연구에서는 화살나무의 껍질에서 분리, 정제한 FG가 지방전구세포인 3T3-L1의 지방세포로의 분화 및 지방축적에 대한 영향 및 관련 메커니즘을 검토하는 것을 목적으로 하였다.
재료 및 방법
실험재료
세포 배양에 필요한 fetal bovine serum(FBS), penicillin, streptomycin, Dulbecco's modified Eagle's medium(DMEM)과 0.5% Trypsin-EDTA은 Hyclone(Logan, UT, USA)에서 구입하였다. 세포 분화에 필요한 methylisobytylxanthine, dexamethasone, insulin과 지방세포 분화 및 지방구 축적 실험을 위한 Oil red O는 Sigma-Aldrich(St. Louis, MO, USA)로부터, sodium pyruvate는 Gibco Invitrogen(Carlsbad, CA, USA)으로부터 구입하였다. Formaldehyde 용액은 JUNSEI chemical Co., Ltd.(Tokyo, Japan)로부터 구입하였다. 단백질 정량에 사용하는 Bio-Rad Protein Assay kit는 Bio-Rad Laboratories, Inc.(Hercues, CA, USA)에서 구입하였다. Western blotting에 사용된 1차 항체 anti-aP2/fatty acid binding protein(FABP) 4 rabbit polyclonal(#2120), anti-CCAAT/enhancer binding proteins(C/EBP)α(D56F10, #8178) rabbit monoclonal는 Cell Signaling TECHNOLOGY (Danvers, MA, USA)로부터, anti-peroxisome proliferator-activated receptor(PPAR)γ(E-8, #sc-7273) mouse monoclonal은 SANTA CRUZ BIOTECHNOLOGY(Dallas, TA, USA)로부터, anti-β-actin mouse monoclonal은 Novus Biologicals (Littleton, CO, USA)에서 구입하여 사용하였다.
FG의 추출 및 분리
본 실험에 사용된 FG는 화살나무(귀전우(鬼箭羽), Euonymus alatus (Thunb.) Sieb)의 껍질로부터 Jeong 등에 의해 서술된 방법(8)으로 추출, 분리한 FG를 DMSO에 녹여 실험에 사용하였다.
3T3-L1 지방전구세포배양
본 실험에 사용한 세포는 마우스 유래의 3T3-L1 지방전구세포로 한국세포주은행(Seoul, Korea)에서 분양 받아 사용하였다. 세포는 10% FBS, 100 U/mL penicillin과 100 mg/mL streptomycin이 함유된 DMEM 배지를 이용하여 37℃, 95% 습도, 5% CO2 환경인 배양기에서 배양하였다.
3T3-L1 지방전구세포의 분화 유도
3T3-L1 지방전구세포를 24-well plate에 5×104 cells/mL/well의 세포수가 되도록 분주하여 37℃, 5% CO2 배양기에서 세포가 well에 가득 찰 때까지 배양하였다(3일간). 그 후 분화용 배지(115 μg/mL methylisobytylxanthine, 1 μg/mL insulin, 1 μM dexamethasone, 10% FBS, 100 U/mL penicillin과 100 mg/mL streptomycin이 함유된 DMEM 배지)로 교환하여 2일 간격으로 새로운 배지로 교환하면서 6일 동안 배양하였다. 그 후 1 μg/mL insulin, 10% FBS, 100 U/mL penicillin과 100 mg/mL streptomycin이 함유된 DMEM 배지로 교환한 후 2일 간격으로 새 배지로 교환하면서 추가 배양하여 지방세포로 분화를 유도하였다. FG는 분화용 배지 및 1 μg/mL insulin을 포함한 배지에 농도별(0, 1, 2.5, 5 μM)로 첨가하여 세포에 처리하였다. 분화가 유도 되었는지는 현미경 관찰 및 Oil Red O염색을 통해서 확인하였다.
세포 증식 측정
FG가 3T3-L1 지방전구세포의 증식에 미치는 영향을 검토하기 위하여 3T3-L1 지방전구세포를 96-well plate에 1×104 cells/200 μL/well의 세포수가 되도록 분주하여 37℃, 5% CO2 배양기에서 18시간 배양하였다. FG를 농도별(0, 1, 2.5, 5 μM)로 처리한 후 48시간 동안 배양시켰다. 배양 후 CellTiter96Ⓡ Aqueous One Solution Assay of Cell Proliferation(Promega, Madison, WI, USA)을 이용해 세포 증식능을 micro plate reader(Sunrise; Tecan, Austria)를 사용하여 측정하였다. 측정값은 FG를 처리하지 않은 0 μM FG군에 대한 상대적인 값으로 나타내었다.
세포 독성 측정
FG가 3T3-L1 지방전구세포의 증식에 미치는 영향을 검토하기 위하여 3T3-L1 지방전구세포를 96-well plate에 1×104 cells/200 μL/well의 세포수가 되도록 분주하여 37℃, 5% CO2 배양기에서 18시간 배양하였다. FG를 농도별(0, 1, 2.5, 5 μM)로 처리한 후 48시간 동안 배양하였다. 배양 후 CytoTox96Ⓡ Non-Radioactive Cytotoxicity Assay(Promega)을 이용해 FG가 3T3-L1 세포에 대해 독성을 나타내는지를 micro plate reader(Sunrise; Tecan, Austria)를 사용하여 측정하였다.
Oil Red O 염색
분화가 종료되면 기존 배지를 제거하고 10% formaldehyde 용액을 1 mL 첨가하여 1시간 동안 세포를 고정시켰다. 2 mL의 60% isopropyl alcohol을 각 well에 첨가하여 세포를 세척하고 건조시켰다. Oil Red O 염색용액을 1 mL씩 각 well에 넣고 10분간 배양하였다. Oil Red O를 제거하고 증류수로 4번 세척한 후 건조하여 염색된 세포를 사진 촬영하였다. 100% isopropyl alcohol을 1 mL 넣어 세포에 염색된 Oil Red O를 용출시켰다. 이것을 96-well plate에 200 μL씩 담고, 490 nm에서 흡광도를 측정하여 3T3-L1 지방세포로의 분화에 따른 지질 방울(lipid droplet) 형성을 평가하였다.
총 단백질 추출 및 western blot 분석
3T3-L1 지방전구세포가 지방세포로 분화하는데 있어서 FG가 어떠한 미치는 영향을 미치는지를 평가하기 위해 세포로부터 총 단백질을 추출하여 지방생성관련 전사인자 및 관련 유전자의 단백질 발현에 미치는 영향을 평가하였다. 3T3-L1 지방전구세포를 분화용 배지로 분화 시킨 후 세포를 PBS로 세척하고 세포에 cell lysis buffer(50 mM Tris-HCl, 150 mM NaCl, 1% Triton X-100, 1 mM ethylenediamine tetra-acetic acid(EDTA), 50 mM sodium fluoride(NaF), 30 mM sodium pyrophosphate(Na4P2O7), 1 mM phenylmethanesulfonyl fluoride, 2 mg/mL aprotinin, 1 mM pervanadate)를 첨가하여 얼음에서 10분 동안 배양 한 후 12,000 ×g로 15분 동안 원심분리 하여 상층액을 얻었고, Bio-Rad Protein Assay kit를 사용하여 단백질을 정량하였다.
세포 총 용해물의 단백질 농도(10 μg protein/lane)가 동일하도록 조정한 후 2×sodium dodecyl sulfate(SDS) sample buffer를 가하고 100℃에서 5분간 끓여 열변성하였다. Mini-PROTEAN system(Bio-Rad, Hercules, CA, USA)을 이용하여 10% SDS polyacrylamide gel을 만들어 각 well에 단백질 양이 동일하도록 각 시료를 loading 하고 전기영동을 시행하였으며 이어서 ImmobilonⓇ transfer membranes 0.45 μm(Millipore, Billerica, MA, USA)에 transfer시켰다. Membrane을 1×blocking buffer(Biofact Biofactory, Daejeon, Korea)로 실온에서 1시간 동안 blocking 한 후 일차항체 anti-FABP4(1:1,000), anti-PPARγ(1:200), anti-C/EBPα(1:1,000), anti-β-actin(1:10,000)를 처리하여 4℃에서 하룻밤 배양하였다. Tris-buffered saline containing 0.1% Tween-20(TBST, pH 8.0)로 세척한 다음 이차항체(HRP-conjugated anti-rabbit IgG(1:2,000), anti-mouse IgGκ(1:5,000), anti-mouse IgG(1:5,000)에 1시간 동안 실온에서 배양하였다. TBST로 세척하고 ECL solution(Thermo Scientific) 기질로 반응시킨 후 LAS-3000 Lumino Image Analyzer System(Fuji film, Tokyo, Japan)를 이용하여 밴드를 확인하였다.
통계 분석
실험에서 얻어진 결과의 통계적 유의성은 GraphPad Prism Verson 5.0 software(GraphPad, San Diego, CA, USA)를 이용하여 분석하였다. 실험 결과는 mean±standard error of mean(SEM)으로 나타냈으며, 각 그룹간의 통계적 유의성을 one-way ANOVA를 통한 Dunnett test나 Tukey's test를 통해서 사후 검정하였다. p 값은 p<0.05를 통계적 유의차가 있다고 판단했다.
결과 및 고찰
FG가 3T3-L1 지방전구세포 성장에 미치는 영향
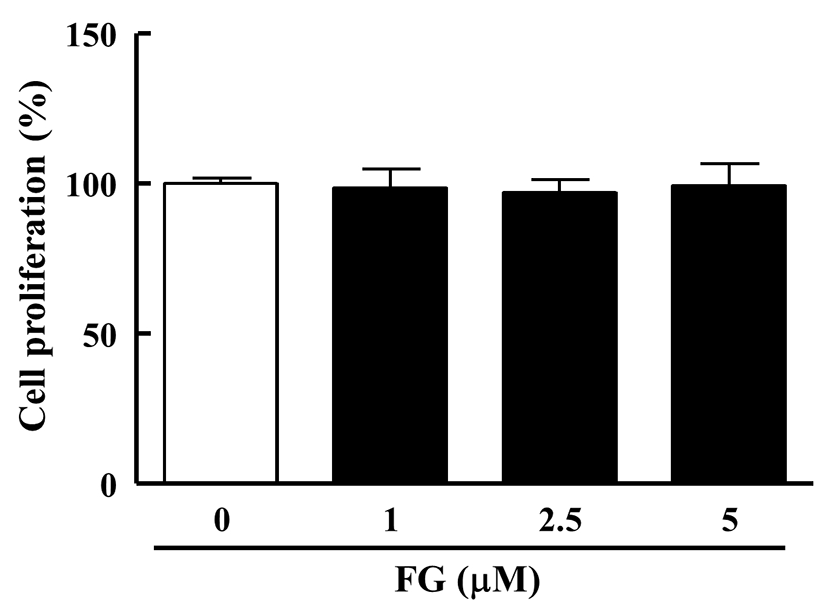
FG가 지방세포로의 분화 및 지방구 축적 억제효과가 3T3-L1 지방전구세포의 성장자체를 억제시킴으로서 나타나는 효과인지를 확인하기 위하여, FG를 농도별(0, 1, 2.5, 5 μM)로 48시간동안 3T3-L1 지방전구세포에 처리하여 세포 성장에 미치는 영향을 평가하였다. 그 결과, 0 μM FG군에서의 흡광도는 0.98±0.02인 것에 비해 1 μM FG군은 0.87±0.06, 2.5 μM FG군은 0.89±0.05, 5 μM FG군은 0.87±0.07로, 5 μM 농도까지 3T3-L1 지방전구세포의 성장에 영향을 미치지 않는 것을 확인하였다(Fig. 2).
Fig. 2. .
Effect of FG on cell proliferation in 3T3-L1 preadipocyte.
3T3-L1 cells were seeded in a 96-well plate and treated with various concentrations of FG (0, 1, 2.5, 5 μM). After 48h, cell proliferation were determined by the methods described in the Material and Methods section. The reseults are reported as the mean±SEM of three independent experiments (n=4). Statistical significance is based on the difference when compared with 0 μM FG.
Download Original Figure
FG가 3T3-L1 지방전구세포 독성에 미치는 영향
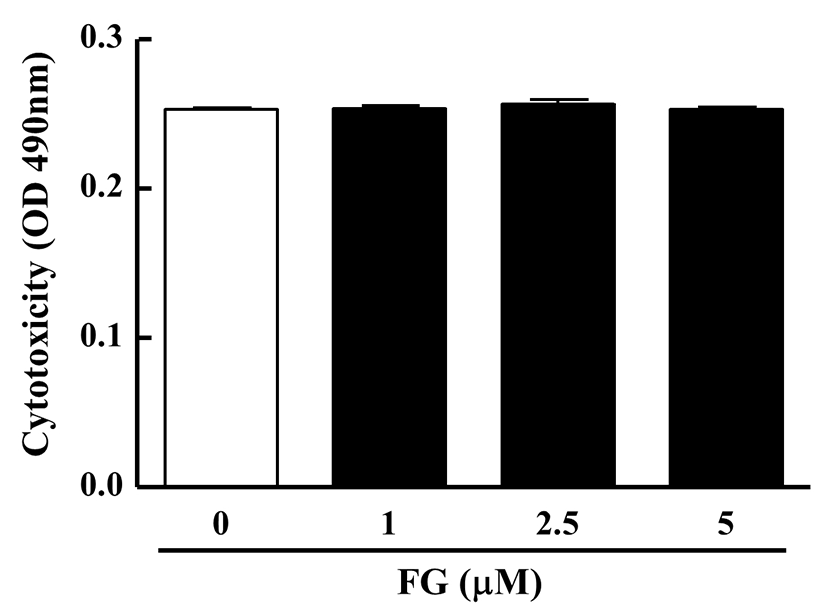
세포 성장과 더불어 FG가 3T3-L1 지방전구세포에 독성을 나타내는지를 평가하기 위하여 FG를 농도별(0, 1, 2.5, 5 μM)로 48시간동안 3T3-L1 지방전구세포에 처리하여 세포 성장에 미치는 영향을 측정한 결과, 0 μM FG군에서의 흡광도가 0.25±0.00인 것에 비해 5 μM FG군은 0.25±0.00으로 대조군에 비해 모든 농도에서 세포 독성이 나타나지 않았다(Fig. 3). 이상의 결과로부터 FG가 3T3-L1 지방전구세포의 성장을 억제시키거나 독성을 나타내지 않는 것을 확인하였으며, 따라서 이후의 모든 실험에서 0-5 μM의 농도로 FG를 처리하였다.
Fig. 3. .
Effect of FG on cell cytotoxicity in 3T3-L1 preadipocyte.
3T3-L1 cells were seeded in a 96-well plate and treated with various concentrations of FG (0, 1, 2.5, 5 μM). After 48h, cell cytotoxicity were determined by the methods described in the Material and Methods section. The reseults are reported as the mean±SEM of three independent experiments (n=4). Statistical significance is based on the difference when compared with 0 μM FG.
Download Original Figure
FG가 3T3-L1 지방 방울 형성에 미치는 영향
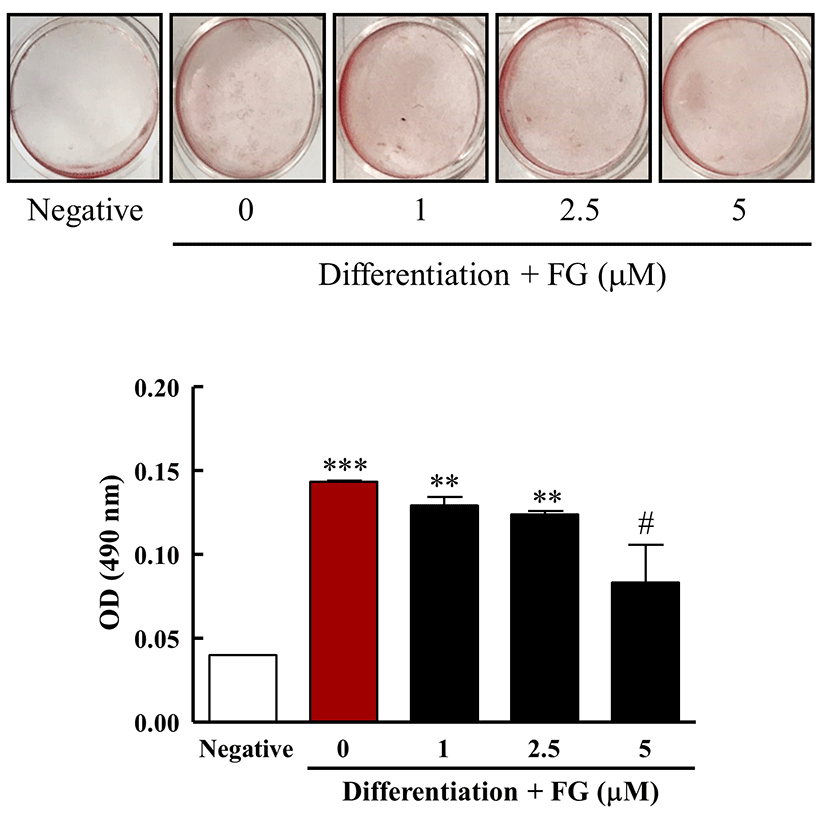
Oil red O 염색법은 지방이 Oil red O 용액에 의해 붉게 염색되는 것을 사진촬영이나 현미경 촬영을 통해 시각적으로 나타내거나 isoprophylalcohol로 염색된 지방을 추출하여 흡광도를 측정함으로써 3T3-L1 지방전구세포의 지방생성을 평가하는 방법이다(13). FG가 3T3-L1 지방전구세포의 지방세포로의 분화 및 지방구 축적에 미치는 영향을 검토하기 위해서, FG를 농도별로 함유한 분화용 배지로 3T3-L1 지방전구세포를 12일간 배양하였다. 그 후 Oil red O 염색 용액을 이용하여 지방구를 염색하여 염색된 시약을 isopropyl alcohol로 용출하여 그 효능을 평가하였다. 그 결과, 분화 전 3T3-L1 지방전구세포의 Oil red O 염색용액에 의한 흡광도는 0.04±0.00인 것에 비해 분화용 배지를 처리하고 FG를 처리하지 않은 군의 흡광도는 0.14±0.00로 그 값이 350% 증가하여 분화용 배지에 의해 3T3-L1 지방전구세포가 지방세포로 분화되었음을 확인 할 수 있었다. 이에 비해 FG를 처리한 결과 5 μM FG를 처리한 군에서의 흡광도가 0.08±0.02로 0 μM FG 군에 비해 57% 수준으로 흡광도가 감소하는 것을 확인하였다(Fig. 4). 이상의 결과로부터, FG는 3T3-L1 지방전구세포의 지방세포로의 분화 및 지방구 형성을 억제하는 것으로 나타났다.
Fig. 4. .
Effect of FG on lipid accumulation in 3T3-L1 cells.
3T3-L1 cells were treated with media for differentiation in the absence or presence of FG (0, 1, 2.5, 5 μM) for 12 days. On day 12, 3T3-L1 cells were stained with Oil red O solution and took a photograph (A). Then, (B) Lipid accumulation was assessed by extracting Oil red O from stained 3T3-L1 cells. The results are reported as the mean±SEM of three independent experiments (n=4). Statistical significance is based on the difference when compared with negative group (**p<0.01; ***p<0.001) or with 0 μM FG (#p<0.05), respectively.
Download Original Figure
FG가 지방분화 관련 전사인자 및 관련 단백질 발현에 미치는 영향
지방생성(adipogenesis)은 다능성 간엽줄기세포(multipotent mesenchymal stem cell)가 성숙 지방세포로 분화하는 발달적 과정으로(14), PPARγ와 C/EBPα와 같은 전사인자의 복잡한 네트워크에 의해 엄격하게 조절된다(15-18). 특히, PPARγ은 지방세포 분화의 주요 조절자로서 FABP4, 지방산 합성효소, GLUT4와 같은 지방형성 유전자들뿐만 아니라 지방방울(lipid droplet) 관련 단백질을 암호화하는 유전자들을 활성화시키는 지방생성 인자이다(19-22). 또한, 마우스 embryonic fibroblast에서 C/EBPα를 제거하면 지방전구세포의 분화 능력이 감소하고, 지방분화에 있어 중요한 전사 인자인 PPARγ의 mRNA가 발현되지 못한다고 알려져 있다. 같은 세포에 PPARγ 유전자를 주입하면 지방구세포로 분화가 된다(23). 이처럼 C/EBPα는 우선적으로 PPARγ의 발현을 유도함으로써 지방생성에 있어서 중요한 역할을 한다.
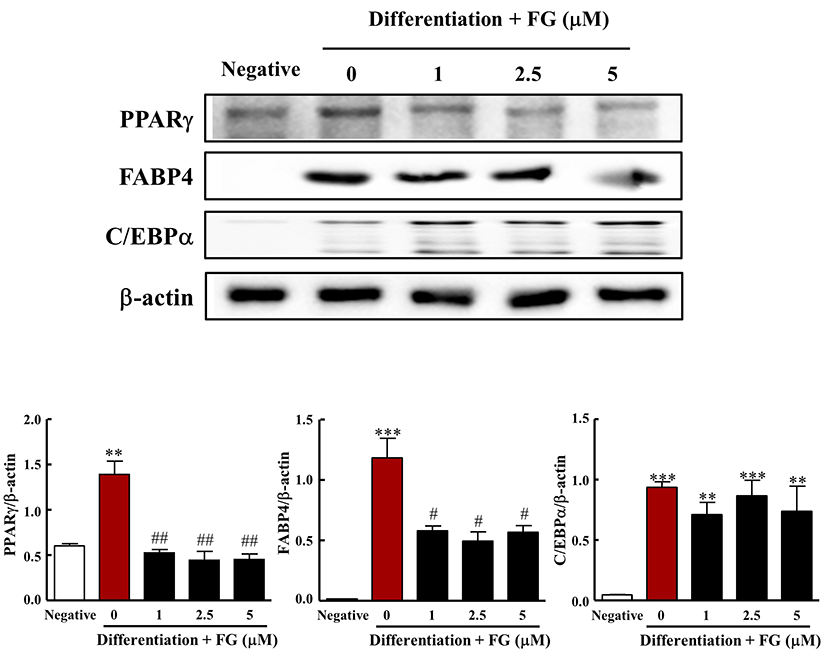
따라서 FG가 3T3-L1 지방전구세포의 지방세포로의 분화 및 지방 생성억제효과에 대한 분자적 메커니즘을 검토하기 위해서, 지방생성과 관련된 전사인자(PPARγ과 C/EBPα) 및 관련 단백질(FABP4)의 발현에 미치는 영향을 western blot 분석법을 통해 검토하였다. 그 결과 분화용 배지로 12일간 배양하였을 때 분화배지를 처리하지 않은 군에 비해 PPARγ의 발현이 현저히 증가하였다. 반면, FG 처리에 의해 PPARγ의 발현이 유의적으로 감소하였다(Fig. 5). 이와 더불어 PPARγ의 표적 유전자이자 지방 생성의 주요한 표지자 중 하나인 FABP4의 발현양도 3T3-L1 지방전구세포의 분화에 의해 현저히 증가하였으나, FG 처리에 의해 FABP4의 발현이 유의적으로 감소하였다(Fig. 6). 반면 C/EBPα는 분화용 배지로 12일간 배양하였을 때 분화 전에 비해 C/EBPα의 발현이 유의적으로 증가하였으나 FG 처리에 의해 C/EBPα의 발현에는 영향을 주지 않았다. Rosen의 보고에 따르면 PPARγ은 지방생성에 절대적으로 필요하지만 C/EBPα는 일차적으로 세포에서 PPARγ의 수준을 증가된 상태로 유지하도록 함으로써 지방 분화에 있어서 PPARγ에 비해 보조적인 역할을 한다고 보고하였다(14). 또한, C/EBPα는 분화된 지방세포에서 인슐린 민간성을 유지하는데 있어서 중요한 역할을 한다고 알려져 있어(14,24), FG가 지방세포가 인슐린 민감성을 획득하는 과정은 저해하지 않으면서 PPARγ에 따른 지방 축적을 억제하는 것으로 생각된다. 이상의 결과로부터, FG는 PPARγ 전사인자의 발현 및 관련 표적 유전자의 발현을 특이적으로 억제함으로써 지방분화를 억제하는 것으로 나타났다.
Fig. 5. .
Effect of FG on expression of PPARγ, FABP4, and C/EBPα in 3T3-L1 cells.
3T3-L1 cells were treated with media for differentiation in the absence or presence of FG (0, 1, 2.5, 5 μM) for 12 days. In each whole cell lysate, 10 μg of proteins was resolved by 10% SDS-PAGE for FABP4, PPARγ, and C/EBPα determination. β-actin expression is shown as a loading control. The bands were quantified using image analysis software, and their relative intensities were expressed as target protein/β-actin. The results are reported as the mean±SEM of three independent experiments (n=3). Statistical significance is based on the difference when compared with negative group (**p<0.01; ***p<0.001) or with 0 μM FG (#p<0.05; ##p<0.01), respectively.
Download Original Figure
요 약
천연물 유래 단일 성분의 지방세포로의 분화 및 지방축적 억제효과에 대한 잠재성을 탐색하기 위해 본 연구에서는 화살나무의 껍질에서 분리 정제한 FG가 3T3-L1 지방전구세포에 있어서 지방세포로의 분화 및 지방구 축적에 미치는 영향에 대해 평가하고, 관련 메카니즘에 대해 검토하였다.
FG는 분화용 배지에 포함된 분화 촉진인자들의 자극에 의한 지방생성에 있어 주요한 전사인자인 PPARγ와 그 표적 단백질인 FABP4의 발현을 억제함으로써 지방세포 분화 및 지방구 축적을 억제하는 것으로 나타났다. 이상의 결과로부터 FG가 비만이나 비만과 관련된 당뇨병 등을 예방, 개선하는데 유용한 물질로 사용될 가능성이 있을 것으로 생각된다.
Acknowledgements
이 논문은 2017학년도 대구대학교 학술연구비지원 (20170214)에 의해 이루어졌으며 이에 감사드립니다. 본 연구를 수행함에 있어서 FG를 제공해 주신 대구대학교 김태훈 교수님께 감사드립니다.
References
KCDC 2016 National Health Statistics. Result Report of KCDCKCDC 11-1351159-000027-10
MurphyN, JenabM, GunterMJ. 2018; Adiposity and gastrointestinal cancers: epidemiology, mechanisms and future directions. Nat Rev Gastroenterol Hepatol. 15:659-670


PicheME, PoirierP, LemieuxI, DespresJP. 2018; Overview of epidemiology and contribution of obesity and body fat distribution to cardiovascular disease: An update. Prog Cardiovasc Dis. 61:103-113.

RehoJJ, RahmouniK. 2017; Oxidative and inflammatory signals in obesity-associated vascular abnormalities. Clin Sci. 131:1689-1700


ChukirT, ShuklaAP, SaundersKH, AronneLJ. 2018; Pharmacotherapy for obesity in individuals with type 2 diabetes. Expert Opin Pharmacother. 19:223-231


dela Garza AL, MilagroFI, BoqueN, CampionJ, MartinezJA. 2011; Natural inhibitors of pancreatic lipase as new players in obesity treatment. Planta Med. 77:773-785.

YinJ, ZhangH, YeJ. 2008; Traditional Chinese medicine in treatment of metabolic syndrome. Endocr Metab Immune Disord Drug Targets. 8:99-111


Jeong SY, Nguyen PH, Zhao BT, Ali MY, Choi JS, Min BS, Woo MH (2015) Chemical constituents of Euonymus alatus (Thunb.) Sieb. and their PTP1B and α-glucosidase inhibitory activities. Phytother Res, 29, 1540-1548
JeongSY, NguyenPH, ZhaoBT, AliMY, ChoiJS, MinBS, WooMH. 2015; Chemical constituents of
Euonymus alatus (Thunb.) Sieb. and their PTP1B and α-glucosidase inhibitory activities. Phytother Res. 29:1540-1548


WuX, HoffstedtJ, DeebW, SinghR, SedkovaN, ZilberingA, ZhuL, ParkPK, ArnerP, GoldsteinBJ. 2001; Depot-specific variation in protein tyrosine phosphatases activities in human omental and subcutaneous adipose tissue: a potential contribution to differential insulin sensitivity. J Clin Endocrinol Metab. 86:5973-5980


ChoH. 2013; Protein tyrosine phosphatase 1B (PTP1B) and obesity. Vitam Horm. 91:405-424.

ChenH, CongLN, LiY, YaoZJ, WuL, ZhangZY, BurkeTR, QuonMJ. 1999; A phosphotyrosyl mimetic peptide reverses impairment of insulin-stimulated translocation of GLUT4 caused by overexpression of PTP-1B in rat adipose cells. Biochemistry. 38:384-389


VenableCL, FrevertEU, KimYB, FischerBM, KamatkarS, NeelBG, KahnBB. 2000; Overexpression of protein-tyrosine phosphatase-1B in adipocytes inhibits insulin-stimulated phosphoinositide 3-kinase activity without altering glucose transport or Akt/protein kinase B activation. J Biol Chem. 275:18318-18326


RizzattiV, BoschiF, PedrottiM, ZoicoE, SbarbatiA, ZamboniM. 2013; Lipid droplets characterization in adipocyte differentiated 3T3-L1 cells: size and optical density distribution. Eur J Histochem. 57:24


RosenED. 2005; The transcriptional basis of adipocyte development. Prostaglandins Leukotrienes Essent Fatty Acids. 73:31-34


GregoireFM, SmasCM, SulHS. 1998; Understanding adipocyte differentiation. Physiol Rev. 78:783-809


CristanchoAG, LazarMA. 2011; Forming functional fat: a growing understanding of adipocyte differentiation. Nat Rev Mol Cell Biol. 12:722-734


TakadaI, KouzmenkoAP, KatoS. 2009; Wnt and PPARgamma signaling in osteoblastogenesis and adipogenesis. Nat Rev Rheumatol. 5:442-447.

Motade Sa P, RichardAJ, HangH, StephensJM. 2017; Transcriptional regulation of adipogenesis. Compr Physiol. 7:635-674.

Amber-VitosO, ChaturvediN, NachlielE, GutmanM, TsfadiaY. 2016; The effect of regulating molecules on the structure of the PPAR-RXR complex. Biochim Biophys Acta. 1861:1852-1863


ThompsonGM, TrainorD, BiswasC, LaCerteC, BergerJP, KellyLJ. 2004; A high-capacity assay for PPARgamma ligand regulation of endogenous aP2 expression in 3T3-L1 cells. Anal Biochem. 330:21-28.

ArimuraN, HoribaT, ImagawaM, ShimizuM, SatoR. 2004; The peroxisome proliferator-activated receptor γ regulates expression of the perilipin gene in adipocytes. J Biol Chem. 279:10070-10076


KimYJ, ChoSY, YunCH, MoonYS, LeeTR, KimSH. 2008; Transcriptional activation of Cidec by PPARγ2 in adipocyte. Biochem Biophys Res Commun. 377:297-302


WuZ, RosenED, BrunR, HauserS, AdelmantG, TroyAE, McKeonC, DarlingtonGJ, SpiegelmanBM. 1999; Cross-regulation of C/EBPα and PPARγ controls the transcriptional pathway of adipogenesis and insulin sensitivity. Mol Cell. 3:151-158


El-JackAK, HammJK, PilchPF, FarmerSR. 1999; Reconstitution of insulin-sensitive glucose transport in fibroblasts requires expression of both PPARγ and C/EBPα. J Biol Chem. 274:7946-7951