서 론
펩타이드는 단백질이 아미노산으로 분해되는 과정의 중간산물로, 다양한 조합의 아미노산이 아미노기와 카르복실기와의 탈수축합반응에 의해 중합물을 형성하고 있는 것으로 일반적으로 분자량 10,000 dalton 이하의 것을 말한다(1). 이 중 인체의 건강에 영향을 주는 펩타이드를 총칭해서 생리활성 펩타이드로 정의한다(2). 식품 중에 존재하는 생리활성 펩타이드는 동물성 식품유래의 호르몬류나 식물성 식품유래의 효소저해물질과 소화과정이나 식품 가공과정 중에 부분 가수분해 되어 생성된다. 펩타이드는 항산화 활성을 비롯하여 항당뇨, 항고혈압, 항암, 피부미백 및 피부면역 활성, 항고혈압, 콜레스테롤 조절 작용 및 혈소판 응집 저해활성 등의 생리활성이 있어 관심이 높아지고 있다(3-6). 뿐만 아니라 펩타이드는 용해성, 점도, 향미, 기포성 및 유화성과 같은 기능적 특성을 가지고 있어(7), 소화·흡수가 용이할 뿐만 아니라 다양한 식품 및 가공품에서의 이용성이 높다(8).
들깨(Perilla frutescens var. japonica HARA)는 꿀풀과에 속하는 일년초의 종실로서 우리나라를 비롯한 중국, 일본 등지에서 재배되고 있으며, 각지의 산기슭이나 길가의 습지에서 흔하게 자라므로 현재 전국적으로 재배되고 있고 그 수요가 증가함에 따라 재배 면적이 증가되고 있다(9). 들깨는 잎을 식용하고 종자를 생이나 볶아 여러 가지 음식을 만드는데 사용되며, 볶은 들깨종자에서 기름을 착유하거나 가루를 내어 양념으로 쓰기도 한다. 2010년 국민건강영양조사에 따르면 들깨는 다가불포화지방산, ω-3계 지방산, 칼슘 및 조섬유 섭취량 주요 급원식품 상위권으로 보고되어(10), 들깨가 한국인의 식생활 및 식습관에 많은 영향을 차지하는 식품임을 알 수 있다. 또한 들깨종실에는 우리 몸에 필요한 필수영양소가 골고루 함유되어 있으며, 특히 지질의 함량이 매우 높다(11). 들깨 지질은 ω-3계 고도불포화지방산의 일종인 α-linolenic acid의 성분이 많으며, α-linolenic acid는 혈압저하, 혈전증 개선, 암세포 증식 억제 등의 기능성을 가지고 있다(12). 들깨는 지방질 이외에도 다양한 생리활성성분이 존재하고 있는데, Park 등(13)은 들깨의 식이섬유소에서 항돌연변이 효과가 있음을 보고하였다. 들깨 종자에는 기름이 약 40% 함유되어 있어 주로 기름을 착유하여 이용하는데, 들깨 종자를 착유하고 남은 부산물인 들깨박의 주성분은 단백질이며 이외에도 인체에 유효한 성분을 다량 함유하고 있어 이용가치가 큰 농산부산물이다. 지금까지 식품의 단백질로부터 다양한 생리활성 펩타이드가 생산되어 기능성 식품소재로서 이용 가능성이 제시되어 왔다. 그러나 들깨박 연구는 들깨박에서 분리한 페놀화합물의 항산화 효과에 대한 연구가 대부분이며(11,14), 들깨박단백질의 생리활성 특성에 관한 연구가 미비하다.
따라서 본 연구에서는 농산가공부산물인 들깨박의 기능성 식품소재로써의 활용가능성을 확인하기 위한 연구의 일환으로 단백질분해효소를 이용하여 들깨박단백질로부터 효소가수분해물 및 한외여과 펩타이드를 분획하고자 하였다. 이를 위해 다양한 단백질가수분해효소를 이용하여 들깨박단백질 분해를 위한 최적의 효소를 선정하고, 선정된 효소의 최적 분해조건을 찾고자 하였다. 또한 들깨박단백질 효소가수분해물 및 한외여과 펩타이드 분획의 항산화 활성을 측정하여 건강기능성 식품소재를 비롯한 다양한 식품재료로의 활용을 위한 기초자료를 제공하고자 하였다.
재료 및 방법
본 실험에 사용된 들깨(Perilla frutescens var. japonica HARA)박은 전라남도 해남군 화산면에서 재배된 국내산 들깨를 냉압착 방식으로 착유하고 남은 부산물로 Queensbucket(Seoul, Korea)으로부터 제공받았다. 들깨박은 이물질을 제거하고 마쇄한 후 체질하여 -40℃ deep freezer(MDF, Sanyo, Tokyo, Japan)에 보관하면서 실험에 사용하였다. 들깨박 단백질을 가수분해하기 위하여 사용한 단백질가수분해 효소인 pepsin, trypsin 및 papain은 Sigma-Aldrich Co.(St. Louis, MO, USA)에서 구입하였으며, acalase, protamex, neutrase 및 flavourzyme은 Novo사(Nordisk Co., Bagvaerd, Denmark) 제품을 사용하였다.
들깨박으로부터 단백질을 추출하기 위해서 동결건조된 들깨박의 중량 대비 1:10(w/v)의 증류수를 넣어 25℃, 120 rpm의 shaking water bath(BS-11, JeioTech, Seoul, Korea)에서 60분간 교반하였다. 이 후 1 N NaOH를 적정량 주입하여 pH 10.0으로 일정하게 유지시켜 25℃에서 60분간 단백질을 용출시킨 후, 원심분리(Supra-21K, Hanil, Incheon, Korea)하여 상등액을 취하였다. 상등액에 1 N HCl 용액을 이용하여 pH 4.0로 조정하고 25℃에서 30분 동안 반응시켜 단백질을 침전시킨 후, 10,000 rpm에서 30분간 원심분리하여 침전 단백질을 얻었다. 이때 얻어진 단백질 침전물을 중량대비 1:2(w/v)의 증류수를 가하여 homogenizer(AM-1, Nissei, Tokyo, Japan)로 충분히 균질화시킨 후 0.1 N NaOH을 이용하여 pH 7.0로 중화시킨 다음, 동결건조 시켜 효소가수분해물 제조를 위한 시료로 사용하였다.
효소활성 측정은 Anson(15)의 방법을 변형하여 측정하였다. 즉, 시험관에 buffer solution 1 mL를 가한 다음, 기질용액(0.6% casein, pH 7.0) 2.5 mL을 넣고 37℃로 incubation한 후 효소액 0.5 mL 넣고 37℃에서 10분간 반응시켰다. 반응 후 0.44 M trichloroacetic acid(TCA) 2.5 mL를 넣어 반응을 중지시키고 실온에서 10분간 방치한 다음 원심분리하였다. 이 후 상등액 1 mL에 0.55 M NaCO3용액 5 mL와 1 N Folin & Ciocalteus reagent 1 mL 용액을 넣어 37℃에서 30분간 발색시켜 660 nm에서 흡광도(U-2900, Hitachi)를 측정하였다. 효소활성 단위는 pH 7.0, 37℃에서 casein(Sigma-Aldrich Co.)으로부터 1분 동안 1 μmol의 tryrosine을 유리시키는 효소의 양을 1 unit으로 하였다. 위의 방법에 따라 측정된 단백질가수분해효소의 활성은 pepsin 81.14 unit/mL, trypsin 314.51 unit/mL, papain 259.82 unit/mL, acalase 420.37 unit/mL, protamex 498.60 unit/mL, neutrase 562.69 unit/mL 및 flavourzyme 189.65 unit/mL이었다.
들깨박단백질의 가수분해를 위한 최적 효소를 선정하기 위하여 Xie 등(16)의 방법을 약간 변형하여 Table 1의 효소 최적 조건에 따라 효소 반응하였다. 즉, 들깨박단백질은 각 효소의 최적 buffer solution를 이용하여 1:20(w/v) 농도로 제조하였으며, 10 unit의 효소를 첨가하였다. 그 후 shaking incubator(BS-11, JeioTech)를 이용하여 각 효소의 최적 온도에서 일정한 시간 동안 교반한 후, 99℃에서 5분간 가열하여 효소 반응을 정지시킨 후 18,000 ×g에서 20분 동안 원심분리하여 얻어진 상등액의 가수분해도 측정하였다.
단백질가수분해물의 가수분해도는 가수분해물에 20% TCA를 동량 첨가하여 실온에서 30분 동안 방치시키고 원심분리한 다음 상등액을 일정량 취하여, bicinchoninic acid(BCA)법(17)에 준하여 10% TCA 가용성 단백질량을 측정한 후, 아래의 식을 이용하여 산출하였다.
들깨박단백질의 가수분해물을 제조하기 위하여 Xie 등(16)의 방법을 약간 변형하여 효소 최적 추출조건에 따라 가수분해하였다. 0.1 M sodium phosphate buffer(pH 7.0)를 이용하여 5%(w/v) 농도로 제조된 들깨박단백질 용액 25 mL에 flavourzyme 10 unit를 첨가하여 50℃에서 4시간 동안 효소 반응시켰다. 이후 99℃에서 10분간 가열하여 효소 반응을 정지시킨 후 18,000 ×g에서 20분 동안 원심분리하였다. 얻어진 상등액을 한외여과막(molecular weight cut-off 1, 3, 5, 10 kDa)을 사용하여 분자량 <1 kDa, 1-3 kDa, 3-5 kDa, 5-10 kDa, >10 kDa으로 분획하고 동결건조하여 각각의 수율 및 항산화 활성을 측정하였다.
1,1-Diphenyl-2-picryl hydrazyl(DPPH) 라디칼 소거능은 Jang 등(18)의 방법에 준하여 측정하였다. Microwell plate에 농도별로 제조한 각 들깨박단백질 가수분해물 100 μL를 취한 후 0.2 mM DPPH 용액 200 μL를 가하고, 37℃에서 30분간 incubation 후 microplate reader(EPOCH, BioTek Instrument Inc, Winooski, VT, USA)를 이용하여 517 nm에서 흡광도를 측정하였다.
환원력은 Mau 등(19)의 방법에 따라 측정하였다. e-Tube에 농도별로 제조한 시료 250 μL, 0.2 M sodium phosphate buffer(pH 6.6) 250 μL와 1% potassium ferricyanide(KFe(CN)6) 250 μL을 첨가하여 잘 혼합하고 50℃에서 20분간 반응시켰다. 이 반응액에 10% trichloroacetic acid(CCl3COOH) 250 μL를 첨가한 후 25℃, 1,000 rpm에서 10분 동안 원심분리하였다. 이 상등액 250 μL와 0.1% ferric chloride(FeCl3·6H2O) 50 μL를 반응시켜 microplate reader(EPOCH, BioTek Instrument Inc.)를 이용하여 700 nm에서 흡광도를 측정하였다.
Superoxide dismutase(SOD) 유사활성 측정은 Bradford(20)의 방법에 따라 농도별로 제조한 시료 0.5 mL에 pH 8.5로 보정한 Tris-HCl buffer(50mM tris[hydroxymethyl] amino-methane+10 mM EDTA) 3 mL와 7.2 mM pylogallol 0.2 mL를 가하여 25℃에서 10분간 방치한 후 1 N HCl 0.1 mL로 반응을 정지시킨 후 spectrophotometer(U-2900, Hitachi)을 이용하여 420 nm에서 흡광도를 측정하였다.
결과 및 고찰
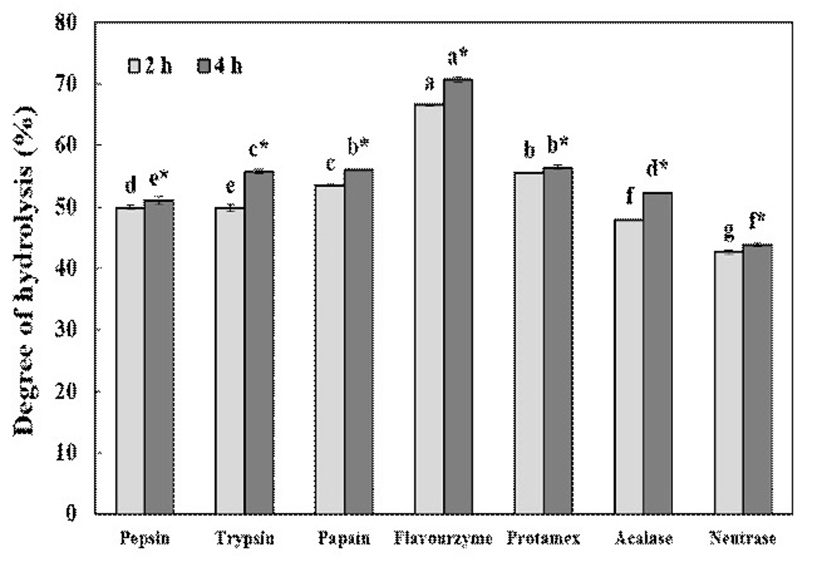
들깨박단백질로부터의 가수분해물을 생산하기 위한 효소를 선정하기 위해 7종의 단백질분해효소를 이용하여 효소 반응시킨 후 이들의 가수분해도를 측정한 결과는 Fig. 1과 같다. 각 효소 종류에 따른 들깨박단백질의 가수분해도는 2시간일 때는 flavourzyme 66.60%, protamex 55.57%, papain 53.49%, pepsin 49.91%, trypsin 49.87%, acalase 47.97%, neutrase 42.60%로 나타났다. 4시간의 경우는 flavourzyme 70.68%, protamex 56.43%, papain 56.08%, trypsin 55.75%, acalase 52.37%, pepsin 51.04%, neutrase 43.89%의 가수분해도가 나타나, 2시간 반응에 비해 유의적으로 높은 가수분해도를 나타내었다. 들깨박단백질 가수분해도는 단백질분해효소 중에서 flavourzyme이 가장 높았는데, Yoon 등(21)은 flavourzyme은 exo형과 endo형을 동시에 가수분해할 수 있는 단백질분해효소이기 때문인 것으로 추정하였다. 또한, 2시간 반응의 경우 가수분해도는 flavourzyme 다음으로 protamex, papain, trypsin, pepsin 순으로 높게 나타났다. 이 중 protamex의 경우는 2시간 반응에서 가수분해도는 55.57%로 flavourzyme 다음으로 높았지만, 4시간 반응에서는 56.43%에 불과하여 다른 효소에 비해 반응시간 증가에 따른 가수분해도의 증가가 상대적으로 낮았다. 이는 같은 기질에서도 효소 종류에 따라 가수분해도 차이가 있으며 단백질의 구조적인 민감성과 효소의 특이 기질에 대한 반응성의 차에 기인한 것으로 판단된다(22). 또한, 반응시간에 따른 유의적인 차이는 나타났지만 반응시간이 길어짐에 따라 가수분해도가 완만하게 증가하였는데, Kim(22)은 효소 첨가 시 반응초기에는 반응성이 좋은 펩타이드 결합이 우선적으로 분해되고, 반응성이 약한 펩타이드 결합은 천천히 분해되기 때문으로 보고하였다. 또한 일정 반응 후에 일정한 분해도를 유지하는 것은 가수분해 생성물이 가수분해 속도를 저해하기 때문으로 보고하였다. 이상의 결과에서 들깨박단백질 가수분해물 제조를 위한 효소는 가수분해도가 가장 높은 flavourzyme으로 선정하였다.
들깨박단백질 효소가수분해물 생산을 위한 최적 분해조건을 설정하기 위하여 pH, 온도, 효소농도에 따른 가수분해물의 가수분해도를 측정하였으며, 그 결과를 Table 2에 나타내었다. 가수분해물의 가수분해도는 pH 7.0에서 70.50%으로 유의적으로 가장 높았으며(p<0.05), pH 4.0에서 pH 7.0까지는 가수분해도가 유의적으로 증가하였다. 그 이후에는 가수분해도가 감소하여 pH 9.0에서는 28.29%로 가장 낮은 가수분해도를 보였다. Beak 등(23)의 연구에서는 홍게자숙부산물의 가수분해물이 pH 7.45에서 가수분해도가 가장 높아 본 연구 결과와 유사하였다. 따라서 들깨박단백질로부터 가수분해물 생산을 위한 flavourzyme의 최적 pH는 7.0으로 선정하였다. 최적 pH 7.0에서 온도에 따른 가수분해물의 가수분해도를 측정한 결과, 50℃에서 69.31%로 유의적으로 가장 높았으며(p<0.05), 30℃에서 59.11%으로 가장 낮은 값을 나타내었다. Jang 등(24)의 연구에서는 홍게 가공부산물로부터 단백질 가수분해물을 얻기 위해 flavourzyme을 이용하여 가수분해도를 측정한 결과, 50℃에서 가장 높은 분해도를 나타내 본 연구 결과와 일치하였다. 따라서, 들깨박단백질로부터 가수분해물 생산을 위한 flavourzyme의 최적 온도는 50℃로 결정하였다. 최적 pH 7.0, 50℃에서 효소농도에 따른 가수분해물의 가수분해도를 측정한 결과, 5 unit에서 44.78%으로 유의적으로 가장 낮았으며, 10 unit에서 67.68%로 유의적으로 가장 높게 나타났다(p<0.05). 그 후에는 가수분해도가 감소하였는데, 이는 효소가 반응할 수 있는 기질의 양이 부족하기 때문으로 사료된다. 따라서 들깨박단백질로부터 가수분해물 생산을 위한 flavourzyme의 최적 효소농도는 10 unit으로 결정하였다. 이상의 결과에 따라 flavourzyme를 이용한 들깨박단백질 가수분해물 생산을 위한 최적 분해 조건은 pH 7.0, 50℃, 효소농도 10 unit, 가수분해시간은 4시간으로 설정하였으며, 이 때의 가수분해도는 69.16%였다. 본 연구결과에서 얻은 들깨박단백질 가수분해 최적조건은 Table 1에서 제시된 flavourzyme의 최적 pH 및 온도와 일치함을 알 수 있었으며, 최적조건 하에서 효소분해 반응속도가 증가함에 따라 가수분해도가 높아진 것으로 판단된다.
가수분해도가 가장 높은 flavourzyme 가수분해물을 한외여과장치를 이용하여 분자량 >10 kDa, 5-10 kDa, 3-5 kDa, 1-3 kDa, <1 kDa으로 분획한 후 동결건조 하여 측정한 수율을 Table 3에 나타내었다. 가수분해물 분획물 5가지 중에서 1 kDa 이하의 분획이 45.65%로 유의적으로 가장 높은 수율을 보였다(p<0.05). 이는 효소 작용으로 인해 고분자의 단백질이 수용성의 저분자 펩타이드로 가수분해되어 수율이 높아진 것으로 판단된다. 또한, >10 kDa 분획과 5-10 kDa 분획은 각각 16.37%와 16.45%로 비슷한 수율을 보였으며, 3-5 kDa 분획과 1-3 kDa 분획은 각각 10.67%, 10.86%으로 낮은 수율을 나타내었다. You 등(25)의 연구에서 담수어류인 미꾸라지 단백질 가수분해물의 분자량별 수율을 측정한 결과, 1 kDa 이하 분획의 수율이 40.23%으로 가장 높았다고 보고하여 본 연구 결과와 유사하였다. 그러나 Yang과 Hong(26)의 연구에서는 10 kDa 이상의 수율이 가장 높은 것으로 나타나 본 연구 결과와 상이하였는데, 이는 사용된 기질, 효소, 반응시간 및 효소농도의 차이로 판단된다.
| Fraction | Yield (%) |
|---|---|
| >10 kDa | 16.37±0.391)b2) |
| 5-10 kDa | 16.45±1.00b |
| 3-5 kDa | 10.67±3.21c |
| 1-3 kDa | 10.86±2.48c |
| <1 kDa | 45.65±0.63a |
항산화 반응은 항산화 물질이 유리 라디칼과 수산기(-OH)가 결합하여 라디칼 생성 및 반응을 종결시켜주는 역할로 생체막의 활성산소 및 지질 과산화 라디칼에 의한 지질과산화 반응의 연쇄반응을 정지시킨다. 1,1-Diphenyl-2-picryl hydrazyl(DPPH) 라디칼은 짙은 자색의 안정한 라디칼로 항산화물질과 반응하여 탈색되어 노란색을 띄게 된다. 이러한 원리를 이용하여 항산화 물질의 수소공여능을 측정하였다(27). 들깨박단백질의 효소가수분해물 및 한외여과공정을 통해 얻은 분획물의 DPPH 라디칼 소거능을 측정하였다. 그 결과는 Fig. 2A에서 보는 바와 같이 효소가수분해물의 IC50 값이 0.58 mg/mL로 유의적으로 가장 낮아 높은 DPPH 라디칼 소거능을 나타내었다. 다음으로 10 kDa 이상의 분획이 0.67 mg/mL, 3-5 kDa 분획이 0.79 mg/mL의 IC50 값을 나타내었다. 1 kDa 이하의 분획은 2.11 mg/mL로 유의적으로 가장 높은 IC50 값을 DPPH 라디칼 소거능이 가장 낮음을 알 수 있었다. 이러한 결과는 Bamdad와 Chen(28)이 보리단백질 효소가수분해의 라디칼 소거능은 10 kDa 이상에서 가장 높은 활성을 보였다고 보고한 연구 결과와 유사하였다. 또한 양송이버섯 단백질 가수분해물로부터 한외여과에 의해 분획된 펩타이드의 DPPH 라디칼 소거능을 측정한 결과, <1 kDa과 3-5 kDa 펩타이드 분획이 단백질 가수분해물에 비해 낮은 소거능을 보였으며, acalase와 flavourzyme을 이용하여 얻은 가수분해물의 5-10 kDa 분획물이 가장 높은 라디칼 소거능을 나타낸 연구 결과(29)와 유사하였다. 이러한 결과는 효소가수분해물과 5-10 kDa의 한외여과 분획물은 전자공여능을 가지고 있는 펩타이드 또는 아미노산을 함유하고 있어 DPPH 라디칼을 안정화시키고 라디칼 연쇄반응을 차단할 수 있기 때문으로 판단된다. 반면, 닭뼈에서 용출된 펩타이드를 한외여과를 통해 얻은 3 kDa 이하 분획이 3-10 kDa 분획에 비해 높은 DPPH 라디칼 소거능을 보여(30) 본 연구 결과와 차이가 있었다. Collupulin MG를 이용하여 도루묵으로부터 얻은 효소가수분해물과 한외여과 펩타이드의 DPPH 라디칼 소거능을 측정한 결과(18), 1.0 mg/mL 농도에서 8-24%의 라디칼 소거능을 가지고 있어 본 연구에서 얻은 들깨박단백질의 DPPH 라디칼 소거능이 우수함을 알 수 있었다. 또한 3 kDa 이하의 펩타이드 분획의 라디칼 소거능이 가장 우수하였으며, 그 다음 10 kDa 이상의 펩타이드 분획이 두 번째로 높은 라디칼 소거능을 보여(18), 본 연구 결과와 다소 차이를 보였다. 이러한 차이는 DPPH 라디칼 소거능은 효소의 특이성, 펩타이드의 분자량, 아미노산의 종류 및 배열에 따라 그 활성에 차이를 보이기 때문으로 판단된다(3).
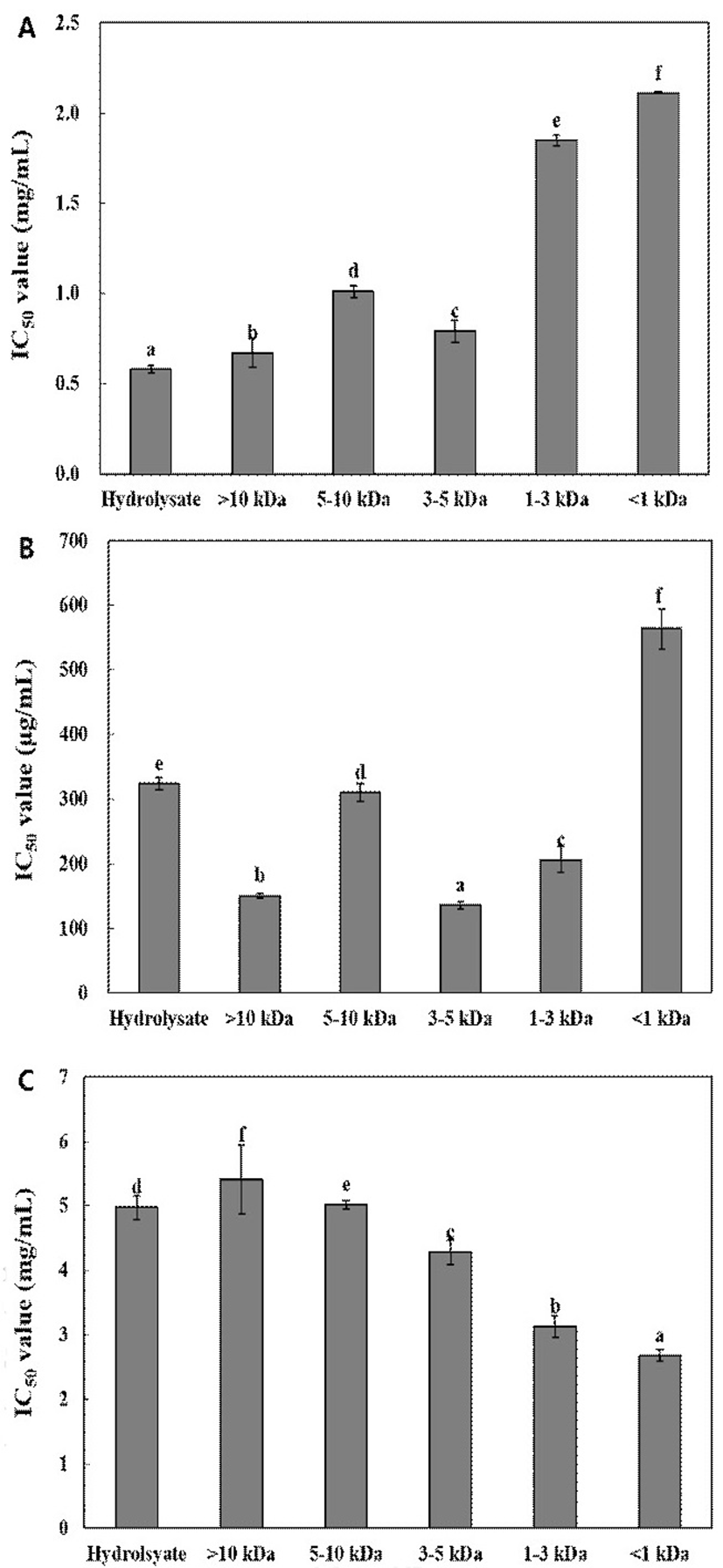
들깨박단백질의 효소가수분해물 및 이들 분획물의 환원력을 측정한 결과(Fig. 2B), 3-5 kDa 분획이 136.42 μg/mL의 IC50 값으로 유의적으로 가장 높은 환원력을 나타내었으며, 10 kDa 이상 분획이 150.59 μg/mL의 IC50 값으로 두 번째로 높은 환원력을 나타내었다. 반면, 1 kDa 이하의 분획이 564.16 μg/mL로 가장 높은 IC50 값을 나타내어 환원력이 가장 낮음을 알 수 있었다. 닭뼈 추출물을 한외여과하여 얻은 펩타이드 분획의 환원력을 측정한 결과, 2 mg/mL 농도에서 0.08-0.18의 환원력을 보였으며, 저분자 펩타이드 분획(3 kDa 이하)이 고분자 펩타이드 분획(3-10 kDa)에 비해 높은 환원력을 보여(30) 본 연구결과와 다소 차이를 보였다. 양송이버섯 단백질을 flavourzyme과 alcalase를 비롯한 다양한 단백질가수분해효소를 이용하여 가수분해 후 한외여과를 통해 얻은 펩타이드의 환원력을 측정한 결과, 1 mg/mL 농도에서 약 0.1-0.2의 환원력을 나타내어 본 연구에서 얻은 단백질 분획물의 환원력이 매우 높음을 알 수 있었다(29). 또한 flavourzyme을 이용하여 얻은 가수분해물 및 한외여과 분획물의 환원력은 1 kDa이하가 가장 높은 반면, 10 kDa 이상 분획물의 환원력이 가장 낮게 나타나(29) 본 연구결과와 차이가 있었다.
세포의 호흡작용에 의해 생성되는 활성산소종은 세포막에 작용하여 세포 손상, DNA 및 단백질에 영향을 주어 노화를 촉진시킨다. Superoxide는 산소가 전자 하나를 받아 환원된 형태로 체내 산화적 손상을 야기할 수 있으며, SOD는 2O2-+2H+→H2O2+O2와 같은 반응으로 활성산소로부터 세포를 보호한다. SOD 유사물질이란 SOD와 같이 superoxide를 정상의 산소로 전환시킬 수는 없으나 superoxide의 반응성을 억제하여 생체를 산화적 손상으로부터 보호할 수 있는 저분자 물질을 의미한다(31). 따라서 SOD 유사활성은 중성이나 알칼리 조건 하에서 superoxide에 의해 pyrogallol이 자동산화 되면서 갈색물질을 생성하는 원리를 이용하여 자동산화를 억제하는 정도로 활성을 측정하였다(32). 들깨박단백질의 효소가수분해물 및 이들 분획물의 SOD 유사활성을 측정한 결과는 Fig. 2C에 나타내었으며, 1 kDa 이하 분획물이 가장 낮은 IC50 값(2.68 mg/mL)을 나타내었다. 1-3 kDa, 3-5 kDa, 5-10 kDa 및 10 이상 분획의 IC50 값은 각각 3.13, 4.28, 5.02 및 5.41 mg/mL로 측정되어 분자량이 작을수록 SOD 유사활성은 커지는 것으로 나타났다. 또한 단백질 효소가수분해물의 IC50 값은 4.98 mg/mL로 분획 중 중간 정도의 활성을 보였다. 이상의 결과 들깨박단백질 효소가수분해물 중 저분자 분획물이 높은 SOD 유사활성을 가져 섭취 시 인체 내 superoxide를 제거하고 산화적 노화를 억제하는 데 도움을 줄 수 있을 것으로 판단된다.
요 약
본 연구에서는 단백질 함량이 높은 들깨박을 기능성 식품소재로서의 활용가능성을 확인하기 위하여 단백질분해효소 및 한외여과를 이용하여 가수분해물과 펩타이드 분획을 제조하고 이들의 항산화 활성을 측정하였다. 먼저 들깨박단백질의 가수분해물 생산을 위한 최적 효소를 선정하기 위해 단백질분해효소 7종을 이용하여 효소 반응 후 가수분해도를 측정한 결과, flavourzyme이 가장 높은 가수분해율을 나타내었다. Flavourzyme에 의한 들깨박단백질 가수분해물을 얻기 위한 최적 조건은 pH 7.0, 50℃, 효소농도 10 unit, 가수분해시간은 4시간으로 결정되었다. 들깨박단백질 가수분해물을 한외여과 후 얻은 각 분획의 수율은 1 kDa 이하가 45.65%로 유의적으로 가장 높았으며, 그 다음으로 5-10 kDa(16.45%), 10 kDa 이상(16.37%), 1-3 kDa(10.86%), 3-5 kDa(10.67%) 순으로 높았다. DPPH 라디칼 소거능은 효소가수분해물이, 환원력은 3-5 kDa 분획물이, superoxide dismutase 유사활성은 1 kDa 이하의 분획물이 가장 높은 활성을 나타내었다. 따라서 들깨박단백질로부터 생산된 가수분해물 및 펩타이드 분획은 각기 다른 항산화 활성 특성을 보여 기능성 식품 소재의 목적에 맞게 선택하여 활용할 수 있을 것으로 판단된다. 또한 향후 식품학적 기능성 평가가 이루어진다면 식품산업에서 다양한 식품재료로의 활용성이 확대될 수 있을 것으로 판단된다.
