서 론
양잠을 위해 오래전부터 재배되어 왔고 우리나라 들이나 야산에서 흔히 자생하기도 하는 뽕나무의 뿌리(상백피)는 전통적으로 혈당 강하, 혈압 강하, 해열, 이뇨 등에 효과가 있는 약제로 이용되어 왔다. 또한 뿌리뿐만 아니라 잎과 열매도 식용하며 우리나라와 일본에서는 잎을 차로 이용하기도 한다. 뽕나무는 다양한 종류의 유용 성분을 함유하여 활용 가치가 큰 식물의 하나이다(1). Jing 등(2)은 뽕나무에서 발견되어 보고된 295종의 성분 목록을 작성하고 그 중 140종의 성분을 상백피에서 확인하였는데, 뽕나무의 다양한 성분에서 항당뇨, 저지질혈, 항동맥경화, 항암, 심보호, 항도파민, 항균, 항산화, 항염증, 항tyrosinase 등의 다양한 생물 활성이 보고되어 있기도 하다(1,3).
자외선은 생물에 일반적으로 해로운 영향을 미친다. 특히, 파장이 짧은 자외선은 세포의 DNA 손상을 유발하여 살균 작용을 하거나 피부암을 일으킬 수 있다. 그러나 생물은 자외선에 적극적으로 대처하기도 하는데, 식물의 경우 자외선 조사에 대한 두드러진 반응은 이차 대사산물의 변화이다(4). 예를 들어, 포도나 블루베리에 자외선을 조사하면 stilbene, flavonol, anthocyanin 등 polyphenol 화합물의 함량이 증가하고(5-7), 뽕나무에서도 잎에 자외선을 조사하면 특유의 polyphenol 화합물인 chalcomoracin과 moracin N의 함량이 증가한다는 보고가 있다(8). 자외선 조사에 의해 증가하는 polyphenol을 비롯한 이차 대사산물은 산화 스트레스에 대처하는 항산화 작용(9) 뿐만 아니라, 항균이나 항암 등의 생물 활성을 갖는 사실은 잘 알려져 있다(4,10).
본 연구에서는 자외선을 처리하였을 때 뽕나무 잎에서 나타나는 이차 대사산물의 변화를 LC-MS를 이용하여 분석하였다. 처리에 따른 성분의 변화를 분석함에 있어서, 분석 대상이 광범위한 경우, 분석 단계에서는 분석 대상 성분을 특정하지 않은 채 시료의 전체 성분을 scanning한 후, scan data의 profiling을 통해 개별 성분의 변화를 판단하는 분석 방법(untarget analysis, 11)은 유용할 수 있다. 이러한 무표적 분석에 적합한 분석 장비는 mass spectrometer(MS)이다(11). MS는 gas 또는 liquid chromatography와 조합(GC-MS 또는 LC-MS)하여 사용할 수 있고, scan mode로 분석하면 한꺼번에 시료에 포함된 전체 성분의 이온화 data를 얻을 수 있다. 이러한 scan data에는 단위시간별로 검출된 이온의 종류(m/z)와 양(intensity)에 대한 3차원 수치 정보가 담겨있는데, data의 규모가 방대하므로 일반적으로 bioinformatics의 컴퓨터 프로그램을 활용하여 scan data를 profiling한다(11). 본 연구에서는 자외선을 조사한 뽕나무 잎을 LC-MS로 무표적 분석하여 얻은 scan data를 R 프로그램의 XCMS package(12)를 이용하여 profiling 하였다. 통계 또는 수치의 시각화를 위한 data 처리 프로그래밍 언어인 R(https://www.r-project.org)과 R에서 작동하는 MS data profiling 전용 프로그램인 XCMS package(http://bioconductor.org/packages/release/bioc/html/xcms.html)는 인터넷을 통해 자유롭게 이용할 수 있다.
앞서 언급한 바와 같이 식물의 이차 대사산물은 다양한 생물 활성을 가지며, 자외선 조사는 이차 대사산물의 조성을 변화시켜 식물에서 유래하는 식품, 약제, 화장품 원료의 기능성을 향상시키는 방편으로 유용하게 활용될 수 있다(4,6). 이에, 본 논문에서는 자외선을 조사한 뽕나무 잎의 이차 대사산물을 분석하고 활성의 변화를 조사하여 뽕나무 잎에서 자외선 처리의 유용성을 확인한 연구결과를 보고하고자 한다.
재료 및 방법
8월 하순, 대구 인근의 밭둑에 자생하는 뽕나무(백상, Morus alba)의 가지 상단 3-6엽에서 채집한 잎을 실험에 이용하였다. 채집한 잎은 실험실에 가져와서, 254 nm의 UV-C를 방출하는 자외선 램프(30 W, 2.5×90 cm, G30T08, Sankyo Denki, Japan) 4개를 7 cm 간격으로 배열하고 그 아래 25 cm 거리에 뒷면이 위로 향하도록 잎을 늘어놓은 후 2분간 램프를 점등하여 UV-C를 조사하였다. 이 조건에서 잎에 가해진 자외선의 강도는 5 mW/cm로 측정되었다(자외선 광도계; LS-125 probe-P254, Linshang, China). UV-C를 처리 또는 처리하지 않은 잎(대조구)을 마르지 않도록 비닐 봉투에 담아서 실온의 어두운 곳에 두었다가 이틀 후 -70℃의 냉동고로 옮겨 동결한 후 분석에 이용할 때까지 냉동고에 보관하였다.
1 g의 잎에 10 mL의 70% methanol을 가하고 tissue homogenizer(T-25 Ultra-Turrax, IKA, Staufen, Germany)를 이용하여 3분간 간 후, 분쇄액을 38,000 ×g에서 15분간 원심분리하여 회수한 상징액을 성분 분석 및 활성 측정용 시료로 이용하였다.
시료의 표적 또는 무표적 분석을 위한 LC-MS의 분석 조건은 다음과 같았다. LC; Alliance 2695(Waters, Miliford, MA, USA), column; Luna C18(3 mm×15 cm, 3 m, Phenomenex, Torrance, CA, USA), solvent program; 0-1분 0.1% formic acid/물+methanol(90:10, v/v)→52분 80% methanol→ 5분 100% methanol→60분 100% methanol, 유속; 0.3 mL/min, 시료 주입량; 2 μL, mass spectrometer; Mass Detector 3100(Waters), 이온화 mode; ESI-, capillary voltage; 4 kV, cone voltage; 30 V, desolvation 온도; 400℃, desolvation gas; N2 400 L/h, 무표적 분석 data mode; m/z 120-850 scanning, 표적 분석 data mode; 해당 성분의 m/z monitoring(SIR).
LC-MS의 scan mode로 얻은 data를 netCDF file로 변환한 후 R의 XCMS package(12)를 이용하여 profiling하였다. XCMS의 parameter는 IPO package(13; https://bioconductor.org/packages/release/bioc/html/IPO.html)를 이용하여 구하였으며, peak grouping은 CAMERA package(14; https://bioconductor.org/packages/release/bioc/html/CAMERA.html)를 이용하여 수행하였다.
시료의 항산화 활성은 DPPH(15) 또는 ABTS(16) radical 소거능을 측정한 후 trolox 함량으로 환산하여 표시하였다. 시료의 tyrosinase 억제 활성은 Takahashi 등(17)의 방법을 변형하여 측정하였다. 즉, 2.5 mM L-tyrosine(50 mM 인산 완충용액, pH 6.8) 용액 300 μL에 시료 용액 20 μL와 10 μL(250 U)의 버섯 tyrosinase(Sigma-Aldrich Co., St. Louis, MO, USA) 용액을 가하고 dopachrome의 생성에 따른 흡광도의 변화를 spectrophotometer(UV 1700, Shimadzu, Kyoto, Japan)를 이용하여 475 nm에서 5분 동안 10초 간격으로 측정하였다. 시료 대신에 70% methanol을 첨가했을 때의 측정값과 비교하여 시료의 tyrosinase 활성 억제 정도(%)를 산출하였다.
성분의 분리 및 정제용 시료의 추출 과정은 다음과 같았다. UV-C를 처리한 500 g의 잎을 1 L의 methanol과 함께 믹서로 간 후 초음파 수조에서 30분간 초음파 처리하였다. 분쇄물은 Büchner 깔때기로 여과하여 여과액과 잔사로 분리한 후 잔사는 750 mL의 methanol을 가하고 다시 한번 분쇄, 초음파 처리, 여과의 과정을 반복하였다. 회수한 여과액은 rotary evaporator를 이용하여 methanol을 증발시키고 물만 남긴 후 500 mL의 hexane으로 3회 세척하여 탈지하였다. Methanol과 물로 차례로 세척하여 활성화시킨 4개의 5 g Sep-Pak C18 cartridge(Waters)에 추출액을 나누어 통과시킨 후 cartridge에 흡착된 성분을 4×100 mL의 60% methanol로 회수하였다. 이 고체상 추출 과정은 chromatography에 방해가 되는 흑색의 타르를 제거하는데 유용하였다. 회수한 용출액은 rotary evaporator를 이용하여 methanol을 증발시키고 물(약 100 mL)만 남긴 후 100 mL의 ethyl acetate로 3회에 걸쳐 용매추출 하였다. 회수한 ethyl acetate 추출액은 rotary evaporator로 용매를 제거하였으며, 이로써 약 2.5 g의 조추출물을 얻었다. 조추출물은 5 mL의 methanol에 재용해하여 성분 분리용 시료로 이용하였다.
Methanol에 용해한 조추출물을 역상 chromatography로 분리하였다. 분리 조건은 다음과 같았다. Pump; LC-10A (Shimadzu, Kyoto, Japan), 검출기; SPD-10A(Shimadzu, Kyoto, Japan), column; Luna C18 semi-prep column(1×25 cm, 5 μm, Phenomenex), solvent program; 0-5분 0.1% formic acid/물+methanol(80:20, v/v)→60분 80% methanol→70분 100% methanol→80분 100% methanol, 유속; 2.5 mL/min, 검출; UV 254 nm, 시료 주입량; 150 μL. 시료는 반복하여 주입하였으며, fraction collector를 이용하여 column 용출액을 80개의 시험관에 2.5 mL씩 분리 회수하였다. 각 시험관의 시료는 LC-MS로 분석하여 성분을 확인한 후 8개의 fraction으로 통합하였다. 한편, 역상 chromatography 만으로 충분히 분리되지 않은 성분의 경우에는 Sephadex column을 이용한 순상 chromatography를 추가하였으며, 그 조건은 다음과 같았다. column; Sephadex LH-20(1×30 cm, GE Healthcare, Chicago, Il, USA), 용매; methanol, 유속; 0.25 mL/min, 시료 주입량; 2 mL, fraction collection volume; 2.5 mL. 80개의 시험관에 분리 회수한 시료는 LC-MS를 이용하여 성분을 확인한 후 31-33번째 시험관의 시료를 통합하여 역상 chromatography로 재분리하였다. 분리한 각 fraction은 rotary evaporator로 건조한 후 10 mg/mL의 농도로 methanol에 재용해하여 냉동 보관하였다.
결과 및 고찰
자외선(UV)은 10-400 nm 파장의 빛인데, UV-A(315-400 nm), B(280-315 nm), C(100-280 nm)로 분류된다. 태양광에는 자외선이 포함되어 있으나 이 중 UV-C는 성층권의 오존층에 흡수되어 지표면에 도달하지 못한다. 자외선은 종류에 따라 식물에 미치는 영향이 다르다(18). 예를 들어, 짧은 파장의 자외선은 DNA 분자에 직접 흡수되어 인접해 있는 두 pyrimidine 염기간에 이량체를 형성시킴으로써 DNA 사슬 구조의 왜곡과 이에 따른 세포 기능의 손상 또는 죽음을 초래한다. 그러나 UV-A는 이와 반대로 DNA 복구 효소인 DNA photolyase를 활성화하여 손상된 DNA를 복구하는 작용을 한다(19). 본 연구에서는 예비실험으로 뽕나무 잎에 UV-A, B, C를 조사하여 이차 대사산물의 변화를 조사하였다. UV-A의 경우 10, 20, 또는 40분간 조사하였을 때 대조구와 이차 대사산물의 조성에 차이가 없었던 반면에, UV-B와 C의 경우에는 1, 2, 4, 8, 16분 조사하였을 때 1분 이상의 처리구에서 모두 대조구와 차이를 보였다(data not shown). 그러나 본 논문에서는 그 중 특히 차이가 가장 뚜렷한 UV-C 2분 처리의 결과에 대해 보고하고자 한다.
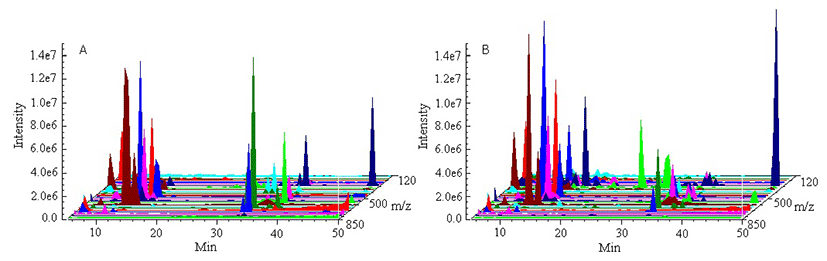
Fig. 1은 UV-C를 2분간 조사하고 이틀이 지난 뽕나무잎을 70% methanol로 추출하여 LC-MS(ESI-mode)로 무표적 분석한 후 전체 이온 peak(m/z 120-850)를 시간별로 m/z에 따라 나열한 total ion chromatogram(TIC)이다. 대조구와 비교하여 UV-C를 조사한 잎에서는 peak 숫자가 증가하였을 뿐만 아니라 크기의 변화가 발견되어 UV-C 조사에 의해 뽕나무 잎의 이차 대사산물의 조성에 변화가 일어났음을 확인할 수 있었다. Table 1은 무표적 분석의 scan data를 전용 프로그램인 XCMS package(14)를 이용하여 data profiling한 결과이다. LC-MS는 시료 성분을 이온화한 후 이온의 질량을 검출한다. ESI-mode로 이온화하는 과정에서, 시료 성분(M)은 탈양성자화(deprotonation)하여 바람직한 [M-H]- 이온을 형성하기도 하지만 그보다 더 작은 단편(fragment ion)으로 깨지거나 또는 뭉쳐서 더 큰 이온(adduct ion)을 형성할 수도 있다. 다양한 이온들의 혼재는 data profile의 해석을 어렵게 하므로, 본 연구에서는 profiling 과정에서 CAMERA package(14)를 이용하여 fragment 또는 adduct ion를 배제하고 [M-H]- 만을 추출한 후, 추출된 전체 이온(198개) 중에서 면적 값이 2,000,000 이하이거나, RT 값이 5분 미만 또는 50분 초과인 이온들은 추가로 배제하였다. 따라서, Table 1에 나열된 이온들은 각각 독립적으로 시료 성분을 대변한다고 볼 수 있다. 무표적 분석 결과의 개요 작성을 통해 드러난 이들 성분들을 중심으로 표준물질을 이용하거나 성분 분리를 통하여 성분의 종류를 확인하였다.
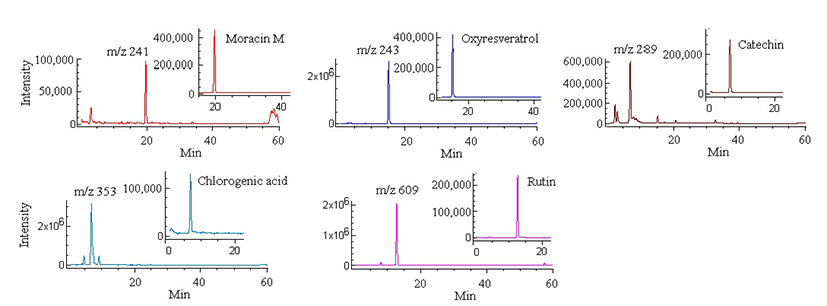
LC-MS의 장점 중 하나는 검출된 이온의 m/z 값으로부터 성분의 분자량 유추가 가능하다는 점이다. Table 1에서, m/z=241, 243, 289, 353, 609인 이온들은 분자량(또는 M)이 각각 242, 244, 290, 354, 610인 성분을 대변할 것으로 예상되었다. Jing 등(2)이 작성한 뽕나무 잎의 성분 목록에서 분자량을 기준으로, 이들 성분은 각각 moracin M, oxyresveratrol, catechin, chlorogenic acid, rutin에 해당한다. 따라서 이들을 표준물질로 하여, 각 표준물질의 SIR chromatogram과 시료의 전체 이온 중에서 표준물질에 상응하는 m/z의 이온을 추출하여 작성한 chromatogram (extracted ion chromatogram, EIC)을 비교한 결과(Fig. 2), 양자의 RT가 모두 일치하였으며, 이를 통하여 위 성분들의 종류를 확인하였다.
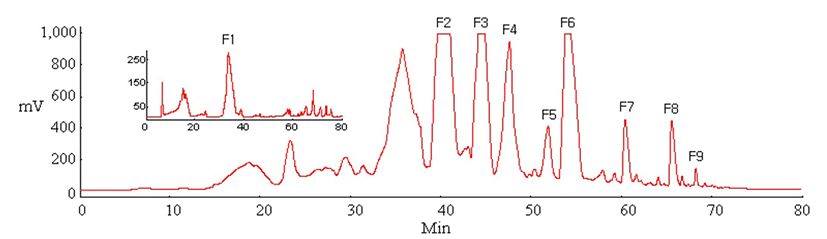
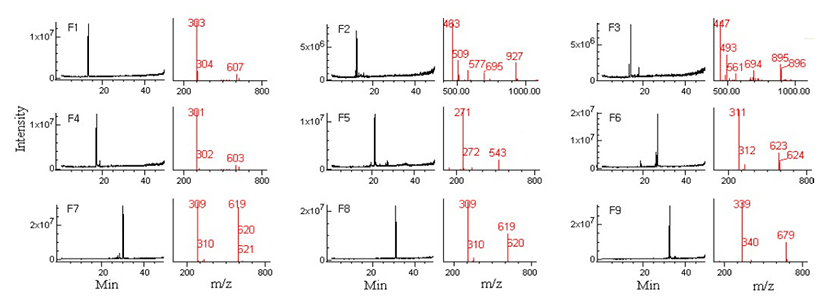
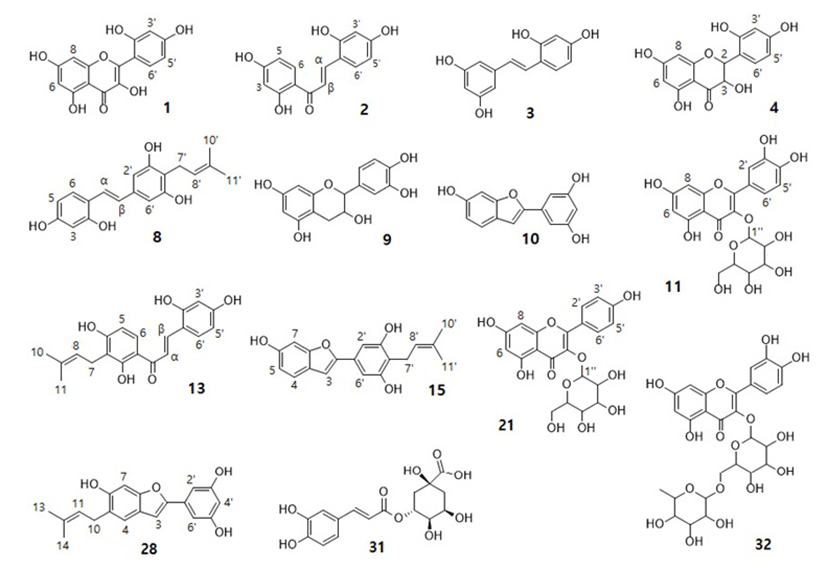
성분 확인을 위하여 뽕나무 잎에 함유되어 있는 성분에 대해 일일이 표준물질을 확보하기는 쉽지 않으므로 UV-C를 조사한 잎으로 부터 성분의 분리를 시도하였다. 용매추출과 C-18 cartridge를 이용한 고체상 추출로 전처리한 조추출물로부터 역상 분리법을 이용하여 UV 흡광 peak를 기준으로 9개의 fraction(F1-F9)을 얻었다(Fig. 3). 그러나 이중 F1은 역상 chromatography 만으로 충분한 순도로 분리되지 않아 조추출물을 Sephadex LH-20 column으로 1차 분리한 후 역상 분리하였다. 분리한 fraction은 LC-MS의 scan mode로 분석하여 TIC를 확인한 결과 뚜렷한 단일 peak가 관찰되었다(Fig. 4). 한편, TIC에 나타난 peak의 질량 spectrum을 조사한 결과, 모든 fraction의 peak에서 공통적으로 [M-H]- 이온과 [2M-H]-이온을 발견할 수 있었다. 예를 들어, Fig. 4에서 F1 peak의 질량 spectrum을 보면, [M-H]- 이온에 해당하는 m/z 303과 [2M-H]-에 해당하는 m/z 607이 함께 발견되었다. 이는 M=304로서 이 peak의 성분은 분자량이 304임을 강하게 암시한다. 그러나 분자량만으로 성분의 정체를 단정할 수 없는데, 예를 들어, Fig. 4에서, F7과 F8은 RT가 각각 29.9분과 31.0분으로 서로 다르므로 서로 다른 화합물일 것으로 추측되지만 분자량은 동일하게 309이다. 따라서 분리된 성분의 종류를 밝히기 위하여 이들의 NMR spectrum을 조사하였으며, 분자량과 NMR spectrum을 문헌과 비교함으로써 이들 성분의 종류를 확인할 수 있었다(Table 2).
| ID no | Chemical shifts1) (δ ppm) | Ref | |
|---|---|---|---|
| 1 | 1H | 7.43 (1H, d, J=9, C-3'), 6.48 (1H, dd, J=2.4, 2.4, C-5'), 6.42 (1H, d, J=2.4, C-6'), 6.33 (1H, d, J=2.4, C-8), 6.18 (1H, d, J=1.8, C-6) | 20 |
| 13C | 177. 8, 165.5, 162.8, 162.5, 159.0, 157.8, 150.0, 136.6, 132.2, 111.6, 109.2, 105.1, 104.7, 99.3, 64.6 | ||
| 2 | 1H | 8.09 (1H, d, J=15.6, C-β), 7.89 (1H, d, J=9.0, C-6), 7.70 (1H, d, J=15.6, C-α), 7.52 (1H, d, J=8.4, C-6'), 6.39 (1H, dd, J=2.4, 2.4, C-5), 6.37 (1H, dd, J=2.4, 2.4, C-5'), 6.35 (1H, d, J=2.4, C-3'), 6.29 (1H, d, J=2.4, C-3) | 3 |
| 13C | 194.2, 167.4, 166.1, 162.8, 160.8, 142.1, 133.1, 132.4, 117.6, 115.6, 114.9, 109.1, 109.0, 103.8, 103.6 | ||
| 4 | 1H | 7.22 (1H, d, J=9.0, C-6'), 6.35 (2H, m, J=9.0, C-3', 5'), 5.91 (1H, d, J=2.4, C-8), 5.87 (1H, d, J=2.4, C-6), 5.39 (1H, d, J=11.4, C-2), 4.78 (1H, d, J=11.4, C-3) | 23 |
| 13C | 197.5, 167.2, 163.9, 163.6, 158.8, 157.2, 129.4, 114.1, 106.4, 102.2, 100.5, 95. 7, 94.8, 78.6, 71.1 | ||
| 8 | 1H | 7.30 (1H, d, J=9.0, C-3), 7.21 (1H, d, J=16.2, C-β), 6.76 (1H, d, J=16.2, C-α), 6.46 (2H, s, C-2', 6'), 6.30 (2H, m, J=11.4, C-5, 6), 5.24 (1H, m, J=18.0, C-8'), 3.31 (1H, m, J=6.6, C-7'), 3.27 (2H, d, J=6.6, C-7'), 1.72 (3H, s, C-10'), 1.62 (3H, s, C-11') | 28 |
| 13C | 159.0, 157.2, 138.5, 131.0, 128.2, 126.7, 124.7, 123.7, 118.1, 115.4, 108.4, 105.6, 103.6, 49.9, 26.0, 23.3, 17.9 | ||
| 11 | 1H | 7.63 (1H, d, J=2.4, C-2'), 7.51 (1H, dd, J=1.8, 2.4, C-6'), 6.79 (1H, d, J=9.0, C-5'), 6.32 (1H, d, J=2.4, C-8), 6.13 (1H, d, J=1.8, C-6), 5.17 (1H, d, J=7.2, C-1’’), 3.2-3.6 (br m, rest H of glucose) | 29 |
| 13 | 1H |
8.07 (1H, d, J=15.0, C-β), 7.74 (1H, d, J=9.0, C-6'), 7.7 (1H, d, J=15.0, C-α), 7.49 (1H, d, J=9.0, C-5), 6.4 (1H, d, J=9.0, C-5'), 6.35 (1H, dd, J=2.4, 2.4, C-6), 6.34 (1H, d, J=2.4, C-3'), 5.23 (1H, t, J=15.0, C-8), 3.31 (2H, d, J=7.8, C-7), 1.77 (3H, s, C-11), 1.65 (3H, s, C-10) |
30 |
| 15 | 1H | 7.32 (1H, d, 8.4, C-4), 6.86 (1H, d, 1.8, C-7), 6.82 (1H, d, 1.2, C-3), 6.76 (2H, s C-2', 6'), 6.71 (1H, dd, 2.4, 6.0, C-5), 5.25 (1H, t, 7.2, C-2''), 3.31 (1H, m, C-1''), 1.77 (3H, s C-5''), 1.66 (3H, s C-4'') | 31 |
| 21 | 1H | 8.05 (2H, d, J=8.9, C-2', 6'), 6.89 (2H, d, J=8.6, C-3', 5'), 6.40 (1H, s, C-8), 6.21 (1H, s, C-6), 5.25 (1H, d, J=7.2, C-1’’), 3.2-3.7 (br m, rest H of glucose) | 29 |
| 28 | 1H | 7.19 (1H, s, C-4), 6.87 (1H, s, C-7), 6.85 (1H, s, C-3), 6.73 (2H, d, J=2.2, C-2', 6'), 6.21 (1H, t, J=2.1, 2,2, C-4'), 5.36 (1H, t, J=7.3, 7.3, C-9), 3.32 (2H, d, J=7.3, C-8), 1.74 (3H, s, C-11), 1.28 (3H s, C-12) | 32 |
1) 600 MHz, CD3OD solvent, s; singlet, d; doublet, dd; double doublet, m; multiplet, J; coupling constant (Hz), carbon numbers are presented in Fig. 5.
UV-C를 조사한 뽕나무 잎의 무표적 분석 data profile에 드러난 35종의 주요 성분 중에서, 14종의 성분은 표준물질을 이용하거나 성분의 분리와 NMR spectrum의 비교를 통하여 종류를 확인할 수 있었으며(Fig. 5), 8종은 분자량을 토대로 문헌과 비교하여 종류를 추측할 수 있었다(Table 1). Table 3은 종류가 확인된 14종의 성분에 대하여 UV-C 조사에 따른 함량의 변화를 LC-MS를 이용하여 정량 분석한 결과이다. 표적 분석의 정량 결과(Table 3)를 무표적 분석의 data profile(Table 1)과 비교해 보면, 화합물의 종류별 함량 변화 순위에 약간의 변동이 있기는 하나. 무표적 분석의 data profile이 시료의 실제 성분 조성을 비교적 옳게 반영함을 확인할 수 있었다. 한편, 확인된 14종의 성분을 기준으로 볼 때, UV-C 조사 후에 뽕나무 잎의 이차 대사산물의 총량은 4.0 mg/gfw에서 6.5 mg/gfw로 1.6배 증가하였다. 자외선을 조사하지 않은 잎에서 14종의 화합물 가운데 함유량이 가장 많은 성분은 chlorogenic acid[31]와 rutin[32]으로서, 이 두 성분의 함량은 각각 2.4 mg/gfw와 1.4 mg/gfw로서, 14종 전체 함량의 95%를 차지하였다. 그러나 이 두 성분은 자외선 조사에 따른 함량의 변화를 보이지 않았다. 이와 달리, morin[1], 2',4',2,4-tetrahydroxychalcone[2], oxyresveratrol[3], 2,3-trans-dihydromorin[4], 4'-prenylresveratrol[8], catechin[9], moracin M[10] 등은 뽕나무 잎에 본래 수 μg/gfw 수준으로 상대적으로 적은 양이 함유되어 있었으나 UV-C 조사 후에 수십 내지 수백 μg/gfw 수준으로 큰 폭의 함량 증가를 보였다. 자외선의 조사에 의해 함량이 증가한 성분들은 대부분 항산화 활성을 가진 화합물이다(1,3,6,9,15,20). 자외선 조사는 식물에서 활성산소종의 생성과 산화 스트레스를 유발하며, 식물은 이를 극복하기 위하여 항산화 활성의 이차 대사산물을 생성하는 것으로 알려져 있다(21). 본 연구에서도, 뽕나무 잎의 70%-methanol 추출액에 대해 DPPH 또는 ABTS radical 소거능을 측정한 결과, UV-C 조사에 의해 뽕나무 잎의 항산화 활성은 대조구에 비해 2.1배 내지 2.7배 증가한 것을 확인할 수 있었다(Table 4). 한편, 뽕나무의 이차 대사산물 중에는 tyrosinase의 활성을 억제하는 화합물들이 있다. Tyrosinase는 동식물 조직에서 polyphenol의 산화를 통하여 melanin 색소의 생성을 유발하는 효소로서, 식품이나 피부의 갈변을 유발한다(22). 식품의 갈변 방지제나 피부 미백제로 이용하는 대표적인 tyrosinase 저해제는 kojic acid와 arbutin인데, 뽕나무 성분 중 morin[1], 2',4',2,4-tetrahydroxychalcone[2], oxyresveratrol[3], 2,3-trans-dihydromorin[4] 등은 kojic acid나 arbutin 보다 강한 tyrosinase 억제 활성을 나타내는 것으로 보고되어 있다(3,17,23,24). 본 연구에서, UV-C 조사에 의해 이들의 함량은 크게 증가하였으며, UV-C를 조사한 뽕나무 잎 추출액은 대조구의 2.3배에 이르는 tyrosinase 활성 억제 효과를 보였다(Table 4).
자외선 조사는 뽕나무 잎의 이차 대사산물의 조성을 변화시키며 특히 morin[1], 2',4',2,4-tetrahydroxychalcone[2], oxyresveratrol[3], 2,3-trans-dihydromorin[4], 4'-prenylresveratrol [8], catechin[9], moracin M[10]의 함량을 적게는 35배, 많게는 465배 증가시키는 것으로 조사되었다. 자외선 조사에 의해 증가하는 이러한 성분들은 항산화 또는 tyrosinase 활성 억제 등의 생물활성을 가지는 것으로 보고되어 있는데, 자외선의 조사는 뽕나무 잎의 항산화 활성을 2.1-2.4배, tyrosinase 억제 활성을 2.3배 향상시켰다. 이러한 조사 결과는 자외선의 조사가 뽕나무 잎의 기능성을 향상시켜 기능성 식품, 약용 또는 화장품 소재로서의 활용 가치를 향상시키는 유용한 수단이 될 수 있음을 보인다.
요 약
식물의 이차 대사산물은 다양한 생물활성을 가지며 자외선은 이차 대사산물의 생성에 영향을 미치는 것으로 알려져 있다. 뽕나무는 다양한 종류의 유용 성분을 함유하여 활용 가치가 높은 식물 중의 하나이다. 본 연구에서는, UV 조사에 따른 뽕나무 잎의 이차 대사산물의 변화를 조사하기 위하여, 뽕나무 잎을 LC-MS를 이용하여 무표적 분석법으로 분석하였으며, 무표적 분석으로 얻은 scan data를 bioinformatics 프로그램인 R의 XCMS package를 이용하여 profiling 한 결과, 적어도 35종 이상의 화합물에서 UV-C 조사에 따른 양적인 변화가 발견되었다. 이들 중 14종의 화합물은 분리 및 NMR spectrum 비교 또는 표적 분석을 통하여 종류를 확인하였으며, 종류가 확인된 성분에 대해 정량 분석을 수행한 결과, morin(464배), oxyresveratrol(256배), 2,3-trans-dihydromorin(170배), 2',4',2,4-tetrahydroxychalcone (120배), catechin(84배), 4'-prenyloxyresveratrol(43배), moracin M(35배) 등의 함량이 현저하게 증가한 것으로 나타났다. 또한 UV-C를 조사한 뽕나무 잎은 대조구에 비하여 항산화 활성이 2.1-2.4배, tyrosinase 억제 활성이 2.3배 증가한 것으로 조사되었다. 이러한 조사 결과는 자외선의 조사가 뽕나무 잎의 기능성을 향상시켜 기능성 식품, 약용 또는 화장품 소재로서의 활용 가치를 향상시키는 유용한 수단이 될 수 있음을 보인다.
