서 론
생물체의 대사과정 중 생성되는 활성산소종(reactive oxygen species, ROS)은 고반응성의 free radical로 인한 염증작용 및 세포노화로 질병을 야기한다(1,2). 이러한 활성산소를 제거하는 대표적인 물질로는 L-ascorbic acid (vitamin C), butylated hydroxy anisol(BHA), epigallocatechin gallate(EGCG) 등이 있으며, 이들은 대부분 –OH(hydroxyl) group으로 활성산소를 소거할 수 있는 환원성 갖으며, 동식물성 유래 천연 antioxidant로 이루어진다(3). 최근에는 아시아를 포함한 중국에서 미세먼지 및 황사에 포함된 내독소(endotoxin)가 생체 내 활성산소를 발생시키고 염증을 야기한다고 밝혀졌으며, 내독소는 세균의 세포 내 성분으로서, 그람음성균에서는 세포막에 포함되는 lipopolysaccharide(LPS) 등을 포함한다(4,5). 염증은 물리, 화학적 자극과 미생물의 성분 등이 항원이 되어 나타나는 생물체의 정상적인 면역 반응과 염증이 과도하거나 지속되면 관절염, 천식 및 다발성 경화증을 포함한 많은 질병의 원인이 된다(6,7). 대식세포는 생체 내 혈관 및 림프 등에 존재하며 병원균에 대한 즉각적인 방어를 제공함으로써 면역 체계에서 중요한 역할을 하고, toll-like receptors(TLRs)를 포함한 pattern-recognition receptors(PRR)을 통해 병원성 물질을 검출 및 IL-1β, IL-6, TNF-α, i-NOS, COX-2와 같은 염증성 인자와 염증을 매개하는 다수의 사이토카인을 방출한다(8,9). 대식세포에서 TLR류 중 하나인 toll-like receptor 4(TLR4)는 세균 막의 당지질인 lipopolysaccharide(LPS)와 같은 항원과 반응하며, NF-κB의 활성화를 가져 오는 IκB kinase(IKK) 복합체를 인산화시킨다. COX-2 및 iNOS 발현은 전사 인자 NF-κB에 의해 조절되며 자극받지 않은 조건하에서, NF-κB는 억제인자 IκB-α에 의해 세포질로부터 정상적으로 분리되지만, 자극조건하에서는 NF-κB는 핵으로 전위되어 염증성 사이토카인과 매개체의 발현을 활성화시킨다(10,11).
토종다래(Actinidia arguta) 열매에 대한 연구는 휘발성 성분(12), 피토케미컬성분(13), 영양성분(14), 아토피 피부염(15), 경구투여에 대한 안전성(16) 등 연구가 활발히 이루어지고 있으며, 일부 염증성 사이토카인(17)에 대한 조사가 이루어졌으나, NF-κB 경로에 따른 염증 발생 기전에 대한 연구는 없는 실정이다.
본 연구에서는 토종다래를 water, 70% ethanol, 및 acetone으로 추출하여 항산화 효과를 검정하고 염증인자인 iNOS, COX-2과 IL-1β, IL-6, TNF-α 사이토카인의 발현을 확인하였으며, 이러한 인자들의 NF-κB 경로의 연관성을 확인하여 항염증 효과를 알아보고자 하였다.
토종다래의 효능을 확인하여 우리나라 자생토종다래의 기능성 소재로서의 발굴을 위한 자료로 사용될 수 있을 것으로 기대된다.
재료 및 방법
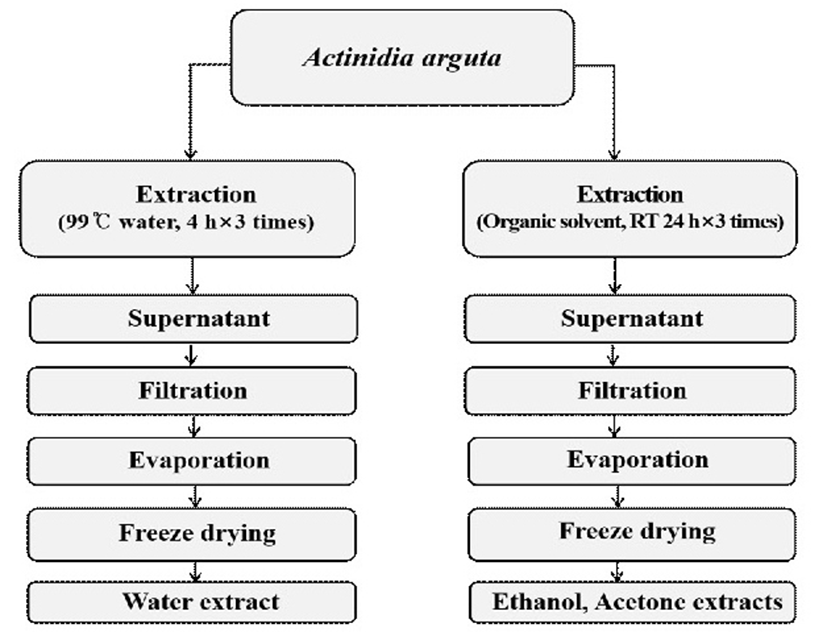
본 실험에 사용된 토종다래(Actinidia arguta)는 강원도 홍천군에서 건조된 상태로 공급받아 사용하였으며, 토종다래의 추출은 Fig. 1과 같이 추출하였다. Hardy kiwifruit extracted with hot water(HKW)는 물을 시료 중량의 10배 양을 가하여 99℃에서 4시간 동안 3번 반복하여 추출하였으며, hardy kiwifruit extracted with 70% ethanol(HKE) 및 hardy kiwifruit extracted with 70% acetone(HKA)는 70% ethanol 및 acetone을 시료 중량에 10배 양을 가하여 실온에서 24시간동안 3번 반복하여 추출하였다. 추출물들의 수율은 HKW > HKA > HKE순으로 각 31.8%, 26.9%, 25.2% 이였다. 추출물들은 원심분리 및 여과, 농축 후 동결 건조하여 냉장실에 보관하면서 본 실험의 시료로 사용하였다.
항산화능 측정 실험에 사용된 시약인 2,2’-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid)(ABTS), 1-1-diphenyl-2-picryl-hydrazyl(DPPH) 등은 Sigma-Aldrich Co.(St. Louis, MO, USA)에서 구입하였다.
항염증 측정 실험에 사용된 시약인 p-dimethylaminobenzaldehyde, sodium nitrite, griess reagent, RIPA lysis and extraction buffer, lipopolysaccharide, protease inhibitor, nuclear and cytoplasmic extraction reagents 등은 Sigma-Aldrich Co.(St. Louis, MO, USA)에서 구입하여 사용하였다. Western blot을 위한 i-NOS, COX-2, NF-κB 및 secondary antibody는 Santa Cruz Biotechnology(Paso Robles, CA, USA)에서 구입하였다.
세포 생존율 측정에 사용된 세포주는 macrophage cell(RAW 264.7)로 American Type Culture Collection (Manassas, VA, USA)에서 구입하여 사용하였다. 세포 배양을 위한 Dulbecco's modified eagle medium(DMEM), fetal bovine serum(FBS)은 GE Healthcare Life Sciences(Logan, UT, USA)에서 구입하여 사용했으며, 0.25% trypsin-EDTA, 0.4% trypan blue stain은 Gibco BRL Co.(Grand Island, NY, USA)에서 구입하여 사용하였고, 3-[4,5-dimethylthiazol-2-yl]-2,5-diphenyl-tetrazolium bromid(MTT)는 Sigma-Aldrich Co.에서 구입하여 사용하였다.
본 실험에 사용된 기기는 UV/VIS spectrophotometer (Hitachi, Tokyo, Japan), polarization microscope(Olympus BX 51, Tokyo, Japan), western imaging system(CAS-400SM, Davinch-K, Seoul, Korea), rotary vacuum evaporator(EYELA, Tokyo, Japan), centrifuge(Hitachi), freeze drier(Ilshin, Gimpo, Korea), microscope(Olympus, Tokyo, Japan), CO2 incubator(Hanbaek Scientific Co., Bucheon, Korea), pH meter(Metrohm, Herisau Switzerland), BOD Incubator (Hanbaek Scientific Co.), autoclave(Hanbaek Scientific Co.), ELISA reader(Molecular Devices, San Jose, CA, USA)를 사용하였다.
총 페놀 화합물은 Folin-Denis 방법(18)으로 측정하였으며, HKW, HKE, HKA, 및 tannic acid를 10 mg/mL 농도로 증류수에 희석한 다음 0.2 mL Folin-Ciocalteu reagent를 첨가하여 잘 혼합한 후 3분간 실온에 방치하였다. 3분 후 Na2CO3 포화용액 0.4 mL를 가하여 혼합하고 증류수를 첨가하여 4 mL로 만든 후 실온에서 1시간 방치하고, 725 nm에서 흡광도를 측정하였다. 이 때 총 폴리페놀 화합물은 tannic acid를 이용한 표준곡선으로부터 양을 환산하였다.
전자공여능(electron donating ability, EDA)은 Blois(19)의 방법을 변형하여 측정하였다. HKW, HKE, HKA, 및 EGCG, BHA는 70% ethanol에 희석하여 사용하였다. 각 시료용액과 0.2 mM의 DPPH를 1:1 비율로 넣고 교반한 후 흡광도 517 nm에서 측정하였다. 전자공여능은 시료용액의 첨가군과 무첨가군의 흡광도 감소율로 나타내었다.
ABTS+ radical을 이용한 항산화력 측정은 ABTS+ radical decolorization assay 방법(20)에 의하여 측정하였다. HKW, HKE, HKA, 및 EGCG, BHA는 증류수에 희석하여 사용하였다. 7 mM ABTS와 2.4 mM potassium persulfate를 혼합하여 실온에서 24시간 동안 방치하여 ABTS+ radical을 형성 시킨 후 ethanol로 희석하여 ABTS+ 용액 100 μL에 시료 100 μL를 더하여 1분 동안 방치한 후 흡광도 734 nm에서 측정하였다.
Mouse 유래 대식세포인 RAW 264.7은 한국 세포주 은행(KCLB)에서 구입하였고 10% Fetal bovine serum(FBS)와 1% penicillin-streptomycin이 첨가된 DMEM 배지를 사용 하였다. 세포는 37℃ 및 5% CO2에서 배양하였다.
세포 생존율 측정은 Carmichael(21)의 방법에 따라 수행하였다. 먼저, RAW 264.7 대식세포를 96-well plate에 5×104 cells/well이 되도록 180 μL 분주하고, 시료를 농도별로 조제(sol. DMEM)하여 0.02 mL 첨가한 후 37℃, 5% CO2 incubator에서 24시간 배양하였다. 여기에 5 mg/mL 농도로 제조한 MTT 용액 0.02 mL 첨가하여 4시간 배양한 후 배양액을 제거하고 각 well당 0.15 mL의 DMSO를 가하여 실온에서 30분간 반응 시킨 뒤 ELISA reader로 540 nm에서 흡광도를 측정하였다. 세포 생존율 측정은 시료용액의 첨가군와 무첨가군의 흡광도 감소율로 나타내었다.
Nitric oxide(NO) 측정은 세포배양액에서 NO의 양을 nitrite and nitrate로서 측정 하였다(22). Nitrate에 대한 nitrate로 환원된 후의 안전한 형태인 griess reagent(Sigma)를 사용하였으며, 6-well plate에 5×105 cell/well을 10% FBS가 포함된 배지를 사용하여 24시간 배양시킨 다음 DMEM 배지를 용매로 농도별로 희석한 시료(HKW, HKE, HKA)를 1시간 동안 첨가한 후, LPS 1 μg/mL이 되도록 normal군을 제외한 모든 well에 24시간 동안 자극시켰다. 세포 배양액을 모아 griess reagent로 10분간 반응시킨 후에 540 nm에서 흡광도를 측정하였다.
i-NOS, COX-2 단백질 발현양을 확인하기 위해, RAW 264.7 대식세포를 DMEM 배지를 사용하여 5×105 cells/well만큼 6-well plate에 접종하고 5% CO2 incubator에서 24시간 동안 배양한 후, 세포에 DMEM 배지로 희석한 HKW 및 HKE, HKA를 100, 500, 1,000, 2,000 또는 100, 500, 1,000 μg/mL로 1 시간 동안 처리한 후, i-NOS, COX-2의 경우는 1 μg/mL의 LPS를 첨가하여 24시간 동안 자극시켰으며, NF-κB, p-IκB 단백질 발현양 확인을 위해서는 세포를 1×106 cells/well만큼 100 mm dish에 접종하고 24시간 동안 배양 한 후, DMEM 배지로 희석한 HKE를 2,000 μg/mL 로 1 시간 동안 처리한 후, 1 μg/mL의 LPS를 첨가하여 1시간 동안 자극시켰다. 배지를 제거하고 phosphate buffered saline(PBS)로 2회 세척하고, I-NOS, COX-2의 단백질의 발현양 확인의 경우는 RIPA buffer로 추출한 후, 원심 분리 과정을 거쳐 pellet을 제거하였으며, NF-κB, p-IκB의 단백질 발현양 확인의 경우는 nuclear and cytoplasmic extraction reagents를 활용하여 세포의 핵과 단백질을 분리하였다. 그 이후, Brad-ford 분석법으로 단백질을 정량하고, BSA 대비 10 μg/mL의 단백질을 10% SDS-PAGE에서 전기영동하여 분리하였다. 분리된 단백질은 PVDF membrane에 옮긴 다음 실온에서 membrane을 5% skim milk(sol. TBST)로 2시간 동안 blocking한 다음 10분마다 tris buffered saline with tween 20(TBST)로 3회 세척하였다. 1차 항체는 1:1,000으로 희석하여 실온에서 2시간 동안 incubation 시켰다. 그 후, TBST로 10분간 3회 세척 한 후 membrane을 horseradish peroxidase(HRP)가 포함된 각각의 2차 항체를 1:1,000으로 희석하여 1시간 동안 반응시켰다. 10분마다 TBST로 3회 세척하였다. Davinch WesternTM imaging system(Seoul, Korea)을 이용하여 protein 발현량을 측정 하였다.
100 mm dish에 1×106 cells/well만큼 접종을 하고 24시간 동안 배양한 후 DMEM 배지로 희석한 시료(HKW, HKE, HKA)를 1시간 동안 37℃, 5% CO2 incubator에서 배양 한 후, 1 μg/mL의 LPS를 첨가하여 24시간 자극시켰다. 상등액을 제거한 후 Trizol lysis buffer를 각각의 dish 에 1 mL씩 분주하여 세포를 lysis한 후 상온에서 5분 동안 방치하였다. Trizol buffer를 lysate에 1 mL 당 chloroform 0.2-0.5 mL를 첨가하여 약 15초 동안 강하게 vortexing 해주고 다시 상온에서 5분간 방치하였다. 원심분리기를 이용하여 4℃에서 12,000-15,000 rpm으로 15분간 실시하고 상등액 0.4 mL를 새 tube로 옮겨서 isopropyl alcohol 400 μL와 1:1로 조심스럽게 섞어준 뒤 상온에서 5-10분간 두었다. 앞의 과정과 동일하게 원심분리를 하고 tube의 바닥에 있는 RNA pellet을 확인한 후 상층액을 제거하였다. 70% ethanol로 RNA pellet을 washing 해주고 남은 ethanol을 날린 후 RNase free water에 RNA pellet을 녹여주었다. cDNA로의 역전사와 증폭은 TOPscriptTM RT DryMIX(Enzynomics, Daejeon, Korea)를 이용하여 시행하였다.
SYBR Green PCR Master Mix(Applied Biosystems, Foster City, CA, USA)를 사용하여 cDNA와 TOPrealTM qPCR 2X PreMIX(Enzynomics), primer(Table 1)를 넣고 ABI step one plus(Applied biosystem, Foster City, CA, USA) 기기를 이용하여 실시간 정량 분석을 하고 StepOne Software(Applied Biosystems)를 사용하여 95℃에서 2분간 denature시킨 후 95℃에서 10초, 60℃에서 15초, 72℃에서 20초간 반응하는 온도순환조건을 40회 반복한 결과를 분석하였다.
결과 및 고찰
Hydroxyl기를 갖는 phenol성 화합물은 단백질 및 고분자들과 결합하여 전자 환원에 의하여 항산화, 항암, 항염증 등을 다양한 생리활성을 나타내는 것으로 알려져 있으며 특히 식물함유 폴리페놀은 그 효능이 높은 것으로 알려져 있다. 또한, 효소활성뿐만 아니라, 세포 내 효소 단백질 발현량을 조절하여 생리활성 반응을 조절한다(23-25). Tannic acid를 표준물질로 하여 표준곡선을 작성한 후, Fig. 1과 같이 추출 공정을 통하여 동결 건조된 용매 추출별 토종다래의 폴리페놀 함량을 측정하여 Table 2와 같이 나타내었다. HKW는 15.54 mg/g, HKE는 14.41 mg/g, HKA는 16.82 mg/g으로 HKA > HKW > HKE 순으로 폴리페놀 함량이 높은 것으로 나타났다.
| Solvent type of extract | Polyphenol contents (mg TAE/g)1) |
|---|---|
| Water extract | 15.54±0.292)3) |
| 70% Ethanol extract | 14.41±0.26 |
| 70% Acetone extract | 16.82±0.27 |
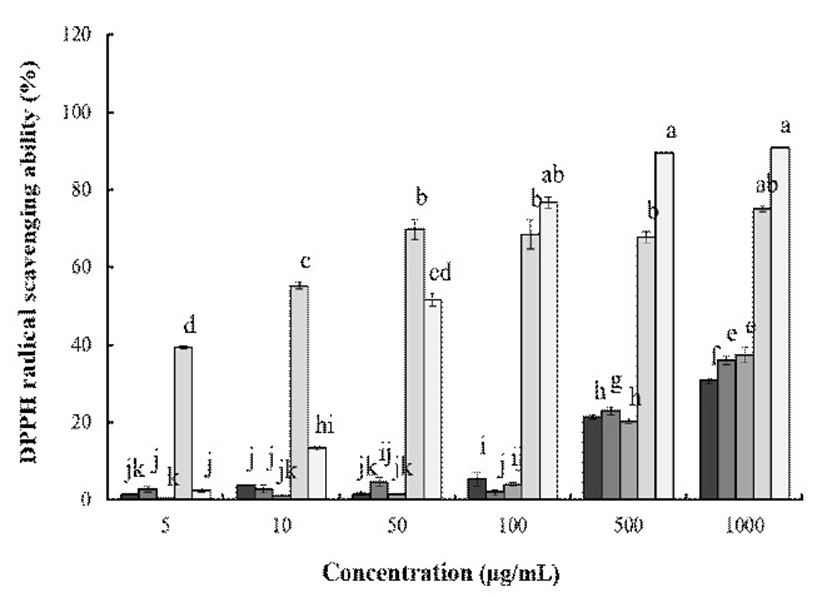
1,1-Diphenyl-2-picrylhydrazyl(DPPH)는 보라색을 띄며 비교적 안정한 자유라디칼을 갖는 화합물로서 517 nm 파장대에서 특징적인 광흡수를 나타낸다. 또한, polyphenol과 같은 hydroxyl기를 갖는 고분자 화합물 등에 의해 환원되어 탈색되므로 여러 소재에서 항산화물질을 확인하는데 많이 사용되고 있다(26). 토종다래의 전자공여능은 Fig. 3와 같이 나타내었다. 최고 농도인 1,000 μg/mL에서 HKW의 경우 30.5%로 나타났고 HKE는 36.1%, HKA는 37.4%의 저해율로 추출물간 큰 차이는 없는 것으로 확인할 수 있었다. 대조군인 EGCG와 BHA는 1,000 μg/mL에서 각각 75.1% 90.9%의 전자공여능을 보였다.
ABTS+는 cation radical을 갖는 화합물로서 화합물 내 radical의 소거를 통한 색변화로 항산화 활성을 측정할 수 있는 실험방법이다. 실험 전 potassium persulfate와 ABTS를 미리 하루 정도 반응하여 청록색의 라디칼을 유도시킨다.
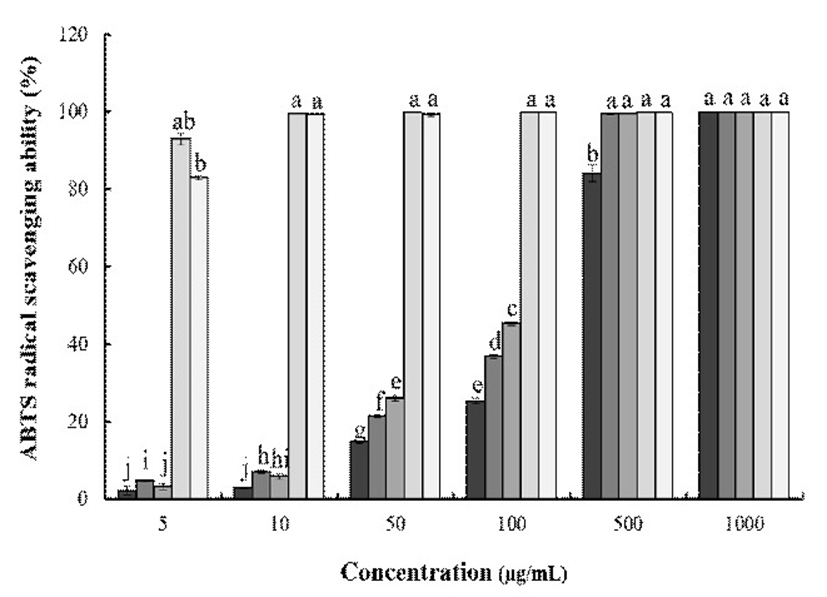
ABTS+은 환원되면 청록색에서 하늘색으로 변하며 hydrogen donating antioxidant와 chain breaking antioxidant 모두를 측정할 수 있는 특징을 갖는다. 토종다래의 ABTS+ radical scavenging activity는 Fig. 4에 나타내었다. 최고 농도인 1,000 μg/mL에서 HKW의 경우 99.9%로 나타났고 HKE는 99.8%, HKA는 99.8%의 저해율을 보여주었다. 이는 1,000 μg/mL의 EGCG와 BHA의 99.83%, 99.8% 저해율와 유사한 수준의 측정치로 용매별 토종다래 추출물의 높은 ABTS+ 라디칼 소거능력을 확인할 수 있었다.
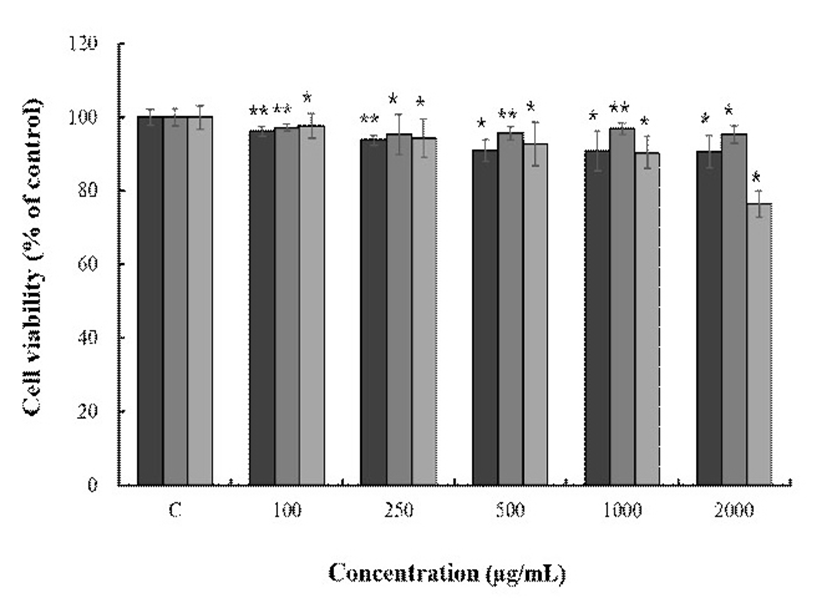
토종다래 추출물에 의한 macrophage cell의 세포 생존율을 MTT assay를 통해 확인한 결과를 Fig. 5에 나타내었다. 추출 용매별, 농도별로 측정한 결과 HKW와 HWE는 농도 2,000 μg/mL까지 90% 이상의 생존율을 보였고 HKA는 1,000 μg/mL까지 90% 이상의 생존율을 보였으며, 이후 진행한 실험인 nitric oxide 측정 및 western blot, real-time PCR은 세포생존율 구간을 참고하여 실험을 진행하였다.
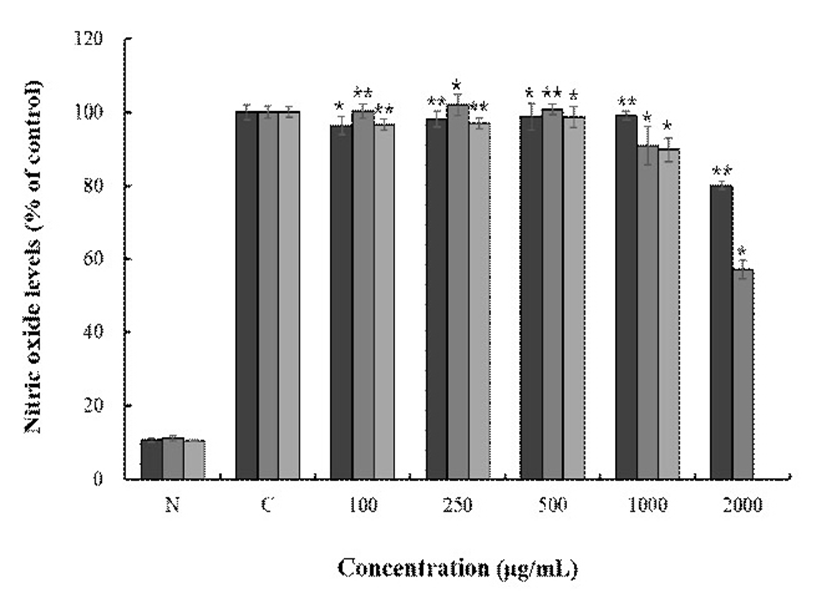
Macrophage cell인 RAW 264.7에서 토종다래의 nitric oxide(NO)의 억제 정도를 측정하기 위해 용매별, 농도별로 샘플을 처리하여 NO의 저해활성율을 측정한 결과 Fig. 6와 같이 나타내었다. 모든 용매에서 농도 의존적으로 감소하는 결과를 보였고 HKW, HKE는 각 추출용매별 최고농도인 2,000 μg/mL에서 20.0%, 42.8%의 저해효과를 보였으며 HKA는 최고농도인 1,000 μg/mL에서 10.1%로 HKE > HKW > HKA 순으로 NO의 저해활성을 보였다.
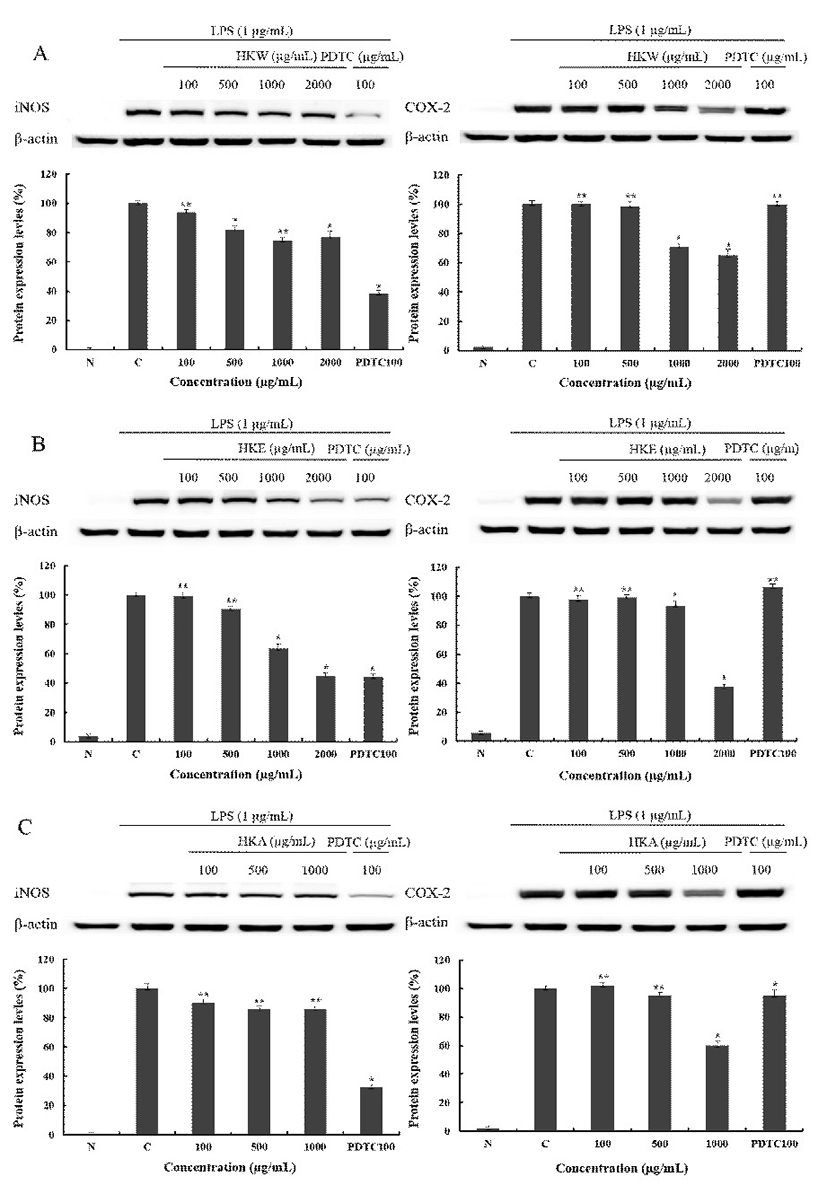
토종다래 추출물에 의한 RAW 264.7 대식세포에서 염증 저해 기전을 보기 위해 i-NOS의 단백질 발현 및 COX-2의 발현을 측정한 결과 Fig. 7과 같이 나타내었다. HKW는 2,000 μg/mL에서 i-NOS 발현 억제율이 23.6%로 측정되었고, COX-2의 발현 억제율은 43.7%로 측정되었다. HKE는 2,000 μg/mL에서 i-NOS 발현 억제율이 55.1%로 측정되었고, COX-2의 발현 억제율은 62.7%로 측정되었다. HKA는 1,000 μg/mL에서 i-NOS 발현 억제율이 24.1%로 측정되었고, COX-2의 발현 억제율은 51.8%로 측정되었다. 따라서 HKE > HKA > HKW 순으로 단백질 발현 억제율이 높게 나타났으며, 추출물 간에 비교적 큰 차이가 나타난 것으로 사료된다. 또한 HKE는 대조군인 ammonium pyrrolidinedithiocarbamate(PDTC)에 비교하여도 높은 효능을 보였으므로, 토종다래의 세포 내 NF-κB 관련 단백질 및 염증성 사이토카인 mRNA 발현량 측정을 위해 HKE로 처리하여 측정하였다.
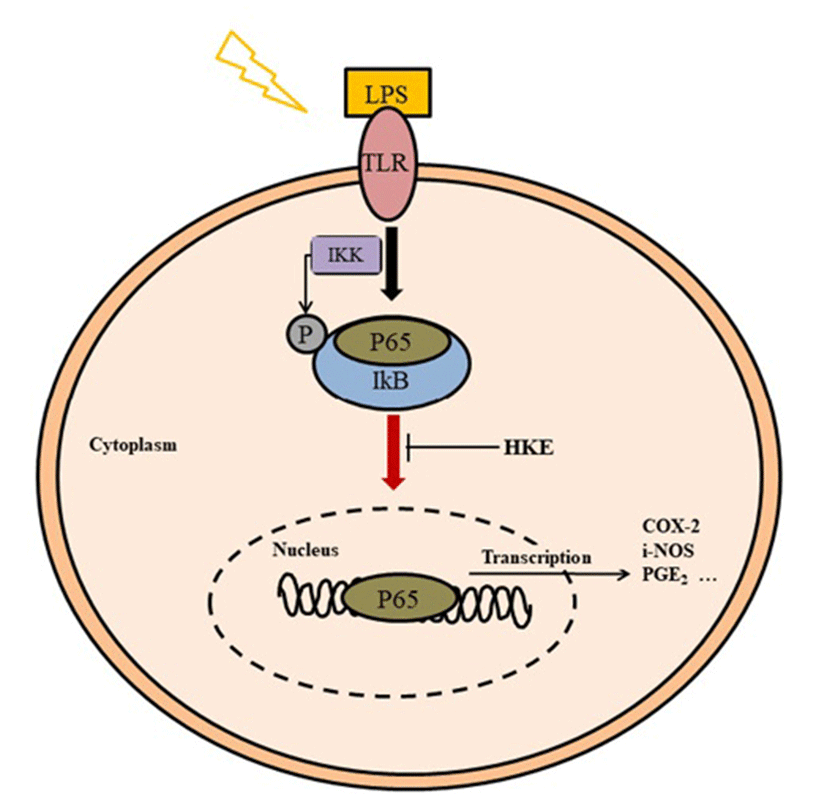
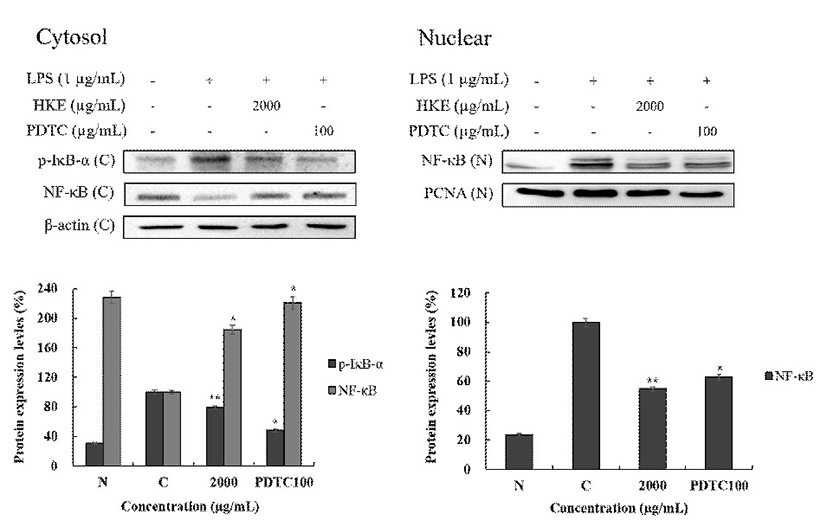
생체 내 대식세포는 Fig. 2와 같이 활성화될 때 LPS에 의한 세포막의 TLR4 수용체의 활성에 의한 IκB의 인산화로 전사인자인 NF-κB가 세포의 핵으로 유도되어 i-NOS, COX-2 등의 염증인자들을 생성하는 것으로 알려져 있다. HKE의 NF-κB 경로의 확인을 위해서 세포를 nuclear와 cytosol로 분리하여 NF-κB관련 단백질 발현을 Fig. 8과 같이 나타내었다. HKE(2,000 μg/mL)는 cytosol에서 NF-κB의 양은 84.6% 증가 및 p-IκB의 발현양은 20.6% 억제되었으며, nuclear에서 NF-κB의 양은 45.4% 감소되었다. PDTC(100 μg/mL)의 경우는 cytosol에서 NF-κB의 양은 121.0% 증가 및 p-IκB의 발현양은 51.8% 억제되었으며, nuclear에서 NF-κB의 양은 37.4% 감소되었다. 따라서 HKE는 NF-κB 전사인자가 IκB의 인산화 저해에 의하여 핵으로 유도되는 과정을 억제하였음을 확인할 수 있었다.
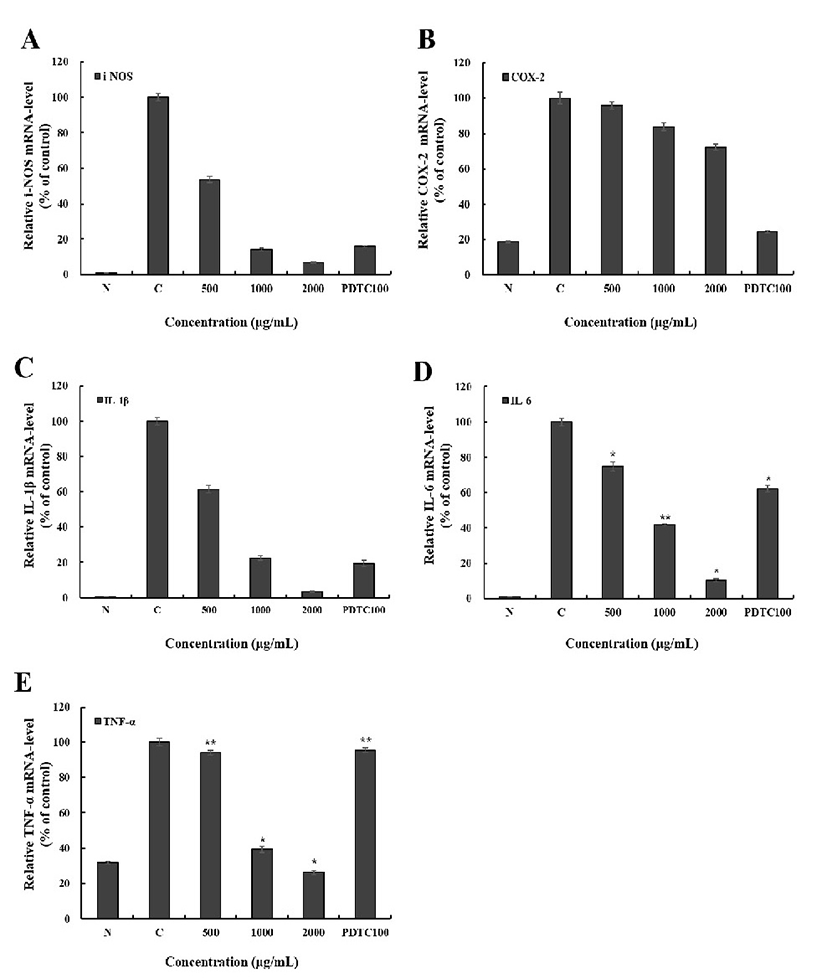
RAW 264.7에서 HKE에 의한 i-NOS, COX-2, 및 IL-1β, IL-6, TNF-α의 mRNA 발현을 측정한 결과 Fig. 9와 같이 나타내었다. HKE는 i-NOS와 COX-2 mRNA 발현을 100 μg/mL에서는 각각 약 93.2%, 27.9%의 억제를 하였으며, 대조군인 PDTC는 100 μg/mL에서 i-NOS, COX-2 mRNA 발현을 각각 84.1%, 75.5% 억제하였다. HKE는 PDTC 보다 COX-2 억제 효과는 약간 낮으나 i-NOS 억제 효과가 거의 근접함을 확인할 수 있었다. 또한 HKE는 염증관련 cytokine으로 IL-1β, IL-6 그리고 TNF-α mRNA 발현을 100 μg/mL에서 각각 96.4%, 89.4%, 73.9%의 억제하였으며, 대조군인 PDTC는 100 μg/mL에서 IL-1β, IL-6 그리고 TNF-α mRNA 발현을 각각 80.6%, 38.0%, 4.6%을 억제하였다. HKE는 PDTC와 비교할 때 IL-1β, IL-6, TNF-α의 mRNA 발현 모두 높은 억제율을 보여 HKE의 우수한 저해효과를 확인할 수 있었다.
최근 나고야 의정서로 인하여 자생 동식물 종의 연구가 필요한 실정이다. 토종다래는 식품소재로서의 역할 뿐만 아니라, 약품, 기능성화장품 등에서의 활용 가능성을 가지고 있다. 토종다래 추출물은 전자공여능, ABTS+ radical scavenging 활성 등의 항산화에 효능이 있는 것으로 나타났으며, nitric oxide 저해활성, i-NOS 및 COX-2 발현 및 pro-inflammatory cytokine 류인 TNF-α, IL-1β, IL-6 그리고 NF-κB pathway의 억제 등 항염증 소재로서도 효능을 나타내었다.
이러한 결과를 종합해 볼 때, 토종다래는 항산화, 항염증 뿐만 아니라 다른 다양한 분야에서도 연구해볼 만한 가치와 가능성을 가진다고 사료된다.
요 약
본 연구의 목적은 토종다래의 용매별 추출물에 따른 약리활성에 대한 검증 및 효능 평가로서 토종다래의 항산화, 항염증에 대한 효과를 확인하였다. 염증 반응은 자극이 가해지면 histamine, serotonin, prostaglandin과 같은 혈관 활성물질에 의해 혈관 투과성이 증대되어 염증을 유발하고 cytokine, free radical, lysosomal enzyme 등 다양한 매개 인자가 관여한다. 자극에 의한 macrophage cell의 염증반응은 tumor necrosis factor-α(TNF-α), interleukin-6(IL-6), interleukin-1β(IL-1β)와 같은 pro-inflammatory cytokine의 발현이 유도되고, inducible nitric oxide synthase(i-NOS)와 cyclooxygenase-2 (COX-2)에 영향을 받는 유전자의 발현을 자극하게 되어 nitric oxide(NO) 등의 염증 인자가 생성된다. 이에 따라 토종다래 추출물의 항염증에 대한 연구를 위해 이에 영향을 주는 인자인 i-NOS, COX-2의 단백질 발현억제 작용을 확인 하였다. 그 결과, HKE > HKA > HKW 순서로 높은 효능을 확인 할 수 있었다. 가장 효과가 좋은 HKE 처리군에서 다양한 염증성 인자의 mRNA 발현량을 확인하였다. 측정 결과, HKE(2,000 μg/mL)는 i–NOS, COX-2, IL-1β, IL-6, TNF-α mRNA 발현이 각각 93.2%, 27.9%, 96.4%, 89.4%, 73.9% 억제되는 효과를 확인할 수 있었다. 또한, HKE의 nuclear factor kappa B(NF-κB) 단백질 발현에 농도의존적으로 유의미한 결과를 확인하였으며, 이에 토종다래의 항염증효과는 LPS에 의한 TLR4의 자극에서 NF-κB 경로의 완화로 나타는 것임을 검증하였다.
결론적으로 토종다래는 70% ethanol 추출물(HKE)의 항염증 효과가 가장 높았으며, HKE는 대식세포에서 NF-κB 염증관련 경로의 억제로 세포 내 mRNA 및 단백질 수준에서의 염증인자들의 생성을 저해하여 항염증 효과가 명백히 확인되었다.
향후 본 연구팀은 토종다래의 항염증과 관련된 유효성분의 분리정제 및 구조분석을 진행할 예정이다.
