서 론
평균 수명이 길어지고 고령화 사회에 접어들면서 인간은 건강에 대한 관심이 높아지고 있으며, 이에 따라 “well-bing”이라는 트렌드가 부각되어 많은 관심이 집중되고 있다. 그러나 바쁜 일상생활로 인해 스트레스, 식생활의 서구화, 외식의 증가 및 환경오염 등과 같은 건강에 악영향을 줄 수 있는 위해 요소로 인해 다양한 질환이 발생하게 된다(1,2). 이러한 인체의 노화 및 여러 질환의 발생은 많은 연구를 통해 프리라디칼인 활성산소종(reactive oxygen species, ROS)과 깊은 관계가 있음이 밝혀지고 있다(3). 활성산소종은 쌍을 이루지 못한 전자에 의해 높은 반응성을 가지는 산소 원자나 분자를 말하며, 세포생체막의 인지질 중 불포화지방산을 공격하여 과산화지질을 생성하고 축적함으로서 세포 손상을 일으켜 염증을 유발하여 면역을 저하시키거나 DNA를 손상시켜 암을 유발하기도 한다(4,5). 인체 내에서 일어나는 산화 반응은 노화, 염증 및 암 등을 유발하므로 이러한 활성산소를 소거하기 위한 항산화성 물질에 대한 연구가 활발히 진행되고 있으며, 최근 안전성 문제로 천연식품 유래 항산화물질을 찾고자 노력하고 있다(6,7).
산수유나무(Cornus officinalis)는 층층나무과에 속하는 낙엽활목이며 오래전부터 가을에 성숙한 산수유나무의 붉은 열매인 산수유(Corni fructus)를 따서 씨를 뽑아내고 햇볕에 말린 것을 한약재로 많이 사용하고 있다(8,9). 독특한 향과 강한 신맛 및 약간의 단맛을 내고 성질이 따뜻하여 간과 신장의 기운을 북돋아주고 항암효과, 항균효과, 이뇨작용 및 혈압강하작용 등이 있으며, 단백질의 소화를 돕는 작용 등이 있다고 한방자료에 기록되어 있다(10). 산수유의 성분으로는 malic acid, tartaric acid, gallic acid, ursolic acid 등 유기산과 morroniside, loganin, sweroside, methylmorroniside 등 iridoid 배당체(11) 및 tellimagrandin 1, tellinagrandin 2, isoterchebin(Cornus-tannin 1), gemin D, Cornusiin A, B, C와 1,7-di-O-galloyl-D-sedoheptullose, Cornusiin D, E, F와 같은 tannin류(12)가 있다. 산수유에 대한 연구로는 항산화 활성(13,14), 항균작용(10), 항암효과(15)와 유용성분에 대한 연구(16)가 있으나, 산수유의 강한 신맛으로 인해 이를 활용한 식품 산업적 활용은 제한적이다.
증숙 공정은 증기를 이용해 구성성분을 변화시켜 새로운 화합물을 만들어내고, 유용성분의 용출을 극대화하는 장점을 가지고 있다. 일반적으로 열처리 공정은 식물의 조직성분을 연소시키며 활성성분을 파괴하여 수율 및 생리활성을 감소시키는 단점이 있다. 이러한 단점을 보완하기 위해 직접적 열처리가 아닌 간접적 열처리인 증기를 이용하여 유용성분의 용출을 증진시킬 수 있는 증숙 공정이 이용되고 있다(17,18). 증숙 관련 연구로는 도라지(19), 인삼(20) 및 마(21) 등에 적용하여 원료의 쓴맛 성분을 제거하거나 감소시켜 기호성을 향상시키고, 유용성분의 변화를 유도하여 기능성 향상 및 제품개발을 위한 품질특성 개선 등 다양한 분야에 적용되고 있다.
따라서 본 연구에서는 산수유의 유용성분의 용출을 향상시키고 산수유의 강한 신맛을 감소시키기 위해 증숙 공정을 전처리로 적용하였으며, 추출용매에 따른 산수유 추출물의 항산화, 면역활성 및 항암 효과를 비교 분석하여, 기능성 식품소재로의 활용 증대 가능성을 조사하였다.
재료 및 방법
산수유 추출물을 제조하기 위한 전처리 공정으로 건산수유를 상온에서 증류수에 3시간 수침하여 불린 후, 가정용 찜솥에서 100℃, 1시간 증숙한 다음 열풍건조기(OF-22, Jeiotech, Seoul, Korea)로 50℃, 6시간 건조하였다. 무처리(건산수유) 및 증숙 산수유를 건식분쇄기(NSG-1002SS, Hanil, Sejong, Korea)로 각각 분쇄한 다음 표준망체(60 mesh, Chung Gye Sang Cong Sa, Seoul, Korea)에 통과한 분말 30 g에 증류수, 50% 에탄올 및 50% 메탄올을 고형분 대비 10배 첨가하였다. 증류수 첨가구는 100℃, 50% 에탄올 및 50% 메탄올 첨가구는 70℃에서 5시간 동안 환류냉각추출기(CA-1112, Eyela Co., Tokyo, Japan)를 사용하여 추출하였고 각각의 추출물은 불순물을 제거하기 위해 여과지(No.2, Whatman International Ltd., Leicestershire, England)를 이용하여 여과하였다. 여과된 시료는 감압농축기(Model N-1N, Eyela Co., Tokyo, Japan)로 농축한 다음, 동결건조기(Free Zone 2.5, Labconco Co., Kansas, MO, USA)를 사용하여 건조한 뒤 -70℃ 이하의 암소에서 보관하면서 실험에 사용하였다.
산수유 추출물의 수율은 동결건조(Free Zone 2.5, Labconco Co.)한 다음 건물 중량을 구하였고 시료 조제에 사용한 원료 건물량에 대한 백분율로 나타내었다.
총 폴리페놀 함량은 Folin-Denis법(22)에 따라 시료 1 mL에 1 N Folin Ciocalteu reagent 1 mL를 첨가하고 충분히 혼합한 다음 20% Na2CO3 1 mL를 첨가하여 실온의 암소에서 30분간 반응시킨 후 분광광도계(Ultrospec 2100pro, Biochrom Ltd., Cambridge, UK)를 이용하여 725 nm에서 흡광도를 측정하였다. 총 폴리페놀 함량은 tannic acid (Sigma-Aldrich Co.)를 사용하여 작성한 표준곡선으로부터 계산하였다.
총 플라보노이드 함량은 Jia 등(23)의 방법을 응용하여 측정하였다. 시료 1 mL에 5% NaNO2 0.15 mL를 혼합하여 실온에서 6분간 반응 시킨 후 10% AlCl3 0.3 mL와 혼합하여 다시 실온에서 5분간 반응 시키고 1 N NaOH 1 mL와 혼합한 다음 분광광도계(Ultrospec 2100pro, Biochrom Ltd.)를 이용하여 510 nm에서 흡광도를 측정하였다. 총 플라보노이드함량은 rutin(Sigma-Aldrich Co.)을 사용하여 작성한 표준곡선으로부터 계산하였다.
총 당 함량은 phenol-sulfuric acid 방법(24)을 응용하여 측정하였다. 시료 1 mL와 5% phenol 1 mL 및 진한 H2SO4 5 mL를 혼합하여 20분간 반응 시킨 후, 분광광도계(Ultrospec 2100pro, Biochrom Ltd.)를 이용하여 470 nm에서 흡광도를 측정하였다. 총 당 함량은 glucose(Sigma-Aldrich Co.)을 사용하여 작성한 표준곡선으로부터 계산하였다.
유기산 함량은 high performance liquid chromatography (HPLC)를 이용하여 분석하였으며, 시료는 증류수에 희석하여 10 mg/mL 농도로 제조한 다음 0.45 μm membrane filter(Waters Co., Milford, MA, USA)로 여과하여 분석용 시료로 사용하였다. Alliance HPLC system 2695 (Waters Co.)를 이용하여 photodiode array detector 2996 (Waters Co.)로 분석하였다. 분석용 컬럼은 Shodex SUGAR SH-1011(partivle size 6 μm, 8.0×300 mm, Showa Denko Co., Tokyo, Japan)를 사용하였으며, 분석용 용매는 20 mM H2SO4를 사용하였다. 분석용 컬럼 온도는 60℃, 유속은 0.6 mL/min으로 설정하였으며, 시료를 10 μL 주입하고 detector 파장 210 nm에서 측정하였다. 유기산 함량은 표준물질을 이용하여 작성한 표준곡선으로 정량하였으며, 표준물질은 Sigma-Aldrich Co.로부터 구입하여 사용하였다.
DPPH radical 소거활성은 1,1-diphenyl-2-pycrylhydrazyl (DPPH)의 환원력을 이용하여 측정하였다(2). 즉, DPPH reagent는 DPPH 12 mg을 absolute ethanol 100 mL에 용해한 후 증류수 100 mL 첨가하여 흡광도를 517 nm에서 약 1.5로 조정하여 제조하였다. 시료 0.5 mL에 DPPH reagent 5 mL를 혼합하여 실온에서 15분간 반응시킨 후 분광광도계(Ultrospec 2100pro, Biochrom Ltd.)로 흡광도를 측정하고 아래와 같이 계산하였다.
2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)(ABTS) radical 소거활성(25)은 7.4 mM ABTS(Sigma-Aldrich Co.)와 2.45 mM potassium persulfate를 최종 농도로 혼합하여 실온인 암소에서 24시간 동안 방치하여 ABTS+을 형성시킨 후 732 nm에서 흡광도 값이 0.70±0.02가 되게 phosphate buffer saline(PBS, pH 7.4)으로 희석하였다. 희석된 용액 180 μL에 시료 20 μL를 혼합하여 정확히 10분간 반응시킨 다음 분광광도계(Ultraspec 2100pro, Biochrom Ltd.)를 이용하여 732 nm에서 흡광도를 측정하였다. ABTS radical 소거활성은 추출물의 첨가 전과 후의 차이를 아래와 같이 백분율로 나타내었다.
FRAP는 Benzie와 Strain의 방법(26)에 따라 다음과 같이 측정하였다. FRAP reagent는 25 mL acetate buffer(300 mM, pH 3.6)를 37℃에서 가온한 후, 40 mM HCl에 용해한 10 mM 2,4,6-tris(2-pyridyl)-s-triazine(TPTZ, Sigma-Aldrich Co.) 2.5 mL와 20 mM ferric chloride(FeCl3) 2.5 mL를 첨가하여 제조하였다. 시료 30 μL에 제조된 FRAP reagent 900 μL와 증류수 90 μL를 넣은 후 37℃에서 10분간 반응시킨 다음 분광광도계(Ultraspec 2100pro, Biochrom Ltd.)를 이용하여 510 nm에서 흡광도를 측정하였다. FRAP는 FeSO4·7H2O(Sigma-Aldrich Co.)을 정량하여 작성한 표준곡선으로부터 계산하였다.
실험에 사용한 인간 폐상피세포주(L-132), 마우스 대식 세포주(RAW264.7), 인간 자궁경부암 세포주(HeLa) 및 인간 유방암 세포주(MCF-7)는 한국세포주은행(KTCC, Seoul, Korea)에서 분양받았다. L-132 및 RAW264.7 세포주는 DMEM 배지(Welgene Co., Daegu, Korea)를 이용하였으며, HeLa 및 MCF-7 세포주는 RPMI 1640 배지(Welgene Co.)를 이용하여 10% fetal bovine serum(Gibco BRL Co., Grand Island, NY, USA) 및 2% penicillin-streptomycin(Gibco BRL Co.)을 첨가한 다음 37℃, 5% CO2 incubator(MCO-18 AIC, Sanyo Eletric Biomedical Co., Ltd., Osaka, Japan)에서 배양하였다.
세포 독성은 MTT assay를 이용하여 측정하였으며, 배양된 세포주를 1×104 cell/well의 농도로 조정하여 96-well plate에 100 μL씩 첨가하고 24시간 동안 배양한 후 새로운 배지 교환 및 시료를 농도별로 처리한 다음 24시간 동안 배양하였다. 배양 후 PBS 완충용액에 녹인 methyl thiazol-2-YL-2,5-diphenyl tetrazolium bromide(MTT 5 mg/mL, Sigma-Aldrich Co.) 용액을 각 well에 10 μL씩 첨가하고 4시간 동안 배양하여 MTT가 환원되도록 하였다. 이후 상등액을 모두 제거하고 dimethyl sulfoxide(DMSO, Jensei Chemical Co., Tokyo, Japan) 100 μL를 각 well에 첨가하여 10분간 반응시켜 formazan 결정을 용해한 다음 microplate reader(UVM-340, Asys Co., Biochrom, Cambridge, UK)를 이용하여 흡광도 파장 540 nm에서 측정하였다.
L-132 세포를 이용한 세포보호 효과는 Hwang(27)의 방법을 응용하여 측정하였다. 배양된 L-132 세포를 1×104 cell/well의 농도로 조정하여 96-well plate에 100 μL씩 첨가하여 24시간 동안 배양하고 이후 새로운 배지 교환 및 H2O2(Duksan pure chemicals Co., Ansan, Korea) 1.25 mM과 시료를 농도별로 처리한 다음 6시간 동안 배양하였다. 배양 후 PBS 완충용액에 녹인 methyl thiazol-2-YL-2,5-diphenyl tetrazolium bromide(MTT 5 mg/mL, Sigma-Aldrich Co.) 용액을 각 well에 10 μL씩 첨가하고 2시간 동안 배양하여 MTT가 환원되도록 하였다. 이후 상등액을 모두 제거하고 dimethyl sulfoxide(DMSO, Jensei Chemical Co.) 100 μL를 각 well에 첨가하여 10분간 반응시켜 formazan 결정을 용해한 다음 microplate reader(UVM-340, Asys Co.)를 이용하여 흡광도 파장 540 nm에서 측정하였다.
RAW264.7 세포를 5×104 cell/well의 농도로 조정하여 96-well plate에 각각 100 μL씩 첨가하여 24시간 동안 배양하고, 농도별 시료 및 lipopolysaccharide(LPS 0.1 μg/mL, Sigma-Aldrich Co.)를 처리하여 24시간 동안 배양하였다. 배양이 완료된 후 상등액 50 μL에 동량의 Griess 시약(Sigma-Aldrich Co.) 50 μL를 혼합하여 10분간 반응시키고 microplate reader(UVM-340, Asys Co.)를 이용하여 540 nm에서 흡광도를 측정하였으며, NO 생성량은 sodium nitrite(Sigma-Aldrich Co.)의 농도별 표준곡선을 이용하여 계산하였다.
암세포 생육 저해활성은 MTT assay를 이용하여 측정하였으며, 배양된 세포주를 2×104 cell/well의 농도로 조정하여 96-well plate에 100 μL씩 첨가하고 24시간 동안 배양하고 이후 새로운 배지 교환 및 시료를 농도별로 처리한 다음 24시간 동안 배양하였다. 배양 후 PBS 완충용액에 녹인 methyl thiazol-2-YL-2,5-diphenyl tetrazolium bromide(MTT 5 mg/mL, Sigma-Aldrich Co.) 용액을 각 well에 10 μL씩 첨가하고 4시간 동안 배양하여 MTT가 환원되도록 하였다. 이후 상등액을 모두 제거하고 dimethyl sulfoxide(DMSO, Jensei Chemical Co.) 100 μL를 각 well에 첨가하여 10분간 반응시켜 formazan 결정을 용해한 다음 microplate reader(UVM-340, Asys Co.)를 이용하여 흡광도 파장 540 nm에서 측정하였다.
결과 및 고찰
추출용매에 따른 무처리 및 증숙 산수유의 추출수율, 총 폴리페놀, 총 플라보노이드 및 총 당 함량은 Table 1과 같다. 추출수율은 무처리 산수유 열수추출물에서 47.45%로 높은 수율을 나타내었는데, 이는 산수유에 수용성 성분의 함량이 많은 것으로 나타났다. 또한 증숙 산수유보다 무처리 산수유의 수율이 더 높게 나타난 것은 증숙 공정을 통해 산수유의 고형물이 유출된 것으로 판단된다. 식물에 많이 분포되어 있는 페놀성 물질은 2차 대사산물로 phenolic hydroxyl기를 가지고 있다. 이로 인해 단백질 및 기타 분자들과 결합하는 성질을 지니고 있으며, 항산화 효과의 기능을 갖는다(28). 총 폴리페놀 함량은 증숙 산수유 50% 에탄올 추출물에서 12.23 g/100 g으로 가장 높은 함량을 나타내었고 무처리 산수유 추출물보다 높은 함량을 나타내었는데, 이는 Kim 등(29)이 보고한 산수유의 총 폴리페놀 함량(3.23 g/100 g)보다 약 2-4배 이상 높게 나타났다. 총 플라보노이드 함량은 총 폴리페놀 함량과 같이 증숙 산수유 50% 에탄올 추출물에서 5.08 g/100 g으로 가장 높은 함량을 나타내었으며, 무처리 산수유 추출물보다 높았다. 이와 같은 결과는 증숙 공정을 통해 총 페놀성 화합물의 함량이 증가하는 것으로 보고되는데, 이는 결합형 페놀성분이 열에 의해 유리형으로 바뀌어 용출되거나 고분자가 저분자로 분해되어 그 함량이 증가한 것으로 보고하였다(30). 총 당 함량은 증숙 산수유 열수추출물에서 71.32 g/100 g으로 가장 높은 함량을 나타내었으며, 모든 추출용매에서 증숙 전처리를 통해 총 당 함량이 증가하였다. 이러한 결과는 증숙 공정을 통해 다당체 성분이 가용화되어 나타난 결과로 판단된다(31).
1)UCH, hot-water extract of untreated Corni fructus; SCH, hot-water extract of steam-treated Corni fructus; UCE, 50% ethanol extract of untreated Corni fructus; SCE, 50% ethanol extract of steam-treated Corni fructus; UCM, 50% methanol extract of untreated Corni fructus; SCM, 50% methanol extract of steam-treated Corni fructus.
추출용매에 따른 무처리 및 증숙 산수유 추출물의 유기산 함량은 Table 2와 같다. 산수유의 유기산 성분으로 gallic acid, malic acid 및 tartaric acid(11)가 이미 알려져 있으며, 본 연구에서는 oxalic acid, citric acid, malic acid, formic acid 및 gallic acid가 검출되었다. 그 중에서 oxalic acid 및 citric acid는 각각 7.07-16.30 g/100 g 및 6.94-15.95 g/100 g으로 가장 높은 함량을 나타내었으며, 증숙 공정을 통해 citric acid, malic acid 및 formic acid는 감소하였으나, oxalic acid 및 gallic acid가 증가하였다. 이는 증숙 공정으로 인해 fructose가 분해되어 5-methyl furfural, HMF 및 furfural 등과 유기산으로 분해되어(32), 증숙 산수유의 일부 유기산 함량이 증가한 것으로 판단된다. 특히 gallic acid는 항암효과가 있는 것으로 알려져 있어 증숙 산수유의 항암활성이 무처리 산수유보다 우수할 것으로 판단된다. 또한 증숙 공정을 통해 전체적인 유기산 함량이 감소하여 식품소재 활용 면에서 제한되었던 산수유의 강한 신맛을 보완하였다.
1)UCH, hot-water extract of untreated Corni fructus; SCH, hot-water extract of steam-treated Corni fructus; UCE, 50% ethanol extract of untreated Corni fructus; SCE, 50% ethanol extract of steam-treated Corni fructus; UCM, 50% methanol extract of untreated Corni fructus; SCM, 50% methanol extract of steam-treated Corni fructus.
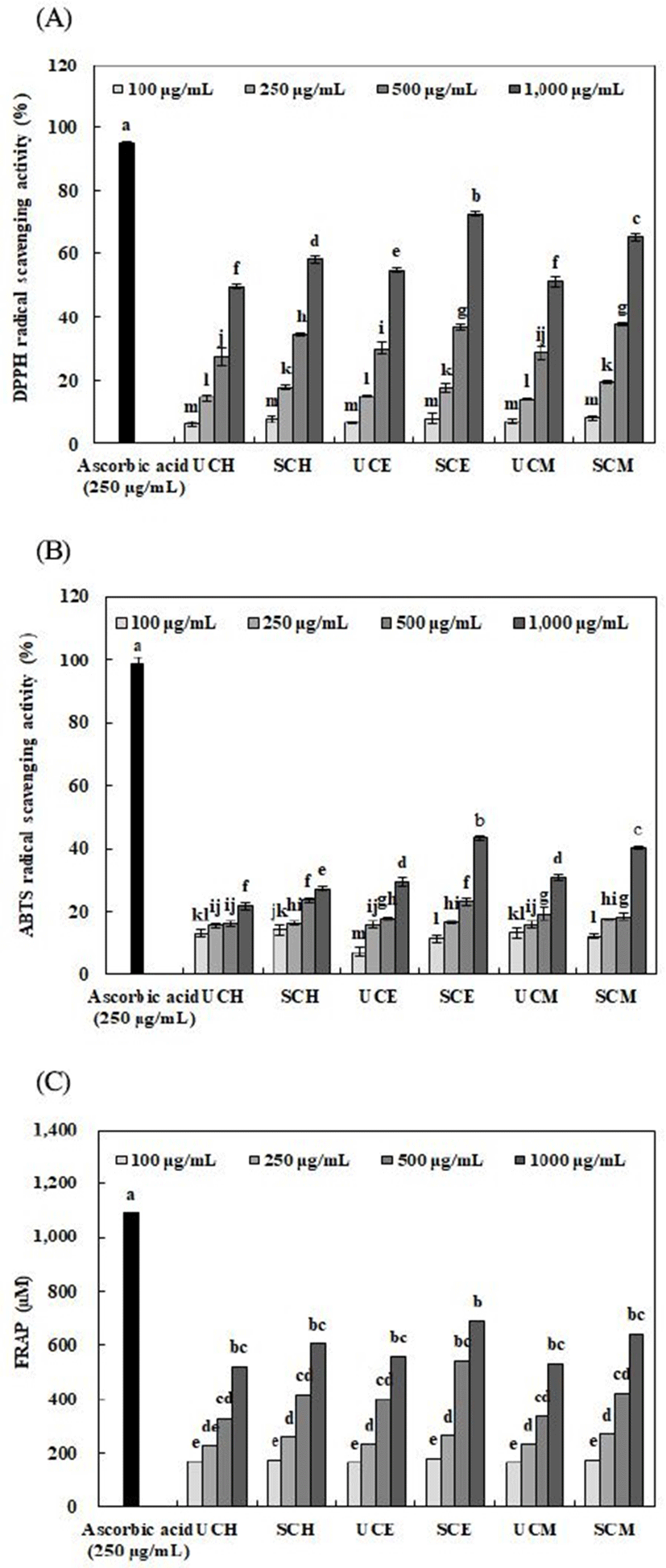
추출용매에 따른 무처리 및 증숙 산수유 추출물의 DPPH radical 소거활성, ABTS radical 소거활성 및 FRAP 활성은 Fig. 1과 같다. 약용열매의 항산화 물질 중 페놀화합물들은 우수한 항산화 효과를 가지는 것으로 보고되어 있으며, 이는 free radical의 안정화를 시킬 수 있는 phenol ring에 의한 것으로 보고되어져 있다(33). DPPH 및 ABTS radical 소거활성은 증숙 산수유 50% 에탄올 추출물(1,000 μg/mL)에서 각각 72.37% 및 43.15%로 높은 활성을 나타내었다. Radical 소거활성은 50% 에탄올, 50% 메탄올 및 열수 추출물 순으로 활성이 높게 나타났으며, 모든 추출용매에서 증숙 공정을 통해 활성이 증가하였음을 확인하였다. Choo 등(34)의 연구에서 오미자의 증숙 횟수에 비례하여 DPPH 및 ABTS radical 소거활성이 증가함을 보고하였고, Yang 등(35)의 연구에서는 인삼에 증숙 공정을 적용함으로써 페놀화합물의 함량이 변화하며 이에 따라 항산화 활성도 증가한다고 보고하여 본 연구결과와 유사한 경향을 나타내었다. 추출용매에 따른 무처리 및 증숙 산수유 추출물의 FRAP 활성은 증숙 산수유의 50% 에탄올 추출물(1,000 μg/mL)에서 689.49 μM으로 높은 활성을 나타내었다. 추출용매를 달리한 각 추출물은 증숙 공정을 통해 활성이 증가하였음을 확인하여 이러한 결과는 앞선 DPPH 및 ABTS radical 소거활성의 결과와 유사하였다. 이는 대표적인 항산화 성분인 페놀화합물이 증숙 공정에 의해 증가하여 항산화 활성이 높아진 것으로 사료된다(36).
추출용매에 따른 무처리 및 증숙 산수유 추출물의 인간 폐상피세포인 L-132 세포에 대한 세포 독성 및 세포보호효과는 Fig. 2와 같다. 추출용매에 따른 무처리 및 증숙 산수유 추출물은 100, 250, 500, 및 1,000 μg/mL로 처리하였으며, 모든 농도 구간에서 세포 생존율을 90% 이상으로 유지시켜 L-132 세포에 대한 독성이 낮음을 확인하였다.
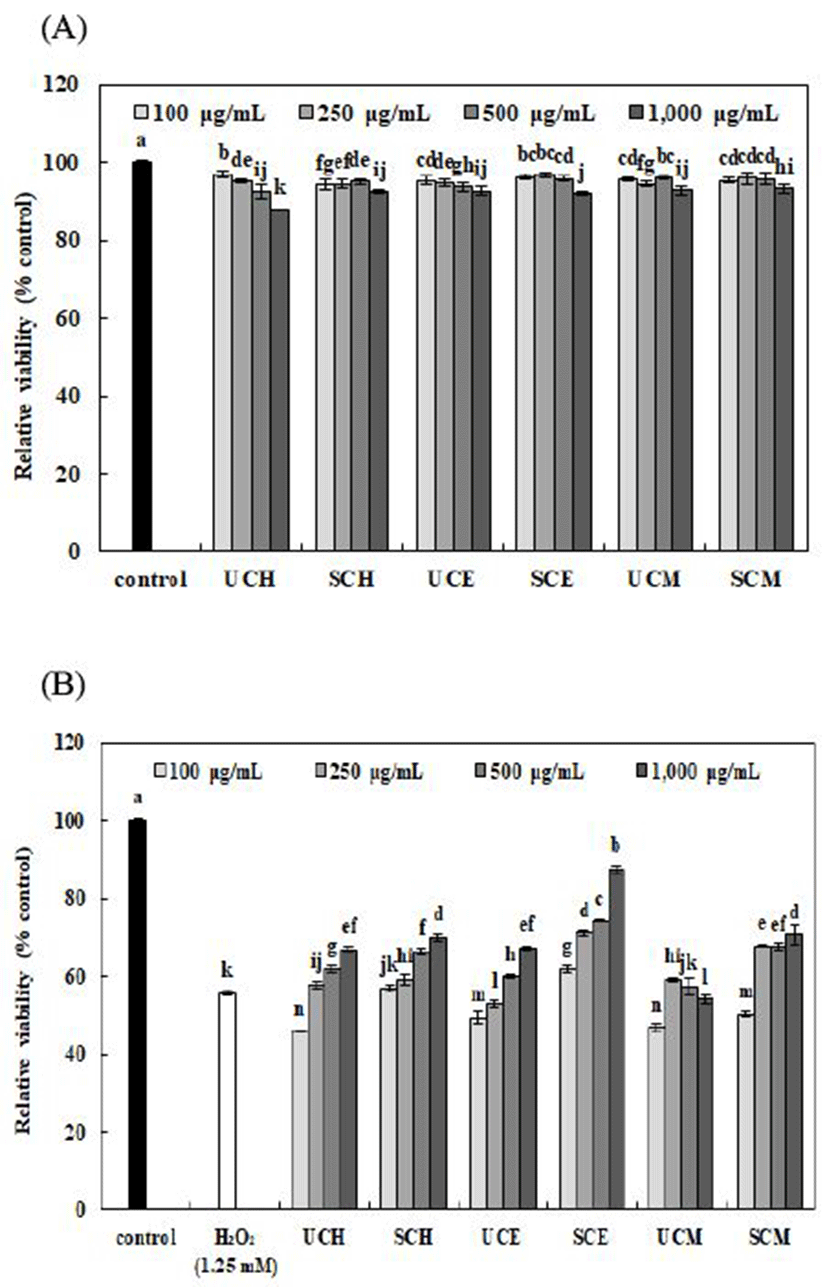
추출용매에 따른 무처리 및 증숙 산수유 추출물의 세포내 항산화 활성을 측정하기 위해 각 농도별 시료와 1.25 mM H2O2를 처리하여 산화적 스트레스(H2O2)에 대한 세포생존율의 차이를 평가한 결과는 대체로 모든 시료에서 농도가 증가함에 따라 세포생존율이 증가하는 경향을 보였으며, 추출용매에 관계없이 증숙 산수유 추출물의 세포생존율이 무처리 산수유 추출물보다 높게 나타났다. 특히 증숙 산수유의 50% 에탄올 추출물(100-1,000 μg/mL)에서 61.88-87.37%로 가장 높은 세포생존율을 나타내어, H2O2에 의해 유도된 L-132 세포보호 효과가 높은 것으로 확인하였다. 이는 앞선 항산화 활성 측정 결과와 세포내 항산화 활성 측정 결과와 유사하게 나타났음을 확인하였으며, 증숙 산수유의 50% 에탄올 추출물에는 H2O2에 의해 유도된 세포 손상으로부터 보호효과를 보이는 다양한 페놀화합물을 포함한 생리활성물질이 다량 함유되어 있을 것으로 판단된다(37).
추출용매에 따른 무처리 및 증숙 산수유 추출물의 대식세포인 RAW264.7 세포에 대한 세포 독성 및 nitric oxide 생성량은 Fig. 3과 같다. 추출용매에 따른 무처리 및 증숙 산수유 추출물은 100, 250, 500, 및 1,000 μg/mL로 처리하였으며, 모든 농도 구간에서 세포 생존율을 90% 이상으로 유지시켜 RAW264.7 세포에 대한 독성이 낮음을 확인하였다.
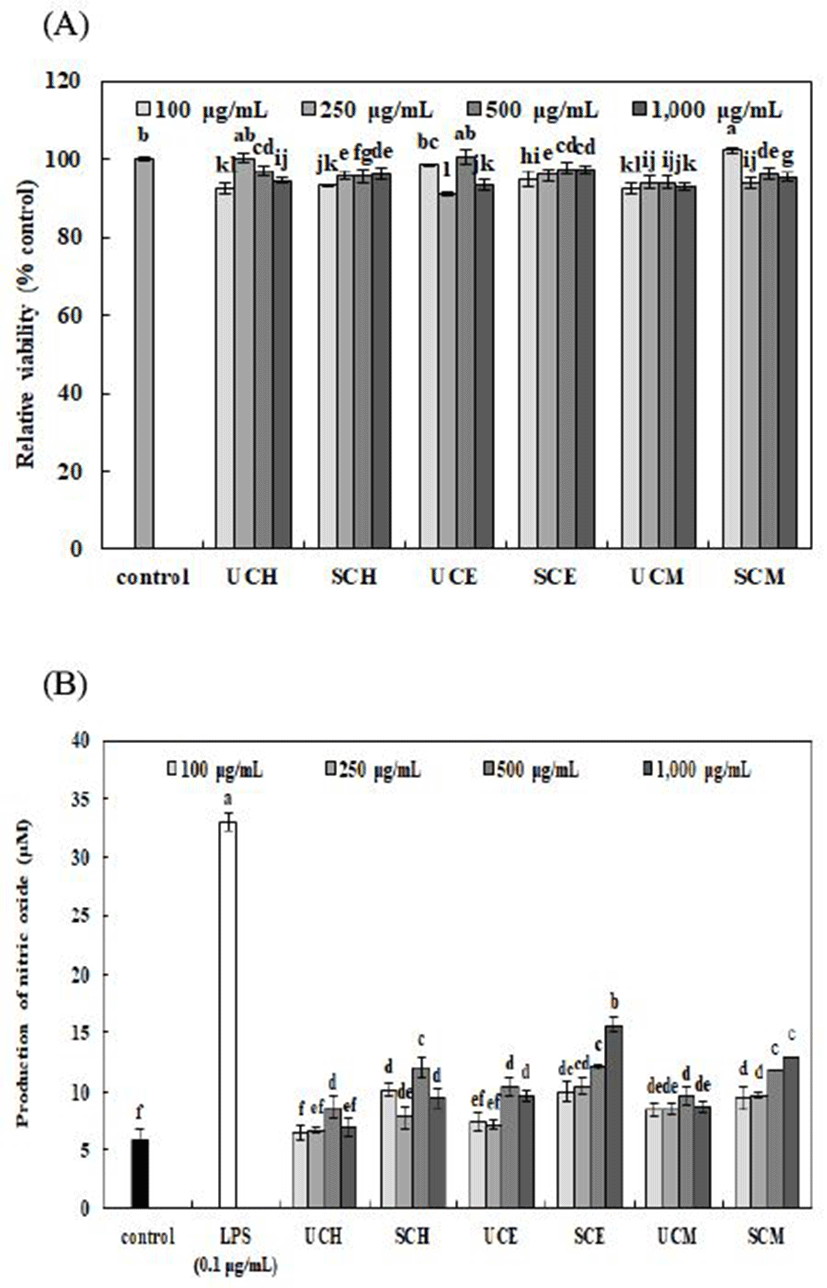
대식세포는 인체에 항원인 박테리아가 침입하였을 때 일차적인 면역반응을 담당하는 세포로서, 이러한 박테리아를 사멸시키기 위해 대식세포는 다양한 물질을 분비한다. 그중에서 nitric oxide(NO, 일산화질소)가 대표적인 물질로 알려져 있다(38). 추출용매에 따른 무처리 및 증숙 산수유 추출물의 면역활성을 확인하기 위해 lipopolysaccharide (LPS, 0.1 μg/mL)로 자극을 유도한 RAW264.7 세포를 이용하여 nitric oxide 생성에 미치는 영향을 분석한 결과, 대조군(control) 및 LPS 처리군이 각각 5.86 μM 및 33.05 μM로 나타났으며, 대조군(control)에 비해 무처리 및 증숙 산수유 추출물이 모든 농도에서 nitric oxide 생성량이 증가하였다. 모든 추출용매에서 증숙 산수유 추출물이 무처리 산수유 추출물에 비해 nitric oxide 함량이 증가하였으며, 그 중 증숙 산수유의 50% 에탄올 추출물(100-1,000 μg/mL)에서 10.02-15.70 μM로 가장 높은 nitric oxide 함량을 나타내었다. Lee 등(39)은 산수유 에탄올 추출물이 흉선 및 비장 림프구의 증식을 촉진시키며, 복강 대식세포의 탐식능 및 nitric oxide 생성을 유발하여 면역을 조절하는 작용이 있다고 보고하였다. 또한 nitric oxide의 비특이적 숙주방어기작 대식작용, 세균 및 암세포의 생육억제활성이 증명된 바가 있으며(40), 활성화된 대식세포에서 생산되는 암세포의 중요 숙주 방어물질로 인정된 TNF-α, IL-1β와 같은 cytokines은 nitric oxide의 중간물질 발생과 연관성이 높은 것으로 알려져 있어(41) nitric oxide 함량이 가장 높게 나타난 증숙 산수유의 50% 에탄올 추출물이 우수한 항암 활성을 나타낼 것으로 사료된다.
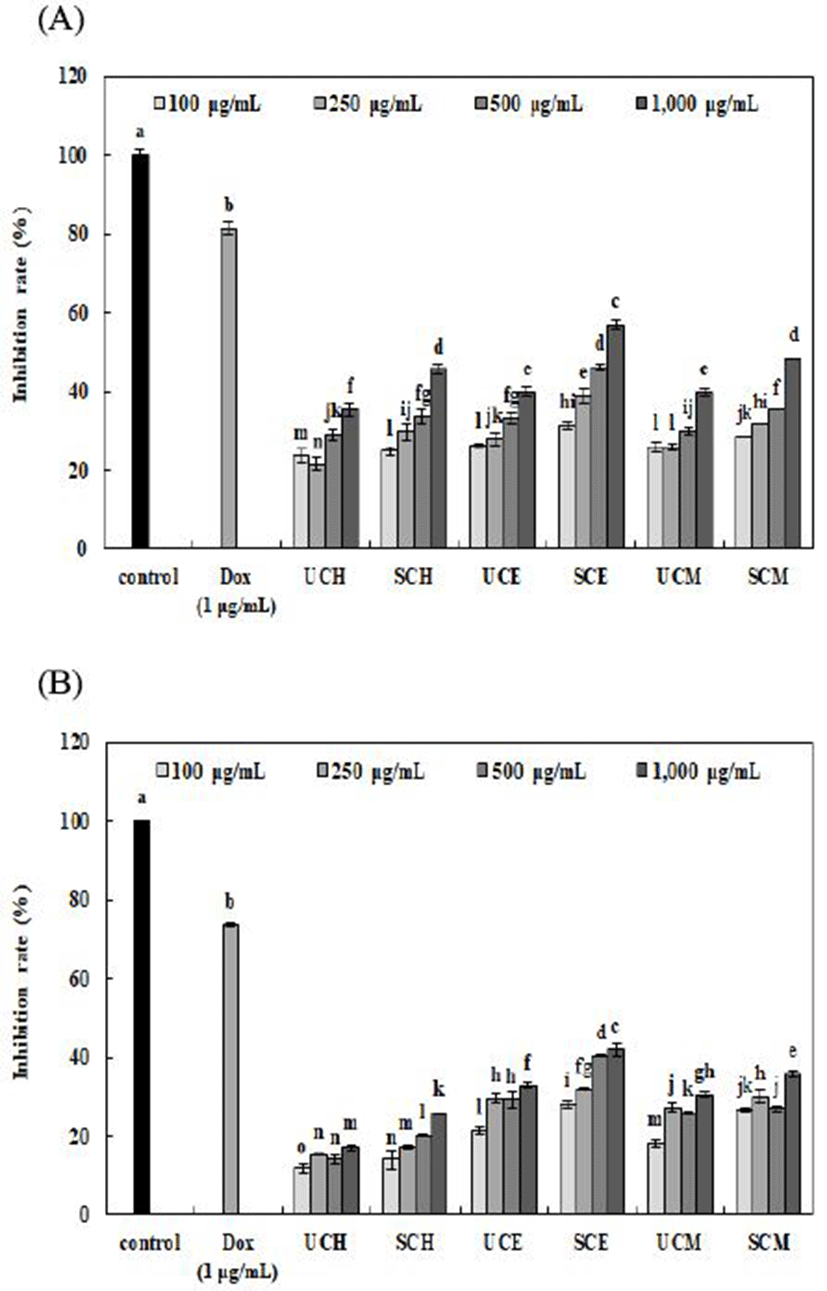
추출용매에 따른 무처리 및 증숙 산수유 추출물의 인간 자궁경부암 세포주인 HeLa 및 인간 유방암 세포주인 MCF-7에 대한 생육 저해활성 결과는 Fig. 4와 같다. HeLa 및 MCF-7 세포에 추출용매에 따른 무처리 및 증숙 산수유 추출물(100, 250, 500, 및 1,000 μg/mL)과 양성대조군으로 doxorubicin(1 μg/mL)을 처리하여 48시간 배양한 후 암세포 생육 저해활성을 측정하였다. 모든 시료에서 농도가 증가함에 따라 암세포 생육 저해활성이 증가하였으며, HeLa 및 MCF-7 세포 생육 저해활성은 증숙 산수유의 50% 에탄올 추출물(1,000 μg/mL)에서 각각 56.94% 및 41.94%로 암세포 생육 저해활성을 나타내었다. 이는 대식세포의 nitric oxide 함량과 유사한 경향을 나타내어 nitric oxide 생성량이 암세포 생육과 연관 있음을 확인하였다. Jeon 등(42)의 연구에서 산수유 에탄올 추출물이 자궁암 HeLa 세포의 증식을 농도 의존적으로 억제하였다고 보고하였으며, Kim 등(16)은 산수유 에탄올 추출물은 유방암 MCF-7 세포뿐만 아니라 폐암 A549 세포의 증식을 유의하게 억제시켜 암세포의 세포주기 변화 등 항암에 우수한 효과가 있다고 보고하였다.
요 약
본 연구에서는 증숙 공정을 전처리로 적용하여 추출용매에 따른 산수유 추출물의 항산화 및 생리활성을 비교 분석하였다. 추출용매에 따른 무처리 및 증숙 산수유 추출물의 추출수율은 13.20-47.45%로, 증숙 산수유보다 무처리 산수유의 추출수율이 높게 나타났다. 총 폴리페놀 및 총 플라보노이드 함량은 증숙 산수유 50% 에탄올 추출물에서 각각 12.23 g/100 g 및 5.08 g/100 g으로 높은 함량을 나타내었으며, 총 당 함량은 증숙 산수유 열수추출물에서 71.32 g/100 g으로 높은 함량을 나타내었다. 유기산 함량은 증숙 공정을 통해 citric acid, malic acid, 및 formic acid 함량은 감소하였고 oxalic acid 및 gallic acid 함량은 증가하였으나, 유기산은 대체로 감소되었다. DPPH radical 소거활성, ABTS radical 소거활성 및 FRAP 활성은 증숙 산수유 50% 에탄올 추출물(1,000 μg/mL)이 각각 72.37%, 43.15% 및 689.49 μM로 가장 우수한 항산화 활성을 나타내었다. 50% 에탄올 추출물(1,000 μg/mL)은 H2O2에 의해 손상된 폐상피세포인 L-132 세포에서 87.37%로 가장 높은 세포생존율을 나타내었으며, LPS로 자극을 유도한 대식세포주인 RAW264.7 세포에서 15.70 μM로 가장 높은 nitric oxide 생성량을 나타내었다. 또한 자궁경부암(HeLa) 세포 및 유방암(MCF-7) 세포에서 각각 56.74% 및 41.94%의 암세포 생육 저해활성을 나타내었다.
