서 론
국내에서 생산되는 주요 과실은 감귤, 사과, 포도, 배 등은 생과 형태로 소비되거나, 통조림, 주스, 잼, 와인 또는 음료 등의 가공식품으로 사용된다(1). 이들 과실류 중에서 복분자(Rubus coreansu, Korean black raspberry)와 머루(Vitis amurensis, Moru)는 전체 식품가공용 사용량 대비 와인 제조용 사용량이 각각 75.8%와 73.6%로 와인으로 가공되는 비율이 높다. 포도(Table grape)는 연간 8,000-10,000 ton이 식품가공용으로 소비되고 전체 식품가공용 사용량 대비 주스 가공용 사용량과 와인 제조용 사용량은 각각 63.2%와 9.0%이다(1). 전체 식품가공용 포도 사용량 대비 와인 가공용 포도 소비량이 낮은 이유는 국내산 포도가 대부분 생식용에 적합한 캠밸얼리나 거봉 등의 품종에 집중된 것에서 기인한다. 이외에도 전체 식품가공용 사용량 대비 와인으로 가공되는 비율이 높은 과종으로는 오디(59.1%)와 단감(27.8%)이 있으나 이들 과종의 전체 식품가공용 사용량은 각각 262 ton과 108 ton으로 낮다. 전체 식품가공용 사용량이 높은 과종으로는 감귤(91,126 ton), 사과(28,087 ton), 유자(15,616 ton) 등이며 이들 과종의 와인 가공비율은 각각 <0.1%, 2.1%와 0.1%이다(1).
최근, 소득의 향상, 교통망 확충, 여가 시간의 증가 및 웰빙붐 등의 사회적 분위기에 편승하여 다양한 과실주들이 개발되고 있다(2-6). 과실주의 품질평가에서 관능적 특성 평가이외에도 기계적 분석에 기반한 이화학적 분석(pH, 산도, 당도, 유기산 및 무기질 함량과 조성, 향 특성, 아미노산 조성) 결과와 항산화능 특성들이 과학적 자료로 사용된다(2-7). 과실주 및 원료과실에서 항산화능 평가에는 Folin-Denis법에 기반한 비색정량을 원리로 하는 총 폴리페놀 화합물 정량(7,8), 총 플라보노이드 함량 측정(9), DPPH 라디컬 소거능 측정(9), ABTS 라디컬 소거능 측정(9) 등의 방법들이 일반적으로 사용된다. 이러한 방법들은 신속하게 원료 과실 또는 와인발효 중 생성되는 항산화 물질들의 총량을 측정하는 장점이 있으나 정성적인 분석에는 제한점이 있다. 최근에는 항산화 물질들의 정성적인 특성을 규명을 위하여 on-line antioxidant assay 기술이 과실 또는 과실주에 적용되고 있다(10-12). On-line antioxidant assay 기술은 HPLC 컬럼속으로 시료를 통과시켜 물질들을 분리시킨 후, 분리된 물질들이 ABTS 또는 DPPH 시약과 반응하도록 장치하여 특정물질의 라디칼 소거능을 측정하는 장치로 구성된다(10-12).
본 연구에서는 과종의 전체 식품가공용 사용량이 높으면서 와인 가공비율이 높은 복분자, 머루, 포도를 포함하여 와인 가공비율은 낮지만 전체 식품가공용 사용량이 높은 사과를 대상으로 하여 이들 과실로 제조한 발효주의 항산화 특성을 분석하였다. 상업용 및 자체 제조한 4가지 과실의 와인을 spectrophotometer를 사용한 비색법과 on-line HPLC-ABTS 분석법으로 분석하였으며 이들 방법들 간의 상관관계를 제시하였다.
재료 및 방법
본 연구에 사용된 와인은 복분자, 사과, 머루와 포도 등 총 4가지 과실을 원료로 제조하였으며, 이중 복분자 와인 2종, 포도주 6종, 머루주 1종 등 총 9개 제품은 상업용 와인을 지역마트에서 구매하여 4℃에서 냉장보관하면서 사용하였다. 사과주 2종과 머루주 1종은 실험실에서 자체 양조하였다. 사과(Fugi, Malus domestica)는 충북 제천산 생과를 사용하였다. 머루포도는 강원 삼척에서 수확된 머루포도 품종의 생과를 사용하였다. 사과와 머루포도는 줄기를 제거한 후, 간단한 수세후 파쇄시켜 액체성분, 껍질과 씨앗부분 모두를 원료로 사용하여 양조하였다. 설탕, potassium metabisulfite(K2S2O5), pectinase(pectinex 100L, 5,000 FDU/mL)는 각각 제일제당(Seoul, Korea), Sigma-Adrich(St. Louis, MO, USA), Novozyme사(Bagsvaerd, Denmark) 제품을 사용하였다. 효모는 Red star premier cuvee(Saccharomyces cerevisiae, LeSaffre, France)를 사용하였다. 항산화 실험에 사용한 시약과 표준물질인 Folin-Ciocalteu's phenol reagent, 갈산(gallic acid), 플라보노이드 측정용 시약(sodium nitrite, aluminum chloride hexa-hydrate, sodium hydroxide), 카테킨하이드레이트((+)-catechin hydrate), 2,2'-azino-bis-3-ethylbenzthiazoline-6-sulphonic acid(ABTS), potassium peroxodisulfate을 포함한 분석시약들은 Sigma-Aldrich사 제품을 사용하였다.
사과주와 머루주 제조를 위하여 착즙한 주스 15 L를 25 L 용량의 플라스틱 발효조에 첨가하고 설탕을 보당하여 24 °Brix로 조절하였다. 여기에 와인의 산화방지 및 발효중 오염 방지를 위하여 potassium metabisulfite 를 1.5 g 첨가한 후, 상온에서 16시간 동안 방치하여 내용물을 살균하였다. 살균 후 pectinase 5 mL, 동결건조된 효모 5 g를 첨가하여 23℃에서 2주 동안 정치발효하였다. 정치발효 기간 중 처음 7일은 하루 2차례, 다음 7일은 하루 1차례 발효액을 완전하게 혼합하였다. 14일 발효 후에는 발효액에서 이산화탄소의 발생이 현저하게 감소하였으며, 발효액을 여과하여 와인을 분리하였다.
12종 와인 시료의 총 폴리페놀 화합물의 함량측정은 페놀성 및 비페놀성 환원물질이 Folin-Ciocalteu`s phenol reagent에 반응하여 발색하는 원리를 바탕으로 하는 Folin-Denis법(8)에 의해 비색 정량하였다. 구체적으로, 시료 100 μL에 동량의 Folin-Ciocalteu’s phenol reagent을 첨가하여 실온에서 3분 간 방치한 후, 200 μL의 20% Na2CO3을 가한 후 실온에서 90분 동안 정치시켰다. 정치된 반응액을 원심분리기를 이용하여 3,000 rpm에서 8분간 원심분리를 한 후 상층액을 이용하여 765 nm로 설정된 microplate spectrophotometer(EON, BioTek, Winooski, VT, USA)으로 흡광도를 측정하였다. 시료에 포함된 환원물질들의 총량은 갈산(gallic acid)를 표준물질로 사용하여 환산하였다. 총 플라보노이드 함량은 플라보노이드(flavonoid)가 알칼리성 pH 조건에서 알루미늄(aluminum)과 반응하여 분홍색의 flavonoid-aluminum 결합체를 형성하는 원리를 활용하여 정량하였다(13). 증류수와 1:4 부피비로 희석한 와인시료 또는 표준물질((+)-catechin hydrate) 250 μL에 15 μL 5% sodium nitrite(NaNO2), 30 μL 10% aluminum chloride(AlCO3·6H2O)를 연속적으로 첨가한 후, 다시 여기에 100 μL 1M sodium hydroxide(NaOH)와 55 μL 증류수를 가한 후 510 nm에서 흡광도를 측정하였다. 시료중에 포함된 플라보노이드 물질의 총량은 (+)-catechin hydrate를 표준물질로 사용하여 농도를 나타내었다. 증류수에 녹인 catechin 표준용액(1 mM, 0.5 mM, 0.25 mM, 0.625 mM, 0.03125 mM)를 사용하였으며 획득된 calibration curve에 시료의 값들을 적용하여 환산하였다. 모든 분석을 3회 분석하였다. ABTS 라디칼 소거활성(radical scavenging activity)은 비색 정량법과 on-line HPLC-ABTS 측정으로 나누어 측정하였다. 비색 정량법은 Re 등(14)의 방법을 변형하여 측정하였다. 구체적으로, 7.4 mM ABTS 용액을 제조한 후 여기에 potassium persulfate를 최종농도 2.6 mM가 되도록 용해시킨 다음, 빛이 들지 않은 암실에서 16시간 반응시켜 ABTS 시약을 제조하였다. ABTS 시약은 흡광도 734 nm에서 측정하여 흡광도 0.700으로 조정하여 사용하였다. 와인시료 20 μL를 취한 후 여기에 ABTS 시약 180 μL를 가하여 실온에서 30분 동안 방치하였다. 방치한 시료를 734 nm에서 흡광도를 측정하였으며(A1), blank로는 와인시료 대신 증류수를 사용하여 위에서 언급한 과정을 반복하여 흡광도 값을 측정하였다(A0). ABTS 라디칼 소거능은 blank 대비 시료의 감소된 흡광도의 비율로 계산되었다.
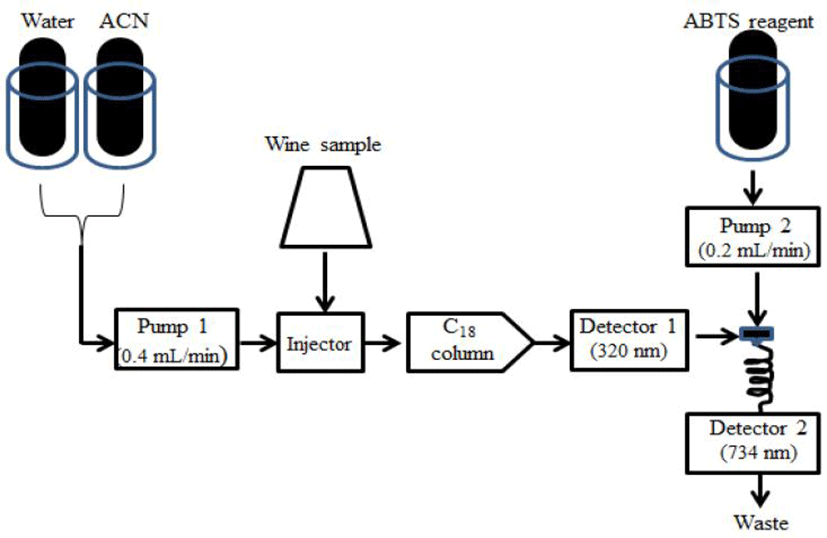
12종 와인시료의 항산화 활성을 on-line HPLC-ABTS 장치를 사용하여 ABTS 라디칼 소거능을 분석하였다(15). Potassium persulfate(3.5 mM in water)와 ABTS(2 mM in water)를 제조한 후, 여기에 물을 가하여 8배로 희석하여 갈색병에 담아 빛을 피할 수 있는 어두운 장소에서 16시간 방치하여 ABTS 라디칼을 생성하였다. 이를 ABTS 시약으로 사용하였다. 제조한 와인 시료 20 μL 를 YMC Hydrosphere C18 컬럼(4.6×250 mm, 5 μL, Wilmington, NC, USA)이 장착된 HPLC(Agilent 1200, Agilent Technologies Inc., Santa Clara, CA, USA)에 주입하였다. 사용한 용매는 water와 acetonitrile(ACN)을 농도구배로 사용하여 시료 주입시점에서 5분까지는 water: ACN=100:0(v/v), 5-40분 까지는 water:ACN=0:100로 증가시킨 후, 40-50분까지 용매조성이 유지되었고, 분석이 완료되면 water:ACN=100:0으로 변경되었다. 분석기간 동안 용매의 유속은 0.4 mL/min였으며 첫 번째 검출기의 파장은 320 nm로 설정하여 페놀성 물질들을 분석하였다(Fig. 1). 첫 번째 검출기를 통과한 물질들이 두 번째 펌프로부터 0.2 mL/min의 유속으로 공급된 ABTS radical 시약과 만나서 radical 소거반응이 이루어 지도록 하였으며 와인시료에서 생성된 성분들에 의한 라디컬 감소를 두 번째 검출기(파장 734 nm)에서 측정하였다.
실험결과는 3회 반복하여 측정한 값을 평균(mean)과 표준편차(SD)로 표시하였고, 실험결과의 통계적 유의성 분석을 위하여 1-way ANOVA-test를 사용하였고(16), 시료간의 유의성 평가는 Duncan's multiple range test를 실시하여 검증하였다.
결과 및 고찰
총 폴리페놀과 총 플라보노이드 함량을 측정한 결과는 Table 1과 같다. 와인 종류에 따른 총 폴리페놀 함량은 상업용 복분자주가 91.7 GAE μg/mL으로 상업용 머루와인(1,369.0 GAE μg/mL)에 비하여 유의적으로 낮은 함량을 보였으며, 사과주(337.5-357.0 GAE μg/mL)와 유사한 결과를 보였다(p<0.05). 포도주의 경우에는 총 폴리페놀 함량이 161.7-1,477.9 GAE μg/mL로 제품별로 큰 차이를 보였다. Hwang와 Park의 연구(7)에서는 Muscat Bailey A 포도과즙을 동결농축 방법으로 농축하여 보당과정없이 양조시 포도주의 총 폴리페놀 함량이 1,520-1,560 μg/mL 수준으로 나타났다. 한편, 동일한 분석조건에서 농도를 달리한 5점의 gallic acid 표준물질로 측정 시 gallic acid(농도 구간 0.03-0.5 mM, X축)와 흡광도값(A765 nm, Y축)의 관계식은 Y=3.51X+0.05(R2=0.999)로 나타났다. 와인 종류에 따른 총 플라보노이드 함량은 상업용 복분자주가 107.4-169.0 CE μg/mL으로 상업용 머루와인(649.3-1,292.6 CE μg/mL)에 비하여 유의적으로 낮은 함량을 보였으며, 사과주(134.2-160.5 CE μg/mL)와 유사한 결과를 보였다(p<0.05)(Table 1). 포도주의 경우에는 총 플라보노이드 함량이 35.7-477.5 CE μg/mL 로 제품별로 큰 차이를 보였다. 한편, 동일한 분석조건에서 농도를 달리한 5점의 catechin 표준물질로 측정 시 catechin(농도 구간 0.06-1.0 mM, X축)와 흡광도 값(A510 nm, Y축)의 관계식은 Y=0.7033X-0.0068(R2=0.997)로 나타났다. Kim 등(17)은 머루종자에는 플라바놀류(flavanol)의 일종인 catechin 함량이 53 mg/100 g 수준으로 존재한다고 보고하였다. 한편, Kang 등(18)은 머루와인의 총 플라보노이드 함량이 567-1,092 CE μg/mL로 보고하였다.
비색법으로 ABTS 라디컬 소거능을 분석한 결과를 Table 2에 나타내었다. 사과주, 머루주, 포도주, 복분자주의 ABTS 라디컬 소거능은 각각 13.7-14.2%, 54.5-89.6%, 7.5-48.2%, 11.2-15.2%로 나타나, 머루주의 ABTS 라디컬 소거능이 다른 3종의 과실주보다 유의적으로 높게 나타났다(p<0.05). Kang 등(18)의 연구에서는 숙성 1-3년산 머루와인의 자유라디컬 포획효과는 80-87% 내외로 합성 합성제인 BHA(90%)와 quercetin(92%)와 유사한 수준으로 나타났다. 온라인(on-line) 항산화 분석장치를 활용하여 과실주 시료들의 항산화 물질 탐색 및 항산화 활성을 측정하였다(Fig. 2). 이동상에 의해서 HPLC 칼럼에 주입된 시료는 칼럼을 통과하면서 순차적으로 분리되며, 분리된 순서에 따라 UV 검출기(320 nm)에서 정보가 수집된다. 검출기를 통과한 시료는 이동상(0.4 mL/min)에 의하여 이동하면서 ABTS 시약을 0.2 mL/min 속도로 공급하는 관과 합류한다. 합류된 시료와 ABTS 시약은 0.6 mL/min의 속도로 이동하면서 반응하고 일정시간 후에는 두 번째 검출기(734 nm)에서 자유라디컬 포획정도가 정량적으로 측정된다. 첫 번째 검출기에서는 사용한 컬럼과 분석조건에서 나타나는 페놀성 화합물과 다른 물질들이 HPLC 크로마토그램을 형성한다. 두 번째 검출기에서는 분석기간동안 ABTS 라디컬 수치가 최대값을 유지된다. 첫 번째 칼럼에서 분리된 물질들이 ABTS 라디컬 소거능이 있으면 해당되는 물질이 두 번째 검출기를 통과하는 시점에 ABTS 라디컬 수치가 아래쪽으로 감소하였다가 다시 최대값으로 복원된다. 연구자는 첫 번째 검출기에서 획득된 크로마토그램과 두 번째 검출기에서 획득된 크로마토그램을 결합시켜서 나타나도록 프로그래밍한다(19). 두 개의 크로마토그램을 동시에 확인함으로써 두 번째 검출기에서 확인된 ABTS 라디컬 소거능을 갖는 피크를 첫 번째 검출기에서 나타난 피크로 특정한다. 첫 번째 검출기에서 나타난 피크의 물질을 확인한 후에 표준물질을 사용하여 해당되는 피크의 정량분석이 가능해 진다. 한편, 두 번째 검출기에서 나타난 피크들은 면적값을 분석기계가 자동적으로 제시함으로써 신뢰할 수 있는 ABTS 라디컬 소거능을 계산할 수 있다. 과실주 시료들을 온라인(on-line) 항산화 분석장치로 분석 시 두 번째 검출기에서 다수의 화합물들이 확인되어 과실주에 ABTS 라디컬을 감소시키는 물질들이 다수 존재하는 것으로 확인되었다(Fig. 2). 특히, 과실주의 종류가 동일한 경우, 정성적인 on-line HPLC-ABTS 분석 결과가 유사하게 나타났다. On-line HPLC-ABTS 분석 시 크로마토그램의 피크 다양성 측면에서 4가지 과실주 중에서 머루주 시료에서 가장 많은 수의 피크와 피크 면적이 확인되었다. 사과주의 경우에는 32-35분대에서 ABTS 라디컬을 감소시키는 물질들이 가장 높게 나타난 반면, 복분자주의 경우에는 26-28분대에서 가장 높아, 과실주별 대표적인 ABTS 라디컬을 감소시키는 물질들이 차이가 있음을 보여준다. 항산화 활성은 원료 과실에 포함된 항산화 물질들이 직접 과실주에 반영되거나, 미생물 발효에 의하여 항산화물질들이 다른 물질로 변할 수 있다. 사과의 경우에는 100 g의 과실에 비타민 C가 4 mg, 베타카로틴(β-carotene)과 루테인(lutein) 등의 카로티노이드류가 0.02-0.09 mg, 시아니딘(cyanidin)를 주성분으로 하는 안토시아닌류(anthocyanidins)가 0.76 mg, 에리오딕티올(eriodictyol), 헤스페레틴(hesperetin), 나린제닌(naringenin) 등의 플라바논류(flavanone)가 <1 mg, 플라바놀류(flavanol) 중에서 카테킨류(catechins)인 카테킨(catechin)이 0.7-22 mg, 에피카테킨(epicatechin)이 5.21-18.80 mg, 에피갈로카테킨(epigallocatechin)이 0.25-111.0 mg, 플라바놀류(flavanol) 중에서 프로안토시아니딘류(proanthocyanidins)가 84.1-91.3 mg, 플라본류(flavones)로 루테올린(luteolin)이 0-0.17 mg, 플라보놀류(flavonols)로 비배당체인 캠퍼롤(kaempferol)이 0-0.02 mg, 미리세틴(myricetin)이 0-0.01 mg, 퀘세틴(quercetin)이 0.13-11.0 mg, 플라보노이드류(flavonoides) 중에서 이소플라본(isoflavones)이 0.14-0.25 mg, 페놀산류(phenolic acids) 중에서 protocatechuic acid가 0-0.49 mg, 페놀산류 중에서 하이드록시벤조산류(hydroxybenzoic acid)로 카페익산(caffeic acid)이 0-67.75 mg, 클로로겐산(chlorogenic acid)이 7.06-32.80 mg, 계피산(cinnamic acid)이 0.06-0.40 mg, 페룰린산(ferulic acid)이 0-4.95 mg, p-쿠마르산(p-coumaric acid)이 0.29-23.75 mg 존재한다. 복분자의 경우에는 100 g의 과실에서 카로티노이드류 중 베타카로틴이 0.13 mg, 루테인이 0.12 mg, 안토시아닌류로 시아니딘이 90.31 mg, 펠라고니딘이 0.15 mg, 플라바놀류 중에서 카테킨류인 카테킨이 0.72-37.06 mg, 에피카테킨이 4.66-11.48 mg, 에피갈로카테킨이 0.1-0.15 mg, 플라바놀류 중에서 프로안토시아니딘류가 15.7 mg, 플라보놀류로 캠퍼롤이 0.06 mg, 미리세틴이 0.67 mg, 퀘세틴이 1.76 mg, 페놀산류 중 클로로겐산이 0.1 mg, 엘라그산이 31.9-43.7 mg 발견된다(20). 포도의 경우에는 100 g의 과실에서 카로티노이드류인 베타카로틴이 0.11-0.15 mg, 루테인이 0.18-0.39 mg, 안토시아닌류로 시아니딘이 1.18-34.19 mg, 델피니딘이 1.82-3.17 mg, 펠라고니딘이 0-2.96 mg, 말비딘이 58.8 mg, 페오니딘이 6.13 mg, 페튜니딘이 2.81 mg, 플라바놀류 중에서 카테킨류인 카테킨이 5.46-10.14 mg, 에피카테킨이 5.24-8.68 mg, 에피갈로카테킨이 0-0.03 mg, 플라바놀류 중에서 프로안토시아니딘류가 60.4 mg, 퀘세틴이 2.54 mg, 플라보노이드류 중 이소플라본류가 0.08 mg, 페놀산류 중 몰식자산(gallic acid)이 375 mg/100 g, protocatechuic acid가 53.5 mg/100 g, 탄닌산(tannic acid)이 40 mg, 클로로겐산이 6.3 mg 존재한다(20).
| Wine | ABTS (%) |
|---|---|
| AW (L)1) | 13.7±0.92)ef3) |
| AW (L) | 14.2±1.1e |
| MW (L) | 89.6±2.2a |
| MW | 54.5±2.9b |
| GW | 29.8±1.8d |
| GW | 8.0±0.7fg |
| GW | 48.2±1.3c |
| GW | 14.3±1.1e |
| GW | 9.8±0.1efg |
| GW | 7.5±1.3g |
| KRW | 15.2±0.8e |
| KRW | 11.2±0.5efg |
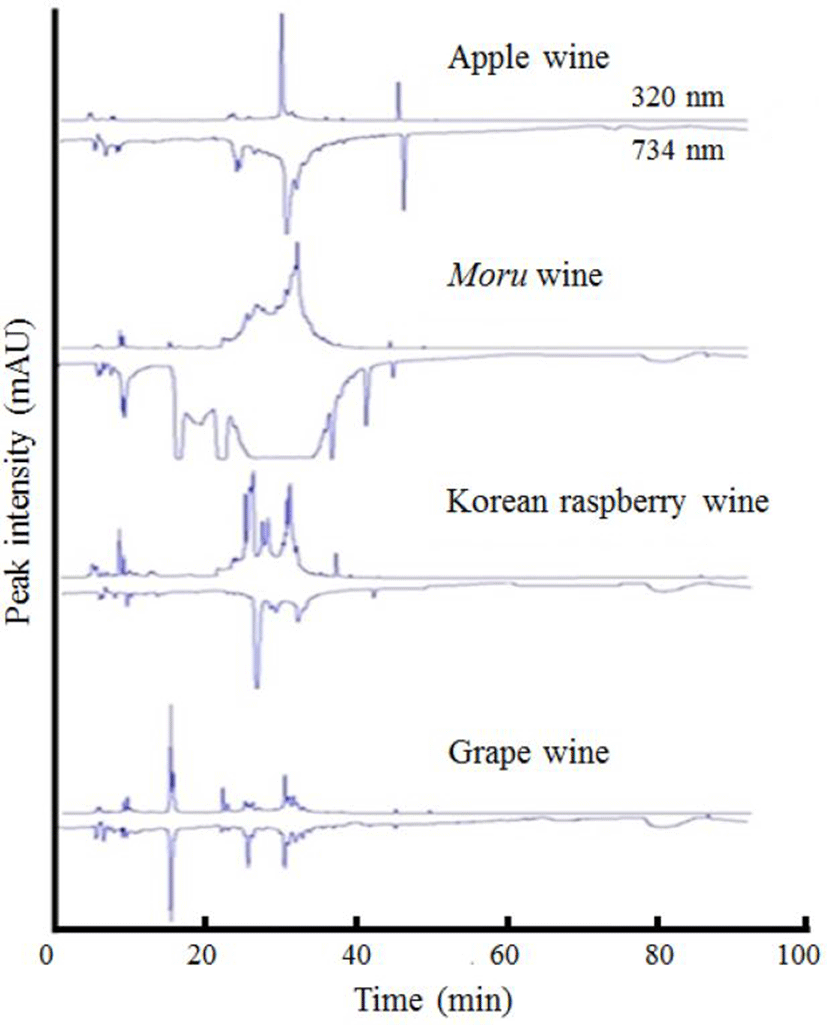
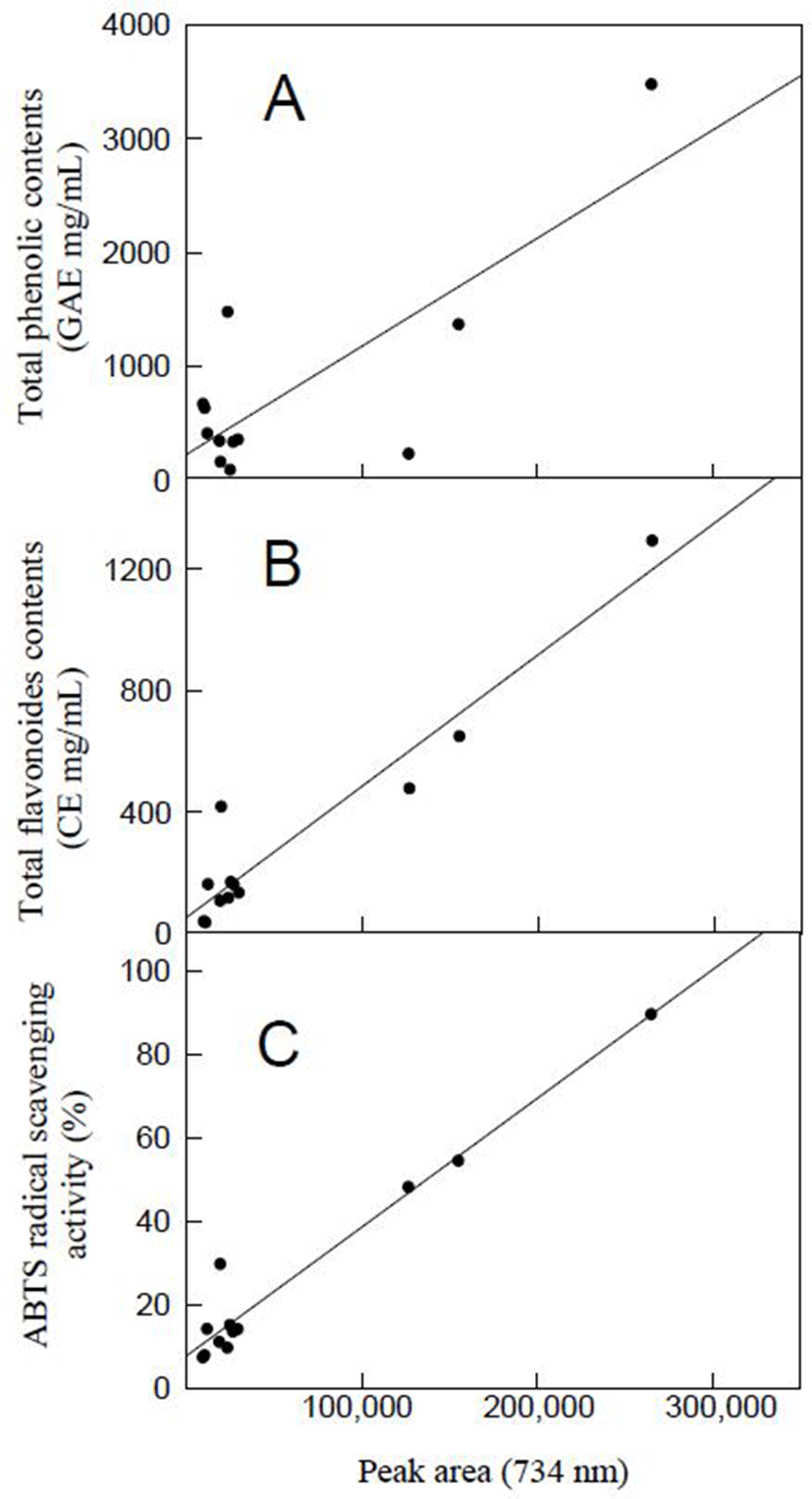
원료 과실에 존재하는 항산화 물질의 다양성이 과실주에 반영되어 다양한 항산화물질로 on-line HPLC ABTS 분석에 반영된 것으로 판단된다(Fig. 2). 과실주의 on-line HPLC-ABTS 분석결과와 항산화 활성의 상관관계를 회기 분석한 결과, 총 페놀, 총 플라보노이드 함량, 비색법에 의한 ABTS 라디컬 소거능의 상관계수(R2)가 각각 0.6388, 0.9150, 0.9527로 나타났다(Fig. 3). 이러한 결과는 on-line HPLC-ABTS 분석이 과실주의 ABTS 라디컬 소거능 측정에 사용될 수 있음을 나타낸다. 비색법에 의한 ABTS 라디컬 소거능 측정은 ABTS 라디컬 소거능 총량을 나타낸 반면, on-line HPLC-ABTS 분석은 ABTS 라디컬 소거능을 대표하는 지표물질을 특정하는 장점이 있다(19,21). 사과주의 주요 항산화물질 함량을 분석한 연구에서는 사과주 100 mL에 클로로겐산이 7.1-9.2 mg, 에피카테킨이 2.3-4.0 mg 존재하는 것으로 나타난 반면, 카테킨, 카페익산, p-쿠마르산은 각각 <0.1 mg으로 정량되어 사과와 사과주의 주요 항산화물질 구성에서 큰 차이가 있었다(22). 결론적으로, on-line HPLC-ABTS 분석 결과로 판정 시, 각종 과실주의 항산화 활성 중 ABTS 라디컬 소거능은 다양한 항산화 물질들로 특징되며, 본 연구에 사용된 4종류의 과실주 중에서 머루주의 ABTS 라디컬 소거능이 가장 높게 나타났다. 본 연구에 사용된 on-line HPLC-ABTS 분석은 mass spectrophotometer와 연계 시 과실주의 ABTS 라디컬 소거능 활성을 대표하는 지표물질의 함량 측정에 도움을 줄 것으로 예상된다.
요 약
국산 과실주인 사과주, 포도주, 머루주, 복분자주는 다양한 항산화 활성을 가지고 있다. 본 연구는 이들 과실주의 라디컬 소거능 활성을 on-line HPLC-ABTS 분석법으로 유효성 검증을 실시하고자 하였다. HPLC에 연결된 컬럼을 통과한 시료의 페놀성 물질의 정량분석은 320 nm로 설정된 첫 번째 검출기에서 실시하였고, 연속적으로 ABTS 라디컬 소거능 활성은 734 nm로 설정된 두 번째 검출기에서 확인되었다. 과실주 종류별 항산화 활성 측정시 비색법으로 측정한 총 페놀 함량, 총 플라보노이드 함량, ABTS 라디컬 소거능 활성 측면에서 머루주에서 가장 높게 나타났다. On-line HPLC-ABTS 분석법으로 분석 시 과실주 종류별 ABTS 라디컬 소거능 활성을 나타내는 물질의 종류에서 차이가 있음을 확인하였으며, 비색법으로 측정한 ABTS 라디컬 소거능 활성 측정과 on-line HPLC-ABTS 분석법 사이의 상관성(R2)을 측정시 0.9527로 나타났다. 이상의 결과, 과실주의 ABTS 라디컬 소거능에 대한 on-line HPLC-ABTS 분석방법은 과실주의 ABTS 라디컬 소거능을 확인하는데 적합한 방법으로 나타났다.