Article
찔레뿌리 초임계 추출물의 항균, 항산화 및 항염증 활성
고영심, 최선은*
Anti-fungal, anti-oxidant, and anti-inflammatory effects of supercritical fluid extracts from Rosa multiflora root
Young Sim Go, Sun Eun Choi*
Department of Cosmetology Science, Nambu University, Gwangju 62271Korea
Copyright ⓒ The Korean Society of Food Preservation. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Jan 18, 2018; Revised: Jan 26, 2018; Accepted: Jan 30, 2018
요약
신규 천연물 유래 난치성 피부면역 질환 기능성 소재를 발굴하기 위해서 찔레나무 뿌리를 초임계 유체 기술을 활용하여 추출을 수행하였고, 확보된 찔레나무 뿌리 초임계 추출물을 대상으로 3종의 피부상재균(Staphylococcus epidermidis, Pityrosporum ovale, Trichophyton mentagrophytes)에 대하여 항균력을 확인한 결과 추출물은 시험된 모든 균종에 대해 항균력이 확인이 되어서 각 균으로 유발될 수 있는 질환으로 알려진, 무좀 및 아토피 피부병, 비염 및 천식으로 이루어진 알레르기성 질환, 염증성 피부질환, 비듬 등의 질환을 예방 및 치료 보조 수단으로 활용이 가능할 것으로 기대된다. 또한, ABTS 라디컬 소거능과 NO 소거능 실험을 통해서 찔레나무 뿌리 초임계 추출물의 항산화 활성과 항염증 활성의 우수한 활성이 확인이 되어서 산화적 스트레스 질환과 염증성 질환에 대해서 예방 및 치료 보완 신소재로 개발이 가능성이 높다는 것을 알 수 있었다. 결론적으로 찔레나무 뿌리 초임계 추출물은 피부상재균에 대한 항균활성, 라디컬 소거능에 의한 항산화 활성, 과 생성된 NO소거능에 의한 항염증활성이 각각 확인이 되어 향후 만성 염증성 피부면역 질환 개선 및 치료 보조제 관련 의약품 또는 기능성 향장품 개발 관련 신소재로 활용이 가능한 소재로 판단된다.
Abstract
The roots of Rosa multiflora Thunberg have been used in traditional oriental medicine as remedies for rheumatic arthralgia and scabies. In this study, the anti-fungal, anti-oxidant, and anti-inflammatory activities of a supercritical extract of Rosa multiflora root were investigated in vitro. To investigate the anti-oxidant and anti-inflammatory effects of the supercritical extract, 2,2'-azino-bis(3-ethylbenzothiazoline-6-sulphonic acid (ABTS) radical scavenging activity, and the inhibition of nitric oxide production in lipopolysaccharide (LPS)-stimulated RAW 264.7 cells were examined, respectively. In addition, the anti-fungal activities of the extract were assessed. The results showed a concentration-dependent, increase in ABTS radical scavenging activity. The supercritical fluid extracts of Rosa multiflora root exhibited low toxicity to RAW 264.7 cells at 100 µg/mL the highest concentration tested. Cells stimulated with LPS produced more nitric oxide than normal control cells; however, cells treated with the supercritical fluid extract decreased this production in a concentration-dependent manner. Finally, the supercritical fluid extracts showed significant anti-fungal activity. These results suggest that extracts of the roots of Rosa multiflora might be used to develop potent anti-fungal, anti-oxidant, and anti-inflammatory agents, and may be useful as ingredients for related new functional cosmetic materials.
Keywords: Rosa multiflora; supercritical fluid; anti-fungal; anti-oxidative; anti-inflammatory
서론
장미과에 속하는 찔레나무는 한국, 일본, 중국을 포함하여 동아시아 지역 야산에 광범위하게 분포하는 식물로서, 예로부터 찔레나무 열매는 토혈, 구갈증, 설사, 말라리아, 상처치유 등에 사용되어 왔으며, 찔레나무 뿌리는 당뇨병, 이질, 류마티스 관절통, 사지마비, 토혈, 비출혈, 빈뇨, 야뇨증, 월경불순, 타박상, 옴 등의 증상에 민간요법으로 사용되어 왔다(1).
찔레뿌리에 관한 성분 연구로는 tormentic acid와 그 배당체를 분리 및 구조동정 연구를 시작으로(2) 그 외에 다양한 flavonoid 계열의 화합물 즉, multiflorin A, multiflorin B, multinoside A, multinoside A acetate, quercetin, quercetin 3-O-β-D-xylopyranoside, quercetin 3-O-β-D-glucuronide methyl ester, isoquercitrin, hyperin, isorhamnetin 3-O-β-D-glucoside, taxifolin 3-O-β-D-xylopyranoside, heliocioside A and 2-hydroxynaringin 5-O-β-D-glucopyranoside 등의 화합물이 분리 및 구조동정 보고된바 있다(3-6). 최근 박 등은 찔레나무 뿌리로부터 2종의 신규 축합형 탄닌을 분리 및 구종동정을 하고 이들 화합물의 항산화 활성과 항염증, 항아토피 활성을 보고하였다(8,9). 또한, 찔레나무 뿌리 용매별 추출물의 항산화, 항염증 활성 연구와 acetone 유기용매 추출물로부터 2종의 poly-phenol 즉, procyanidin B3와 (+)-catechin을 분리하고 그들의 우수한 항상화 활성이 보고된 바 있다(10,11).
본 연구에서 활용된 초임계 추출 기술은 기존의 공정을 환경친화적인 방법으로 대체하려는 관련 산업계의 변화와 더불어 특히, 인체 적용을 목적으로 하는 생리활성 물질의 추출, 정제에 있어서 지속적으로 문제시 되어오는 유기용매 사용에 대한 위해성, 환경독성 등의 문제점을 극복하기 위한 방법으로 알려져 있다. 초임계 유체 추출 기술을 천연물 추출, 정제 분야에 적용하기 위해 국내외 많은 연구자들에 의해 활용되어지고 있다(12-15).
초임계 유체 기술 중 이산화탄소는 낮은 임계 온도, 압력, 저렴한 비용, 무독성, 환경친화성 등의 장점을 이유로 가장 인기 높은 초임계 유체 기술로 잘 알려져 있다(15-18).
최근 본 연구자들은 기존 열수추출방법과 다양한 유기용매를 활용하여 추출한 후 항산화 및 항염증 활성이 보고된 찔레나무뿌리를 대상으로 친환경적이고 기존에 밝혀지지 않은 찔레나무 뿌리 초임계 추출물의 항균활성, 항산화 및 항염증 활성 연구를 수행하여 천연물 유래 생리활성 기능성 신소재를 발굴하기 위해 본 연구를 수행하였다.
재료 및 방법
실험재료 및 초임계 추출방법
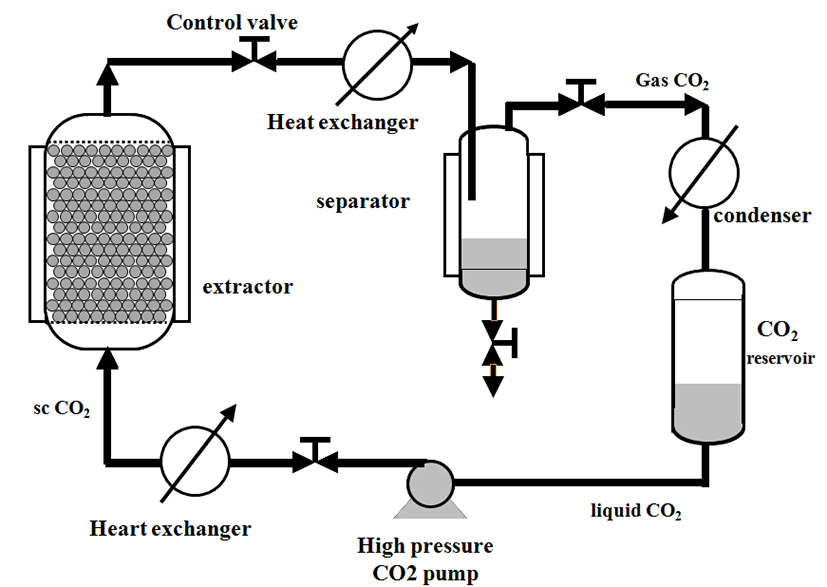
본 연구에서는 찔레나무 뿌리 추출은 초임계유체 추출 연구용 장비(ISA-SEFE-0500-0700-080, Ilsin Autoclave, Daejeon, Korea)를 사용하였다. 사용한 찔레나무 뿌리를 서울약령시장에서 구입하여 이물질을 제거하고 세척한 후, 음건하여 실험재료로 사용하였다. 건조된 시료 450 g을 200 mesh의 분쇄망을 통과하도록 분쇄하고, 분쇄된 찔레나무 뿌리를 추출조의 온도를 50℃로 조절하여 온도를 유지시킨다. 온도가 안정화되면 찔레나무 뿌리 시료를 넣고 CO2 가스를 등압으로 유지시킨 후, 고압펌프를 이용하여 line을 통해 실험압력 조건인 400 bar에 도달할 때까지 control valve를 조절하여 주입하였다. 설정 압력에 도달 후 추출조 하부로 에탄올(HPLC grade)을 분당 3 mL씩 60분 동안 총 180 mL를 투입하여 추출을 진행하였으며, 시료에 남아있는 잔존 에탄올을 제거하기 위해 설정된 압력과 온도로 30 min 동안 고압펌프를 이용하여 CO2를 흘려보내며 추출을 완료 하였다.
본 실험에 사용된 lab-scale 초임계 유체추출장치의 개략도를 Fig. 1에 나타내었다. Lab-scale 추출장치는 이산화탄소의 공급을 위한 추출조, 분리조, 열교환기, 고압펌프 등으로 구성되어져 있다.
사용균주 및 균주 배양
항균활성에 사용된 미생물 균주를 한국생명공학연구원 생물자원센터(KCTC/BRC, Jeongeup, Korea), 한국미생물보존센터(KCCM, Seoul, Korea)로부터 분양받았다, 실험에 사용한 각 미생물 균주의 균종과 번호를 Table 1에 정리하였다.
Table 1. .
List of microorganisms used for antimicrobial experiment
|
Strains |
Culture collection |
Gram strain |
Media |
Temp |
|
S.epidermidis
|
KCCM 35494 |
Gram (+) |
TSB |
37℃ |
|
P. ovale
|
KCCM 12679 |
Yeast |
YMB |
37℃ |
|
T. mentagrophytes
|
KCCM11950 |
Fungl |
SGB |
26℃ |
Download Excel Table
Paper disc에 의한 찔레나무 뿌리 초임계 추출물의 항균력 분석
항균력 검색은 paper disc법을 사용하였다(19). 배양된 균주는 1.0×106 CFU/mL으로 조절한 후 본 실험에 사용하였다. 평판배지에 배양된 각 균주를 100 μL씩 도말하여 준비하였고, 추출물을 각각 0.5-10 mg/mL 농도로 40 μL 씩 paper disc(diamerter 8 mm, Roshi kaisha. Ltd., Tokyo, Japan)에 천천히 흡수시킨 뒤 다음 37℃에서 24시간 동안 배양하였다. 대조군으로 에탄올을 사용하였으며, 배양 후 disc 주변에 생성된 저해환(clear zone, mm)을 측정하여 항균활성을 비교하였다.
ABTS 래디칼 소거작용의 측정
ABTS 래디칼 소거 활성은 Re 등(20)의 방법을 수정하여 측정하였다. ABTS(Sigma-Aldrich Co., St. Louis, MO, USA) 시약을 증류수에 용해하여 7.0 mM의 농도로 준비하고, potassium persulfate(Sigma-Aldrich Co.)를 증류수에 용해하여 2.45 mM 농도로 준비하여 두 용액을 1:1 비율로 섞어서 12-16시간 동안 암실상태로 방치하여 radical stock solution을 제조하고 제조된 solution을 PBS buffer(pH 7.4)로 희석하여 750 nm에서 흡광도를 측정하여 0.7-1.0 사이의 흡광값이 나오도록 희석하여 준비한다.
농도별로 시료를 준비하여 96-well plate에 sample:ABTS 반응 비율을 1:9로 맞춰서 30분 동안 암실에서 반응을 시키고, 반응이 끝난 후 750 nm 파장에서 흡광도를 측정한다.
Mouse macrophage RAW 264.7 cell 배양
Mouse macrophage RAW 264.7 cell은 한국 세포주 은행에서 동결상태로 구입하였으며 cell이 들어있는 앰플을 미온수(30-40℃)에 바로 녹여 10% FBS(fetal bovine serum), penicillin G(100 IU/mL), streptomycin(100 μg/mL)을 포함한 DMEM 배지를 이용하여 동결 과정에서 넣어준 DMSO를 제거하고, DMSO를 제거한 RAW 264.7 cells에 DMEM을 5 mL 넣어, 온도 37℃와 5%의 CO2를 유지하면서 incubator에서 배양하였으며, 1-2일마다 세포의 성장 정도에 따라 계대 배양하였다.
MTT assay
본 실험에서 RAW 264.7 cells에 대한 찔레뿌리 초임계 추출물의 세포 독성 및 실험 시 처리 농도를 결정하기 위해 MTT assay를 실행하였다. RAW 264.7 cells을 DMEM으로 medium 1 mL 당 5×104개만큼 배양시킨 다음, 1 mL 당 1×104개로 희석하여 96-well에 180 μL씩 넣고 2시간 동안 배양하여 cell들이 부착되도록 하고, 부착된 cells 배양액에 각각의 시료를 20 μL씩 넣은 후 24시간 동안 배양하였다. 24 시간 배양 후, 새로운 medium으로 교체하고 미리 조제한 MTT를 최종 농도가 0.5 mg/mL가 되게 첨가한 후, 보라색으로 생성된 formazan의 양을 정량하였다.
Nitric oxide 생성 억제 작용 측정
Nitric oxide 생성 억제 작용은 Griess의 방법(22,23)으로 측정하였다. 즉, Griess reagent(1% sulfanilamine, 0.1% N-(1-naphthyl)-ethylene diamine dihydrochloride, 2.5% H3PO4)는 NO를 산화시켜 NO2로 변화시키며 생성된 NO2는 540 nm에서 흡광도를 측정하여 그 농도를 NaNO2의 검량선을 이용하여 구하였다.
즉, RAW 264.7 cell을 DMEM으로 medium 1 mL 당 5×104개 만큼 배양시킨 다음, 1 mL 당 1×104개로 희석하여 96-well에 160 μL씩 넣고 2시간 동안 배양해서 cell들이 부착되도록 한 다음 LPS(1 μg/mL) 10 μL을 포함한 각각의 시료를 20 μL씩 넣고 20시간 배양시킨 후, 배양액에 생성되어 있는 NO의 양을 Griess reagent를 이용하여 정량하였다.
총 페놀 함량
총 페놀 함량은 Folin-Denis법(24)에 따라 각 추출물 1 mL에 Folin-Ciocalteu 시약 및 10% Na2CO3용액을 각 1 mL씩 차례로 가한 다음 실온에서 1시간 정치시킨 후 ELISA reader(TECAN, Salzburg, Austria)를 사용하여 700 nm에서 흡광도를 측정하였다. 표준물질로 gallic acid와 ethyl gallate를 사용하여 시료와 동일한 방법으로 분석하여 얻은 검량선 으로부터 총 페놀 함량을 산출하였다.
통계 처리
본 연구의 실험 결과들은 3회 반복 측정하여 평균값±표준편차로 나타내었으며, 모든 자료의 통계처리는 SPSS (Statistical Package for Science, version 24.0 SPSS Inc, Chicago, IL, USA)를 사용하여 처리하였다. 각 실험 농도 별 표준차이를 검증하기 위해 분산분석을 수행하였으며, 유의성이 발견된 경우 Tukey’s HSD test(25)에 의해 농도 간의 유의성을 분석하였다.
결과 및 고찰
찔레나무뿌리 초임계 추출물의 항균효과
Staphylococcus epidermidis (S. epidermidis)는 정상인 피부에서도 관찰되지만 모공이 막힌 경우 급격하게 증식하여 염증을 유발하는 것으로 알려져 있다. 피부가 염증에 노출될 경우 미생물 침입을 방어하는 방어 기작 또한 약해지고 2차적인 피부장벽의 약화를 발생시키고, 또 다른 미생물 감염의 원인이 되어 악순환이 반복된다(26). 찔레나무 뿌리 초임계 추출물의 S. epidermidis에 대한 항균효능을 확인하기 위해 균의 생육저해환인 clear zone(mm)을 측정한 결과 Fig. 2A와 같이 나타났다. 500 μg/mL-10 mg/mL 농도에서 찔레나무 뿌리 초임계 추출물은 모든 농도에서 clear zone(mm)이 9, 12 mm로 각각 항균력이 확인 되었다(Table 2). 실험 농도 중 500 μg/mL-5 mg/mL 농도에서는 9 mm로 저해환이 확인이 되었지만, 강력하거나 뚜렷한 항균활성이 확인되지 않았고, 농도 의존적으로 항균력이 증가하지는 못하였으나, 실험 최고 농도인 10 mg/mL 농도에서부터는 명확하게 항균력이 확인이 되어서 향후 해당 균종을 대상으로 유효한 항균력을 기대하려면 최소한 10 mg/mL 이상의 농도에서 사용해야 할 것으로 사료된다.
Fig. 2.
Inhibitory activities of supercritical extraction of Rosa multiflora Root against S. epidermidis, P. ovale and T. mentagrophytes.
Download Original Figure
Table 2. .
Antimicrobial activity of supercritical extraction of Rosa multiflora Root
|
Concentration(mg/mL) |
Microorganisms |
|
S. epidermidis
|
P. ovale
|
T. mentagrophytes
|
|
Clear zone diameter (mm) |
|
0.5 |
9 |
- |
- |
|
1 |
9 |
10 |
- |
|
5 |
9 |
11 |
10 |
|
10 |
12 |
12 |
13 |
Download Excel Table
피부에 가려움증을 동반한 지루성 피부병을 유발하는 것으로 잘 알려진 비듬균은 과도한 땀 분비와 스트레스 등에 의해 영향을 많이 받는 것으로 잘 알려져 있다(27). 찔레나무 뿌리 초임계 추출물의 P. ovale에 대한 항균효능을 확인하기 위해 균의 생육저해환인 clear zone(mm)을 측정한 결과 Fig. 2B와 같이 나타났다. 1-10 mg/mL 농도에서 찔레나무 뿌리 초임계 추출물은 농도의존적으로 항균력이 증가되는 것이 확인 되었다. 항균력 확인된 농도에서 각각 10, 11, 12 mm clear zone이 확인 되어 농도가 높아짐에 따라서 해당 균종에 대해서 항균력이 높아지는 것을 확인할 수 있었다(Table 2).
무좀의 원인균은 Trichophyton sp.이며, 주원인균으로는 T. mentagrophytes와 T. rubrum이 알려져 있다(28). 기존에 밝혀진 연구들을 통해서 Trichophyton 균은 무좀 및 아토피 피부병, 비염 및 천식으로 이루어진 알레르기성 질환군을 유발하는 것으로 알려져 있다(29,30).
찔레나무 뿌리 초임계 추출물의 T. mentagrophytes에 대한 항균효능을 확인하기 위해 균의 생육저해환을 측정한 결과 Fig. 2C와 같이 나타났다. 찔레나무 뿌리 초임계 추출물은 5와 10 mg/mL의 농도에서 각각 10, 13 mm의 clear zone을 형성하여 T. mentagrophytes에 대한 항균력이 있음을 확인할 수 있었다(Table 2). 이러한 결과를 통해서 찔레나무 뿌리 초임계 추출물은 5 mg/mL의 농도 이상에서 T. mentagrophytes에 의해 유발되는 무좀 및 아토피 피부염, 비염과 천식 등을 포함한 알러지성 질환을 예방 및 치료를 위한 기능성 소재로 활용될 수 있는 가능성이 있음을 확인할 수 있었다.
ABTS 래디칼 소거능 활성
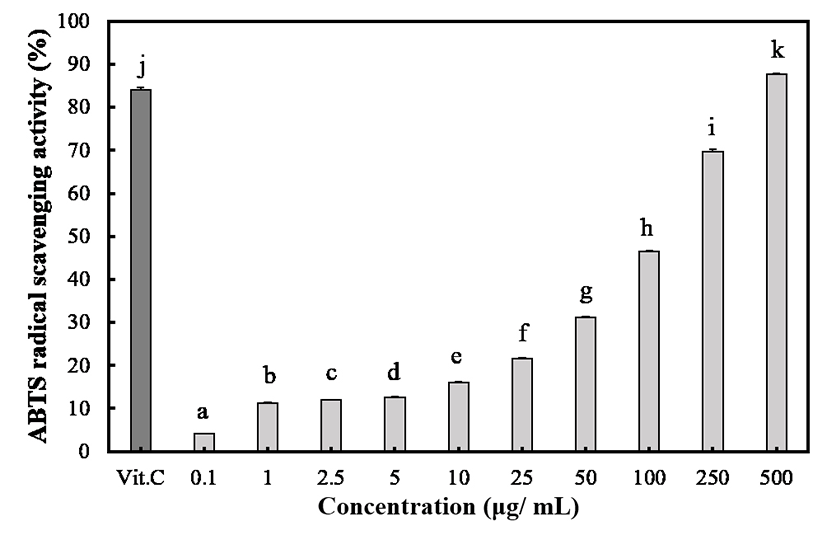
찔레나무 뿌리 초임계 추출물의 ABTS radical 소거능을 비교한 결과는 Fig. 3과 같다. 찔레나무 뿌리 초임계 추출물을 0.1 mg/mL부터 500 mg/mL까지 측정한 결과 모든 실험 농도에서 농도 의존적으로 유의적인 ABTS 라디컬 소거능이 관찰 되었다. 특히, 실험 최고 농도인 500 mg/mL에서는 양성 대조군인 비타민 C의 항산화 활성이 더 우수한 것으로 확인되었다. 이러한 결과로서 찔레나무 뿌리 초임계 추출물이 산화적 스트레스로 인해 유발하는 노화, 알러지질환, 피부질환을 포함한 다양한 난치성 질환을 예방 및 치료에 도움을 줄 수 있는 신규 천연항산화제로 개발이 가능할 것으로 사료된다.
Fig. 3.
ABTS radical scavenging activities of supercritical extraction of Rosa multiflora Root.
Values are means±SD of triplicate determinations. Different superscripts within a column indicate significant differences (p<0.05).
Download Original Figure
Nitric oxide(NO) 소거능
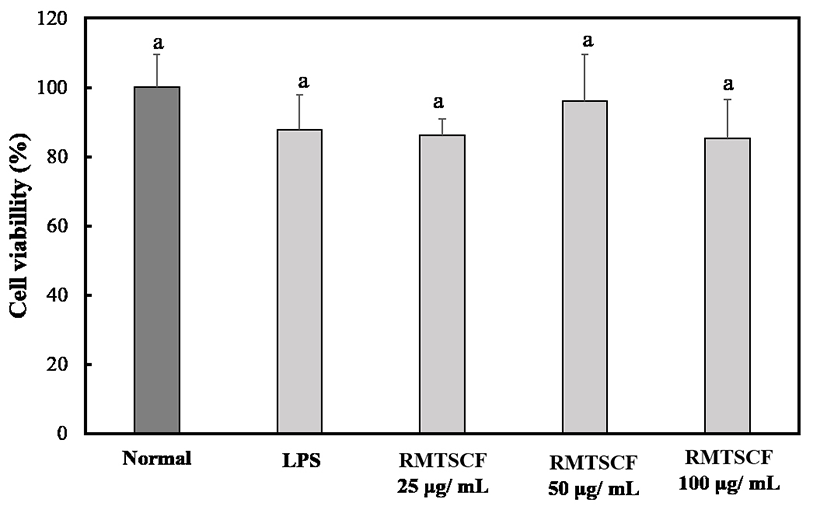
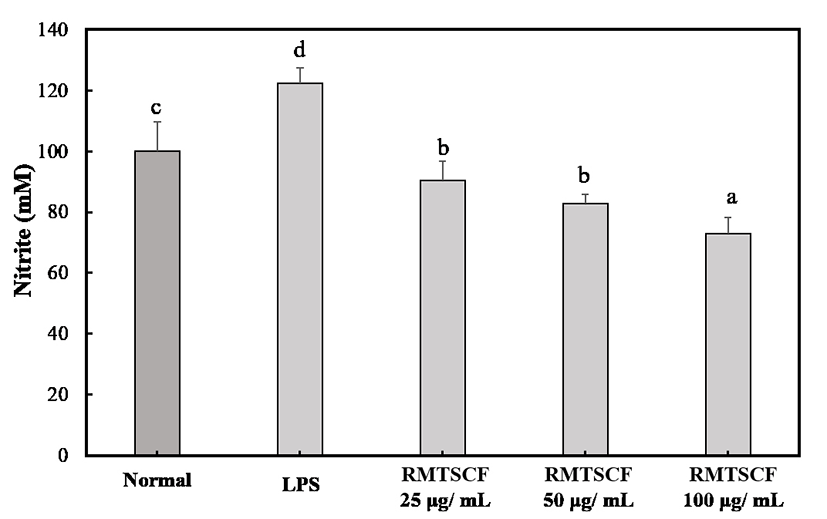
과 생성된 NO에 의해서 류마티스 관절염, 아토피피부염 등과 같은 난치성 피부면역 질환의 염증반응이 악화시키므로 유해한 작용을 나타내게 된다. 염증성 자극의 반응에 의한 NO생성의 저해는 만성염증성 피부면역 질환에서 치료적 방법으로 중요한 영역으로 인지되고 있다(32). 찔레나무 뿌리 초임계 추출물의 난치성 피부면역 질환 소재로서 활용 가능성을 확인하기 위해서 Raw 264.7 macrophage cell line에서 LPS로 유도된 NO 생성 억제능을 실험하기에 앞서 실험에 사용된 농도 25-100 μg/mL 모든 농도에서 MTT assay를 통해서 세포 독성을 확인해 본 결과는 Fig. 4에서와 같이 모든 실험군에서 찔레뿌리 초임계 추출물의 첨가에 따른 세포활성 억제가 관찰되지 않았다. 찔레나무 뿌리 초임계 추출물의 NO 소거능을 확인해 본 결과는 Fig. 5에 나타내었다. 즉, 실험에 사용된 모든 농도에서 음성 대조군인 LPS 유도군에 비해서 통계적으로 유의성 있게 NO 소거능이 확인이 되었으며, Normal 대조군과 비교하였을 때 찔레나무 뿌리 초임계 추출물은 NO 소거능이 매우 강한 것으로 확인되어, 신규 천연물 유래 항염증 활성 소재로 개발이 가능할 것으로 사료되며, 특히 만성 염증성 피부면역 질환에 적용이 가능할 것으로 사료된다.
Fig. 4.
Effects of supercritical extraction of Rosa multiflora Root on the viability of mouse RAW 264.7 macrophage cells.
The cell viability was measured by MTT assay. Results were expressed as % of control absorbance. Values are means±SD of triplicate determinations. Different superscripts within a column indicate significant differences (p<0.05).
Download Original Figure
Fig. 5.
NO contents of each supercr itical extraction of Rosa multiflora Root in LPS stimulated mouse RAW 264.7 macrophage cells.
Values are means±SD of triplicate determinations. Different superscripts within a column indicate significant differences (p<0.05).
Download Original Figure
총 페놀 함량
식물유래 polyphenol 화합물은 식물의 이차대사산물로서 항산화 활성을 기반으로 노화, 면역력 감소로 인한 다양한 질환을 예방하고 증상을 완화시켜 주는 것으로 알려져 있다(33,34). 본 실험에서는 총 페놀 함량을 측정하기 위해서 페놀 화합물의 표준물질로 가장 보편적으로 잘 활용되고 있는 gallic acid와 ethyl gallate를 각각 사용하여 Folin-Denis법(24)에 의해 구해진 검량선 으로부터 총 페놀 함량을 Table 3과 같이 확인이 되었다. 이러한 결과로 인해서 신규 천연 항산화제로서의 가치가 있을 것으로 기대가 된다. 하지만, 초임계 추출물이 항산화 활성 실험에서는 상대적으로 고농도에서 활성이 확인되고, NO 억제능 실험인 cell line에서는 저농도에서도 강력한 활성을 나타내는 원인에 대해서는 향후 지속적인 성분 연구를 통하여 찔레나무 뿌리 초임계 추출물의 생리활성을 나타낸 단일 화합물을 밝혀나가야 할 것으로 사료된다.
Table 3. .
Total phenolic contents of supercritical extraction of Rosa multiflora Root (mg/g)
|
Groups1)
|
Phenol |
|
TPCEG |
12.76±0.172)
|
|
TPCGA |
9.59±0.08 |
Download Excel Table
Acknowledgements
이 논문 2017년도 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원을 받아 수행된 연구임(No. NRF-2017R1C1B5016051).
References
KimCM, ShinMK, AhnDK, LeeKS. 1998; An Unabridged Dictionary of Chinese Herbs. Jeongdam Publishing House. Seoul, Korea: p. 4735-4738.

Takahashi K, Ogura M, Tanabe Y (1969) Studies on constituents of medicinal plants. IX. A constituent of the roots of Rosa multiflora Thunb. Chem Pharm Bull, 17, 2223-2229
TakahashiK, OguraM, TanabeY. 1969; Studies on constituents of medicinal plants. IX. A constituent of the roots of
Rosa multiflora Thunb. Chem Pharm Bull. 17:2223-2229


Takagi S, Yamaki M, Masuda K, Kubota M (1976) On the constituents of the fruits of Rosa multiflora Thunb.Ⅰ. Yakugaku Zasshi, 96, 284-288
TakagiS, YamakiM, MasudaK, KubotaM. 1976; On the constituents of the fruits of
Rosa multiflora Thunb.Ⅰ. Yakugaku Zasshi. 96:284-288.

Takagi S, Yamaki M, Masuda K, Kubota M (1976) On the constituents of the fruits of Rosa multiflora Thunb.Ⅱ. Yakugaku Zasshi, 96, 1217-1222
TakagiS, YamakiM, MasudaK, KubotaM. 1976; On the constituents of the fruits of
Rosa multiflora Thunb.Ⅱ. Yakugaku Zasshi. 96:1217-1222.

HuangTK, DingZZ, ZhaoSX, YanYQ, XuGJ, ChenL, YuCL, GaoXL, ZhangZD. 2001; Compendium of modern materia medica. China Medico Pharmaceutical Science & Technology Publishing House. Beijing, China: p. 2473-2474.

Seto T, Yasuda I, Akiyama K (1992) Purgative activity and principals of the fruits of Rosa multiflora and R. wichuraiana. Chem Pharm Bull, 40, 2080-2082
SetoT, YasudaI, AkiyamaK. 1992; Purgative activity and principals of the fruits of
Rosa multiflora and
R. wichuraiana. Chem Pharm Bull. 40:2080-2082.

KawakamiS, MatsunamiK, OtsukaH, KawahataM, YamaguchiK. 2009; Chemical constituents of imported rosae fructus. J Nat Med. 63:46-51


Park KH, Kim SK, Choi SE, Kwon JH, Oh MH, Lee MW (2010) Three new stereoisomers of condensed tannins from the roots of Rosa multiflora. Chem Pharm Bull, 58, 1227-1231
ParkKH, KimSK, ChoiSE, KwonJH, OhMH, LeeMW. 2010; Three new stereoisomers of condensed tannins from the roots of
Rosa multiflora. Chem Pharm Bull. 58:1227-1231


Park KH, Choi SE, Choi YW, Lee DI, Joo SS, Jeong MS, Bang H, Lee CS, Lee MK, Seo SJ, Lee MW (2011) Topical application of two condensed tannins from the root of Rosa multiflora Thunberg for the treatment of atopic dermatitis (AD) in NC/Nga mice, Phytother Res, 25, 1564-1569
ParkKH, ChoiSE, ChoiYW, LeeDI, JooSS, JeongMS, BangH, LeeCS, LeeMK, SeoSJ, LeeMW. 2011; Topical application of two condensed tannins from the root of
Rosa multiflora Thunberg for the treatment of atopic dermatitis (AD) in NC/Nga mice. Phytother Res. 25:1564-1569


Han JT (2006) Development of functional material using the root of Rosa multiflora, Food ind nutr, 11, 59-65
HanJT. 2006; Development of functional material using the root of
Rosa multiflora. Food ind nutr. 11:59-65.

Park GH, Lee JY, Kim DH, Cho YJ, An BJ (2011) Anti-oxidant and antiinflammatory effects of Rosa multiflora root. J Life Sci, 21, 1120-1126
ParkGH, LeeJY, KimDH, ChoYJ, AnBJ. 2011; Anti-oxidant and antiinflammatory effects of
Rosa multiflora root. J Life Sci. 21:1120-1126


BevanCD, MarshallPS. 1994; The use of supercritical fluids in the isolation of natural products. Nat Prod Rep. 11:451-466


ChesterTL, PinkstonJD, RaynieDE. 1994; Supercritical fluid chromatography and extraction. Anal Chem. 66:106-130.

ModeyWK, MulhollandDA, RaynorMW. 1995; Analytical supercritical fluid extraction of natural products. Phytochem Anal. 7:1-15.

McHughMA, KrukonisVJ. 1994; Supercritical fluid extraction: Principles and practice. 2nd edButterworth-Heinemann. Boston, MA, USA: p. 1-16.

HoyerGG. 1985; Extraction with supercritical fluids: why, how and so what. Chemtech. 7:440-448.

StahlE, QuirinKW, GerardD. 1988; Dense gases for extraction and refining. Springer VerlagBerlin, Germany:173.

ChoiYH, ParkEJ, KimYL, ChinYW, KimJW, JeonSH, JoungSN, YooKP. 1999; Selective extraction of cytotoxic substances from medicinal plants using supercritical carbon dioxide. Korean J Pharmacogn. 30:59-64.

DavidsonPM, ParishME. 1989; Methods for testing the efficacy of food antimicrobials. Food Technol. 43:148-155.

ReR, PellegriniN, ProteggenteA, PannalaA, YangM, Rice-EvansC. 1999; Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Rad Biol Med. 26:1231-1237


MosmannT. 1983; Rapid colorimetric assay for the cellular growth and survival. J Immunol Methods. 65:55-63.

FeelischM, StamlerJ. 1996; Methods in nitric oxide research. John Wiley & SonsChichester, UK:492-497.

Park SY, Hong SS, Han XH, Ro JS, Hwang BY (2005) Inhibitory constituents of LPS-induced nitric oxide production from Arctium lappa, Nat Prod Sci, 11, 85-88
ParkSY, HongSS, HanXH, RoJS, HwangBY. 2005; Inhibitory constituents of LPS-induced nitric oxide production from
Arctium lappa. Nat Prod Sci. 11:85-88.

FolinO, DenisW. 1912; On phosphotungstic-phosphomolybdic compounds as color reagent. J Biol chem. 12:239-243.

SteelRGD, TorrieJH. 1980; Principle and procedures of statistics. 1st edKogakusha, McGraw-Hill. Tokyo, Japan: p. 187-221.

LeeBE, YangJC, KimBA. 2016; A Study of Antioxidative and Antimicrobial Effects of Coffee Residue Extracts. J Korean Oil Chem Soc. 33:606-613


Lee IH, Kim MJ, Choi JH, Choi SH (2010) Antifungal effect of bilobalide and ginkgolide extracted from leaves of Ginkgo biloba Against Pityrosporum ovale, KSBB J, 25, 173-178
LeeIH, KimMJ, ChoiJH, ChoiSH. 2010; Antifungal effect of bilobalide and ginkgolide extracted from leaves of
Ginkgo biloba Against
Pityrosporum ovale. KSBB J. 25:173-178.

LeeSK. 2003; Antimicrobial effect of bamboo (Phyllosrachys Bambusoides) essential oil on Trichophyton and Pityrosporum. J Food Hyg Saf. 18:113-117.

KimSS, LeeSK, NahmDH, ParkHS. 2001; Trichophyton and asthma : specific IgE, IgG1 and IgG4 determination. Korean J Asthma Allergy Clin Immunol. 21:241-249.

Kivity S, Schwarz Y, Fireman E (1992) The association of perennial rhinitis with Trichophyton infection. Clin Exp Allergy, 22, 498-500
KivityS, SchwarzY, FiremanE. 1992; The association of perennial rhinitis with
Trichophyton infection. Clin Exp Allergy. 22:498-500


MillerNJ, Rice-EvansC, DaviesMJ, GopinathanV, MilnerA. 1993; A novel method for measuring antioxidant capacity and its application to monitoring the antioxidant status in premature neonates. Clinical Sci. 84:407-412.

KharitonovS, YatesD, RobbinsRA, Logan-SinclairR, ShinebourneEA, BarnesPJ. 1994; Increased nitric oxide in exhaled air of asthmatic patients. Lancet. 343:133-135


NakataniN. 1990; Recent advances in the study on natural antioxidants. Jpn Soc Food Sci Technol. 37:569-576


NozakiK. 1986; Current aspect and future condition of phytogenic antioxidants. Fragrance J. 6:99-106.