Article
건조 구기자의 추출조건에 따른 유리아미노산의 변화
이기동

Free amino acids extracted from dried Gugija (Lycium chinensis) under different extraction conditions
Gee-Dong Lee

Division of Integrated Biotechnology, Joongbu University, Geumsan 32713Korea
Copyright ⓒ The Korean Society of Food Preservation. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Mar 08, 2018; Revised: Apr 05, 2018; Accepted: Apr 09, 2018
요약
본 연구는 건조 구기자의 추출에 따른 유리아미노산의 변화를 모니터링 하고자 하였으며, 추출을 위한 조건변수는 에탄올 농도(X1, 0-80%) 및 추출 시간(X2, 1-5 h)이고, 종속변수로는 각각의 유리아미노산과 총 아미노산으로 반응표면분석을 실시하였다. 중심합성 실험계획의 중심점에서 유리아미노산은 asparagine 186.28, phosphoethanolamine 166.21, proline 46.51, alanine 43.35, aspartic acid 27.23, hydroxyproline 21.17, glutamic acid 16.53, taurine 16.24, arginine 14.66, serine 11.65, γ-amino-n-butyric acid 10.82, leucine 10.52, tryptophan 8.75, ethanolamine 8.49 mg/100 g 등의 순이었으며, 총 유리아미노산은 629 mg/100 g이었다. 유리아미노산 중 1-5%의 유의수준에서 유의성이 인정되는 methionine, arginine, histidine, carnosine, ornithine, aspartic acid, phosphoserine 및 γ-amino-n-butyric acid에 대한 회귀식의 R2는 각각 0.9418, 0.9074, 0.9463, 0.9691, 0.9685, 09052, 0.9305, 0.9810으로 분석되었다. 총 유리아미노산에 대한 회귀식의 R2는 0.8608로 10%의 유의수준에서 유의성이 인정되었다. 건조 구기자 유리아미노산의 추출 수율은 추출조건에 따라 282-641 mg/100 g의 넓은 범위로 나타났으며, 총 유리아미노산의 추출조건은 20% 에탄올용액으로 5시간 추출할 때 가장 많이 추출되었다.
Abstract
The amounts of free amino acids extracted from dried Gugija (Lycium chinensis Mill) were monitored under different extraction conditions. The response methodology was applied using the ethanol concentration (X1 0-80%) and extraction time (X2 1-5 h) as operational parameters with regard to various free amino acids (glycine, serine, alanine, threonine, proline, valine, methionine, isoleucine, leucine, tyrosine, tryptophan, phenylalanine, asparagine, lysine, arginine, histidine, carnosine, ornithine, aspartic acid, glutamic acid, phosphoserine, hydroxyproline, γ-amino-n-butyric acid, taurine, phosphoethanolamine, citrulline, β-alanine, β-amino-isobutyric acid, hydroxylysine, sarcocine, and ethanolamine) and their sum. Under the optimum conditions, the free amino acid contents were asparagine 186.28, phosphoethanolamine 166.21, proline 46.51, alanine 43.35, aspartic acid 27.23, hydroxyproline 21.17, glutamic acid 16.53, taurine 16.24, arginine 14.66, serine 11.65, γ-amino-n-butyric acid 10.82, leucine 10.52, tryptophan 8.75, ethanolamine 8.49, and total free amino acid 629 mg/100 g. The coefficients of determination (R2) of the models for methionine, arginine, histidine, carnosine, ornithine, aspartic acid, phosphoserine and γ-amino-n-butyric acid were within 0.9052-0.9810 (p<0.01-0.05). For the total free amino acids, the R2 of the model was 0.8608 (p<0.1), the extraction yield ranged from 282 to 641 mg/100 g depending on the extraction conditions and was the highest when extracted for 5 h with 20% ethanol.
Keywords: Gugija (Lycium chinensis Mill); extraction condition; free amino acid; response surface methodology; monitoring
서론
최근 구기자의 효능이 널리 알려지면서 구기자 가공제품이 다양하게 시판되고 있다. 구기자를 가공하는 대표적인 방법은 구기자 유용성분을 물로 추출하여 음료나 차로 마시는 것이다. 그러나 아직 구기자의 추출방법에 대한 구체적인 연구가 많이 이루어지지 않아 전통적인 열탕추출법에 크게 의존하고 있다.
청양 구기자의 유리아미노산은 18종이 보고되었고 serine이 가장 많았으나, methionine과 asparagine은 들어 있지 않았다(1). 청양 구기자의 채취시기와 품종에 따른 구기자순의 구성 아미노산이 19종류가 확인되었으며, aspartic acid, glutamic acid, glycine, alanine 등의 함량이 상대적으로 많은 것으로 보고되었다(2).
청양산 볶은 구기자를 이용한 구기자추출물 70%에 오미자추출물 10%를 첨가한 구기자음료의 아미노산은 16종류의 유리형의 구성 아미노산과 6종류의 유리형 비구성 아미노산이 보고되었으며, 구성 아미노산에서는 methionine이 가장 많았으며, 비구성 아미노산에서는 taurine 및 asparagine이 가장 많은 것으로 알려졌다(3).
진도산 구기자의 구성 아미노산은 aspartic acid 등 18종이 보고되었으며 threonine이 특별히 많았다. 당류는 과당이 가장 많았으며 포도당, 설탕 순으로 많은 것으로 보고되었다(4). 그러나 진도산 구기자에 대한 다른 연구는 aspartic acid와 asparagine이 가장 많다고 보고하였으며 methionine은 상대적으로 적은 함량이 확인되었다(5). 이것은 실험에 사용된 구기자 시료의 채취부위, 종류, 부위, 단백질의 가수분해 유무 및 가공에 따라 많은 차이를 보이고 있는 것이다(6,7).
이와 같이 아미노산이 풍부한 구기자는 오래전부터 장수식품으로 알려져 구기자 열매를 열탕에 끓여 그 추출물을 건강 기호식품인 차로 즐겨 먹어 왔다. 청양 구기자의 항산화성에 대한 다양한 연구가 이루어져 왔으며, 건조 구기자의 항산화성분에는 페놀성 화합물, 플라보노이드 및 안토시아닌 성분이 확인되었으며 플라보노이드와 같은 페놀성 화합물이 항산화 효과에 주로 관여하고 있는 것으로 밝혀졌다(8,9). 또한 구기자를 100℃에서 30분간 증자 후 상온에서 2시간 동안 말리는 과정을 4회 반복한 증포 구기자는 갈변물질이 아주 많이 발현되었으며, 이러한 갈변물질이 구기자 플라보노이드 보다 항산화 효능이 훨씬 더 많아 건조 구기자의 8배까지 증가한다는 것이 최근 보고되었다(10). 우리 선조들이 열탕으로 끓여 마시는 구기자차에는 항산화 효능이 우수한 갈변물질이 다량 함유되어 있어 구기자가 장수식품으로 지금껏 이어져 내려온 것으로 보인다.
따라서 본 연구에서는 청양군에서 가장 많이 생산 및 판매되는 건조 구기자의 추출 중 각종 유리아미노산의 변화를 모니터링 함으로써 아미노산 함량변화를 조사하고 그 아미노산이 갈변물질로 전환되거나 소실되는 동적변화를 알아보고자 하였다.
재료 및 방법
실험재료
본 실험에 사용된 구기자(Lycium chinensis Mill)는 충남 청양군 청양구기자농협에서 건조구기자를 구입하여 시료로 사용하였다. 구기자의 전처리는 건조 구기자를 분쇄기(Samsung Pharmaceutical Machine, Seoul, Korea)로 마쇄하여 20-40 메쉬 분말을 추출시료로 사용하였다.
실험계획 및 반응표면분석
추출조건은 환류냉각기에 부착한 250 mL 둥근플라스크에 구기자 분말 20 g과 추출용매 200 mL를 넣고 70℃에서 일정 시간 추출하였다. 이 때 추출용매의 에탄올 농도와 추출 시간은 실험계획에 따라 설정하였다.
건조 구기자의 추출조건에 따른 각각의 유리아미노산 및 그 유도체의 변화를 모니터링하기 위한 실험계획은 중심합성계획법(11)에 의하여 설계하였고, 중심합성 실험계획에 따라 추출용매로서 에탄올의 농도(0, 20, 40, 60, 80%) 및 추출 시간(1, 2, 3, 4, 5 h)은 -2, -1, 0, 1, 2 다섯 단계로 부호화 하였으며, 실험계획은 Table 1에 나타내었다. 종속변수로는 31종류의 유리 아미노산과 그 유도체로 하였으며, 반응표면분석을 위한 각각의 유리아미노산 함량은 3회 반복 분석한 수치를 평균하여 사용하였다. 반응표면 회귀분석을 위해서는 SAS program(Statistical Analysis System, ver. 8.01, SAS Institute Inc., Cary, NC, USA)을 사용하였다.
Table 1. .
Central composite design for response surface analysis
|
Exp. No.1)
|
Extraction conditions |
|
Ethanol concentration (%) |
Extraction time (h) |
|
1 |
60 (1) |
4 (1) |
|
2 |
60 (1) |
2 (-1) |
|
3 |
20 (-1) |
4 (1) |
|
4 |
20 (1) |
2 (-1) |
|
5 |
40 (0) |
3 (0) |
|
6 |
40 (0) |
3 (0) |
|
7 |
80 (2) |
3 (0) |
|
8 |
0 (-2) |
3 (0) |
|
9 |
40 (0) |
5 (2) |
|
10 |
40 (0) |
1 (-2) |
Download Excel Table
유리 아미노산 함량 측정
구기자추출물의 아미노산분석을 위한 시료는 구기자분말을 중심합성 실험계획에 따라 물 또는 에탄올용액으로 추출하여 상등액을 취하였다. 상등액은 0.2 μm membrane filter(Millipore Co., MA, USA)로 여과한 후 아미노산 자동분석기(Sykam GmbH, S430-H, Germany)를 사용하여 Table 2와 같은 조건으로 유리 아미노산 함량을 측정하였다. Column은 cation separation column(LCA K07/Li)을 사용하였으며, 크기는 4.6×150 mm이었고, 온도는 37-74℃이었고, 완충용액과 o-phthalal aldehyde(OPA)시약의 flow rate는 각각 0.45 mL/min, 0.25 mL/min이었으며, 이때 완충용액의 pH 범위는 2.90-7.95이었고, 파장은 440 nm 및 570 nm을 적용하였다.
Table 2. .
Operating conditions of amino acid auto-analyzer
|
Instrument |
S430 (SYKAM) |
|
Column |
Cation separation column (LCA K07/Li) |
|
Column size |
4.6×150 mm |
|
Column temperature |
37-74℃ |
|
Flow rate |
Buffer 0.45 mL/min, reagent 0.25 mL/min |
|
Buffer pH range |
2.90-7.95 |
|
Wave length |
440 nm and 570 nm |
Download Excel Table
결과 및 고찰
중성 유리아미노산의 변화
건조 구기자의 추출에 따른 중성 유리아미노산의 변화를 관찰해 본 결과, 에탄올 농도 및 추출 시간의 변화에 따른 유리아미노산의 변화가 다소 있는 것으로 나타났다(Table 3). Glycine은 0.78-1.32 mg/100 g로 에탄올의 농도와 추출 시간에 따라 변화가 많았으나 상대적으로 그 함량이 높지 않았으며, serine은 4.06-12.37 mg/100 g로 큰 변화가 있었으며, alanine과 proline은 28.86-44.71과 36.72-54.28 mg/100 g으로 변화의 폭은 크지 않았으나 그 함량이 높게 나타났다. Threonine, valine, methionine, isoleucine, leucine, tyrosine, tryptophan, phenylalanine 등도 에탄올의 농도와 추출시간에 따라 함량의 변화가 많았으며, 특히 asparagine은 72.77-198.82 mg/100 g으로 큰 차이를 보이고 그 함량도 유리아미노산 중에서 가장 많은 것으로 나타났다. Oh 등(1)은 청양산 구기자의 구성 아미노산을 분석하여 serine이 가장 많이 분석되었다고 보고하였으나, 본 연구에서는 상대적으로 serine 함량이 적었고 alanine, proline, asparagine 등이 많았다. 이렇게 차이가 나는 것은 단백질을 가수분해한 구성 아미노산과 에탄올용액으로 추출한 유리아미노산의 차이로 여겨진다.
Table 3. .
Experimental data on free amino acids of the dried Gugija (Lycium chinensis Mill) under different conditions based on central composite design for response surface analysis (unit: mg/100 g)
|
Amino acids |
The number of experimental conditions by central composite design |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
Glycine |
0.9521)
|
0.782 |
1.138 |
1.038 |
1.176 |
1.266 |
0.525 |
1.183 |
1.322 |
1.166 |
|
Serine |
7.687 |
7.472 |
9.544 |
9.335 |
12.367 |
10.894 |
4.055 |
9.628 |
9.868 |
10.689 |
|
Alanine |
35.226 |
33.485 |
42.379 |
37.864 |
44.006 |
42.788 |
28.859 |
41.440 |
44.705 |
42.139 |
|
Threonine |
3.838 |
3.017 |
4.548 |
3.647 |
6.044 |
5.544 |
2.805 |
3.956 |
5.161 |
4.595 |
|
Proline |
37.999 |
37.283 |
45.311 |
40.548 |
47.235 |
46.856 |
36.722 |
45.045 |
54.286 |
47.508 |
|
Valine |
3.502 |
3.159 |
4.279 |
3.530 |
4.273 |
4.112 |
3.046 |
4.420 |
4.512 |
4.018 |
|
Methionine |
1.128 |
1.019 |
1.942 |
1.957 |
1.485 |
1.408 |
1.081 |
2.180 |
1.139 |
1.103 |
|
Isoleucine |
3.796 |
3.758 |
4.527 |
4.158 |
4.872 |
4.980 |
2.890 |
4.942 |
5.106 |
4.976 |
|
Leucine |
7.968 |
7.386 |
9.332 |
8.450 |
10.756 |
10.361 |
4.689 |
11.351 |
11.639 |
9.342 |
|
Tyrosine |
2.670 |
2.570 |
2.546 |
2.499 |
3.411 |
3.320 |
2.245 |
3.443 |
3.670 |
3.206 |
|
Tryptophan |
5.466 |
6.331 |
7.217 |
6.522 |
8.206 |
9.147 |
4.659 |
7.964 |
8.637 |
8.495 |
|
Phenylalanine |
2.876 |
2.644 |
3.316 |
2.613 |
3.325 |
3.371 |
2.884 |
3.752 |
3.447 |
3.126 |
|
Asparagine |
137.434 |
129.485 |
180.657 |
154.911 |
184.309 |
188.246 |
72.773 |
188.601 |
198.823 |
179.654 |
|
Lysine |
0.000 |
0.000 |
0.000 |
0.000 |
0.000 |
3.344 |
0.417 |
1.968 |
1.831 |
1.754 |
|
Arginine |
10.675 |
10.238 |
14.445 |
12.436 |
14.749 |
14.570 |
3.538 |
15.371 |
15.647 |
14.718 |
|
Histidine |
2.439 |
2.195 |
3.920 |
2.948 |
3.548 |
3.535 |
0.762 |
3.993 |
3.955 |
3.088 |
|
Carnosine |
0.423 |
0.577 |
0.875 |
0.831 |
0.868 |
0.815 |
0.150 |
0.788 |
0.744 |
0.969 |
|
Ornithine |
0.322 |
0.325 |
0.467 |
0.474 |
0.425 |
0.474 |
0.080 |
0.408 |
0.458 |
0.342 |
|
Aspartic acid |
17.326 |
17.967 |
25.680 |
21.396 |
28.121 |
27.433 |
5.427 |
24.590 |
27.509 |
26.153 |
|
Glutamic acid |
11.049 |
10.080 |
14.239 |
13.335 |
18.010 |
15.455 |
6.031 |
14.158 |
15.634 |
16.206 |
|
Phospho-serine |
2.915 |
3.293 |
3.071 |
3.382 |
4.037 |
3.600 |
1.240 |
2.721 |
3.070 |
4.016 |
|
Hydroxy-proline |
18.386 |
19.348 |
21.495 |
17.157 |
21.282 |
21.039 |
27.225 |
22.365 |
18.161 |
16.505 |
|
γ-Amino-n-butyric acid |
7.974 |
7.974 |
10.292 |
9.311 |
10.870 |
10.765 |
4.654 |
9.013 |
9.047 |
8.580 |
|
Taurine |
11.890 |
12.211 |
7.106 |
5.649 |
16.365 |
16.197 |
4.293 |
16.140 |
16.335 |
17.077 |
|
Phospho-ethanolamine |
116.327 |
123.172 |
143.651 |
139.262 |
167.690 |
165.423 |
59.577 |
152.121 |
160.083 |
174.814 |
|
Citrulline |
1.211 |
1.173 |
1.360 |
1.078 |
1.443 |
1.074 |
1.074 |
1.335 |
1.449 |
1.355 |
|
β-Alanine |
0.019 |
0.000 |
0.031 |
0.000 |
0.031 |
0.000 |
0.000 |
0.000 |
0.030 |
0.000 |
|
β-Amino-isobutyric acid |
0.068 |
0.000 |
0.000 |
0.000 |
0.000 |
0.000 |
0.000 |
0.000 |
0.000 |
0.000 |
|
Hydroxy-lysine |
0.000 |
0.000 |
0.117 |
0.100 |
0.000 |
0.100 |
0.050 |
0.118 |
0.102 |
0.135 |
|
Sarcocine |
0.887 |
0.858 |
1.078 |
1.249 |
5.646 |
1.082 |
0.653 |
1.136 |
0.903 |
0.999 |
|
Ethanolamine |
13.312 |
12.860 |
16.500 |
14.060 |
16.492 |
0.440 |
0.038 |
0.092 |
0.088 |
0.045 |
|
Total amino acids |
465.762 |
460.662 |
581.061 |
519.740 |
641.041 |
617.641 |
282.439 |
594.221 |
627.358 |
606.770 |
Download Excel Table
중성 유리아미노산에 대한 회귀분석 결과(Table 4,5), methionine만이 R2가 0.9418로 유의수준 5% 이내에서 유의성이 인정되었으며, asparagine, glycine 및 serine은 R2가 0.8843, 0.8672 및 0.8390으로 유의수준 10% 이내에서 유의성이 인정되었다. 그러나 나머지 중성 유리아미노산은 유의성이 인정되지 않았으나 tyrosine을 제외하고는 R2가 높은 편이었다. 추출변수인 에탄올 함량과 추출 시간이 중성 유리아미노산에 미치는 영향을 알아보고자 회귀분석을 통해 F값을 구해 본 결과(Table 5), glycine, serine, alanine, methionine, asparagine 등 중성 아미노산이 에탄올 함량의 영향이 높게 나타났으나 추출 시간의 영향은 미미하였다.
Table 4. .
Polynomial equations calculated by RSM program for free amino acids of the dried Gugija
|
Responses |
Parameters of polynomial equations1)
|
|
β0
|
β1
|
β2
|
β11
|
β12
|
β22
|
|
Glycine |
1.214500 |
0.006150 |
-0.088500 |
-0.000201 |
0.000875 |
0.017000 |
|
Serine |
7.157006 |
0.154630 |
1.243893 |
-0.002710 |
0.000075 |
-0.224732 |
|
Alanine |
35.778729 |
0.304895 |
0.540125 |
-0.004422 |
-0.034675 |
0.299313 |
|
Threonine |
1.521259 |
0.091370 |
1.137923 |
-0.001294 |
-0.00100 |
-0.143348 |
|
Proline |
45.465372 |
0.258110 |
-4.817196 |
-0.002747 |
-0.050587 |
1.404491 |
|
Valine |
3.587262 |
0.015135 |
0.062619 |
-0.000202 |
-0.005075 |
0.052286 |
|
Methionine |
1.665110 |
-0.028874 |
0.483101 |
0.000097 |
0.001550 |
-0.088545 |
|
Isoleucine |
4.613464 |
0.031921 |
-0.226774 |
-0.000517 |
-0.004137 |
0.074643 |
|
Leucine |
9.017432 |
0.049358 |
0.061315 |
-0.001297 |
-0.003750 |
0.098920 |
|
Tyrosine |
3.428280 |
0.005174 |
-0.337952 |
-0.000204 |
0.000663 |
0.066839 |
|
Tryptophan |
5.717432 |
0.117208 |
0.237982 |
-0.001179 |
-0.019500 |
0.091920 |
|
Phenylalanine |
2.601688 |
0.003612 |
0.260792 |
0.000064 |
-0.005887 |
0.017688 |
|
Asparagine |
150.731467 |
1.874236 |
0.817589 |
-0.030726 |
-0.222463 |
2.347277 |
|
Arginine |
12.686429 |
0.173718 |
-0.300048 |
-0.002978 |
-0.019650 |
0.240786 |
|
Histidine |
2.084476 |
0.043981 |
0.481262 |
-0.000661 |
-0.009100 |
0.021429 |
|
Carnosine |
0.703092 |
0.016711 |
-0.002577 |
-0.000219 |
-0.002475 |
0.009152 |
|
Ornithine |
0.233423 |
0.006338 |
0.099393 |
-0.000131 |
0.0000500 |
-0.013982 |
|
Aspartic acid |
13.596723 |
0.560666 |
2.801315 |
-0.007310 |
-0.061562 |
0.031795 |
|
Glutamic acid |
12.926979 |
0.196396 |
0.092375 |
-0.003668 |
0.000813 |
-0.010687 |
|
Phospho-serine |
2.484473 |
0.079266 |
0.178149 |
-0.001126 |
-0.000838 |
-0.059955 |
|
Hydroxy-proline |
5.814036 |
0.024904 |
8.084690 |
0.002632 |
-0.06625 |
-0.812893 |
|
γ-Amino-n-butyric acid |
2.5708881 |
0.178305 |
3.489726 |
-0.002413 |
-0.012262 |
-0.474107 |
|
Taurine |
12.667009 |
0.237720 |
-2.199411 |
-0.002781 |
-0.022225 |
0.509902 |
|
Phospho-ethanolamine |
144.568033 |
2.204564 |
-7.380673 |
-0.034192 |
-0.140425 |
1.722973 |
|
Citrulline |
1.157295 |
0.008373 |
-0.083220 |
-0.000020 |
-0.003050 |
0.041259 |
|
Hydroxy-lysine |
0.291342 |
-0.002839 |
-0.107494 |
0.000025 |
-0.000213 |
0.018652 |
|
Sarcocine |
-3.491330 |
0.093448 |
3.009363 |
-0.001342 |
0.002500 |
-0.522866 |
|
Ethanolamine |
-25.352872 |
0.617540 |
18.091613 |
-0.007022 |
-0.024850 |
-2.808242 |
|
Total amino acids |
458.077863 |
7.309615 |
24.758381 |
-0.106576 |
-0.702763 |
2.053089 |
Download Excel Table
Table 5. .
Coefficient of determination value of polynomial equations and analysis of variance for the dried Gugija
|
Responses |
R2
|
Pr>F |
Morphology |
F-value |
|
Ethanol concentration (%) |
Extraction time (h) |
|
Glycine |
0.8672 |
0.0672 |
Saddle point |
6.91**1)
|
0.65 |
|
Serine |
0.8390 |
0.0957 |
Maximum |
6.60**
|
0.17 |
|
Alanine |
0.8314 |
0.1041 |
Saddle point |
5.31*
|
0.45 |
|
Threonine |
0.6401 |
0.3772 |
Maximum |
2.03 |
0.37 |
|
Proline |
0.6897 |
0.2985 |
Saddle point |
1.29 |
1.01 |
|
Valine |
0.7639 |
0.1889 |
Saddle point |
3.12 |
0.99 |
|
Methionine |
0.9418 |
0.0140 |
Saddle point |
18.15***
|
1.86 |
|
Isoleucine |
0.7708 |
0.1795 |
Saddle point |
3.65 |
0.19 |
|
Leucine |
0.7702 |
0.1802 |
Saddle point |
3.65 |
0.47 |
|
Tyrosine |
0.3778 |
0.7757 |
Saddle point |
0.49 |
0.16 |
|
Tryptophan |
0.6372 |
0.3819 |
Saddle point |
1.93 |
0.14 |
|
Phenylalanine |
0.5276 |
0.5590 |
Saddle point |
1.02 |
0.61 |
|
Asparagine |
0.8843 |
0.0519 |
Saddle point |
8.57**
|
0.51 |
|
Arginine |
0.9074 |
0.0341 |
Saddle point |
11.23**
|
0.36 |
|
Histidine |
0.9463 |
0.0119 |
Saddle point |
20.30***
|
2.31 |
|
Carnosine |
0.9691 |
0.0040 |
Saddle point |
35.52***
|
2.85 |
|
Ornithine |
0.9685 |
0.0042 |
Maximum |
38.97***
|
2.24 |
|
Aspartic acid |
09052 |
0.0356 |
Saddle point |
11.22**
|
0.30 |
|
Glutamic acid |
0.8070 |
0.1327 |
Maximum |
4.92*
|
0.00 |
|
Phosphoserine |
0.9305 |
0.0197 |
Maximum |
14.20**
|
2.07 |
|
Hydroxyproline |
0.8264 |
0.1097 |
Saddle point |
2.76 |
1.88 |
|
γ-Amino-n-butyric acid |
0.9810 |
0.0016 |
Maximum |
67.99***
|
10.17**
|
|
Taurine |
0.2608 |
0.9011 |
Saddle point |
0.28 |
0.04 |
|
Phosphoethanolamine |
0.8631 |
0.0711 |
Saddle point |
6.94**
|
0.15 |
|
Citrulline |
0.5303 |
0.5548 |
Saddle point |
0.60 |
0.89 |
|
Hydroxylysine |
0.6182 |
0.4127 |
Minimum |
1.59 |
0.79 |
|
Sarcocine |
0.3285 |
0.8343 |
Maximum |
0.50 |
0.46 |
|
Ethanolamine |
0.3346 |
0.8275 |
Maximum |
0.50 |
0.49 |
|
Total amino acids |
0.8608 |
0.0733 |
Saddle point |
7.21**
|
0.16 |
Download Excel Table
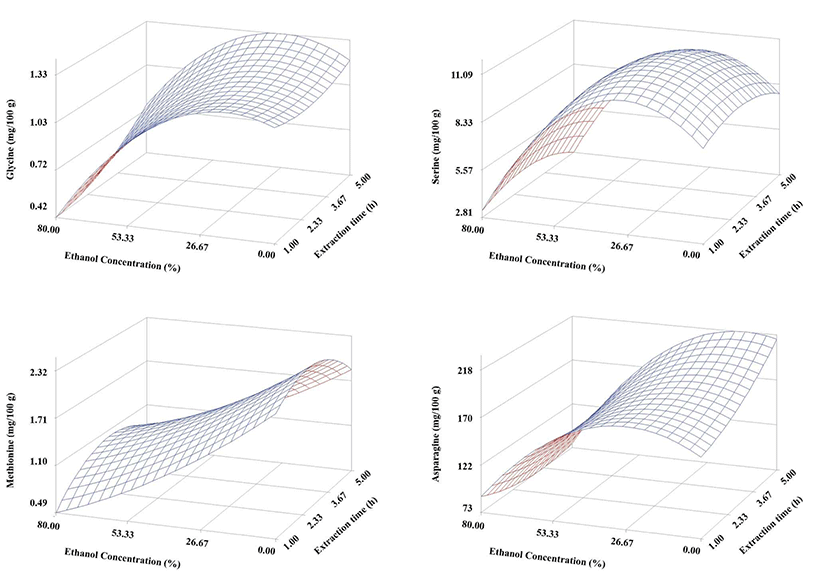
유의성이 인정되는 glycine, serine, methionine 및 asparagine의 반응표면만을 관찰해 보면(Fig. 1), glycine은 에탄올 함량 30%까지는 에탄올 함량 증가에 따른 변화가 없었으나 30% 이상의 에탄올 함량에서는 급격히 감소하는 경향을 보이고 있다. 상대적으로 추출 시간의 영향은 크지 않았으나 4시간까지는 다소 줄어드는 것처럼 보였으나 4시간 이상에서는 glycine 함량이 다소 증가하는 것을 볼 수 있었다. Serine은 에탄올 30%까지는 에탄올 함량이 증가할수록 증가하다가 30% 이상에서는 급격히 감소하는 반응표면을 보였다. 그러나 glycine과는 반대로 3시간까지는 추출 시간이 증가할수록 증가하다가 그 이상에서는 다소 감소하는 경향을 나타내었다. 이것은 고온 장시간 추출시 serine이 갈색화 반응에 관여하는 것으로 여겨진다. Methionine은 특이적으로 에탄올 함량과 반비례적으로 감소하는 경향을 나타내어 추출 수율이 에탄올 함량에 크게 영향을 받고 있는 것을 볼 수 있었다. Asparagine은 glycine과 유사한 경향을 나타내었으나 추출 시간이 증가할수록 완만하게 증가하는 경향을 나타내었다. 이러한 경향은 수용액이든 에탄올용액이든 관계없이 asparagine이 천천히 추출된다는 것을 보여주고 있다.
Fig. 1.
Response surfaces for neutral amino acids of the dried Gugija as a function of extraction ethanol concentration and time.
Download Original Figure
염기성 유리아미노산의 변화
건조 구기자의 추출에 따른 염기성 유리아미노산의 변화를 관찰해 본 결과(Table 3), 에탄올 농도 및 추출 시간에 따라 lysine은 0.00-3.34 mg/100 g로 함량 변화가 아주 크게 나타났으며, lysine이 검출되지 않는 시료도 많았다. Arginine은 3.54-15.65 mg/100 g로 큰 변화가 있었으며, histidine은 0.762-3.99 mg/100 g로 변화의 폭은 크게 나타났으며, 염기성 유리아미노산이 상대적으로 에탄올과 고온추출에 변화가 큰 것으로 나타났다. 단백질을 구성하지 않은 아미노산 중 염기성을 띠고 있는 ornithine과 carnosine은 각각 0.08-0.47 mg/100 g, 0.15-0.97 mg/100 g로 변화가 큰 편이었으나 그 함량은 많지 않았다.
염기성 유리아미노산에 대한 회귀분석 결과(Table 4,5), lysine은 유의성이 인정되지 않으나 arginine과 histidine은 R2가 각각 0.9074, 0.9465로 유의수준 5% 이내에서 유의성이 인정되었다. Ornithine과 carnosine은 R2가 각각 0.9685, 0.9691로 유의수준 1% 이내에서 유의성이 인정되었다. 추출변수인 에탄올 함량과 추출 시간이 염기성 유리아미노산에 미치는 영향을 알아보고자 회귀분석을 통해 F값을 구해 본 결과(Table 5), 대부분의 염기성 아미노산이 에탄올 함량의 영향이 높게 나타났으나 추출 시간의 영향은 미미하였다.
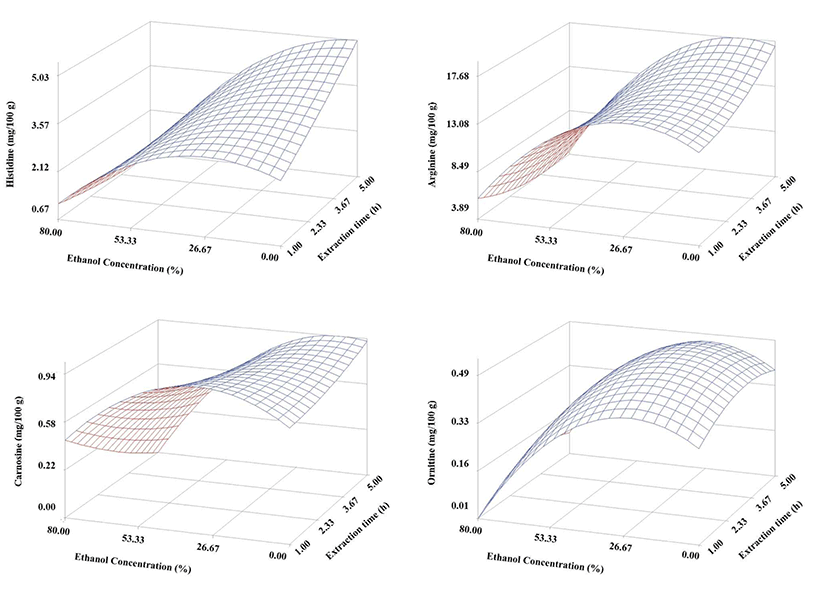
건조 구기자의 추출에 따른 염기성 유리아미노산 중에서 유의성이 인정되는 arginine, histidine, carnosine 및 ornithine의 반응표면만을 관찰해 보면(Fig. 2), histidine은 에탄올 함량 20% 이상에서는 급격히 감소하는 경향을 보이고 있으며 높은 에탄올 농도에서는 추출시간이 길어질수록 더 많이 감소하는 경향을 나타내었다. 그러나 에탄올 함량 30% 이하에서는 추출시간이 경과할수록 점점 더 histidine이 증가하는 경향을 나타내었다. Arginine과 carnosine 또한 histidine과 유사한 경향의 반응표면을 보이고 있어 염기성 아미노산은 추출속도가 낮아 장시간 추출해야 충분히 추출할 수 있는 것으로 보인다. 그러나 에탄올 함량이 많은 조건에서 장시간 추출하면 아미노산의 R기에 아미노기가 2개 이상인 염기성 아미노산이 소실될 수도 있을 것으로 여겨진다. 그러나 R기에 아미노기가 하나인 ornithine은 histidine, carnosine 및 ornithine과는 다소 다른 경향을 나타내어 에탄올 함량이 많은 조건에서 안정적이나 수용액에서 단시간 추출로 쉽게 추출되어 나오는 것으로 보인다.
Fig. 2.
Response surfaces for basic amino acids of the dried Gugija as a function of extraction ethanol concentration and time.
Download Original Figure
산성 유리아미노산과 단백질 비구성 아미노산의 변화
추출과정 중 산성 유리아미노산의 변화를 관찰해 본 결과, 에탄올 농도 및 추출 시간의 변화에 따라 aspartic acid는 5.43-28.12 mg/100 g로 에탄올의 농도와 추출 시간에 따라 큰 변화가 있었으며, glutamic acid도 6.03-16.21 mg/100 g로 변화의 폭이 컸다(Table 3). Sung 등(5)은 진도산 구기자 아미노산에서 aspartic acid와 asparagine이 가장 많이 분석되었다고 보고하여 본 연구와 유사한 것을 볼 수 있었다. 단백질을 구성하지 않는 아미노산으로는 phosphoserine, hydroxyproline, γ-amino-n-butyric acid, ornithine, taurine, phosphoethanolamine, citrulline, β-alanine, β-amino-isobutyric acid, carnosine, hydroxylysine, sarcocine, ethanolamine 등이 검출되었으며, 그 중에서 phosphoethanolamine이 59.58-174.81 mg/100 g로 가장 많은 함량이 추출되었다. 다음으로 hydroxyproline, taurine, γ-amino-n-butyric acid, phosphoserine, citrulline의 순으로 많이 추출되었다. 그 이외 β-alanine, β-amino-isobutyric acid, hydroxylysine, sarcocine, ethanolamine 등은 미량 추출되었다(Table 3).
산성 유리아미노산 및 단백질을 구성하지 않는 유리아미노산에 대한 회귀분석 결과(Table 4,5), γ-amino-n-butyric acid의 R2가 0.9810으로 유의수준 1% 이내에서 유의성이 인정되었으며, phosphoserine 및 phosphoethanolamine의 R2가 각각 0.9305, 0.8631로 유의수준 5%, 10% 이내에서 유의성이 인정되었다. 그러나 나머지 단백질을 구성하지 않는 유리아미노산은 유의성이 인정되지 않았다. 추출변수인 에탄올 함량과 추출 시간이 유리아미노산에 미치는 영향을 알아보고자 회귀분석을 통해 F값을 구해 본 결과(Table 5), 산성 아미노산과 phosphoserine, γ-amino-n-butyric acid, phosphoethanolamine 등 비구성 유리아미노산이 에탄올 함량의 영향이 높게 나타났으나 추출 시간의 영향은 미미하였다. 그러나 γ-amino-n-butyric acid만이 추출 시간의 영향도 높게 나타났으며 5%의 유의수준에서 유의성이 인정되었다.
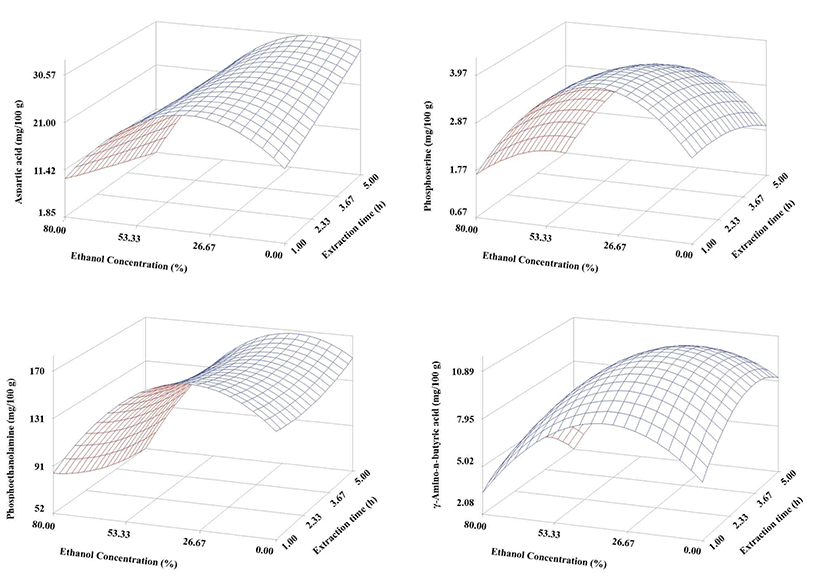
구기자의 추출에 따른 aspartic acid, phosphoserine, phosphoethanolamine 및 γ-amino-n-butyric acid는 에탄올 함량 30% 이상에서는 급격히 감소하는 경향을 보이고 있으며 높은 에탄올 농도에서는 추출 시간이 길어질수록 더 많이 감소하는 경향을 나타내었다. 그리고 aspartic acid와 phosphoethanolamine은 에탄올 함량 30% 이하에서는 추출 시간이 경과할수록 점점 더 증가하는 경향을 나타내었으나, phosphoserine과 γ-amino-n-butyric acid는 추출 시간이 2시간 이상 경과시 감소하는 경향을 나타내었다(Fig. 3). 이러한 경향은 다른 아미노산으로 전환되거나 소실되는 것으로 여겨진다.
Fig. 3.
Response surfaces for acidic amino acids and others of the dried Gugija as a function of extraction ethanol concentration and time.
Download Original Figure
총 유리아미노산의 변화
건조 구기자의 추출과정 중 총 유리아미노산의 변화를 관찰해 본 결과, 에탄올 농도 및 추출 시간의 변화에 따라 282-641 mg/100 g로 나타나 추출에 따라 많은 함량변화가 있었다(Table 3).
총 유리아미노산에 대한 회귀분석 결과(Table 4,5), R2는 0.8608로 유의수준 10% 이내에서 유의성이 인정되었다. 추출변수인 에탄올 함량과 추출 시간이 총 유리아미노산에 미치는 영향을 알아보고자 회귀분석을 통해 F값을 구해 본 결과(Table 5), 에탄올 함량의 영향이 높게 나타나 5%의 유의수준에서 유의성이 인정되었다.
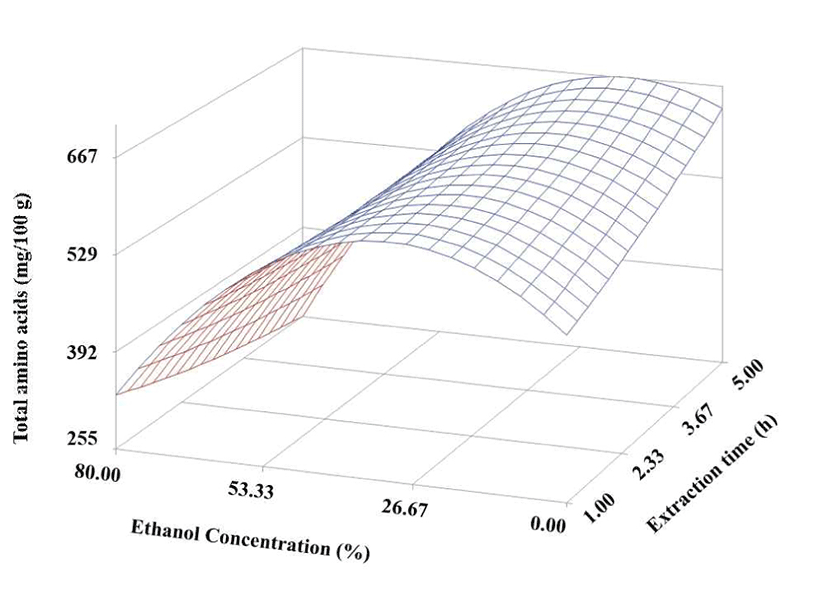
구기자의 추출에 따른 총 아미노산은 염기성 아미노산과 같이 에탄올 함량 30% 이상에서는 급격히 감소하는 경향을 보이고 있으며, 높은 에탄올 농도에서는 추출 시간이 길어질수록 더 많이 감소하는 경향을 나타내었으나 에탄올 함량 30% 이하에서는 추출 시간이 경과할수록 점점 더 증가하는 경향을 나타내었다(Fig. 4). 총 유리아미노산의 추출 수율은 20% 에탄올용액으로 5시간 추출할 때 가장 많이 추출되는 것으로 나타났다.
Fig. 4.
Response surface for total amino acids of the dried Gugija as a function of extraction ethanol concentration and time.
Download Original Figure