ARTICLE
국내 생막걸리에서 분리한 야생 효모의 특성
정수지, 여수환, 문지영, 최한석, 백성열*
Characteristics of wild yeast isolated from non-sterilized Makgeolli in Korea
Su Ji Jung, Soo-Hwan Yeo, Ji-Young Mun, Han-Seok Choi, Seong Yeol Baek*
Department of Agro-food Resource, National Institute of Agricultural Science, Wanju 55365, Korea
© The Korean Society of Food Preservation. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Sep 29, 2017; Revised: Nov 13, 2017; Accepted: Nov 14, 2017
Abstract
Wild yeasts were isolated from domestic non-sterilized Makgeolli and their fermentation characteristics were analyzed to select the best fermentation seed culture. A total of 65 yeast strains isolated yeasts from non-sterilized Makgeolli and Nuruk. In order to select fermentable strains, hydrogen sulfide, CO2 production ability, alcohol tolerance and aroma component production ability were analyzed. To screen the aromatic strains of isolates, media containing cerulenin, 5,5,5-trifluor-DL-leucine (TFL) and API ZYM kit were used. There were 36 strains resistance to cerulenin and all strains produced esterase and demonstrated tolerance against TFL. Hydrogen sulfide, which could degrade the quality of the fermented beverage, was not produced in 34 yeast. The correlation between alcohol tolerance of yeast and carbon dioxide production was analyzed by principal component analysis. YM22, YM31, YM32 and YM37 produced a total of 0.14-0.18 g/72 h of CO2 indicating high fermentability. Alcohol tolerance was measured by alcohol concentration. YM32, YM37 yeast had 20% alcohol tolerance. As a result, alcohol and flavor characteristics of wild yeast isolated from non-sterilized Makgeolli were analyzed and it was confirmed that yeast was suitable for the production of alcohol.
Keywords: Makgeolli; fermentation; wild yeast; yeast flavor
서 론
막걸리 및 청주, 약주 등 한국의 전통주는 찹쌀, 멥쌀의 전분질을 원료로 하고, 발효제로써 누룩을 첨가하여 술덧 을 혼탁하게 제성한 것으로(1) 당화와 발효가 동시에 일어 나는 병행복발효주이다(2). 막걸리의 원료인 누룩은 자연 에서 유래한 미생물로 곰팡이, 효모, 젖산균 등 미생물의 종류와 그 비율이 다양하다(3). 전통주는 양조시 젖산균, 곰팡이 등으로 인한 효소작용으로 원료 성분이 분해되면서 당, 아미노산, 유기산 등이 생성되고(4) 효모의 유리 아미노 산과 핵산 물질이 분해되어 알코올 발효 시 정미성분 형성 으로 품질의 조화를 이룬다(4,5). 이러한 미생물의 다양성 은 효소 활성, 알코올 발효력, 유기산과 유리 아미노산 함량 등에서 차이를 나타나게 되고 이는 우리 술의 맛, 향기, 색 등의 품질 특성에 영향을 미친다(6).
누룩이 생산된 지역의 기후나 풍토, 제조 환경 등에 따라 특색 있는 야생 효모가 있으며, 효모에 의한 발효는 탁주의 맛을 좌우하는 여러 요인 중 하나로 고유의 향미를 생성한 다고 알려져 있다(7,8). 지역에 따라 옥수수, 고구마, 보리 (10) 유자(11), 배(12), 포도(13) 등 다양한 잡곡류 및 과채류 의 첨가로 차별화된 막걸리가 제조된다(14). 이로 인해 막걸 리에는 수없이 다양한 조합과 조성의 우리나라 토착 미생물 들이 함유되어 있고 다양한 연구를 통해 누룩 및 막걸리 유래의 미생물이 분리 동정 되었다(3,15). Park과 Chung(16) 은 누룩의 젖산균 분리 동정 및 품질특성을 보고하였고, Lee 등(3)는 18속 97종의 곰팡이와 15속 47종의 효모, 6속 19종의 세균을 보고한 바 있다. 또한 Choi 등(6), Jeong 등(7), Baek 등(8)은 누룩과 막걸리의 다양한 원료물질들로부터 기인하는 균주의 특성을 보고하였다. 이러한 토착 미생물 들을 보존 및 활용하는 연구가 많아지면서, 막걸리 유래의 미생물과 대사산물의 다양한 생리활성 및 기능성이 새롭게 주목받고 있다(14).
본 연구에서는 2015년도에 개최된 우리 술 품평회에서 입상한 다양한 지역의 생막걸리를 수집하여 야생 효모를 분리 동정하였다. 또한, 이들의 배양특성, 생리특성 및 발효 특성을 조사하여 고부가가치 발효 스타터 개발 가능성을 연구하였다.
재료 및 방법
사용 균주
본 실험에 사용한 효모는 전국에서 수집한 34종의 생막 걸리에서 분리된 야생 효모 61균주와 누룩에서 분리된 야 생 효모 1균주를 사용하였다. 비교 균주로 시판 효모인 Fermivin(Saccharomyces cerevisiae, Oenobrands SAS, France), 송천효모(SCY, S. cerevisiae, Songcheon Yeast, Cheongyang, Korea), 충무효모(CM, S. cerevisiae, Chungmu Fermentation Ltd., Ulju, Korea)를 사용하였다. 누룩 10 g을 0.85% NaCl 90 mL 용액에 현탁한 후 YPD 한천 배지에 100 μL 도말하여 30℃에서 24-48시간 배양 하였고, 막걸리 도 YPD 한천 배지에 100 μL씩 분주하여 같은 방법으로 배양하였다. 그리고 YPD 한천 배지에 계대 배양 하여 순수 분리된 효모를 YPD 액체배지에 배양 후 글리세롤 20% 함유하도록 첨가해 -80℃에 보관하여 stock으로 실험에 사 용하였다. 실험에 사용된 배양 배지는 YPD 고체 및 액체배 지(YPD, BD, Franklin Lakes, NJ, USA)를 사용하였고, 실험 에 따라 YPD 한천배지에 배양 후 4℃ 보관하여 실험에 사용하였다.
균주 동정
분리 효모의 동정은 26S rDNA 유전자의 D1/D2 부위 염기서열을 분석하였다. 프라이머는 NL1(5'-GCATATCAATAAGCGGAGGAAAAG- 3') 및 NL4(5'-GGTCCGTGTTTCAAGACGG- 3')을 사용하였고, PCR은 initial denaturation 5분, 그리고 94℃에서 45초간 denaturation, 55℃에서 60초간 annealing 및 72℃에서 60초간 extension cycle을 35회 수행 하였다. PCR 산물의 염기서열은 ㈜ZENOTECH사에 의뢰 하였다. National Center for Biotechnology Information (NCBI, RP, Bethesda, MD, USA)의 BLAST(Basic Local Alignment Search Tool, http://www.ncbi.nlm.nih.gov/BLAST/) 프로그램을 사용하여 기존에 보고된 균주의 염기서열과 상동성을 비교하였다. 계통학적 분석을 위한 multiple sequence alignment는 Lasergene pro software(Seqman Pro, Ver 8.1.5, DNASTAR inc., Madison, WI, USA)를 사용하였 고, multiple alignment의 정보량을 가장 손쉬운 형태로 축소 시켜 데이터를 취급하기 쉬운 장점이 있는 neighborjoining( NJ) method에 의한 계통수 작성 및 분석에는 Molecular Evolutionary Genetics Analysis(MEGA6.0) 프로 그램을 이용하였다(17,18).
황화수소 생성능
황화수소 생성능을 알아보기 위해 -80℃에 보관하여 stock한 균주를 사용하였다. 96-well cell culture plat(SPL Co., Ltd., Pocheon, Korea)에 180 μL씩 YPD 액체배지를 분주한 후 stock 균주를 20 μL씩 일정하게 접종하였다. 이를 Biggy 한천배지(BD, Franklin Lakes, NJ, USA)에 96 pin replicator(250520, Nalge Nunc International, Rochester, NY, USA)를 이용하여 Biggy agar에 접종한 후, 25℃에서 48시간 배양하여 colony의 색깔 진하기에 따라 황화수소 생성능을 평가하였다(19).
CO2 생성능
분리된 야생 효모 stock 균주를 YPD 액체배지 5 mL에 20 μL씩 접종한 후 25℃에서 72시간 동안 배양하였다. 0시 간부터 72시간까지 12시간마다 배양액이 감소한 무게를 g 단위로 측정하였다. 72시간까지 감소하는 총 무게를 효모 의 CO2생성량으로 판단하였고, CO2 g/72 h로 표시하였다.
알코올 내성
10 mL YPD 액체배지에 분리된 야생효모 stock 균주를 각각 10 μL씩 접종하여 25℃에서 48시간동안 정치 배양하 였다. YPD 액체배지를 제조하여 고압멸균(121℃, 15min)한 후, 배지 온도가 40-50℃ 되었을 때 무수 에탄올 농도를 0%, 5%, 10%, 15%, 20% (v/v)가 되도록 각각 첨가하여 배양된 야생 효모를 접종하였다. 25℃에서 48시간 동안 정 치 배양하였으며, 분광광도계(SYNERGY MX, Biotek, Winooski, VT, USA)를 이용하여 600 nm에서 흡광도를 측 정하였다(20).
효모 응집성
분리된 야생 효모들의 응집성 실험은 Helm’s assay method에 따라 수행하였다(21). 배양된 효모 균주 5-6 g을 30 mL calcium sulfate에 현탁하여 원심분리 후 효모를 회수 하였다. 회수한 효모 1 g(약 1×107-108 cells/mL)을 15 mL centrifuge tube에 넣고 10 mL buffered calcium sulfate 용액 을 첨가하여 현탁 시킨 후 20℃의 water bath(VS-1321-80, VISION, Gyeonggi-do, Korea)에서 20분간 정치하고, 재현 탁하여 10분 간격으로 60분까지 침전된 균체의 부피를 측 정하였다. 균체의 부피가 1.0 mL 이상인 효모는 high flocculation type이며, 0.5 mL 이하인 것을 low flocculation type이라 하였다.
Cerulenin 및 5,5,5-trifluor-DL-Leucine 내성, API 분석
Cerulenin과 5,5,5-trifluor-DL-leucine(TFL)(Sigma-Aldrich, St. Louis, MO, USA)의 대한 저항성은 0.67% YNB(yeast nitrogen base), 2% glucose, 2% agar 조성 배지에 celurenin (25 μM)과 TFL(1 mM)을 각각 첨가하여 제조하였다. 96 well cell culture plat에 180 μL씩 YPD 액체배지를 분주한 후 stock으로 보관한 분리 균주를 20 μL씩 일정하게 접종하 여 30℃에서 48시간 배양 한 다음 colony 생성 여부에 따라 평가하였다(22). 효모가 생성하는 효소 분석은 API ZYM kit(REF 25 200, BioMerieux SA, Chemin de l'Orme, France) 를 이용하여 효소 활성을 측정하였다. YPD 한천배지에 3 0℃에서 48시간 배양한 균주들의 colony를 API ZYM kit의 suspension standard 5 탁도에 맞춰 균을 suspension medium 에 풀었다. 이를 cupule에 100 μL씩 분주한 후 30℃에서 4시간 동안 정치하였다. 4시간 후 ZYM A와 ZYM B를 한 방울씩 차례로 분주 후 효소가 발색하는 색의 유무를 측정 하였다.
주성분분석
효모의 알코올 내성과 CO2 생성의 상관성 및 특성의 상 관관계를 시각적으로 요약하기 위하여 주성분분석 (Principal Component Analysis, PCA)을 나타내었다. 주성분 분석은 XLSTAT(Paris, France)을 이용하여 분석하였다.
결과 및 고찰
야생효모의 동정
국내 생막걸리 및 누룩에서 분리한 효모들의 계통수는 Fig. 1과 같다. 이미 보고된 같은 속 균과 26S rDNA의 D1/D2 부위의 유전자 염기서열을 비교하였을 때 S. cerevisiae임을 확인 할 수 있었으며, 누룩에서 분리된 균은 P. kudriavzevii 로 확인 되었다. 생막걸리에는 최소 5% 이상의 알코올 함유 로 알코올 내성이 약한 효모들은 사멸되어 상대적으로 내성 을 가진 S. cerevisiae가 분리되었다. 하지만 누룩은 생막걸 리와 다른 환경으로 인해 S. cerevisiae 효모가 아닌 P. kudriavzevii가 분리된 것으로 보인다. P. kudriavzevii와 같은 non-Saccharomyces 효모들은 누룩이나 메주 등 발효식품에 주로 분리되는 균으로 보고되었다(8,14).
Fig. 1.
Phylogenetic tree of yeast strains isolated from non-sterilized Makgeolli and Nuruk collected in Korea based on the nucleotide sequences of 26S ribosomal DNA.
The tree was generated by the neighbor-joining method using the Mega 6.0 program. The numbers above or below branches mean the bootstrap supporting values.
Download Original Figure
황화수소 생성능
Biggy agar에 62종의 분리 효모와 3종류의 대조구를 접종 하여 25℃에서 48시간 동안 배양한 결과를 Table 1에 나타 내었다. 배양 후 효모 주위에 진한 갈색의 집락이 형성되면 황화수소 생성능이 있는 양성(+)으로 판단하였고, 집락 크 기에 따라(+, ++, +++)로 나눠 확인하였다. 효모 주위에 진한 갈색의 집락이 없이 배양되면 음성(-)으로 하였다. 발 효 시 효모는 단백질 합성을 위하여 필수적으로 황함유 화합물을 필요로 하며, 이 대사 과정의 부산물로 황화수소 가 만들어진다. 황화수소는 썩은 달걀 냄새를 내는 독성의 기체로 황화수소 생성능이 있는 효모는 알코올 발효의 부산 물로 생성되는 불쾌한 향을 생성함으로 인해 발효주의 품질 을 떨어뜨릴 수 있으나 사람이 느낄 수 있는 역치 값 미만으 로 생성하게 되면 발효주의 향기에 영향을 미치지 않을 수 있다(23). 대조구 중 하나인 CM과 62종의 분리 효모 중 31종의 효모가 황화수소 생성능이 있었고, 34개의 효모 는 황화수소를 생성하지 않았다. 분리원이 같고 같은 속의 효모라도 황화수소 생성능이 각각 다른 것으로 나타났다. 이 중 YM54와 YM57은 황화수소 생성능이 가장 높게 나타 났으며, 황화수소 생성능이 낮은 양성(+)인 효모는 14개로 확인되었다.
Table 1.
H2S and CO2 production, alcohol tolerance, and flocculation of isolated from non-sterilized Makgeolli and Nuruk in Korea
|
Yeast strains |
H2S1) |
CO22) (g) |
Alcohol tolerance (%) |
Flocculation type3) |
Cerulenin 1% |
Cerulenin 2% |
TFL |
|
0 |
5 |
10 |
15 |
20 |
|
Fermivin |
- |
0.08 |
1.245±0.0294) |
0.668±0.017 |
0.573±0.016 0.395±0.019 |
0.360±0.015 |
F |
++ |
++ |
+ |
|
SCY |
- |
0.1 |
1.167±0.021 |
0.585±0.011 |
0.525±0.026 0.404±0.012 |
0.283±0.004 |
L |
++ |
++ |
+ |
|
CM |
+ |
0.07 |
1.079±0.003 |
0.072±0.008 |
0.011±0.001 0.023±0.002 |
0.035±0.001 |
F |
++ |
++ |
+ |
|
YM1 |
++ |
0.14 |
1.217±0.010 |
0.388±0.011 |
0.172±0.012 0.172±0.006 |
0.173±0.031 |
F |
++ |
+ |
+ |
|
YM2 |
++ |
0.11 |
1.229±0.009 |
0.486±0.020 |
0.352±0.027 0.097±0.009 |
0.027±0.003 |
F |
++ |
+ |
+ |
|
YM3 |
- |
0.1 |
0.943±0.027 |
0.460±0.003 |
0.438±0.032 0.059±0.004 |
0.005±0.001 |
F |
++ |
+ |
+ |
|
YM4 |
- |
0.11 |
1.295±0.023 |
0.586±0.016 |
0.403±0.014 0.231±0.002 |
0.019±0.002 |
F |
++ |
+ |
+ |
|
YM6 |
+ |
0.09 |
0.915±0.010 |
0.068±0.007 |
0.022±0.001 0.008±0.006 |
0.003±0.000 |
F |
++ |
++ |
+ |
|
YM7 |
++ |
0.12 |
1.149±0.004 |
0.496±0.017 |
0.232±0.005 0.152±0.005 |
0.089±0.008 |
F |
++ |
+ |
+ |
|
YM8 |
+ |
0.13 |
1.170±0.005 |
0.611±0.018 |
0.398±0.021 0.322±0.022 |
0.153±0.010 |
F |
++ |
++ |
+ |
|
YM10 |
+ |
0.11 |
1.130±0.035 |
0.578±0.014 |
0.408±0.008 0.161±0.011 |
0.021±0.005 |
L |
+ |
+ |
+ |
|
YM12 |
- |
0.11 |
1.198±0.036 |
0.663±0.007 |
0.517±0.013 0.274±0.008 |
0.175±0.004 |
F |
+ |
- |
+ |
|
YM13 |
- |
0.12 |
0.924±0.027 |
0.506±0.014 |
0.445±0.007 0.362±0.002 |
0.297±0.013 |
F |
++ |
+ |
+ |
|
YM14 |
- |
0.14 |
0.913±0.011 |
0.559±0.002 |
0.469±0.052 0.206±0.008 |
0.006±0.002 |
F |
+ |
+ |
+ |
|
YM15 |
- |
0.12 |
0.913±0.026 |
0.564±0.012 |
0.546±0.011 0.422±0.012 |
0.285±0.014 |
F |
+ |
+ |
+ |
|
YM16 |
++ |
0.14 |
1.076±0.022 |
0.527±0.019 |
0.441±0.038 0.190±0.016 |
0.002±0.001 |
F |
++ |
+ |
+ |
|
YM17 |
++ |
0.17 |
1.008±0.015 |
0.647±0.033 |
0.639±0.036 0.312±0.010 |
0.129±0.006 |
F |
++ |
+ |
+ |
|
YM18 |
- |
0.11 |
1.058±0.012 |
0.491±0.003 |
0.364±0.016 0.225±0.002 |
0.001±0.001 |
F |
+ |
++ |
+ |
|
YM19 |
++ |
0.13 |
0.822±0.045 |
0.394±0.008 |
0.308±0.005 0.264±0.009 |
0.213±0.005 |
F |
++ |
- |
+ |
|
YM20 |
+ |
0.1 |
1.096±0.010 |
0.183±0.024 |
0.014±0.000 0.009±0.002 |
0.004±0.001 |
F |
+ |
- |
+ |
|
YM21 |
- |
0.15 |
1.066±0.019 |
0.510±0.028 |
0.011±0.001 0.013±0.002 |
0.018±0.001 |
F |
+ |
- |
+ |
|
YM22 |
+ |
0.14 |
1.003±0.033 |
0.912±0.017 |
0.760±0.044 0.543±0.012 |
0.058±0.006 |
F |
+ |
- |
+ |
|
YM23 |
++ |
0.15 |
0.764±0.034 |
0.310±0.008 |
0.219±0.010 0.193±0.004 |
0.252±0.028 |
F |
++ |
- |
+ |
|
YM24 |
++ |
0.12 |
1.139±0.032 |
0.608±0.030 |
0.412±0.028 0.377±0.013 |
0.267±0.019 |
F |
++ |
+ |
+ |
|
YM25 |
++ |
0.11 |
0.748±0.316 |
0.396±0.008 |
0.242±0.008 0.189±0.013 |
0.219±0.015 |
F |
++ |
- |
+ |
|
YM26 |
- |
0.15 |
0.890±0.015 |
0.482±0.004 |
0.477±0.034 0.372±0.008 |
0.292±0.009 |
F |
+ |
+ |
+ |
|
YM27 |
- |
0.13 |
0.984±0.007 |
0.308±0.011 |
0.014±0.001 0.014±0.004 |
0.039±0.014 |
F |
+ |
- |
+ |
|
YM28 |
++ |
0.18 |
1.112±0.033 |
0.568±0.005 |
0.524±0.023 0.202±0.009 |
0.003±0.001 |
F |
++ |
- |
+ |
|
YM29 |
++ |
0.17 |
1.002±0.030 |
0.222±0.014 |
0.172±0.018 0.161±0.007 |
0.168±0.012 |
F |
++ |
- |
+ |
|
YM30 |
- |
0.13 |
1.010±0.025 |
0.588±0.005 |
0.485±0.032 0.325±0.010 |
0.080±0.013 |
F |
+ |
- |
+ |
|
YM31 |
- |
0.18 |
1.167±0.006 |
0.763±0.006 |
0.708±0.022 0.532±0.010 |
0.310±0.014 |
F |
+ |
++ |
+ |
|
YM32 |
- |
0.15 |
1.120±0.020 |
0.664±0.016 |
0.592±0.029 0.483±0.007 |
0.377±0.044 |
F |
++ |
- |
+ |
|
YM33 |
- |
0.13 |
1.300±0.002 |
0.653±0.013 |
0.385±0.009 0.348±0.006 |
0.327±0.006 |
F |
- |
- |
+ |
|
YM34 |
- |
0.18 |
1.170±0.005 |
0.626±0.007 |
0.475±0.028 0.373±0.008 |
0.307±0.010 |
F |
+ |
- |
+ |
|
YM35 |
- |
0.17 |
1.293±0.131 |
0.214±0.027 |
0.032±0.003 0.002±0.003 |
0.017±0.001 |
F |
+ |
- |
+ |
|
YM36 |
- |
0.14 |
1.261±0.029 |
0.092±0.022 |
0.017±0.001 0.012±0.004 |
0.012±0.005 |
F |
+ |
- |
+ |
|
YM37 |
- |
0.16 |
1.363±0.026 |
0.696±0.015 |
0.580±0.012 0.493±0.010 |
0.410±0.007 |
F |
+ |
+ |
+ |
|
YM38 |
- |
0.1 |
1.299±0.012 |
0.622±0.017 |
0.479±0.022 0.365±0.008 |
0.306±0.011 |
F |
+ |
- |
+ |
|
YM39 |
- |
0.1 |
0.817±0.008 |
0.401±0.020 |
0.290±0.023 0.258±0.004 |
0.183±0.029 |
F |
+ |
- |
+ |
|
YM40 |
++ |
0.12 |
1.136±0.052 |
0.402±0.152 |
0.037±0.000 0.035±0.005 |
0.040±0.002 |
F |
++ |
- |
+ |
|
YM42 |
+ |
0.1 |
1.188±0.021 |
0.682±0.006 |
0.653±0.031 |
0.301±0.007 |
0.034±0.001 |
F |
+ |
- |
+ |
|
YM43 |
+ |
0.09 |
1.189±0.0184)
|
0.694±0.018 |
0.575±0.027 |
0.253±0.004 |
0.031±0.007 |
F |
+ |
- |
+ |
|
YM44 |
- |
0.09 |
1.092±0.015 |
0.476±0.015 |
0.273±0.017 |
0.074±0.006 |
0.024±0.001 |
L |
++ |
++ |
+ |
|
YM45 |
- |
0.08 |
1.260±0.052 |
0.548±0.010 |
0.324±0.020 |
0.125±0.003 |
0.045±0.001 |
L |
+ |
- |
+ |
|
YM46 |
- |
0.1 |
0.864±0.013 |
0.440±0.011 |
0.293±0.023 |
0.098±0.006 |
0.036±0.002 |
L |
++ |
++ |
+ |
|
YM47 |
- |
0.09 |
1.367±0.022 |
0.605±0.005 |
0.264±0.002 |
0.225±0.011 |
0.030±0.001 |
L |
+ |
+ |
+ |
|
YM48 |
++ |
0.1 |
1.100±0.024 |
0.588±0.005 |
0.476±0.011 |
0.181±0.014 |
0.062±0.003 |
F |
++ |
- |
+ |
|
YM49 |
+ |
0.09 |
0.717±0.015 |
0.504±0.025 |
0.562±0.022 |
0.279±0.002 |
0.038±0.001 |
F |
++ |
- |
+ |
|
YM50 |
++ |
0.12 |
1.064±0.005 |
0.522±0.014 |
0.464±0.051 |
0.220±0.006 |
0.047±0.003 |
F |
++ |
- |
+ |
|
YM51 |
++ |
0.1 |
0.939±0.003 |
0.560±0.008 |
0.519±0.023 |
0.068±0.004 |
0.033±0.001 |
F |
++ |
+ |
+ |
|
YM52 |
+ |
0.11 |
0.778±0.011 |
0.503±0.009 |
0.496±0.017 |
0.189±0.010 |
0.028±0.001 |
F |
++ |
+ |
+ |
|
YM53 |
- |
0.06 |
0.997±0.032 |
0.425±0.018 |
0.231±0.017 |
0.039±0.001 |
0.030±0.002 |
L |
+ |
- |
+ |
|
YM54 |
+++ |
0.08 |
1.167±0.062 |
0.385±0.015 |
0.196±0.006 |
0.057±0.003 |
0.038±0.004 |
F |
++ |
- |
+ |
|
YM55 |
- |
0.1 |
1.118±0.003 |
0.114±0.030 |
0.019±0.002 |
0.015±0.001 |
0.016±0.002 |
L |
++ |
+ |
+ |
|
YM57 |
+++ |
0.09 |
0.961±0.014 |
0.291±0.018 |
0.110±0.008 |
0.059±0.001 |
0.051±0.004 |
F |
+ |
- |
+ |
|
YM58 |
- |
0.08 |
0.932±0.009 |
0.161±0.013 |
0.011±0.001 |
0.017±0.004 |
0.026±0.001 |
L |
++ |
+ |
+ |
|
YM59 |
- |
0.1 |
1.126±0.014 |
0.508±0.014 |
0.309±0.026 |
0.025±0.004 |
0.026±0.000 |
L |
+ |
+ |
+ |
|
YM60 |
+ |
0.11 |
1.053±0.009 |
0.587±0.003 |
0.464±0.023 |
0.031±0.003 |
0.030±0.001 |
L |
++ |
++ |
+ |
|
YM62 |
+ |
0.09 |
1.120±0.007 |
0.418±0.024 |
0.258±0.002 |
0.048±0.003 |
0.045±0.001 |
L |
++ |
+ |
+ |
|
YM63 |
- |
0.07 |
1.054±0.006 |
0.204±0.008 |
0.014±0.001 |
0.018±0.003 |
0.030±0.002 |
L |
+ |
++ |
+ |
|
YM64 |
+ |
0.08 |
1.106±0.009 |
0.118±0.025 |
0.014±0.001 |
0.015±0.001 |
0.017±0.003 |
F |
++ |
+ |
+ |
|
YM65 |
- |
0.14 |
1.217±0.004 |
0.125±0.010 |
0.013±0.002 |
0.016±0.001 |
0.047±0.001 |
L |
++ |
++ |
+ |
|
YM66 |
- |
0.12 |
1.160±0.008 |
0.230±0.014 |
0.012±0.001 |
0.018±0.007 |
0.034±0.002 |
L |
+ |
+ |
+ |
|
YM68 |
- |
0.12 |
1.214±0.007 |
0.388±0.010 |
0.036±0.005 |
0.033±0.002 |
0.034±0.001 |
F |
+ |
- |
+ |
|
SS |
+ |
0.07 |
1.272±0.008 0.108±0.006 |
0.108±0.006 |
0.014±0.001 |
0.019±0.003 |
0.026±0.002 |
L |
+++ |
+++ |
+ |
Download Excel Table
효모의 CO2 생성능 및 알코올 내성
생막걸리에서 분리된 야생 효모의 CO2 생성과 알코올 내성은 Table 1에 나타내었다. 대부분 효모들은 12-24시간 사이 높은 CO2 생성능을 보였으며, 72시간 동안 대조구인 Fermivin, SCY, CM은 0.07-0.1 g을 감소하였다. 분리된 효 모 중 YM17, YM29, YM35는 0.17 g을 YM28, YM31, YM34 는 0.18 g 감소로 발효성이 높은 균주로 관찰되었다. CO2 생성량이 가장 낮은 효모는 YM53로 총 0.06 g이 감소하여 YM28, YM31, YM34와 3배의 차이를 보였다.
효모의 알코올 내성은 알코올 농도별(0, 5, 10, 15, 20%)로 효모의 생육정도를 흡광도로 측정하였다. 대조구 중 CM은 알코올 내성이 낮아 비교 균주에서 제외하였으며 알코올 첨가량이 10%인 배지에서 대조구 Fermivin, SCY의 평균값 인 0.549보다 높은 알코올 내성을 보유한 효모는 8개 균주 로 YM17, YM22, YM31, YM32, YM37, YM42, YM43, YM49로 확인되었다. 알코올 15%를 첨가한 배지에서 대조 구 평균값인 0.4 이상 알코올 내성을 보유한 효모는 5균주로 YM15, YM22, YM31, YM32, YM37이었고, 알코올 20%를 첨가한 배지에서 대조구 평균값인 0.321 이상 알코올 내성 을 보유한 효모는 YM31, YM32, YM37로 나타났다.
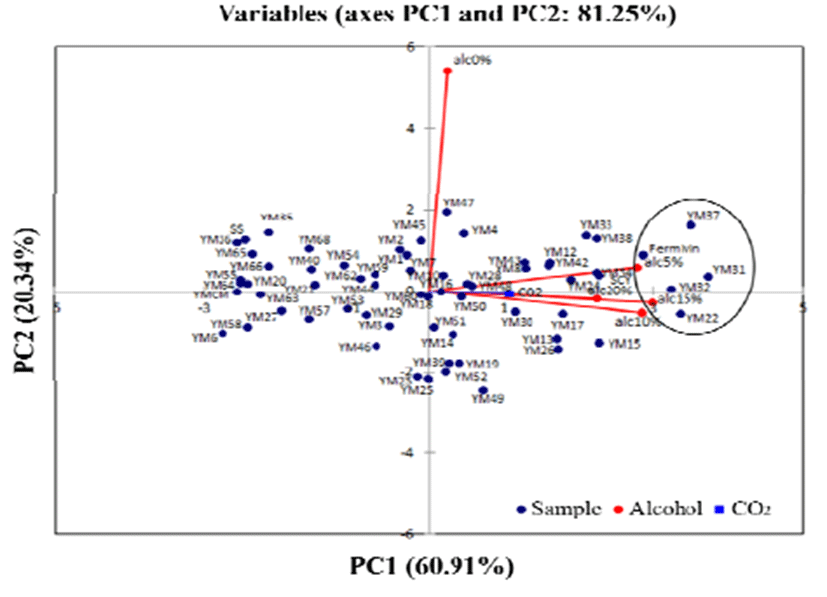
효모의 CO2 생성능과 알코올 내성의 상관성을 시각적으 로 요약하기 위해 주성분 분석(Principal Components Analysis)을 하여 Fig. 2에 나타내었다. 주성분 분석은 1주성 분(PC1)과 2주성분(PC2)으로 구분되어 각각 60.91%, 20.34%로 총 변동의 81.25%의 설명력을 갖는 것으로 분석 되었다. PC1 양의 방향으로 알코올 내성과 CO2 생성능이 부하되었고, PC2은 알코올 내성 0%와 5%는 양의 방향으로, 10%, 15%, 20%와 CO2 생성능은 음의 방향으로 부하되었 다. 시료들의 주성분 중 PC1 양의 방향에 부하되는 효모는 32개로 나타났다. 그 중 양의 방향으로 강하게 부하된 효모 는 대조구를 제외한 YM37, YM31, YM32, YM22로 0.14-0.18 g의 높은 CO2 생성능을 보였고 15% 이상 알코올 에서도 내성이 있어 서로 양의 상관관계가 있음을 확인하였 다. 양조효모의 주된 역할은 신속하고 효율적으로 당화액 의 당을 전환하고 에탄올 및 이산화탄소를 만드는 것이다 (5). 주성분으로 분석한 4개의 효모들은 높은 알코올 내성과 CO2 생성능으로 주류 제조에 적합한 야생 효모로 판단되었 다.
Fig. 2.
PC loadings and scores of the 62 wild yeast, alcohol tolerance and CO2 produce evaluated by the descriptive pane in the PCA plot.
Download Original Figure
효모 응집성 분류
효모는 발효 시 강한 응집성을 갖으며, 응집성이 높을수 록 발효 후 효모를 효율적으로 분리할 수 있기 때문에 양조 시 중요한 역할을 한다(24). Burns(25) 등은 효모를 10분 정치 후 침전량이 1 mL보다 크면 강응집성 효모로 분류하 여 보고하였다. 본 실험에서는 Helm(21)과 Burns(25) 방법 에 따라 60분 후의 효모 침전량이 1.0 mL 이상이면 high flocculation type 효모로, 0.5-1.0 mL 사이이면 flocculation type 효모로 0.5 mL 이하이면 Low flocculation type으로 분류하였다. 실험 결과 모든 효모가 시간이 경과함에 따라 침전량이 증가하였으며, 60분 후 1.0 mL 이상의 High flocculation type의 효모는 없었다. 46개의 효모는 0.5-1.0 mL 사이의 flocculation type이었으며 대조구 SCY를 포함한 16종의 효모는 low flocculation type으로 나타났다.
Cerulenin 및 5,5,5-trifluor-DL-Leucine(TFL) 내성, API 분석
Cerulenin 및 5,5,5-trifluor-DL-Leucine(TFL) 내성은 Table 1에 나타내었다. Cerulenin는 균이 자라면 양성(+)으 로, 균이 자라지 않으면 음성(-)으로 하였으며 균의 크기에 따라(+, ++, +++)로 나타내었다. Cerulenin 1% 첨가한 배지 에서는 YM33을 제외하고 대조구를 포함한 64종의 균이 자랐고, 2%를 첨가한 배지에서는 36종의 균이 자라 cerulenin에 저항성을 갖는 것으로 나타났다. Ethylcaproate 의 생산은 지방산 생합성 효소가 촉진하는 것으로 알려져 있고 지방산 생합성 효소는 cerulenin에 의해 저해되기 때문 에 cerulenin 저항성 균주를 찾는다면 ethyl caproate 생산 균주를 찾을 때 유용하게 이용할 수 있다고 보고되었다(26). TFL을 첨가한 배지에서 모든 균주가 자라 TFL의 저항성을 보였다. Isoamyl acetate 또한 과일 향과 달콤한 향을 내는 주요 성분으로 L-leucine이 과잉 생산되는 균주는 에스테르 와 고급 알코올류의 생산이 증가하여 isoamyl acetate 역시 증가한다. 이러한 균주는 L-leucine의 유사물질인 TFL을 이용하여 저항성 균주를 선발하는 방법이 보고되었다(26). API ZYM kit를 이용한 효모의 효소활성의 결과는 Table 2와 같다. Esterase, esterase lipase 외 5개 효소가 62개 균주 에서 활성을 나타냈고, α-fucosidase 외 5개 효소의 활성은 발견되지 않았다. Ester는 맥주와 와인과 같은 발효 음료에 서 미량 화합물이지만 음료의 향미에 매우 중요한 역할을 한다. 발효주에서 향기성분의 주요 지표로서 사용되는 ester 는 esterase(EC3.1.1.1)에 의한 가수분해 반응과 alcohol acetyltransferase(EC2.3.1.84)를 포함한 합성반응의 상호작 용에 의해 이루어지며 효모는 이에 영향을 미치는 가장 중요한 요소 중 하나이다(26,27).
Table 2.
Enzyme activity assay of flavor producing yeasts using API ZYM Kit
|
Enzyme |
Yeast strains |
|
Esterase |
All yeasts (62 strains) |
|
Esterase lipase |
|
Leucine arylamidase |
|
Valine arylamidase |
|
Cystine arylamindase |
|
Acid phosphatase |
|
Naphthol-As-BI-phosphohydrolase |
|
Alkaline phosphatase |
YM1-YM10, YM13-SS (61 strains) |
|
α-Galactosidase |
CM,YM1, YM2, YM7, YM8, YM12, YM16, YM17, YM19, YM23-25, YM28, YM29, YM32, YM40, YM45, YM48-52, |
|
YM54, YM57, YM60, YM62-64 YM68 (29 strains) |
|
β-Galactosidase |
YM16, YM22, YM33, YM34 (4 strains) |
|
N-Acetyl-β-glucosaminidase |
YM48, YM52 (2 strains) |
|
Trypsin |
YM23 (1 strain) |
|
β-Glucuronidase |
YM25 (1 strain) |
|
Lipase |
-1) |
|
α-Chymotrypsin |
|
β-Galactosidase |
|
β-Glucosidase |
|
α-Mannosidase |
|
α-Fucosidase |
Download Excel Table
요 약
본 연구는 각 지역의 생막걸리에서 분리된 야생 효모의 다앙한 발효학적 특성을 조사하기 위해 34종을 수집하고 효모를 분리, 동정하였다. 야생효모는 62 균주로 분리되었 고, 26S rDNA 염기서열을 분석한 결과, Saccharomyces cerevisiae와 Pichia kudriavzevii로 동정 되었다. 62개의 균주 들 중 발효학적 특성이 우수한 균주들을 선발하기 위해 황화수소와 CO2 생성능, 알코올 내성, 응집성 및 향기 성분 생성능을 분석하였다. 알코올 내성과 CO2 생성능의 상관성 을 확인하기 위해 주성분분석(Principal Components Analysis)을 하였다. PC1 양의 방향에 강하게 부하되는 균주 는 YM37, YM31, YM32, YM22로 분석되었으며, 총 0.14-0.18 g/72 h의 CO2 생성으로 대조군에 비해 높은 발효 능을 보였고, 이들 중 YM22를 제외하고 불쾌취인 황화수소 를 생성하지 않았다. 또한 이 4개의 균주들은 알코올 내성 15% 이상을 보유하며, 응집성은 0.5-1.0 mL 사이인 flocculation type으로 확인되었다. API 분석 및 cerulenin, TFL 저항성을 실험한 결과, 향기성분 생성능이 좋은 효모 는 황화수소와 알코올 내성, 응집성 실험에서 우수한 발효 학적 특성을 보인 YM37, YM31, YM32, YM22를 포함한 총 33개로 확인되었다. 이러한 결과를 통해 우리나라 생막 걸리에서 분리한 야생 효모의 알코올 발효 및 향미 특성을 확인하였으며, 분리된 야생 효모는 주류 제조의 종균 효모 로 이용 가능성을 확인하였다.
감사의 글
This work was carried out with the support of “Cooperative Research Program for Agriculture Science & Technology Development (Project No. PJ01198401)” Rural Development Administration, Republic of Korea.
References
Lee T.J., Hwang D.Y., Lee C.Y., Son H.J. Changes in yeast cell number, total acid and organic acid during production and distribution processes of
Makgeolli, traditional alcohol of Korea.. Korean J Microbiol. 2009; 45:391-396.

Jung S.J., Chung C.H. Production and properties of ale beer with
Nuruk, a Korean fermentation starter.. Korean J. Food Sci. Technol. 2017; 49:132-140


Lee Y.S., Seol J.M., Jeong D.Y., Kim S.R. Application of functional microbial strains isolated from traditional rice wine in Korea.. Microbiol Biotechnol Lett. 2016; 44:229-235


Kim H.R., Kwon Y.H., Jo S.J., Kin J.H., Ahn B.H. Characterization and volatile flavor components inglutinous rice wines prepared with different yeasts of
Nuruks.. Korean J. Food Sci. Technol. 2009; 41:296-301.

Jung S.J. Beer production and properties using Nuruk, a Korean fermentation starter. MS Thesis. 2015Sejong University. .

Choi D.H., Park E.H., Kim M.D. Characterization of starch-utilizing yeast
Saccharomycopsis fibuligera isolated from
Nuruk.. Korean J Microbiol Biotechnol. 2014; 42:407-412


Jeong S.T., Kwak H.J., Kim S.M. Quality characteristics and biogenic amine production of
Makgeolli brewed with commercial
Nuruks.. Korean J. Food Sci. Technol. 2013; 45:727-734


Baek SY, Lee YJ, Kim MD. Characterization of ethanol fermentation with wild type yeast strains.. Microbiol Biotechnol Lett. 2015; 43:227-235


Baek S.Y., Lee Y.J., Kim J.H., Yeo S.H. Isolation and characterization of wild yeasts for improving liquor flavor and quality.. Microbiol Biotechnol Lett. 2015; 43:56-64


Baek C.H., Choi J.H., Choi H.S., Jeong S.T., Kim J.H., Jong Y.J., Yeo S.H. Quality characteristics of brown rice
Makgeolli produced under differing conditions.. Korean J Microbiol Biotechnol. 2013; 41:168-175


Lee J.W., Shim J.Y. Quality characteristics of
Makgeolli during freezing storage.. Food Eng Prog. 2010; 14:328-334.

Lee D.H., Kim J.H., Lee J.S. Effect of pears on the quality and physiological functionality of
Makgeoly.. Korean J Food Nutr. 2009; 22:606-611.

Kim G.W., Lee J.H., Lee S.A., Shim J.Y. Brewing characteristics of grape-
Makgeolli.. Food Eng Prog. 2012; 16:263-269.

Park M.J., Kim H.K., Choi K.K., Koo B.Y., Lee S.K. Fermentation characteristics of
Makgeolli containing Aronia (
Aronia melanocarpa, Black chokeberry).. Korean J. Food Sci. Technol. 2016; 48:27-35


Lee H.L., Kang K.W., Seo D.H., Jung J.H., Jung D.H., Kim G.W., Park S.Y., Shin W.C., Shim H.S., Park C.S. Diversity of lactic acid bacteria (LAB) in
Makgeolli and their production of I3-aminobutyric acid.. Korean J. Food Sci. Technol. 2015; 47:204-210


Park J.H., Chung C.H. Characteristics of
Takju (a cloudy Korean rice wine) prepared with
Nuruk (a traditional Korean rice wine fermentation starter), and identification of lactic acid bacteria in
Nuruk.. Korean J. Food Sci. Technol. 2014; 46:153-164


Tamura K., Stecher G., Peterson D., Filipski A., Kumar S. MEGA6: Molecular evolutionary genetics analysis version 6.0.. Mol. Biol. Evol. 2013; 30:2725-2729


Saitou N., Nei M. The neighbor-joining methods: a new method for reconstructing phylogenetic trees.. Mol. Biol. Evol. 1987; 4:406-425.

Comitini F., Gobbi M., Domizio P., Romani D., Lencioni L., Mannazzu I., Ciani M. Selected non-
Saccharomyces wine yeasts in controlled multistarter fermentations with
Saccharomyces cerevisiae.. Food Microbiol. 2011; 28:873-882


Tracey R.P., Simpson E. Effect of rehydration temperature of active dried yeast on wine production and quality.. S. Afr. J. Enol. Vitic. 1986; 7:66-70.

Helm E, Nohr B, Torne RSW. 1953 The measurement of yeast flocculation and its significance in brewing.. Wallerstein communications. .

Viana F., Gil J.V., Genoves S., Valles S., Manzanares P. Rational selection of non-
Saccharomyces wine yeasts for mixed starters based on ester formation and enological traits.. Food Microbiol. 2008; 25:778-785


Kim Y.R., Moon S.T., Park S.K. Effects of yeast strains and fermentation temperatures in production of hydrogen sulfide during beer fermentation.. Korean J. Food Sci. Technol. 2008; 40:238-242.

Verstrepen K.J., Derdelinckx G., Verachtert H., Delvaux F.R. Yeast flocculation: what brewers should know.. Appl. Microbiol. Biotechnol. 2003; 61:197-205


Burns J.A. Yeast flocculation.. J. Inst. Brew. 1937; 43:31-43.

Seo D.J., Yeo S.H., Mun J.Y., Jung W.J., Cho Y.S., Baek S.Y. Characteristics of yeast with low temperature adaptation for
Yakju brewed.. Korean J Food Preserv. 2015; 22:908-914


Verstrepen K.J., Derdelinckx G., Dufour J.P., Winderickx J., Thevelein J.M., Pretorius I.S., Delvaux F.R. Flavor-Active Esters: Adding Fruitiness to Beer.. J. Biosci. Bioeng. 2003; 96:110-118