서 론
위 질환에는 위궤양, 위암, 위염, 위산과다증 등이 있으 며, 이 중 위염은 조직학적으로 위 점막에 염증 세포의 침윤 이 있는 상태를 지칭하며, 급성위염과 만성위염으로 구분 할 수 있다. 위염의 증상으로는 속쓰림, 복부불쾌감, 구역질, 구토, 복부팽만감 등이 있는 것으로 알려져 있다(1,2). 만성 위염은 노화에 의한 위 점막 위축 및 헬리코박터 파이로니 감염 등의 원인으로 유발되어지고, 급성위염은 비스테로이 드성 항염증제(non-steroidal anti-inflammatory drugs, NSAIDs)의 장기간 사용, 과다한 알코올 섭취 및 스트레스 등과 같은 원인으로 유발된다(3,4). 비스테로이드 항염증제 는 위장에서 에이코사노이드(eicosanoid)의 생합성을 담당 하는 효소인 cyclooxygenase-1(또는 COX-1)을 억제하여 소 화성궤양 형성 가능성을 높이는 것으로 알려져 있다(5). 또한 인도메타신(indomethacin), 아스피린(aspirin), 록소프 로펜(loxoprofen), 디클로페낙(diclofenac)과 같은 NSAIDs 는 프로스타글란딘(prostaglandin)이라고 불리는 위 보호물 질을 감소시키며, 단기간 사용은 일반적으로 위험하지 않 으나 정기적 사용은 위염을 유발 가능성이 있는 것으로 알려져 있다(6).
현재 시판되어지고 있는 위염치료제는 우수한 효능을 가지고 있으나, 장기적인 복용으로 인한 소화기질환, 두드 러기 등의 부작용(7-9)과 비용부담 등에 대한 문제점이 대 두대면서 안전성이 확보된 천연물유래의 위장건강소재에 대한 관심이 높아져 다양한 연구가 진행되어져왔다. 특히 현재까지 위 건강에 대한 건강기능식품 소재로 연구된 소재 로는 위 점막 내 헬리코박터균 증식을 억제하고 위 점막을 보호하여 위 건강에 도움을 줄 수 있는 감초추출물(10,11), 위 불편함 개선에 도움을 줄 수 있는 매스틱검(12,13), 위 점막을 보호하여 위 건강에 도움을 주는 비즈왁스알코올 (14,15), 담즙분비를 촉진하여 지방소화에 도움을 줄 수 있 는 아티초크추출물(16) 등이 있다.
까마귀쪽나무(Litsea Japonica)는 제주도 해안가를 중심 으로 자생하고 있는 자원(17)으로 염증완화, 관절염완화, 통증개선, 설사 등 생리활성에 대한 연구가 수행되어져 왔 으나(18-22), 위 기능개선에 대한 체계적인 연구는 아직 이 루어지지 않았다. 이에 본 연구에서는 까마귀쪽나무추출물 의 다양한 생리활성 중 위염 유발 원인의 하나인 화학적인 원인 모델인 인도메타신으로 유도된 위염 동물모델에서 위 손상에 대한 보호 효과 및 위 보호에 대한 작용기전을 확인하여 위 건강에 도움을 줄 수 있는 건강기능식품소재 개발의 자료로 활용하고자 하였다.
재료 및 방법
제주도에 자생하고 있는 까마귀쪽나무열매(2015년)를 채취하여 열매를 종자와 과육으로 분리 후 과육 부분을 동결건조하였다. 까마귀쪽나무열매 과육 동결건조물 (1,000 g)을 n-hexane으로 실온에서 24시간 동안 추출 후 여과 및 감압 농축하여 n-hexane을 제거하고 추출물을 제조 하였다. 이때 까마귀쪽나무열매추출물의 n-hexan 잔류량이 식품의약품안전처의 건강기능식품소재로 활용이 가능한 규격인 0.005 g/kg 이하를 충족하는 0.001 g/kg로 분석되었 다. 까마귀쪽나무열매추출물(LJF-HE)의 수율은 약 30.6% (w/w)이고, 사용 전까지 4℃에서 보관하였다.
지표성분 Hamabiwalactone B(99.0%, (주)천연물화학, Daejeon, Korea)를 dichloromethan(Fisher Scientific Korea Ltd., Seoul, Korea) 5 mL로 정용하여 표준원액을 제조하고, methanol(Fisher Scientific Korea Ltd.)로 희석하여 12.5, 25, 50, 100, 200 μg/mL의 농도로 표준용액을 제조하였다. 시료 (LJF-HE) 약 150 mg을 무게 칭량 후 ethanol 15 mL을 넣어 ultrasonic cleaner(Powersonic 420, Hwashin Tech, Seoul, Korea)에서 30분간 추출하고 25 mL로 정용하여 0.45 μm syringe filter(PTFE, Whatman, Cardiff, Wales, UK)로 여과 후 시험용액으로 사용하였다. 상기 제조된 표준용액과 시 험용액은 HPLC(Waters 2695/996, Milford, MA, USA)로 함 량을 분석하였으며, 검출파장은 254 nm로 설정하였다. 컬 럼은 Cadenza C18(4.6 mm 150 mm, 5 μm, Imtakt, Japan)을 사용하였고, 온도는 30℃로 유지하였다. 이동상조건은 H2O(0.5% Acetic acid)와 acetonitrile(Fisher Scientific Korea Ltd.)을 구배용매 조성법으로 유속을 1.2 mL/min 속도로 10 μL를 주입하여 아래 식으로 함량을 구하였다(18).
실험동물(㈜대한바이오링크, Eumseong, Korea)은 200-220 g의 7주령 수컷 SD rat를 온도 23±3℃, 습도 50±5%에서 light cycle은 12시간으로 유지하면서 순화시킨 후에 무작위 법을 이용하여 Table 1과 같이 군당 8마리씩 군 분리를 실시하였다. 군 분리는 정상군(G1, normal), 대조군(G2, control, 인도메타신 위염 유발), 양성대조군(G3, ranitidine, 50 mg/kg, 인도메타신 위염 유발), 까마귀쪽나무열매추출 물 저농도 투여군(G4, LJF-HE-L, 30 mg/kg, 인도메타신 위 염 유발), 까마귀쪽나무열매추출물 중농도 투여군(G5, LJF-HE-M, 60 mg/kg, 인도메타신 위염 유발), 까마귀쪽나 무열매추출물 고농도 투여군(G6, LJF-HE-H, 120 mg/kg, 인도메타신 위염 유발)의 총 6군으로 구성하여 ㈜이비오 실험동물운영위원회(EBOA-2016-05-02)의 승인을 받아 진 행하였다. G1과 G2 그룹은 0.5% CMC를, G3 그룹과 까마귀 쪽나무열매추출물 그룹(G4, G5, and G6)들은 7일 동안 시험 물질을 매일 1회씩 경구 투여하였으며, 시험기간 동안 일반 증상 및 사망동물의 유무를 관찰하였다. 실험 종료 전 16시 간 동안 절식 시킨 다음 인도메타신을 4 mL/kg로 피하투여 (인도메타신 25 mg을 4 mL에 녹여 사용)하였으며, 인도메 타신 투여 3시간 후 마취하고 개복하여 유문부를 결찰하고 4시간 후 시험동물을 희생시켰다. 동물을 희생시키기 전에 복대동맥에서 혈액을 채취하여 EDTA가 처리된 tube에 넣 고 roller에서 10분간 반응 시킨 후, 1,800 ×g으로 20분간 원심분리하여 혈장을 채취하였다(23,24).
G1 (normal, vehicle), G2 (control, indomethacin-induced gastritis), G3 (ranitidine 50 mg/kg, indomethacin-induced gastritis and pretreatment of ranitidine 50 mg/kg), G4 (LJF-HE-L, indomethacin-induced gastritis and pretreatment of LJF-HE 30 mg/kg), G5 (LJF-HE-M, indomethacin-induced gastritis and pretreatment of LJF-HE 60 mg/kg), G6 (LJF-HE-H, indomethacin-induced gastritis and pretreatment of LJF-HE 120 mg/kg) groups.
6개 그룹(G1-G6)의 실험동물을 희생시킨 후 개복하여 위를 적출하였다. 적출한 위로부터 위액을 채취한 후, 위는 대만곡부를 따라 종 절개하여 위 내용물을 제거하고 식염수 로 세척한 후, cork board에 펼쳐서 사진을 촬영하였다. 위 점막 손상(위궤양, 출혈부위) 측정의 길이(mm)는 촬영된 사진으로 Image J 프로그램(NIH, Bethesda, MD, USA)을 사용하여 측정하였으며, 점상출혈인 경우 5개를 1 mm로 계산하여 측정하였다. 또한 손상된 길이를 아래의 식으로 계산하여 위염 억제율(%)로 나타냈다(25).
6개 그룹(G1-G6)의 실험동물을 희생시킨 후 위의 대만곡 부를 따라 절개하기 전에 pipette을 이용하여 위액을 수집하 고 위액량(mL)을 측정하였다. 또한 6개 그룹(G1-G6)의 실 험동물로부터 채취한 위액 0.01 mL에 hemoglobin(Sigma- Aldrich, St. Louis, MO, USA) 기질 용액 2.5 mL과 0.01 N HCl(Sigma-Aldrich) 0.49 mL을 가하여 37℃에서 10분간 반응시키고 5% trichloroacetic acid(Sigma-Aldrich) 5 mL을 첨가하여 반응을 종결 시킨 후, 4,000 ×g에서 20분간 원심분 리하여 얻은 상등액 2.5 mL에 0.5 N NaOH (Sigma-Aldrich) 5 mL과 3배로 희석된 Folin Ciocalteau's agent(Sigma- Aldrich) 1.5 mL을 가하여 5-10분간 반응 시킨 후 595 nm에 서 흡광도를 측정하였다. 표준용액은 0.2 N HCl에 용해시킨 tyrosine(Sigma-Aldrich)용액 1 mL에 0.2 N HCl 4 mL을 가하 여 0, 0.5, 1 mM의 농도를 조제하고, 펩신 활성은 mg tyrosine produced/h로 구하였다(26).
6개 그룹(G1-G6)의 실험동물을 희생시키기 전 채취한 혈장에서의 염증 지표와 위 점막 보호 지표와 관련된 TNF- α, IL-1β, PGE2 및 VEGF를 측정하였다. 각각의 지표 측정 을 위해 TNF-α Platinum ELISA(eBioscience, San Diego, CA, USA), IL-1β Platinum ELISA(eBioscience), PGE2 ELISA kit(Abcam, Cambridge, UK) 및 VEGF Plantinum ELISA (eBioscience)를 사용하여 실험하였으며, ELISA reader (Tecan Austria GmbH, Grödig, Austria)를 이용하여 측정하 였다.
6개 그룹(G1-G6)의 실험동물의 위에서 적출한 점막 부분 으로 TRI reagent®(Sigma-Aldrich)로 total RNA를 추출하고 cDNA는 Reverse Transcription System(Promega, Madison, WI, USA)으로 합성하였다. 합성된 cDNA는 TaqMan®Universal PCR master mixture(Applied Biosystems, Foster, CA, USA) 와 real-time PCR system(7500, Applied Biosystems, Foster, CA, USA)을 사용하여 real-time PCR을 수행하였다. Real-time PCR taqman probes는 Table 2에 나타내었으며, real-time PCR 조건은 50℃에서 1분, 95℃에서 10분간 수행 한 후, 95℃에서 15초, 60℃에서 1분간 40 cycling으로 PCR 을 수행하였다.
결과 및 고찰
까마귀쪽나무열매추출물(LJF-HE)에 대한 표준화는 지 표성분인 Hamabiwalactone B의 함량범위를 식품의약품안 전처의 개별인정형 건강기능식품소재 개발에 적합하게 Hamabiwalactone B 함량에 대한 평균값 15.2 mg/g의 80-120%인 12.1-18.3 mg/g 로 설정하여 확립하였으며, 본 연구에 사용한 까마귀쪽나무열매추출물(LJF-HE)의 지표 성분인 Hamabiwalactone B의 함량이 15.2±0.1 mg/g 으로 분석되어 까마귀쪽나무열매추출물의 표준화 규격에 적합 한 것으로 확인하였으며, 본 연구에 사용하였다. 까마귀쪽 나무는 일본에서 hamabiwa로 불리우며, Hamabiwalactone B는 lactone류의 일종으로 까마귀쪽나무 열매에 특이적으 로 함유되어 있어 까마귀쪽나무열매추출물의 지표성분으 로 설정하였으며, 이는 까마귀쪽나무열매주정추출물을 소 재화하여 관절염개선효능 연구에서도 Hamabiwalactone B 를 지표성분으로 설정하였으며 평균함량이 15.9±0.009 mg/g으로 제시(20)되어 본 연구에서의 함량과 유사하게 측 정되었다.
위 기능 개선을 확인하기 위하여 인도메타신으로 유도된 위염 모델연구는 보편적인 방법 중에 하나로 다양한 연구자 들에 의해 수행되어져왔다(23,27). 까마귀쪽나무열매추출 물의 인도메타신으로 유도된 위염모델에서의 위 염증에 대해 육안 병변을 살펴본 결과 G1(normal) 그룹에서는 위 염증이 관찰되지 않은 반면, G2(control) 그룹에서는 위 점막출혈을 관찰할 수 있었으며, 까마귀쪽나무열매추출물 그룹(G4, G5, G6)에서의 위염증과 점막출혈 부위가 G2 그 룹에 비해 감소하였음을 관찰할 수 있었다(Table 3). G2(control) 그룹의 위 염증 길이는 17.2±4.0 mm로 분석되 었으며, 양성대조군인 G3(ranitidine) 그룹에서는 4.7±1.8 mm로 G2군에 비해 통계적으로 유의성 있는 감소결과를 얻었다(p<0.01)(Table 3). 까마귀쪽나무열매추출물 그룹인 G4(LJF-HE-L), G5(LJF-HE-M) 및 G6(LJF-HE-H)에서 염증 의 길이는 각각 11.1±1.2 mm, 11.1±2.6 mm, 8.0±1.5 mm로 측정되었으며, G2 그룹에 비해 통계적으로 유의하게 감소 하였다(p<0.05)(Table 3).
G1 (normal, vehicle), G2 (control, indomethacin-induced gastritis), G3 (ranitidine 50 mg/kg, indomethacin-induced gastritis and pretreatment of ranitidine 50 mg/kg), G4 (LJF-HE-L, indomethacin-induced gastritis and pretreatment of LJF-HE 30 mg/kg), G5 (LJF-HE-M, indomethacin-induced gastritis and pretreatment of LJF-HE 60 mg/kg), G6 (LJF-HE-H, indomethacin-induced gastritis and pretreatment of LJF-HE 120 mg/kg) groups.
실험 종료 후에 6 그룹의 실험동물에 대한 위액을 수집하 여 그 양을 측정한 결과, G2 그룹의 위액량은 7.3±1.3 mL로 측정되어 G1 그룹의 3.2±1.7 mL에 비해 증가하였으며, G3 그룹의 위액량은 1.8±0.7 mL로 측정되어 G2 그룹 대비 유의적으로 감소한 결과를 얻었다(p<0.001)(Table 4). 또한 까마귀쪽나무열매추출물 그룹인 G4(LJF-HE-L), G5(LJFHE- M) 및 G6(LJF-HE-H)에서 각각의 위액량은 4.9±1.6 mL, 4.9±1.1 mL, 4.8±1.4 mL로 G2 그룹 대비 유의적으로 감소한 결과를 얻었다(p<0.05)(Table 4). 또한 펩신 활성도를 측정 한 결과, control 그룹의 펩신 활성도는 52.1±3.2 mg tyrosineproduced/h로 normal 그룹의 42.1±3.6 mg tyrosine produced/h에 비해 증가한 결과를 얻었으며, ranitidine 그룹 은 48.4±2.4 mg tyrosine produced/h로 control 그룹 대비 감소한 결과를 얻었다(Table 4). 또한 까마귀쪽나무열매추 출물 저농도(G4), 중농도(G5), 고농도(G6) 그룹에서 펩신 활성도는 각각 41.4±6.4, 35.2±3.6, 34.6±3.6 mg tyrosine produced/h로 control 대비 유의성 있게 감소하는 것으로 나타났다(Table 4).
G1 (normal, vehicle), G2 (control, indomethacin-induced gastritis), G3 (ranitidine 50 mg/kg, indomethacin-induced gastritis and pretreatment of ranitidine 50 mg/kg), G4 (LJF-HE-L, indomethacin-induced gastritis and pretreatment of LJF-HE 30 mg/kg), G5 (LJF-HE-M, indomethacin-induced gastritis and pretreatment of LJF-HE 60 mg/kg), G6 (LJF-HE-H, indomethacin-induced gastritis and pretreatment of LJF-HE 120 mg/kg) groups.
위염은 위 점막에 염증세포의 침윤이 있는 염증의 상태 로 외부 인자에 대한 비 특이적인 반응으로 나타나는 증상 으로, 위 점막의 손상은 위 점막을 보호하는 방어인자(프로 스타글라딘, 상피세포, 점액 등)와 위 점막을 손상시키는 공격인자(비스테로이드성 항염제, 헬리코박터 파이로니, 위산, 펩신 등) 사이의 균형이 깨져서 위염이 유발된다. 방어인자와 공격인자의 불균형으로 인한 위 점막 손상이 발생하면 위산이나 펩신분비가 증가하여 위 점막 손상이 악화되는 것으로 알려져 있다. 위산이나 펩신은 과다 분비 되거나 방어인자가 약해졌을 때 공격인자로 작용하여 자기 소화(autolysis) 작용을 통해 위 점막에 손상을 일으킨다 (28,29). 또한 위에서 분비되는 펩시노겐은 위산으로 인한 강한 산성상태에서 펩신으로 활성화되며, 펩신은 단백질 분해 작용을 한다. 따라서 펩신 활성이 증가하면 단백질 분해활성이 증진되는 효과를 나타낸다(30). 반면에 위산과 마찬가지로 위 손상 발생 시에는 펩신 활성을 감소시키는 것이 위 손상을 악화시키지 않는데 도움을 줄 수 있다.
본 연구에서와 같이 인도메타신 유발에 의한 위염은 화 학물질에 의한 급성손상으로 점막의 표층이 손상되거나 궤양을 동반한다. 위 손상이 있는 경우 위액이 많이 분비될 수록 손상을 악화시키므로 위액분비량이 감소될 경우 위손 상이 예방될 것이다(31,32). 따라서 까마귀쪽나무열매추출 물(LJF-HE)은 인도메타신으로 유발되어진 위염모델에서 위액량의 유의적인 감소효과로 위산분비가 억제되어 공격인자 작용이 약해져서 위염발생을 억제하는 것으로 사료되어지며, 또한 펩신의 활성도를 낮추어 위염발생을 억제하는 것으로 판단되어진다.
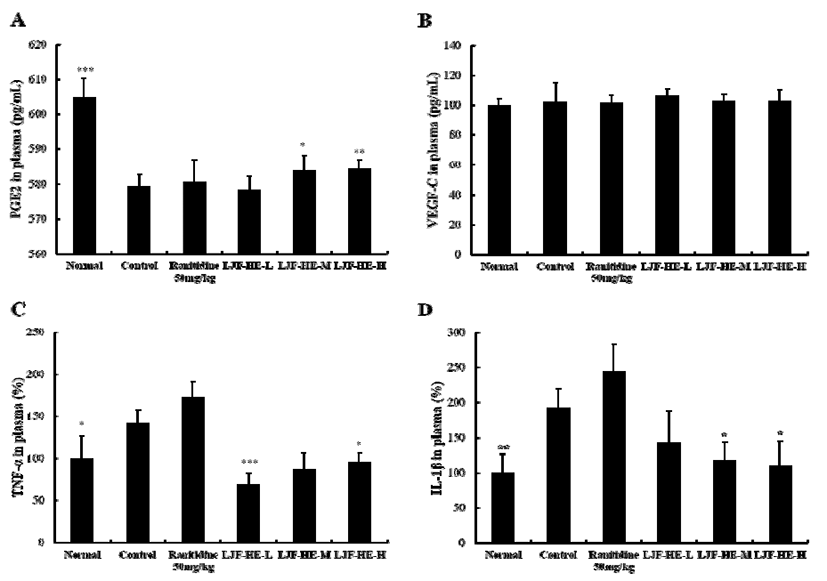
인도메타신으로 유도된 위염 모델에서 까마귀쪽나무열 매추출물(LJF-HE)의 위 점막 보호 및 염증 개선 기전을 확인하기 위하여, 실험동물의 혈장 내에 존재하는 PGE2, VEGF, TNF-α, IL-1β 등을 측정한 결과, G5와 G6 그룹에서 세포보호물질로 점액 및 혈류량을 증가시켜 위 점막을 보호 하는 역할을 하는 PGE2의 혈장 내 함량이 대조군에 비해 유의적으로 증가하였다(Fig. 1A). 반면에 모든 실험군에서 점막조직 생성을 촉진하는 VEGF의 혈장 내 농도는 유의적 인 차이를 보이지 않았다(Fig. 1B). 까마귀쪽나무열매추출 물(G4, G5, G6) 그룹은 염증성 cytokine중에 하나인 TNF-α 의 혈장 내 함량을 대조군에 비해 유의적으로 감소하였다 (Fig. 1C). 또한, 또 다른 염증성 cytokine중에 하나인 IL-1β 의 혈장 내 함량은 까마귀쪽나무열매추출물(G5, G6) 그룹 에서 대조군에 비해 유의적으로 감소하였다(Fig. 1D). 이러 한 결과들로 볼 때, 인도메타신으로 유도된 위염 모델에서 LJF-HE는 점액을 증가시켜 위 점막을 보호하는 PGE2의 함량을 높여, 위 점막 보호 기능을 나타내고 있으며, 더불어 염증성 cytokine인 TNF-α와 IL-1β의 생성을 낮춰주어 염증 매개반응을 저해하는 것으로 판단되어진다.
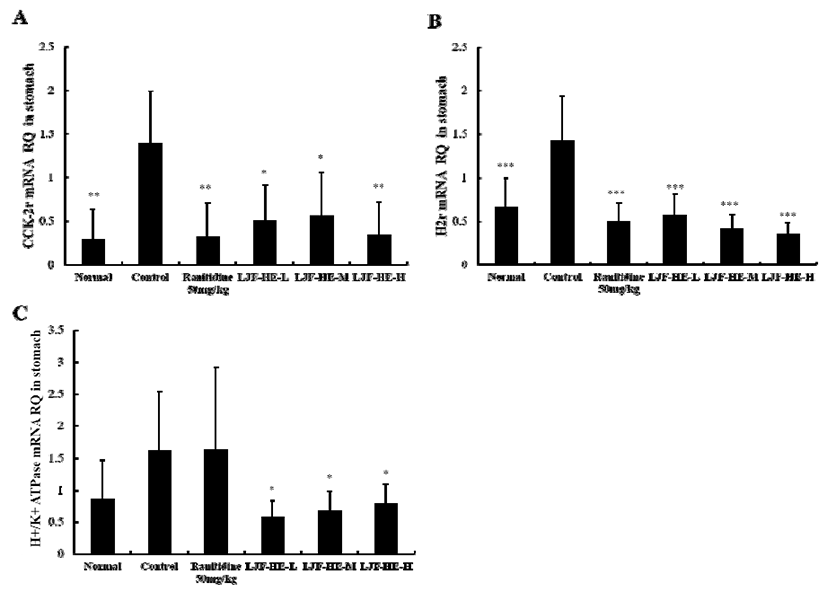
인도메타신으로 유도된 위염 모델에서 까마귀쪽나무열 매추출물(LJF-HE)의 위산 분비 억제 기전을 확인하기 위하 여, 실험동물의 위 조직으로 부터 total RNA를 분리하여, real-time PCR을 통해 histamine receptor H2(H2r), cholecystokinin 2 receptor(CCK-2r), H+/K+ ATPase 등을 housekeeping gene인 GAPDH와 비교하여 상대적인 mRNA level을 측정한 결과, G3(0.33±0.39)그룹과 G4(0.51±0.40), G5(0.56±0.50), G6(0.34±0.38) 그룹에서 gastrin에 의해 활 성화 되는 CCK-2r 유전자 발현이 G2(1.39±0.61)에 비해 유의적으로 억제되는 것으로 나타났으며, 이는 G1(0.29 ±0.35)과 유사한 수준으로 나타났다(Fig. 2A). 또한 histamine 에 의해 발현되는 H2r 유전자 발현도 G3(0.50±0.21)그룹과 G4(0.57±0.24), G5(0.42±0.15), G6(0.35±0.14) 그룹에서 G2(1.43±0.51)에 비해 유의적으로 억제 되었으며(Fig. 2B), cAMP와 Ca2+ 농도 증가 등에 의해 활성화 되어 HCl 분비 를 증가시키는 H+/K+ ATPase 유전자 발현에서는 G4 (0.58±0.27), G5(0.68±0.31), G6(0.80±0.29) 그룹에서 대조 군에 비해 유의적으로 억제되는 것으로 나타났다(Fig. 2C). 위산 분비는 스트레스 등의 다양한 원인에 의해 히스타민, 아세틸콜린, gastrin 분비가 증가되고 관련 수용체인 H2r 및 CCK-2r이 증가되면서 가중된다(33,34). 이렇게 증가된 위산은 위의 공격인자로 작용하여 위 점막 손상을 야기한다 (35). 본 연구에서와 같이 인도메타신으로 유발되어지는위 손상 모델에서 까마귀쪽나무열매추출물(LJF-HE)의 위산 분비 억제 기능은 gastrin 및 histamine에 의해 발현되는 CCK-2r와 H2r 유전자의 발현을 억제하여, gastrin 및 histamine에 의한 위산 생성 단계를 조절하여, proton pump 인 H+/K+ ATPase 유전자 발현을 억제시키며, 그 결과로 인하여 위산 분비를 억제하는 것으로 판단되어진다.
요 약
본 연구에서는 까마귀쪽나무열매추출물(LJF-HE)의 흰 쥐모델에서 인도메타신으로 유발되어지는 위염에 대한 억 제효과를 확인하고자 하였다. 까마귀쪽나무열매추출물 투 여그룹(LJF-HE-L, LJF-HE-M, LJF-HE-H)에서 염증길이와 위액량이 control 그룹에 비하여 통계적으로 유의하게 감소 한 결과를 얻었다. 또한 위액량의 유의적인 감소효과로 위 산분비가 억제되어 공격인자 작용이 약해지는 원인과 펩신 의 활성도를 낮추는 원인으로 인하여 위염발생을 억제하는 것으로 판단되어진다. 까마귀쪽나무열매추출물(LJF-HE) 의 위산 분비 억제 기능은 gastrin 및 histamine에 의해 발현 되는 CCK-2r와 H2r 유전자의 발현을 억제하여, gastrin 및 histamine에 의한 위산 생성 단계를 조절하여, proton pump 인 H+/K+ ATPase 유전자 발현을 억제시키며, 그 결과로 인하여 위산 분비를 억제하는 것으로 판단되어진다. 그리 고 까마귀쪽나무열매추출물은 점액을 증가시켜 위 점막을 보호하는 PGE2의 함량을 높여, 위 점막 보호 기능을 나타내 고 있으며, 더불어 염증성 cytokine인 TNF-α와 IL-1β의 생 성을 낮춰주어 염증 매개반응을 저해하는 것으로 판단되어 진다. 이와 같은 결과를 종합하면 까마귀쪽나무열매추출물 (LJF-HE)이 인도메타신으로 유발되어지는 위염에 대한 억 제효과가 있는 것으로 판단되었다.