ARTICLE
폴리페놀 함량이 높은 Hylotelephium erythrosticum 추출물의 항산화 및 항염 활성
김상숙1,*, 박경진1, 이승은2, 이정훈2, 최영훈1
Antioxidant and anti-inflammatory effects of phenolic rich Hylotelephium erythrostictum extracts
Sang Suk Kim1,*, Kyung Jin Park1, Seung Eun Lee2, Jeong Hoon Lee2, Young Hun Choi1
1Citrus Research Institute, National Institute of Horticultural and Herbal Science, RDA, Jeju 63607, Korea
2Department of Herbal Crop Research, National Institute of Horticultural and Herbal Science, RDA, Eumseong 27709, Korea
© The Korean Society of Food Preservation. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Sep 8, 2017; Revised: Oct 10, 2017; Accepted: Oct 11, 2017
Abstract
Hylotelephium erythrostictum is commonly used as a medicinal herb. In this study, H. erythrostictum leaf (HEL), branch (HEB), root (HER), and above ground (HEAG) extracts were evaluated for their antioxidant properties. The antioxidant activities were assayed by three methods based on scavenging of DPPH, ABTS and superoxide anion radical. HEAG extract showed the highest DPPH, ABTS, superoxide anion radical scavenging activities. HEAG extract also exhibited the highest phenolic content (230 mg/g gallic acid equivalent). In our research for anti-inflammatory ingredients, the extract of HEAG inhibited the generation of nitric oxide (NO) in lipopolysaccharide (LPS)-stimulated RAW264.7 macrophage cells. To test the inhibitory effects of HEAG on pro-inflammatory cytokines, we conducted ELISA assay for the measuring the generation of tumor necrosis factor (TNF)-α, IL (interleukin)-1β, and IL(interleukin)-6 in LPS-stimulated RAW264.7 macrophage cells. In these assays, HEAG ethanol extract showed a dose-dependent decrease in the production of TNF-α, IL-1β, and IL-6. Based on these results, extract of HEAG could be the efficient candidate for anti-inflammatory agents.
Keywords: Hylotelephium erythrostictum; anti-inflammatory; nitric oxide; cytokine
서 론
현대의 웰빙 트랜드는 건강을 중시하며 친환경을 내포한 자연주의 성향을 나타내고 있어 환경오염과 합성 화학성분 들에서 나타나는 부작용등에 대한 염려가 없는 순수 식물 성분에 대한 선호도가 높아지고 있다. 이러한 소비자의 건 강한 아름다움에 대한 욕구로 천연물 소재를 활용한 건강식 품, 화장품, 생활용품 등의 개발이 활발히 진행 중이다.
천연물 소재는 오랫동안 사용되고 있는 약재와 같은 식 물을 이용하여 연구가 진행 중이며, 천연물에 함유되어 있 는 다양한 생리활성 성분들이 밝혀지고 있다(1-3). 특히 식 물 속에 존재하는 phytochemical은 각종 미생물, 해충 등과 같은 외부 이물질로부터 자신의 몸을 보호하는 역할을 하는 식물생리활성 영양소로 항산화, 항염, 항균 등에 대한 효능 이 알려지면서 피부친화적이고 안전한 화장품 소재개발에 적용하기 위한 연구가 진행 중이다(4,5). 또한 암, 동맥경화 증 및 염증을 예방과 감소에 크게 기여하는 것으로 보고되 고 있는 항산화 물질은 체내에서 생성되는 활성산소 감소에 영향을 미치는 것으로 알려지고 있다. 이에 활성산소를 조 절하거나 제거하는 능력을 지닌 생리활성물질에 대한 연구 의 필요성이 대두되면서 천연물을 이용한 항산화 및 항염 소재 개발 연구가 활발히 진행되고 있다(6-8).
돌나무과에 속하는 다년생 초본으로 우리나라 전역에서 자생하며 한방에서는 경천이라고 불리는 꿩의비름 (Hylotelephium erythrostictum)을 연구하고자 하였다. 꿩의 비름은 피부병 치료에 사용되며 몸에 열을 내리고 해독작용 과 지혈 작용을 하는 것으로 알려져 민간에서는 뱀이나 독충에 물렸을 때 사용하며, 잎은 뒷면의 표피를 벗기고 피부 화농에 사용하기도 한다(9). 본 연구에서는 항산화 및 항염 활성의 천연물 소재 개발을 위해 꿩의비름 추출물 의 항산화 활성과 함께 염증반응을 효과적으로 억제시키는 항염 활성을 알아보고자 하였다.
재료 및 방법
실험재료
꿩의비름(H. erythrostictum) 뿌리, 잎, 줄기, 지상부 추출 물은 국립원예특작과학원 인삼특작부 추출물 은행에서 분 양 받아 사용하였다. 본 연구에 사용한 꿩의비름 뿌리와 줄기 추출물은 50℃에서 100% 에탄올로 24 h 동안 3회 반복하여 추출하였고, 잎과 지상부는 100% 메탄올로 24 h 동안 3회 반복하여 추출하여 제조되었다.
DPPH radical scavenging 활성 측정
DPPH(1,1-diphenyl-2-picryhydrazyl) 라디칼 소거 활성 실 험은 Blois 방법(10)을 이용하여 사용하였다. 0.2 mM로 준 비된 DPPH 180 μL와 시료 20 μL를 섞고 실온에서 10분간 방치한 후 SpectraMaxⓇ M3 Multi-Mode Microplate Reader(Molecular Devices, Sunnyvale, CA, USA)를 사용하 여 517 nm 에서 흡광도를 측정하였다. DPPH의 흡광도가 50% 감소 할 때 나타나는 시료의 농도(SC50)로 표시 하였으 며, 각 시료는 3회 반복실험을 실시하여 평균값을 구하였다. 이 때 사용된 대조군으로는 vitamin C(Sigma-Aldrich, Damstadt, Germany)를 사용하였다.
ABTS radical scavenging 활성 측정
ABTS(2,2'-azinobis(3-ethylbenzothiazoline-6-sulfonic acid)-diammonium salt) radical 소거활성은 7.4 mM ABTS 와 2.6 mM potassium persulfate를 혼합 후 실온 암소에서 15시간 동안 방치하여 radical을 형성시킨 후 이 용액을 734 nm에서 흡광도 값이 0.70±0.02가 되도록 준비하였다. 준비 된 ABTS 용액 180 μL에 추출물 20 μL를 가하여 실온에서 15분 동안 방치한 다음 734 nm에서 흡광도를 측정하였다. ABTS radical 소거활성은 시료 용액의 첨가구와 무첨가구 사이의 흡광도 차이를 백분율로 나타내었다.
-
A : ABTS 흡광도
-
B : ABTS와 시료 반응액의 흡광도
-
C : 시료를 녹인 용매 흡광도
Superoxide radical scavenging 활성 측정
Superoxide radical 소거활성은 Liu의 방법(11)에 따라 측 정하였다. 준비된 시료 20 μL에 30 mM의 Tris-HCl, buffer(pH 8.0) 100 μL와 100 μM의 phenazine methosulfate (PMS)를 넣고 blank를 560 nm에서 측정한다. 그 다음 500 μM nitro blue tetrazolium(NBT) 40 μL와 500 μM β -nicotinamide adenine dinucleotide(NADH) 20 μL를 혼합한 후 흡광도를 측정한다. 즉, 비효소적으로 PMS/NADH로 유 발된 superoxide radical은 NBT를 자주색의 formazan으로 환원시키며, 생성된 formazan을 측정하기 위해 560 nm에서 10분 동안 반응물의 흡광도를 측정하였다. 시료의 superoxide radical 소거활성은 [(흡광도시료 무첨가-흡광도시료)/흡광 도시료무첨가]×100의 공식으로 계산하였다.
FRAP법에 의한 항산화 활성 측정
추출물에 대한 FRAP(ferric reducing antioxidant power)법 에 의한 항산화 활성은 300 mM acetate buffer(pH 3.6), 40 mM HCl에 용해한 10 mM TPTZ(2,4,6-tripyridyl-s- triazine) 용액 및 20 mM FeCl3·7H2O를 각각 10:1:1 (v/v/v)의 비율로 혼합하여 37℃의 수욕상에서 가온한 것을 FRAP 기질액으 로 사용하였다. 96 well plate에 시료액 40 μL, FRAP 기질액 100 μL 및 증류수 200 μL를 차례로 혼합하여 37℃에서 4분 간 반응시킨 후 593 nm에서 흡광도를 측정하였으며, FeCl3·7H2O를 표준물질로 하여 얻은 표준검정곡선으로부 터 계산하였다.
총 폴리페놀과 총 플라보노이드 함량 측정
꿩의비름 추출물의 총 폴리페놀 함량 측정은 Folin-Denis (12)법을 이용하여 비색 정량하였다. 추출물 100 μL에 증류 수 900 μL를 넣어 total volume이 1 mL가 되도록 희석하였 다. 여기에 Folin-ciocalteus' phenol reagent 100 μL를 첨가하 여 실온에서 5분간 반응 후 Na2CO3 용액(7%, w/v) 200 μL와 증류수 700 μL를 넣어 실온에서 1시간 반응시켰다. 흡광도 는 SpectraMaxⓇ M3 Multi-Mode Microplate Reader (Molecular Devices, Sunnyvale, CA, USA)를 이용하여 720 nm에서 측정하였고, gallic acid를 이용하여 작성한 표준검 정곡선을 이용하여 추출물의 총 폴리페놀 함량을 나타내었 다. 총 플라보노이드 함량은 Moreno 등(13)의 방법을 이용 하여 정량하였다. 추출물 15 μL에 diethylene glycol 150 μL, 1 N NaOH 15 μL를 첨가하여 혼합한 후 상온에서 1시간 반응시키고 UV-spectrophotometer를 사용하여 420 nm에서 흡광도를 측정하였다. Quercetin을 표준물질로 작성한 표준 검정곡선을 이용하여 추출물의 총 플라보노이드 함량을 나타내었다.
세포배양
Korean Cell Line Bank(KCLB, Seoul, Korea)로부터 분양 받아 사용한 RAW264.7 murine macrophage cell은 37℃, 5% CO2 항온기에서 1% penicillin/streptomycin과 10% fetal bovine serum(FBS)이 함유하는 Dulbecco’s modified Eagle’s minimal essential medium(DMEM, Gifco BRL, Grand Island, NJ, USA) 배지를 사용하여 배양하였으며, 3일에 한번 씩 계대하여 사용하였다.
Nitric oxide(NO) 측정
RAW264.7 세포에서의 NO 생성을 확인하기 위해 24 well plate에 1.5×105 cells/mL으로 분주한 후 18시간 배양하 여 준비하였다. 준비된 세포에 1 μg/mL의 lipopolysaccharide (LPS, Sigma-Aldrich, Damstadt, Germany)와 시료를 처리하 여 24시간 배양 후 세포 배양 상등액을 이용하여 NO의 생성을 확인하였다. NO의 생성은 Griess reagent를 사용하 여 흡광도 540 nm에서 측정하였다.
Pro-inflammatory cytokine 억제 활성 측정
Pro-inflammatory cytokine 억제 활성 측정을 위해 RAW264.7 세포를 24 well plate에 1.5×105 cells/mL로 분주 하여 18시간 배양 후 E. coli 유래 LPS를 1 μg/mL로 처리하 여 cytokine의 생성을 유도하였다. Cytokine이 생성된 세포 에 농도별로 시료를 처리하여 24시간 배양 후 상등액을 이용하여 cytokine 생성 억제 활성을 측정하였다. Mouse TNF-α(Invitrogen Corp., Carlsbad, California, USA), IL-1β (R&D System Inc., Minneapolis, Minnesota, USA), IL-6(Invitrogen Corp., Carlsbad, California, USA) ELISA kit 를 사용하여 측정하였다.
세포 생존율 측정
RAW264.7 세포에 대한 세포독성 평가는 24 well plate에 1.5×105 cells/mL로 분주하여 18시간 배양 후 LPS를 1 μ g/mL와 시료를 처리하여 다시 24시간 배양 후 세포 독성을 측정하였다. 24시간 배양된 세포에 WST-1 reagent(Roche Applied Science, Mannheim, Germany)를 10%(v/v)로 첨가 하여 4시간 추가 배양한 후 440 nm에서 흡광도를 측정하였 다.
통계분석
모든 실험은 3회 이상 반복하여 이루어졌으며, 실험 결과 는 각 항목에 따라 평균과 표준편차로 나타내었다. 실험군 과의 차이는 SAS package(Statistical Analysis Program, version 9.1)를 사용하여 Duncan’s multiple range test로 평균 을 비교하여 나타내었고, p<0.05 수준에서 통계적 유의성을 검정하였다.
결과 및 고찰
꿩의비름 부위별 추출물의 항산화 활성
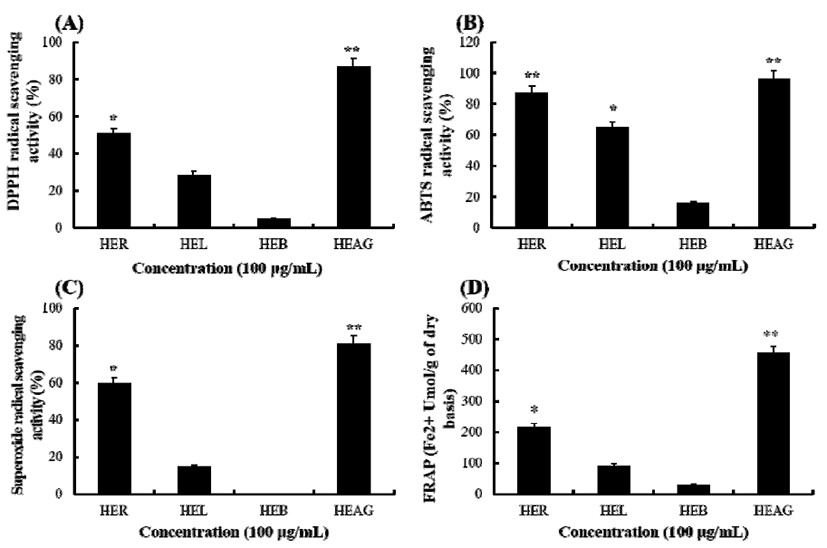
각종 질환 발생에 영향을 미치는 것으로 알려진 활성산 소는 비공유 전자를 갖고 있는 불안정한 분자로 세포 구성 성분들과 쉽게 반응하게 된다. 활성산소는 비선택적이고 비가역적으로 지질과산화, 단백질 변성, DNA 변형 등을 일으켜, 염증, 암, 노화, 혈관질환 자가면역질환 등의 각종 질병을 유발하는 것으로 알려져 있다(14-16). 이러한 활성 산소에 대한 꿩의비름 추출물의 항산화 활성은 시료의 전자 공여에 의한 free radical 소거 활성을 측정할 수 있는 DPPH, ABTS, superoxide anion radical 제거능과 산화, 환원 반응 메카니즘을 이용한 FRAP를 측정하였다. 시료는 인삼특작 부 추출물은행에서 분양 받은 꿩의비름 뿌리(HER), 줄기 (HEB), 잎(HEL), 지상부(HEAG) 추출물을 사용하였으며, 부위별 꿩의 비름 추출물(100 μg/mL)의 항산화 활성을 측정 하여 활성이 가장 우수한 부위를 선발하여 소재화하고자 하였다.
꿩의비름 부위별 추출물의 DPPH와 ABTS radical 소거능 을 알아본 결과 Fig. 1A와 같이 100 μg/mL의 농도에서 DPPH radical 소거능은 각각 HER 50±4.8%, HEL 32±3.5%, HEB 5±3.8%, HEAG가 87±6.1%로 나타났으며, 지상부 추 출물인 HEAG 추출물의 활성이 가장 우수하였다. ABTS radical 소거 활성 역시 Fig. 1B에서와 같이 HEAG는 96±5.7%로 가장 높았으며 HER 87±2.5, HEL 65±3.4%, HEB 16.3±2.1, HER이 87±6.9%의 ABTS radical 소거 활성 을 보였다. 또한 superoxide anion radical 소거능은 DPPH와 ABTS에서와 비슷한 양상으로 HEAG 추출물에서 81±4.4% 로 가장 우수한 라디칼 소거능을 보였으나 HEB 추출물에 서는 소거능을 확인할 수 없었다(Fig. 1C). 호기성 세포의 효소 및 비효소적 단계에서 생성되는 독성이 강한 superoxide anion radical은 노화와 관련된 산화 반응의 개시 단계에서 hydrogen peroxide, hydroxyl radical, singlet oxygen 등과 같은 다른 활성산소종의 생성에 관여하여 지 질, 단백질, DNA 등에 산화적 손상을 유도하는 것으로 알려 져 있다(17,18).이러한 superoxide anion radical 등은 페놀성 화합물들에 의해 소거된다는 보고가 있으며(19), 본 실험 결과 지상부추출물인 HEAG에서 DPPH, ABTS, superoxide anion radical 소거능이 높은 것은 총 폴리페놀 함량이 높기 때문인 것으로 추측된다.
Fig. 1.
DPPH (A), ABTS (B), and superoxide anion (C) radical scavenging activities and FRAP(D) of HER, HEL, HEB, and HEAG.
The data represent the mean±SD of triplicate experiments. *p,0.05, **p,0.01, versus control.
Download Original Figure
또한 FRAP assay에 의한 꿩의비름 부위별 추출물들의 항산화 활성을 측정하였다(Fig. 1D). FRAP assay는 ferric (Fe3+) TPTZ complex가 ferrous(Fe2+) 형태로 환원될 때 발생 하는 청색파장을 흡광도 593 nm에서 측정하는 방법으로 라디칼 소거방식의 항산화 측정법과는 다른 메커니즘의 항산화 측정법이다(20). FRAP assay 결과 HEAG 추출물 100 μg/mL에서 455±21.3 Fe2+μmol/g으로 가장 높았으며, 이는 대조군인 vitamin C의 처리농도 15 μg/mL(487±33.4 Fe2+ μmol/g)과 비숫한 활성으로 항산화 활성이 매우 우수함 을 알 수 있었다. 꿩의비름 부위별 추출물을 이용한 항산화 활성 측정에서 지상부 추출물인 HEAG의 활성이 가장 우수 하였으며 HEAG의 DPPH, ABTS, superoxide anion radical 의 50% 소거 활성인 SC50(μg/mL)은 Table1에서와 같이 각 각 16.95±2.33, 11.24±0.98, 24.93±2.54로 나타났다.
Table 1.
Anti-oxidative activities of HEAG. SC50 value in DPPH, ABTS, and superoxide anion radical scavenging activities of HEAG
|
|
|
HEAG |
AA1) |
|
SC502) (μg/mL) |
DPPH |
16.95±2.33 |
8.78±0.89 |
|
ABTS |
11.24±0.98 |
5.51±0.63 |
|
Superoxide anion |
24.93±2.54 |
1,259±87.35 |
Download Excel Table
HEAG의 총 폴리페놀 및 총 플라보노이드 함량 분석
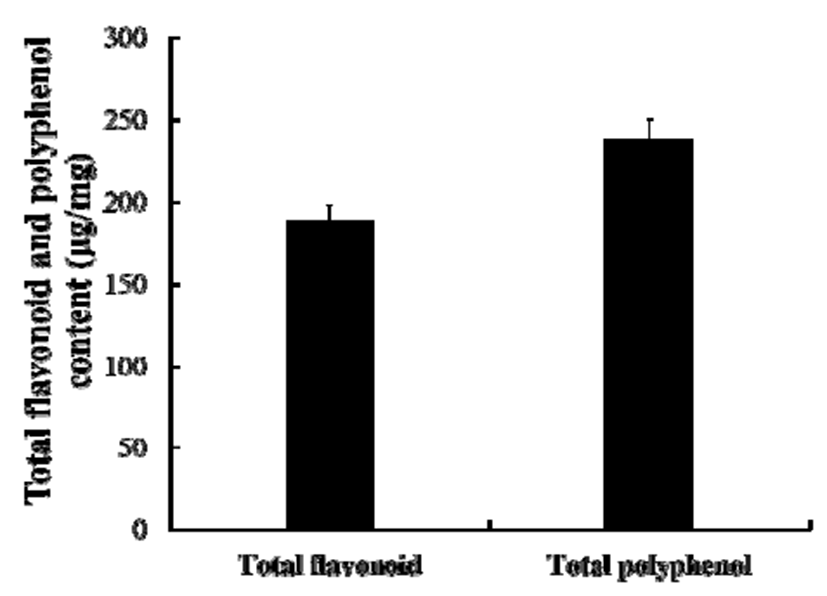
항산화, 항암, 항염 등의 생리 활성을 갖는 것으로 알려진 페놀성 화합물은 식물계에 널리 분포되어 있는 2차 대사산 물의 하나로 다양한 분자량과 구조를 가지고 있다. 이러한 페놀성 화합물의 함량을 항산화 활성이 가장 우수하였던 꿩의비름 지상부 추출물(HEAG)에서 gallic acid를 기준물 질로 사용하여 측정하였다(Fig. 2). HEAG의 총 폴리페놀 함량은 238.5±18.9 mg/g gallic acid equivalent로 높은 수치 를 나타내었다. 이는 항산화 활성이 우수하고 phenolic compound를 다량함유하고 있는 것으로 알려진 감귤 추출 물(150±19.4 mg/g gallic acid equivalent)과 비교해서도 높은 수치이다(21). 또한 자연적으로 생성되는 페놀성 화합물 중 가장 큰 그룹중의 하나로 담황색 또는 노란색 계통의 화합물인 플라보노이드(22-24)의 함량은 quercetin을 기준 물질로 사용하여 측정하였다. HEAG의 총 플라보노이드 함량 역시 189±15.21 mg/g quercetin equivalent로 높게 나타 났다. 꿩의비름 추출물에 다량 함유되어 있는 페놀성 화합 물은 분자 내에 phenolic hydroxyl 기를 가지고 있는 방향족 화합물로 단백질 및 기타 거대 분자들과 쉽게 결합하여 HEAG의 항산화 및 항염 활성에 영향을 줄 것으로 여겨진 다.
Fig. 2.
Total flavonoid and total polyphenol contents of HEAG.
Total flavonoid and polyphenol contents were expressed as quercetin and gallic acid equivallent, respectively. The data represent the mean±SD of triplicate experiments. *p<0.05, **p<0.01,
Download Original Figure
HEAG의 NO와 염증성 cytokine 생성 억제
폴리페놀을 다량 함유하고 있는 꿩의비름 지상부 추출물 인 HEAG에 대한 항염 활성 측정을 위해 대식세포인 RAW264.7을 LPS로 염증을 유도한 후 생성되는 NO와 염증 성 cytokine인 TNF-α, IL-1β, IL-6의 생성 억제 효과를 확인 하고자 하였다. 염증반응은 생체나 조직에 물리적 작용이 나 화학적 물질, 세균 감염 등에 의해 나타나는 생체반응으 로, 일단 자극이 가해지면 국소적으로 염증성 성분과 같은 혈관 활성 물질이 유리되어 부종, 발열, 조직손상, 세포증식 등 여러 질환을 발생 시키는 원인이 된다(25-27).
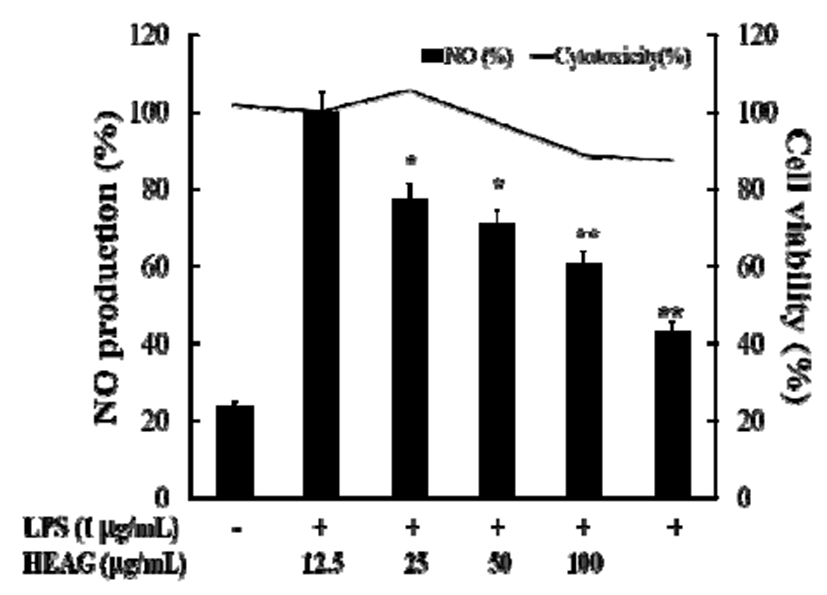
면역반응에서 중요한 역할을 하는 NO의 과도한 생성은 염증을 유발하는 매개인자가 되므로 RAW264.7 대식세포 에서 LPS로 염증 유발하여 NO의 생성을 급속히 증가시킨 후 HEAG를 농도 별로 처리하였다. 내독소로 알려진 LPS에 의해 염증이 유발된 RAW264.7 세포에 HEAG를 처리하였 을 때 농도 의존적으로 NO의 생성이 억제되었고, 100 μ g/mL의 농도로 처리시 LPS 처리군 대비 세포 독성 없이 60% 감소하여 HEAG가 NO의 생성 억제에 관여함을 알 수 있었다(Fig. 3).
Fig. 3.
Inhibitory effects of HEAG on the production of NO in LPS-stimulated RAW264.7 murine macrophage cell.
RAW264.7 cells were treated with extracts and LPS (1 μg/mL) for 24 h. LPS(-), PBS without LPS; LPS (+), PBS with LPS. The data represent the mean±SD of triplicate experiments. *p<0.05, **p<0.01, versus LPS alone.
Download Original Figure
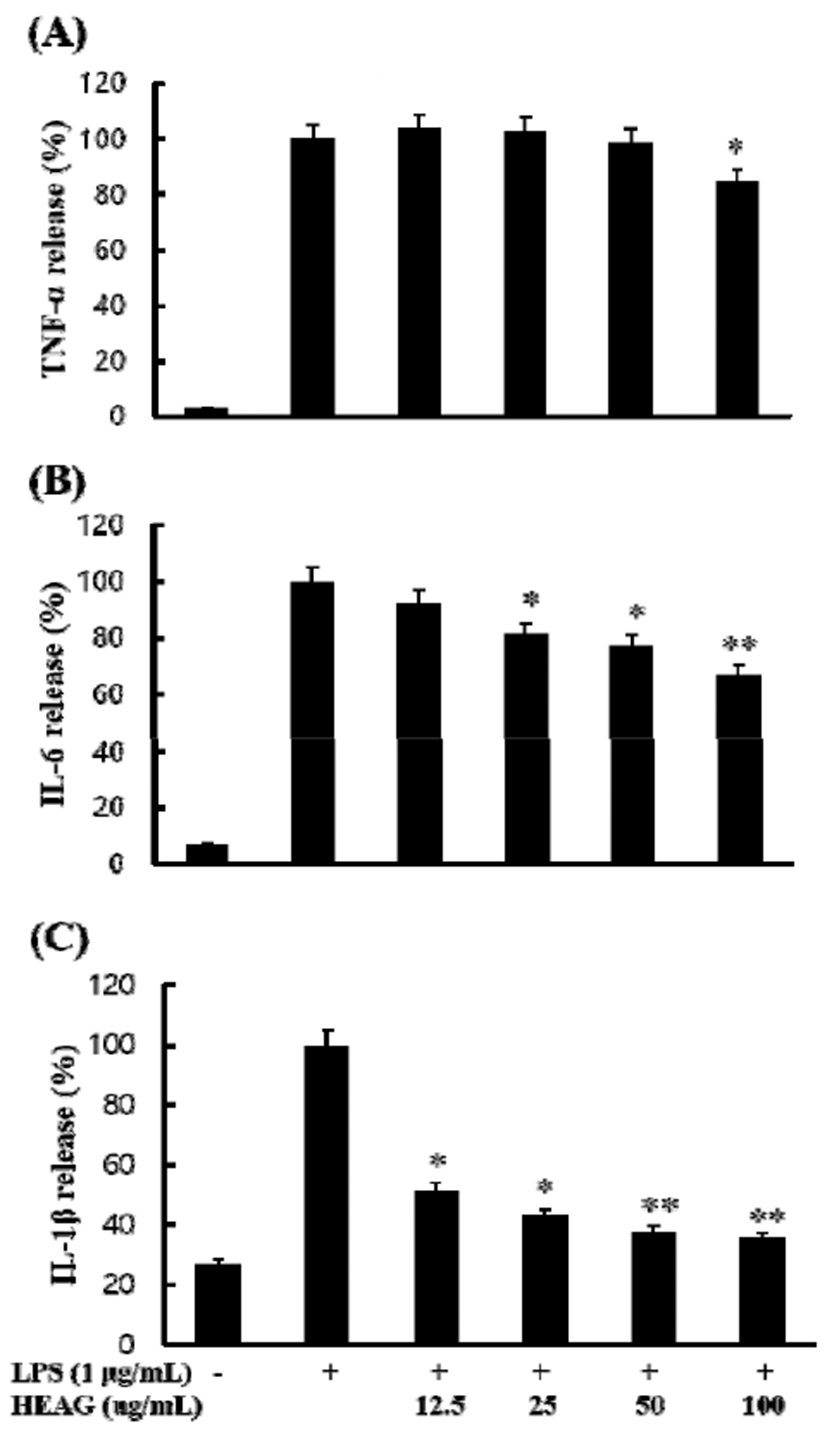
또한 HEAG의 염증 유발 사이토카인의 생성 억제 활성을 알아보기 위해 RAW264.7 세포에 LPS를 18시간 처리하여 TNF-α, IL-1β, IL-6 생성을 유도하고 HEAG를 12.5, 25, 50, 100 μg/mL의 농도별로 처리하여 생성 억제 활성을 측정하 였다. 그 결과 Fig. 4에서와 같이 LPS 처리군 대비 염증성 사이토카인의 생성이 농도 의존적으로 억제하는 것을 확인 할 수 있었다. 염증성 사이토카인 중 TNF-a는 감염초기 호중구와 단핵구가 감염부위로 이동하도록 자극하는 염증 반응 조절에 관여하는 중요한 인자로 HEAG 추출물은 100 μg/mL에서 15% 정도의 저해 활성을 확인할 수 있었으나 피부노화와 관련된 염증 유발인자로 알려진 IL-6와 IL-1β 에 대해서는 100 μg/mL에서 각각 33%와 64%의 우수한 억제활성을 확인 할 수 있었다(28).
Fig. 4.
Inhibitory effects of HEAG on the production of TNF-α (A), IL-6 (B), and IL-1β (C) in LPS-stimulated RAW264.7 murine macrophage cell.
RAW264.7 cells were treated with extracts and LPS (1 μg/mL) for 24 h. The concentrations of TNF-α , IL-6, and IL-1β were measured by ELISA. LPS(-), PBS without LPS; LPS (+), PBS with LPS. The data represent the mean±SD of triplicate experiments. *p<0.05, **p<0.01, versus LPS alone.
Download Original Figure
요 약
피부병 치료에 사용되던 꿩의비름 추출물을 항산화 및 항염 효능을 지니는 천연물 소재로 활용하기 위해 꿩의비름 의 뿌리(HER), 잎(HEL), 줄기(HEB), 지상부(HEAG) 추출 물에 대해 항산화 활성을 측정한 결과 지상부 추출물인 HEAG에서 DPPH, ABTS, superoxide anion radical 소거 활 성이 가장 우수하였으며, FRAP 활성 역시 HEAG에서 가장 우수하였다. 항산화 활성이 가장 우수한 HEAG의 총 폴리 페놀 함량을 측정한 결과 235.5±18.96 mg/g gallic acid equivalent로 항산화 및 항염 활성을 갖는 것으로 알려진 페놀성 화합물을 다량 함유하고 있는 것을 확인할 수 있었 다. 또한 마우스 대식세포인 RAW264.7 세포를 이용하여 항염 활성에서는 NO의 생성을 억제하였으며 염증성 사이 토카인인 IL-1β의 생성 억제 화성이 가장 높았다. 꿩의비름 추출물은 항산화 및 항염 활성의 천연물 소재로 활용이 가능 할 것으로 여겨진다.
감사의 글
본 성과물은 농촌진흥청 연구사업(세부과제: PJ01093402) 의 지원에 의해 이루어진 것입니다.
References
Nanes M.S. Tumor necrosis factor-Iα: molecular and cellular mechanisms in skeletal pathology.. Gene. 2003; 321:1-15


Jeon AL, Kim JE, Lee NH. Whitening and anti-inflammatory constitutes from the extract of Citrullus lanatus vines.. J Soc Cosmet Sci Korea. 2017; :53-60.

Kim S.S., Oh H.J., Baik J.S., Oh T.H., Yun P.Y., Kim C.S., Lee N.H., Hyun C.G. Chemical composition and biological activities of
Elsholtzia splendens essential oil.. J Appl Biol Chem. 2008; 51:69-72


Kim S.S., Hyun C.G., Choi Y.H., Lee N.H. Tyrosinase inhibitory activities of the compounds isolated from
Neolitsea aciculata (Blume) Koidz.. J. Enzyme Inhib. Med. Chem. 2013; 28:685-689


Shih M.F., Cheng Y.D., Shen C.R., Cherng J.Y. A molecular pharmacology study into the anti-inflammatory actions of
Euphorbia hirta L. on the LPS-induced RAW 264.7 cells through selective iNOS protein inhibition.. J. Nat. Med. 2010; 64:330-335


Tsatsanis C., Androulidaki A., Venihaki M., Margioris A.N. Signalling networks regulating cyclooxygenase-2.. Int. J. Biochem. Cell Biol. 2006; 38:1654-1661


Kim M.J., Kim S.S., Park K.J., An H.J., Choi Y.H., Lee N.H., Hyun C.G. Methyl j asmonate inhibits lipopolysaccharide-induced inflammatory cytokine production via mitogen-activated protein kinase and nuclear factor-I B pathways in RAW 264.7 cells.. Pharmazie. 2016; 71:540-543.

Ham Y.M., Yoon W.J., Lee W.J., Kim S.C., Baik J.S., Kim J.H., Lee G.S., Lee N.H., Hyun C.G. Anti-inflammatory effects of isoketocharbroic acid from brown alga,
Sargassum micracanthum.. EXCLI J. 2015; 14:1116-1121.

Yoon E.S. Effect of plant growth regulators on plant regeneration from leaf and stem explant cultures of
Sedum erythrostichum Miq.. Korean J Plant Tissue Culture. 1997; 24:285-289.

Blois M.S. Antioxidant determinations by the use of a stable free radical.. Nature. 1958; 181:1199-1200


Liu F., Ooi V.E., Chang S.T. Free radical scavenging activity of mushroom polysaccharide extracts.. Life Sci. 1997; 60:763-771.

Singleton V.L., Orthofer R., Lamuela-Raventos R.M. Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteu reagent.. Methods Enzymol. 1999; 299:152-178.

Nieva Moreno M.I., Isla M.I., Sampietro A.R., Vattuone M.A. Comparison of the free radical-scavenging activity of propolis from several regions of Argentina.. J. Ethnopharmacol. 2000; 71:109-114.

Devasagayam T.P., Tilak J.C., Boloor K.K., Sane K.S., Ghaskadbi S.S., Lele R.D. Free radicals and antioxidants in human health: Current status and future prospects.. J. Assoc. Physicians India. 2004; 52:794-804.

Valko M., Leibfritz D., Moncol J., Cronin M.T., Mazur M., Telser J. Free radicals and antioxidants in normal physiological functions and human disease.. Int. J. Biochem. Cell Biol. 2007; 39:44-84


Maeda H., Akaike T. Nitric oxide and oxygen radicals in infection, inflammation, and cancer.. Biochemistry (Mosc.). 1998; 63:854-865.

Samak G., Shenoy R.P., Manjunatha S.M., Vinayak K.S. Superoxide and hydroxyl radical scavenging actions of botanical extracts of
Wagatea spicata.. Food Chem. 2009; 115:631-634


Gulcin I., Berashvili D., Gepdiremen A. Antiradical and antioxidant activity of total anthocyanins from
Perillapankinensis decne.. J. Ethnopharmacol. 2005; 101:287-293.

Joung Y.M., Park S.J., Lee K.Y., Lee J.Y., Suh J.K., Hwang S.Y., Park K.E., Kang M.H. Antioxidant and antimicrobial activities of
Lilium species extracts prepared from different aerial parts.. Korean J. Food Sci. Technol. 2007; 39:452-457.

Choi J.S., Kim H.Y., Seo W.T., Lee J.H., Cho K.M. Roasting enhances antioxidant effect of bitter melon (
Momordica charantia L.) increasing in flavan-3-ol and phenolic acid contents.. Food Sci. Biotechnol. 2012; 21:19-26


Kim S.S., Park K.J., An H.J., Choi Y.H. Phytochemical, antioxidant, and antibacterial activities of fermented
Citrus unshiu byproduct.. Food Sci. Biotechnol. 2017; 26:461-466


Kwak J.H., Choi G.N., Park J.H., Kim J.H., Jeong H.R., Jeong C.H., Heo H.J. Antioxidant and neuronal cell protective effect of purple sweet potato extract.. J Agriculture Life Sciences. 2010; 44:57-66.

Lee S.Y., Shin Y.J., Park J.H., Kim S.M., Park C.S. An analysis of the
Gyungokgo's ingredients and a comparison study on anti-oxidation effects according to the kinds of extract.. Kor J Herbology. 2008; 23:123-136.

Kang M.H., Choi C.S., Kim Z.S., Chung H.K., Min K.S., Park C.G., Park H.W. Antioxidative activities of ethanol extract prepared from leaves, seed, branch and aerial part of
Crotalaria sessiflora L.. Korean J. Food Sci. Technol. 2002; 34:1098-1102.

Yoon W.J., Lee J.A., Kim K.N., Kim J.Y., Park S.Y.
In vitro anti-inflammatory activity of the
Artemisia fukudo extracts in murine macrophage RAW 264.7 cells.. Korean J. Food Sci. Technol. 2007; 39:464-469.

Fenton M.J., Golenbock D.T. LPS-binding proteins and receptors.. J. Leukoc. Biol. 1998; 64:25-32


Shih M.F., Cheng Y.D., Shen C.R., Cherng J.Y. A molecular pharmacology study into the anti-inflammatory actions of Euphorbia hirta L. on the LPS-induced RAW 264.7 cells through selective iNOS protein inhibition.. J. Nat. Med. 2010; 64:330-335


Choe S.I., Jo M.J., Kim S.C., Byun S.H. Inhibitory effect of
Sunbanghwalmyungeum MeOH extract on pro-inflammatory mediator in lipopolysaccharide-activated Raw 264.7 cells.. Kor J Herbology. 2008; 23:11-18.