서 론
21세기에 현대인들은 소득 및 교육수준이 높아지고 고령 화 시대에 접어듦에 따라 건강에 대한 관심이 아주 증가되 고 있어 건강식품에 대한 수요가 매우 증대할 것으로 예상 된다. 특히 우리나라의 경우 지속적인 노인인구증가, 식생 활 변화에 의한 다양한 질병들의 증가 및 국민소득 수준 향상에 의한 식품의 건강 기능성에 대한 소비자의 관심 증가 등에 의해 최근 천연자원으로부터 건강유지 및 생명연 장을 위한 노력이 산학협력을 통해 이루어지면서 다양한 기능성을 가진 산채류에 대한 관심이 증가하게 되었다.
생활의 다양화, 국민 생활 수준의 향상과 더불어 건강기 능식품에 대한 인식과 관심이 고조됨에 따라 산채의 수요가 증가되는 추세이다. 한편 산채류는 일반적으로 고유의 특 유한 맛과 향을 가지고 있으며, 영양적인 측면에서 무기물 과 각종 비타민, 약리적인 특수성분을 함유하고 있으며 오 염된 토양, 수질, 공기로부터 해방되고 농약이나 인공 비료 를 사용하지 않아 자연 그대로 오염되지 않은 식품소재를 찾는 시대에 더 없이 좋은 채소로서 최근 항균, 항산화, 항암, 항당뇨 등 다양한 생리활성 효과에 대해 보고되었다 (1-3).
현재까지 일반적으로 사용되고 있는 항산화제는 합성항 산화제인 butylated hydroxy anisole(BHA), butylated hydroxytoluene(BTH), tertiary butylhydroquinone(TBHQ)등 이 있으며 이들 항산화제는 효력이 매우 우수하고 많이 사용되고 있으나 생체효소의 활성을 억제하고 발암성 있고 독성이 강하다는 문제점이 보고되고 있으며 이취와 함께 고온에서 불안정하여 사용규제를 받고 있다(4,5). 따라서 천연물로부터 항산화제를 얻고자 하는 연구가 많이 진행되 고 있다. 또한 항산화 효과를 가지는 물질들이 항염증 효과 를 가질 수 있다는 연구와 연계하여 항산화 효과와 함께 함염증 효과를 가진 천연 물질들을 검토한 연구 결과도 다수 보고되어져 있다(6-8).
염증(inflammation)은 세균이나 바이러스 등의 미생물 또 는 기생충의 감염과 물리학적인 외상, 화학적인 항원-항체 반응 등에 대한 생체 조직의 방어 기전이라고 할 수 있으며, 염증의 발생 부위에는 혈관 투과성 항진과 과립구 및 대식 세포와 같은 세포의 침윤으로 인한 발열, 발적, 작열, 동통과 같은 염증의 4대 징후가 발생된다(9-11).
비만세포는 폐, 코점막, 장점막에 주로 존재하는 점막형 비만세포와 피부, 점막하 조직 등 결체 조직에 많이 분포하 는 결체 조직형 비만세포로 구분할 수 있다(12). 면역글로불 린 E는 비만세포의 탈과립을 유도하는 감작항체로서 Fc epsilon Receptor Ⅰ(FcεRI)와 응집체를 형성하여 비만세포 를 탈과립 시키며 그 외 compound 48/80, protein kinase C(PKC) activator인 phorbol 12-myristate 13-acetate(PMA)와 calcium ionophore A23187 등과 같은 약리학적 복합물질 역시 비만세포를 탈과립시킨다(13,14).
비만세포의 활성화로 헤파린, 히스타민, 세포토닌과 같 은 화학적 매개물질 이외에도 초기 자극에 대한 염증성 사이토카인인 tumor necrosis factor(TNF)-α, Interleukin (IL)-1β, 다음으로 IL-6, IL-8 등이 분비되며 이로 인해 알레 르기, 염증반응이 유도된다(15-18). IL-6와 TNF-α 같은 염 증 사이토카인은 염증성 알레르기성 질환에 수반 된다(19). 단핵구나 대식세포에서 생성된 TNF-α는 점막의 염증 반응 에 중요한 작용을 하는데, TNF-α는 비만세포가 활성되면 분비하는 다기능성 사이토카인으로 면역반응과 염증반응 에 관여한다. 따라서 TNF-α를 과발현시키면 만성 염증성 질환을 지속시킬 수 있고 반대로 TNF-α를 억제하면 만성 염증성 질환이 개선된다고 보고되어 있다. 또 다른 인자인 IL-6은 과잉 생성되었을 때 발열이나 식욕부진, 피로의 증 상을 나타낼 수 있고, 각종 염증, 감염, 외상이 있을 때 증가 된다고 알려져 있다. IL-8은 화학주성을 가지는 케모카인의 일종으로 염증세포를 점막과 점막하로 끌어 모으는 역할을 한다. 이러한 염증성 사이토카인의 과량 생성은 여러 염증 성 질환을 비롯한 알레르기성 질환을 야기시킨다(20,21).
곰취(Ligularia fischeri)는 넓은 잎을 특징으로 하는 취나 물의 일종으로 전국의 심산 수림이나 비옥 습윤한 토양에서 자라는 국화과의 다년생 초본 식물이다. 한국을 비롯한 동 아시아 등지에 분포하고 있으며 고원이나 깊은 산의 습지에 서 자라는 특징을 갖고 있다. 우리나라에서는 봄에 어린잎 을 채취하여 주로 식용으로 이용되며, 최근에는 재배도 이 루어지고 있다. 한방에서는 가을에 뿌리를 캐서 말린 것을 호로칠이라 하며 약리작용으로는 가래를 제거하고 기침을 멎게 하며, 항암, 항균작용이 있고, 민간요법으로 종기의 고름을 빨아내는 작용을 하는 것으로 알려져 있다(22,23). 그러나 곰취에 대한 국내외 연구는 미비하며 최근에 항돌연 변이, 항산화 등에 관한 연구가 보고되고 있는 실정이나 항산화 및 항염증 관련 연구에 관한 효과를 입증할 만한 과학적 근거가 부족하다.
이에 본 연구에서는 영양군에서 생산되는 곰취의 추출 온도에 따른 항산화효과 및 항염증효과를 평가하여 기능성 식품소재 가능성을 확인하고자 하였다.
재료 및 방법
실험에 사용된 곰취(L. fischeri)는 영양군에서 채취하여 햇빛에 말린 후 마쇄하여 분말로 만든 후 항산화 및 항염증 등 각종 생리활성 분석을 실시하였다.
1,1-diphenyl-2-picrylhydrazyl(DPPH), Folin-Ciocalteu's phenol reagent, galic acid, PMA, calcium ionophore A23187, 3-(4, 5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)- 2-(4-sulfophenyl)-2H-tetrazolium(MTT), avidin peroxidase 는 Sigma Chemical Co.(St. Louis, MO, USA)에서 구매하였 다. 또한 Iscove's Modified Dulbecco's Media(IMDM) 및 fetal bovine serum(FBS)은 Hyclone(Hyclone Labs Logan, UT)에서 구입하였고, human TNF-α, IL-6, IL-8 ELISA kit는 BD Biosciences(San Diego, CA, USA)에서 구입하여 사용하 였다. 그 외 시약은 모두 특급시약을 구입하여 사용하였다.
건조된 곰취는 시료 100 g당 10배량(w/w)의 증류수를 가수하여 환류추출장치를 이용하여 3시간 동안 100℃ 혹은 상온에서 각각 3회 추출한 것을 열수추출물(hot water extract, HWE) 및 냉수추출물(cold water extract, CWE)로 명명하였으며, 각각의 추출액은 여과지(Whatman No. 2, England)로 여과하였다. 각각의 여액을 50℃ 수욕상에서 rotary vacuum evaporator(EYELA, Tokyo Rikakikai Co., Tokyo, Japan)로 감압농축한 후 동결 건조하여 수율을 계산 하였으며 4℃ 이하로 냉장보관하면서 실험에 사용하였다.
총 폴리페놀 화합물의 함량을 측정하기 위하여 Folin- Denis 방법을 이용하여 측정하였다. 시료를 농도별로 용해 시킨 후 40 μl와 증류수 1.56 mL를 첨가한 후 0.1 mL Folin-Ciocalteu's phenol reagent를 첨가하여 혼합한 후 5분 간 실온에서 방치하였다. 2 M sodium carbonate 용액 0.3 mL를 가하여 혼합하고 40℃에서 30분간 반응시켜 720 nm 에서 흡광도를 측정하였고, 표준물질은 galic acid를 이용하 여 표준곡선을 작성한 후 이 검량곡선으로부터 시료 중의 총 폴리페놀 함량을 구하였다.
항산화 활성은 DPPH를 이용하여 시료의 라디칼 소거능 (radical scavenging effect)를 측정하는 Blois(24)방법을 이용 하여 실시하였다. 각 분획물을 농도별로 제조한 시료와 0.02 mM DPPH 100 μL를 혼합하여 상온 암소에서 30분간 반응시킨 후 525 nm에서 microplate reader(Sunrise, TECAN, Mannedorf, Switzerland)로 흡광도를 측정하였으며 시료에 대한 대조군은 ascorbic acid를 사용하였다.
인간 비만세포주(Human mast cell)인 HMC-1 세포는 원 광대학교 한약학과로부터 분양받았고, 100 U/mL 페니실 린, 100 mg/mL 스트렙토마이신, 그리고 10% FBS가 추가된 IMDM 배지를 이용하여 37℃의 5% CO2 배양기에서 배양 하였다.
세포생존율은 MTT 분석에 의해서 측정하였다. HMC-1 세포(3×105 cells/mL)를 24 well plate에 1시간 동안 CO2 배양기에서 안정화 한 다음 0.01, 0.1, 0.5 및 1 mg/mL의 농도의 곰취를 1시간 동안 전처리하였다. 다음으로 MTT 용액(5 mg/mL)을 각각의 well에 50 μL씩 첨가한 후 37℃에 서 4시간 보존하였다. 세포배양 상층액과 동량의 DMSO를 첨가하여 MTT를 용해시킨 후 microplate reader기를 이용하 여 570 nm에서 흡광도를 측정하였다.
HMC-1 세포(3×105 cells/mL)를 24 well plate에 1시간 동안 CO2 배양기에서 안정화한 다음 0.01, 0.1, 0.5 및 1 mg/mL의 농도의 곰취를 1시간 동안 전 처리하였다. 여기에 PMA(50 nM)+A23187(1 μM)(PMACI)을 처리한 후 12시간 동안 배양한 후, 상층액을 걷어 TNF-α, IL-6와 IL-8의 변화 량을 측정하였다. 96 well plates에 각 사이토카인에 대한 단클론 항체를 희석한 coating buffer(0.1 M carbonate, pH 9.5)를 100 μL씩 각각 coating한 다음, 4℃에서 밤새 방치되 었으며 0.05% tween-20을 포함한 PBS로 세번 세척하였다. 이 plate를 1% BSA, 5% sucrose, 0.05% NaN3를 함유한 PBS 로 1시간 동안 blocking한다. 배양한 직후 각각의 샘플과 각 사이토카인의 표준물질을 well에 첨가 하였고 plates는 2시간 동안 배양하였다. 각 well을 다시 세정하고 biotin이 결합된 2차 항체를 첨가하여 다시 2시간 동안 방치한다. Well을 씻어낸 다음 avidin peroxidase를 첨가하고 37℃에 30분 동안 암소에 방치한 후, well을 다시 세정한 다음에 기질인 ABTS 용액을 첨가하고, 발색반응은 microplate reader를 사용하여 405 nm에서 측정한다. 모든 standard와 샘플은 동일한 것을 두 개씩 분석 하였다.
결과 및 고찰
영양군 곰취의 항산화 및 항염증 효과를 측정하기 위하 여 햇빛에 자연 건조하여 마쇄한 시료 100 g당 10배량(w/w) 의 증류수를 가수하여 환류추출장치를 이용하여 3시간 동 안 100℃ 혹은 상온에서 각각 3회 추출한 것을 열수추출물 (hot water extract, HWE) 및 냉수추출물(cold water extract, CWE)로 명명하였으며 각각의 추출물을 여과, 감압농축 및 동결건조한 후 고형분 함량을 추출수율(dry basis, %)로 계산한 결과는 Table 1과 같다.
| Fractions | Yield (%, w/w)1)L. fischeri |
|---|---|
| Hot water extract (HWE) | 24.43±1.82 |
| Cold water extract (CWE) | 16.26±1.05 |
열수추출물 및 냉수추출물의 추출수율을 측정한 결과, 각각 24.43±1.82%, 16.26±1.05%(w/w)로 나타났으며 냉수 추출물보다 열수추출물이 150%정도 높은 수율을 나타내 었다. 이러한 결과는 Han(25)의 곰취 열수추출물 수율이 21.97%로 나타났다는 결과와 유사하였으며 You 등(26)의 보고에서 곰취 동결건조 블록의 물 추출물이 7.2%인 것과 는 높은 수율 결과를 나타내었다.
기능성 물질의 대표적인 성분 중 하나인 폴리페놀계 화 합물들은 한 분자 내에 2개 이상의 phenolic hydroxyl(-OH) 기를 가진 방향족 화합물로서 식물체에 특수한 색깔을 부여 하고 충치예방, 고혈압억제, 항산화, 항암 등의 다양한 생리 활성을 가진다(27). 일반적으로 식물 성분의 항산화 활성은 페놀성 화합물이 원인물질로 관련되어 있는 것으로 알려져 있어 gallic acid를 표준용액으로 하여 작성한 표준곡선으로 부터 영양군 곰취 열수추출물및 냉수추출물의 총 폴리페놀 함량을 조사하여 Table 2에 나타내었다.
| Fractions | Polyphenol contents (mg/g, GAE1)) Ligularia fischeri |
|---|---|
| Hot water extract (HWE) | 198.07±0.242) |
| Cold water extract (CWE) | 184.16±1.08 |
영양군 곰취 열수추출물 및 냉수추출물의 총 폴리페놀 함량은 각각 198.07±0.24 μg/mL, 184.16±1.08 μg/mL로 나 타났다. You 등(26)의 곰취 열수추출물의 총 폴리페놀 함량 은 471.66±3.52 μg/mg, Han(25)의 곰취 열수추출물의 총 폴리페놀 함량은 112.07±0.09 μg/mg으로 나타났으며 Jang(28)의 제주도 곰취의 메탄올 추출물의 총 폴리페놀 함량은 50 μg/mg으로 나타났다. 이와 같이 수율 및 총 폴리 페놀 함량이 차이가 나는 것은 곰취의 산지, 수확시기, 야생 및 재배용, 추출 및 측정방법 등의 방법에 기인된 결과로 생각된다.
DPPH 용액은 517 nm에서 강한 흡수를 가지는 보라색의 화합 반응물로서 DPPH 라디컬 반응은 안정한 자유 라디컬 로서 시스테인, 글루타치온과 같은 황함유 아미노산과 아 스콜빅신, 아민화합물 등에 의해 환원되어 탈색되므로 다 양한 천연소재로부터 항산화 성분을 검색하는데 많이 이용 되고 있다. 하지만 자유 라디컬을 소거할 수 있는 항산화제 로부터 전자 혹은 수소를 공유 받아 1,1-diphyenyl-picrylhydrazine 이 되면 보라색이 노란색으로 변화하여 517 nm에서 흡광도 가 감소하는데, 이를 이용하여 쉽게 항산화효과를 측정할 수 있다(29).
대조군으로는 기존에 잘 알려져 있는 수용성 항산화제인 ascorbic acid를 양성대조군으로 하여 DPPH radical 소거활 성을 측정한 결과는 Table 3와 같다. DPPH radical 소거활성 은 검체 농도에 따른 항산화 활성 변화로부터 검량선을 작성하여 산화를 50% 억제시키는 농도인 IC50 값으로 나타 내었다. 양성대조군인 ascorbic acid의 경우 DPPH radical 소거활성은 IC50 값이 3.5±0.01 μg/mL으로 나타났으며 영양 군 곰취의 열수 및 냉수 추출물의 DPPH IC50 값이 각각 28.2±0.04, 40.9±0.05 μg/mL로 나타났다.
| Fractions | DPPH radical scavening activity (ug/mL)1)Ligularia fischeri |
|---|---|
| Hot water extract (HWE) | 28.2±0.042) |
| Cold water extract (CWE) | 40.9±0.05 |
다른 연구자 결과의 경우, DPPH radical 소거활성은 Han(25)의 곰취 열수추출물의 IC50 값이 1.94 mg/mL로 보고 한 바 있으며, You 등(26)의 곰취 열수추출물 50 ppm 농도에 서 60% 소거활성을 나타내었다고 보고하였으며 Lee(30)의 곰취 열수추출물 100 ppm 농도에서 28% 소거활성을, Jang(28)의 제주도 곰취 메탄올 추출물의 IC50 값이 8.6±1 μg/mL, ascorbic acid의 IC50 값이 2.7±0.1 μg/mL로 나타내었 다고 보고하였다. 이로부터 물층 분획물에서는 IC50 값이 37.2 μg/mL로 나타났다. 건강기능식품 소재로 알려져 있는 포도씨(grape seeds)의 메탄올 추출물의 DPPH IC50 값은 56.7 μg/mL, 블랙 라스베리 메탄올 추출물의 DPPH IC50 값은 40.9 μg/mL, 양성대조군인 ascorbic acid의 IC50 값이 17.9 μg/mL로 나타났다(31). 약용식물의 물 추출물은 총 폴리페놀 함량과 항산화 효과와의 높은 상관관계가 있는 것으로 알려져 있다(32).
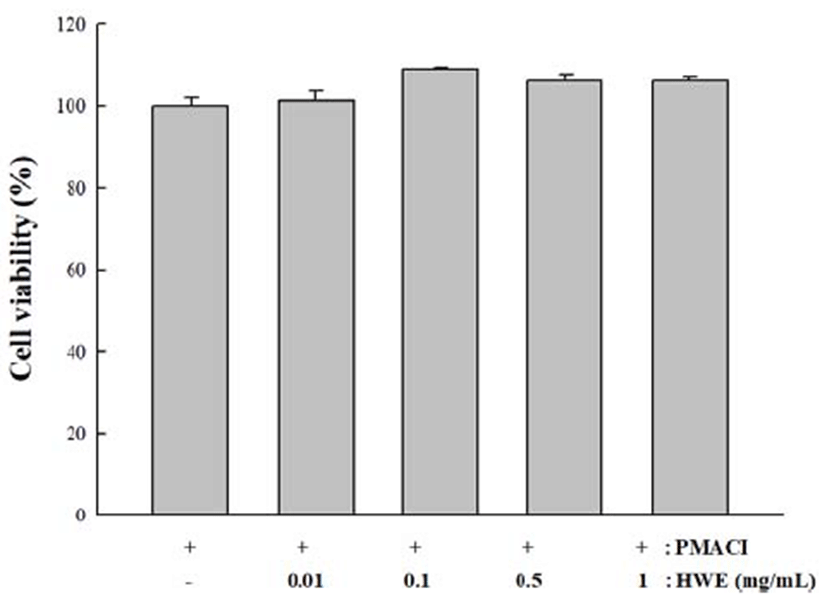
HMC-1에서 곰취의 세포독성 효과는 MTT 분석에 의해 서 측정되었다. Fig. 1은 곰취를 0.01, 0.1, 0.5 및 1 mg/mL의 농도로 처리하였을 때 HMC-1의 생존율에 영향을 미치지 않는다는 것을 보여준다. 따라서 본 실험에 사용한 영양군 에서 자생하는 곰취의 세포독성은 없는 것으로 판단된다.
염증(inflammation) 반응은 인체에서 상해작용(감염, 상 처 등)에 대한 생체조직의 반응이며, 혈관반응을 통하여 세포성분과 액체성분이 해당부위에 모여 상해인자를 제거 하는 과정이다(33). 염증 반응은 그 원인과 부위에 관계없이 아주 유사한 변화를 보이는데 염증 반응을 중개하는 물질로 는 즉시형 혈관투과성 항진에 관여하는 amine류(serotonin, histamine 등)와 kinin류(bradykinin 등), 지연형 반응에 주로 작용하는 사이토카인류, 아라키돈산 대사산물류(prostaglandin, PG), 산화질소(nitric oxide, NO) 등으로 분류 할 수 있다(34).
Calcium ionophore A23187은 칼슘 이온 운반체이고, PMA는 PGE2의 합성을 촉진하여 결과적으로 골흡수를 증 가시켜 혈장 칼슘 항상성 조절에 중요한 생리적 기능을 가지고 있으므로, 비만세포를 PMA와 A23187로 동시에 자 극할 경우 사이토카인이 대량 생산되는 것으로 잘 알려져 있다(35). 염증관련 사이토카인은 세포 간 상호작용에 관여 하는 가용성 peptide로 각종 세포가 자극을 받게 되면 생성 된다. 염증 반응 시 비만세포는 TNF-α, IL-6, IL-8과 같은 인자를 생성한다. TNF-α, IL-6, IL-8은 사이토카인으로서 단핵구 등 면역세포 뿐만 아니라 내피세포, 상피세포, 성상 세포 등에서도 물리적, 화학적, 면역학적 자극에 의해 분비 된다.Fig. 2Fig. 3
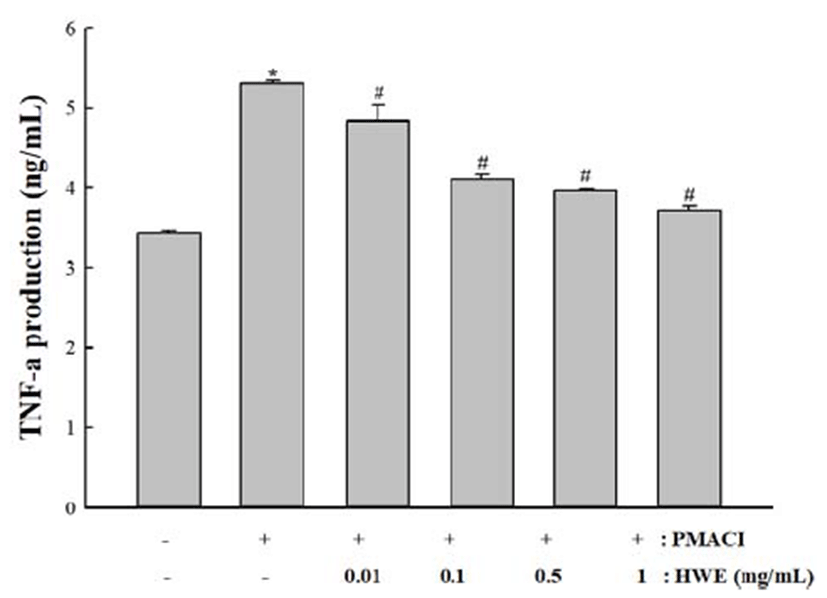
TNF-α는 전염증성 인자로 알레르기 초기 반응에 관여하 는 주요한 매개물로 잘 알려져 있다. 본 실험에서는 곰취의 TNF-α 생성에 미치는 영향을 조사하였다. HMC-1 세포에 다양한 농도의(0.01, 0.1, 0.5 및 1 mg/mL)의 곰취 추출물을 전처리 후 PMACI로 자극하였다. 세포에서 분비된 TNF-α 의 농도는 ELISA 방법으로 측정하였다. 실험 결과. 대조군 에 비해 PMACI에 의하여 TNF-α의 생성은 증가하였으나, 곰취 추출물에 의하여 농도 의존적으로 억제하였다.
단핵구나 대식세포에서 생성된 TNF-α는 점막의 염증 반응에 중요한 작용을 하는데, 기질세포로부터 metalloproteinase 의 분비를 유도하여 조직손상을 초래하고, 내피세포를 직 접적으로 활성화시켜 ICAM-1과 같은 부착분자의 발현을 증가시킨다(36). 또한 내피세포와 점막 단핵구로부터 다양 한 사이토카인과 케모카인의 발현을 유도하며, 상피세포의 사멸을 유도하여 점막층을 파괴하고 염증반응이 지속적으 로 일어날 수 있도록 한다. 따라서 TNF-α를 과발현시키면 만성 염증성 질환을 지속시킬 수 있고 반대로 TNF-α를 억제 하면 만성 염증성 질환이 개선된다고 보고되어 있다.
비만세포는 골수에서 유래한 세포로 과립 속에 많은 활 성아민을 가지고 있는 중요 면역세포로 알려져 있다. 인체 내에서 비만세포는 고르게 분포되어 있으며 특히 결합조 직, 외부환경과 맞닿아 있는 피부, 호흡기, 위장관의 점막 등에서 다량 발견된다. 비만세포는 혈액 응고 억제, 혈관 투과성 증가 등을 비롯하여 알레르기 반응의 유발에 필수적 인 세포로 알려져 있다(37). 비만세포는 anti-IgE를 비롯한 PMA, calcium ionophore A23187과 compound 48/80과 같은 면역학적 및 약리학적 자극원에 의해 활성화 된다. 비만세 포가 활성화되면, TNF-α, IL-1β, IL-6과 IL-8 등 염증성 사이 토카인의 생성뿐만 아니라 히스타민과 같은 가려움 유발물 질을 방출한다(15,16). 특히 IL-6은 과잉 생성되었을 때 발 열이나 식욕부진, 피로의 증상을 나타낼 수 있고, 각종 염증, 감염, 외상이 있을 때 증가된다고 알려져 있다(38).
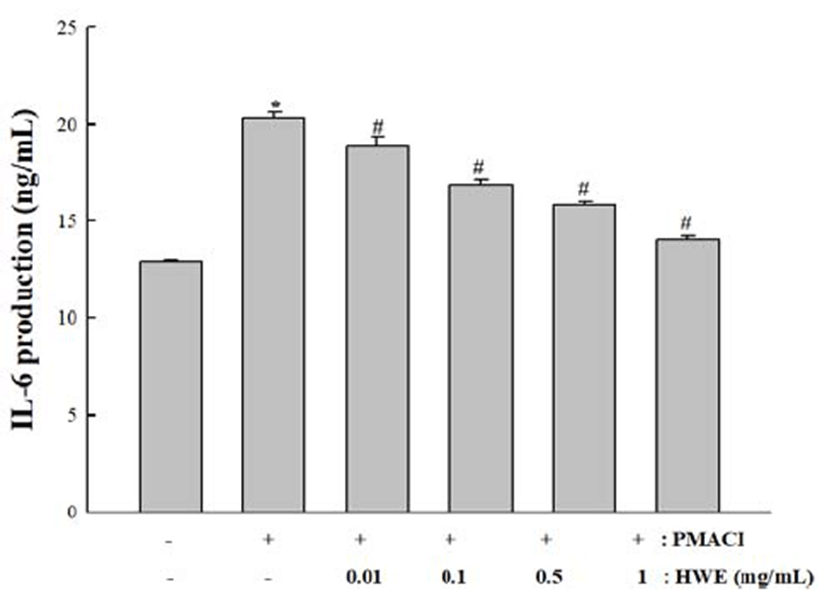
IL-6는 전염증성 인자로 다양한 염증 초기 반응에 관여하 는 주요한 매개물로 잘 알려져 있다. 본 실험에서는 곰취의 IL-6 생성에 미치는 영향을 조사하였다. HMC-1 세포에 다 양한 농도의(0.01, 0.1, 0.5 및 1 mg/mL)의 곰취 추출물을 전처리 후 PMACI로 자극하였다. 세포에서 분비된 IL-6의 농도는 ELISA 방법으로 측정하였다. 실험 결과. 대조군에 비해 PMACI에 의하여 IL-6의 생성은 증가하였으나, 곰취 추출물에 의하여 농도 의존적으로 억제하였다.
IL-8은 화학주성을 가지는 케모카인의 일종으로 염증세 포를 점막과 점막 하로 끌어 모으는 화학유인 사이토카인이 다. 이러한 염증성 사이토카인의 과량 생성은 여러 염증성 질환을 비롯한 알레르기성 질환을 야기시킨다.
본 실험에서는 곰취의 IL-8 생성에 미치는 영향을 조사하 였다. HMC-1 세포에 다양한 농도의(0.01, 0.1, 0.5 및 1 mg/mL)의 곰취 추출물을 전처리 후 PMACI로 자극하였다. 실험 결과. 대조군에 비해 PMACI에 의하여 IL-8의 생성은 증가하였으나, 곰취 추출물에 의하여 농도 의존적으로 억 제 하였다.Fig. 4
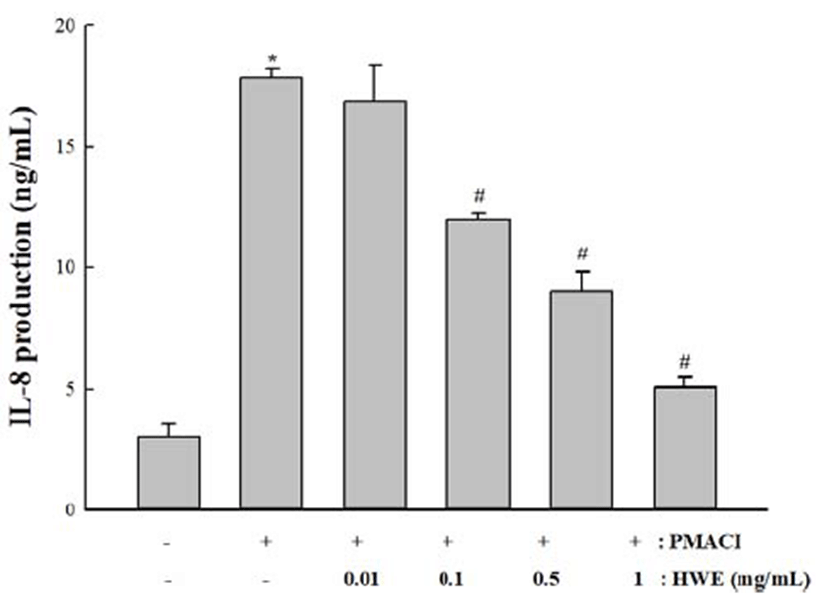
본 실험에서는 활성화된 HMC-1 세포에 처리했을 때 염 증성 사이토카인인 TNF-α, IL-6 및 IL-8의 생성에 대한 곰취 추출물의 효과를 확인하기 위해 세포배양액으로부터 TNF- α, IL-6 및 IL-8의 농도를 ELISA의 방법으로 측정한 결과 TNF-α, IL-6 및 IL-8 의 생성이 곰취 추출물의 농도 의존적 으로 감소하였으며 각각의 고농도의 곰취 추출물의 억제율 은 각각 30.1, 31와 71.7%로 확인되었다. 또한, 곰취 추출물 의 세포독성 여부를 판단하기 위해 MTT법으로 측정한 결 과 곰취 추출물이 세포생존율에 영향을 주지 않는 것으로 확인되었다. 이 결과로부터 곰취는 염증 매개인자인 TNF- α, IL-6와 IL-8의 생성억제를 통해 염증성 질환에 효과를 보임을 알 수 있다.
본 연구에서는 곰취의 염증성 질환에 대한 효능을 활성 화된 비만세포로부터 분비되는 다양한 염증성 인자를 조절 하는 효과가 있음을 입증하였다. 이 결과에 기초하여 곰취 는 염증성 질환의 치료에 효과가 있다는 것을 추측할 수 있다.
요 약
본 연구는 대표적인 산채지역으로 알려져 있는 영양군 곰취 열수추출물의 총 폴리페놀 함량과 DPPH 라디컬 소거 능을 측정하였으며 사람 비만세포주인 HMC-1 세포를 이 용하여 PMACI을 처리하여 비만세포를 활성화시켜 세포 생존률을 확인하였고, 염증성 사이토카인인 TNF-α, IL-6, IL-8의 변화량을 측정하여 곰취의 기능성 식품 소재로서의 이용 가능성을 알아보고자 실험을 실시하였다.
영양군 곰취 열수 추출물의 추출수율은 원물 건조량 대 비 24.43±1.82%(w/w), 총 폴리페놀 함량은 198.07±0.24 mg/g 으로 다른 곰취 추출물의 연구결과와 유사한 값을 나타내고, 영양군 곰취 열수 추출물의 DPPH radical 소거 활성을 측정한 결과, IC50 값이 28.2±0.04 μg/mL로 양성대조 군인 ascorbic acid의 IC50 값 3.5±0.01 μg/mL보다 낮은 항산 화활성을 보였으나 일반 천연물 유래 추출물보다 비교적 높은 항산화활성을 나타내었다. 영양군 곰취 열수 추출물 을 HMC-1 세포에 처리했을 때 MTT assay법으로 분석한 결과, 세포 생존률에는 아무런 영향을 미치지 않고, TNF-α, IL-6, IL-8 생성에 대한 억제효과는 유의성 있게 나타났다.
이상의 결과를 종합해 보면 항산화력 및 세포를 이용한 in vitro 실험을 실시한 결과 영양군 곰취 열수 추출물은 항산화력이 매우 우수할 뿐만 아니라 항염증효과도 뛰어나 향후 기능성 소재로서의 이용 가능성이 높은 것으로 판단되 나 보다 다양하고 진보된 연구로 곰취의 염증성 질환 치료 에 대한 정확한 기전이 설명되어야 할 것이다.