서 론
인체는 산화적 스트레스로부터 자신을 보호하기 위해 활성산소종으로부터 숙주를 보호하는 방어체계를 가지고 있으나, 산화적 스트레스의 강도가 클 경우 생체 내 산화작 용을 효율적으로 예방하기 위해 지속적인 항산화 물질 섭취 가 필요하다(1). 항산화제로 알려져 있는 2차 대사산물인 페놀화합물은 채소류, 과일 및 한약재 등과 같은 식물 소재 에 다량 함유되어 있어 가공식품의 주원료 또는 부재료로 건강 기능 증진을 위한 소재로 이용되고 있으며, 식물 소재 에 대한 항산화 활성 연구가 수행되어져 왔다(2,3). 항산화 활성을 가지는 원료는 염증성 질환에도 효과를 보이는데, 염증반응은 여러 가지 형태의 감염이나 생체 내 대사산물 중의 자극성 물질에 대한 생체 방어기작이다. Nitric oxide(NO)는 염증반응의 대표적인 매개체로 혈압조절 및 신경전달 작용 등의 역할을 하지만, 체내에 필요 이상으로 생성되면 세포 사멸 및 면역 체계 이상을 나타낸다(4,5). 이러한 염증반응에서 방어적 역할을 담당하는 대식세포는 혈액단핵세포로부터분화한조직세포이며, lipopolysaccharide (LPS)는 대식세포 표면의 toll-like receptor(TLR)를 자극하 여 신호전달경로의 활성화를 유도하고, 유도된 신호전달경 로는 여러 가지 염증성 매개인자들의 발현을 유도한다(6).
현대인들의 항산화와 염증 및 면역에 관한 관심은 현재 생활수준의 급속한 향상과 함께 많은 성인병이 보편화된 것과 여유로운 생활과 건강한 삶을 추구하는 것에 기인한 다. 이에 따라 질환예방의 목적으로 최근 생리활성을 가지 는 식품에 대한 연구가 활발히 진행 중이며, 한국인의 취향 에 맞는 건강기능식품들이 많이 개발되고 있다(7,8). 그 중 생맥산(生脈散)은맥문동(Liriope platyphylla), 오미자(Schizandra chinensis) 및 인삼(Panax ginseng C.A. Meyer)을 추출 및 혼합하여 만든 전통한방음료로서 원기부족, 식욕부진, 여 름철 더위에 땀을 많이 흘려 기운이 없거나 마른기침을 하고 식은땀을 흘릴 때 예로부터 음용하여 왔으며, 전신의 생리기능을 촉진하여 심장기능 회복 및 면역증강에도 응용 되고 있다(9).
생맥산 원료 중 맥문동(Liriope platyphylla)은 백합과에 속하는 다년생 초본 약용식물로 우리나라, 중국, 일본 등에 분포하며, 주로 덩이뿌리를 한약재로 폐기능 및 체력 향상 을 돕는 약재로서 기침, 가래, 해열 등 약리작용을 한다 (10,11). 맥문동의 다양한 생리활성물질에 관한 연구로는 ophiogonine-A 등 7종류의 saponin과 flavonoid sterol, isoflavonoid, stigmasterol, β-sitosterol, polysaccharides 및 oligosaccharides 등이 있으며, steroid saponin의 항암효과와 그 외 항염증, 미생물 억제, 혈당강하, 당뇨예방, 기억력 증진 등의 기능이 있다고 알려져 있다(12,13). 오미자는 오 미자나무과(Schisandraceae)에 속하는 오미자나무(Schizandra chinensis Baillon)의 열매로서 신경쇠약, 두통, 간염 등의 치료 및 진해, 거담 효과를 나타내는 한약재이다. 오미자의 약리기능은 항산화작용, 면역력증강, 항균효과 및 위암세 포 사멸 등 다양한 연구가 수행되었다(14,15). 오미자의 주 성분은 lignan 화합물이고, palmitic acid와 stearic acid 등의 지방산, anthocyanin 등의 색소 및 유기산 등을 함유하고 있다(16). 인삼은 오갈피나무과(Araliaceae)의 인삼속에 속 하는 다년생 초본 약용식물로 사용된 역사가 깊은 우리나라 의 대표적인 한약재이다(17). 주요한 생리활성 물질로는 ginsenosides, polyacetylenes, 페놀성 화합물(18,19)과 면역 활성, 항종양활성 혈당강하효능 등을 가지는 다당체 성분 들이 있으며(20), 항피로작용, 면역력 증진, 항암, 항산화 효과 및 몸속의 지방 대사를 촉진시키는 기능성 식품으로 알려져 있다(21,22). 이처럼 맥문동, 오미자 및 인삼 혼합추 출물인 생맥산은 많은 약리작용과 효능을 가지고 있음에도 불구하고, 생맥산 원료인 맥문동, 오미자 및 인삼 각각에 대한 연구는 활발히 진행되고 있지만 생맥산 자체에 대한 연구는 미흡한 실정이다.
따라서 본 연구에서는 맥문동, 오미자 및 인삼의 혼합비 율에 따른 추출물의 이화학적 특성과 항산화 활성 및 NO 생성 억제능을 비교분석하여 기능성이 증진된 맥문동, 오 미자 및 인삼 혼합비율을 설정하고, 이를 이용한 기능성 식품소재 개발을 위한 기초자료를 제공하고자 한다.
재료 및 방법
본 실험에 사용된 맥문동은 충청남도 청양군, 건오미자 는 경상북도 문경시 및 인삼은 경상북도 영주시에서 재배되 어 건조된 것을 2016년 12월 경상북도 영천시 소재 농업회 사법인 두손애약초에서 구입하여 사용하였으며, 구입한 재 료는 냉장 보관하였다.
맥문동은 열풍건조기(OF-22, Jeiotech, Daejeon, Korea)에 서 50℃, 24시간 건조하여 수분함량이 10%가 되도록 하였 다. 그 후, 맥문동 및 인삼을 건식분쇄기(NSG-1002SS, Hanil, Sejong, Korea)로 각각 분쇄하여 60 mesh 이하의 분말 과 건오미자 원시료를 Table 1과 같이 비율별로 혼합한 시료 30 g에 증류수 300 mL를 첨가하였다. 환류냉각추출기 (CA-1112, Eyela Co., Tokyo, Japan)를 이용하여 100℃에서 4시간 추출하였으며, 각각의 추출물은 여과지(Whatman No. 2)를 이용하여 불순물을 제거하였다. 여과된 용액은 감압농축기(Model N-1N, Eyela Co., Tokyo, Japan)를 이용 하여 농축한 후, 동결건조기(Free Zone 2.5, Labconco Co., Kansas, MO, USA)로 건조하여 -70℃ 이하의 암소에 보관하 면서 분석용 시료로 사용하였다.
| Samples1) | Liriope platyphylla | Schizandra chinensis | Panax ginseng C.A. Meyer |
|---|---|---|---|
| MEC | 2 | 1 | 1 |
| ME1 | 1 | 2 | 1 |
| ME2 | 1 | 1 | 2 |
| ME3 | 1.34 | 1.33 | 1.33 |
MEC, Mixed extract of control (Liriope platyphylla : Schizandra chinensis : Panax ginseng C.A. Meyer = 2 : 1 : 1); ME1, Mixed extract 1 (Liriope platyphylla : Schizandra chinensis : Panax ginseng C.A. Meyer = 1 : 2 : 1); ME2, Mixed extract 2 (Liriope platyphylla : Schizandra chinensis : Panax ginseng C.A. Meyer = 1 : 1 : 2); ME3, Mixed extract 3 (Liriope platyphylla : Schizandra chinensis : Panax ginseng C.A. Meyer = 1.34 : 1.33 : 1.33).
맥문동, 오미자 및 인삼 혼합추출물의 수율은 동결건조 (Free Zone 2.5, Labconco Co.)한 다음 건물 중량을 구하였고 시료 제조에 사용한 원료 건물량에 대한 백분율로 나타내었 다.
총 폴리페놀 함량은 Folin-Denis법(23)에 따라 측정하였 다. 시료 1 mL와 1 N Folin Ciocalteu reagent 1 mL를 혼합한 다음 20% Na2CO3 1 mL를 첨가하여 실온의 암소에서 30분 간 반응시킨 후 분광광도계(Ultrospec 2100pro, Biochrom Ltd., Cambridge, UK)를 이용하여 725 nm에서 흡광도를 측정하였다. 총 폴리페놀 함량은 tannic acid(Sigma-Aldrich Co., St. Louis, MO, USA)로 표준곡선을작성하여계산하였다.
총 플라보노이드 함량은 Jia 등(24)의 방법을 응용하여 측정하였다. 시료 1 mL와 5% NaNO2 150 μL를 실온에서 6분간 혼합 및 반응시킨 후 10% AlCl3 300 μL와 혼합하여 다시 실온에서 5분간 반응 시킨 다음 1 N NaOH 1 mL와 혼합한 다음 분광광도계(Ultrospec 2100pro, Biochrom Ltd.) 를 이용하여 510 nm에서 흡광도를 측정하였다. 총 플라보 노이드함량은 rutin(Sigma-Aldrich Co.)으로 표준곡선을 작 성하여 계산하였다.
총 당 함량은 phenol-sulfuric acid 방법(25)을 응용하여 측정하였다. 시료 1 mL와 5% phenol 1 mL 및 진한 H2SO4 5 mL를 혼합하여 20분간 반응 시킨 후, 분광광도계 (Ultrospec 2100pro, Biochrom Ltd.)를 이용하여 470 nm에서 흡광도를 측정하였다.
1,1-diphenyl-2-picryl hydrazyl(DPPH) radical 소거활성 (26)은 DPPH 용액을 DPPH 12 mg을 99.9% ethanol 100 mL에 용해한 후, 증류수 100 mL 첨가하여 흡광도 517 nm에 서 약 1.5로 조정 및 제조하여 실험하였다. 시료 0.5 mL와 DPPH reagent 5 mL를 혼합하여 실온에서 15분간 반응시킨 후, 분광광도계(Ultrospec 2100pro, Biochrom Ltd.)로 흡광 도를 측정하고 계산하였다.
2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)(ABTS) radical 소거활성은 7.4 mM ABTS(Sigma-Aldrich Co.)와 2.45 mM potassium persulfate를 최종 농도로 혼합하여 실온의 암소에서 24시간 동안 방치하여 ABTS+을 형성시킨 후 흡광도 732 nm에서 0.70±0.03이 되도록 phosphate buffer saline(PBS, pH 7.4)으로 희석하여 실험하였다(27). 희석된 용 액 180 μL에 시료 20 μL를 혼합하여 1분간 반응시킨 다음 분광광도계(Ultraspec 2100pro, Biochrom Ltd.)를 이용하여 흡 광도 732 nm에서 측정하였다. ABTS radical 소거활성은 추출 물의 첨가 전과 후의 차이를 계산하였다.
Superoxide radical 소거활성은 Nishikimi 등(28)의 방법에 따라 측정하였다. 시료 500 μL와 0.1 M Tris-HCl 완충용액 (pH 8.5) 100 μL, 100 μM phenazine methosulfate(PMS, Sigma-Aldrich Co.) 200 μL를 혼합시킨 후, 500 μL nitro blue tetrazolium(NBT, Sigma-Aldrich Co.) 200 μL 및 500 μM β-nicotinamide adenine dinucleotide(NADH, Sigma- Aldrich Co.) 400 μL를 첨가하여 실온에서 10분간 반응시킨 다음 분광광도계(Ultraspec 2100pro, Biochrom Ltd.)를 이용 하여 흡광도 560 nm에서 측정하였다. Superoxide radical 소거활성은 추출물의 첨가 전과 후의 차이를 계산하였다.
DPPH, ABTS, Superoxide radical 소거활성은 양성대조군 으로서 ascorbic acid를 사용하여 활성을 비교하였다.
FRAP는 Benzie와 Strain의 방법(29)에 따라 측정하였다. FRAP 용액은 25 mL acetate buffer(300 mM, pH 3.6), 40 mM HCl에 용해한 10 mM 2,4,6-tris(2-pyridyl)-s-triazine (TPTZ, Sigma-Aldrich Co.) 2.5 mL 및 20 mM ferric chloride(FeCl3) 2.5 mL를 혼합하여 제조한 후, 37℃에서 10 분간 가온하였다. 시료 30 μL와 제조된 FRAP 용액 900 μL 및 증류수 90 μL를 넣은 후 상온에서 30분간 반응시킨 후 분광광도계(Ultraspec 2100pro, Biochrom Ltd.)를 이용하 여 흡광도 510 nm에서 측정하였다. FRAP는 FeSO4· 7H2O(Sigma-Aldrich Co.)로 표준곡선을 작성하여 계산하 였다.
실험에 사용한 인간 폐상피세포주인 L-132 세포 및 대식 세포주인 RAW264.7 세포는 한국세포주은행(KTCC, Seoul, Korea)에서 분양받아 사용하였다. 세포배양은 dulbeco’s modifled eagle’s media(DMEM) 배지(Welgene, Daegu, Korea)를 이용하여 각각 10% fetal bovine serum(Gibco BRL Co., Grand Island, NY, USA), 1% penicillin-streptomycin (Gibco BRL Co.)을 첨가하여 배양하였다. 세포는 모두 3 7℃, 5% CO2 incubactor(MCO-18 AIC, Sanyo Co., Osaka, Japan)에서 배양하였다.
L-132 세포 및 RAW264.7 세포의 세포독성은 methyl thiazol-2-YL-2,5-diphenyl tetrazolium bromide(MTT) assay 로 측정하였으며, 배양된 세포주를 각각 1×104 및 5×104 cell/well의 농도로 조정하여 96 well plate에 100 μL씩 첨가 하여 24시간 배양하고 이후 새로운 배지에 시료를 농도별 로 처리한 다음 24시간 동안 배양하였다. 배양 후 PBS 완충 용액에 녹인 MTT(5 mg/mL, Sigma-Aldrich Co.) 용액을 각 well에 10 μL씩 첨가하고 다시 4시간 동안 배양하여 MTT가 환원되도록 하였다. 이후 상등액을 완전히 제거하고 dimethyl sulfoxide(DMSO, Junsei Chemical Co., Tokyo, Jpan) 100 μL를 각 well에 첨가하여 10분간 반응시켜 formazan 결정을 완전히 용해한 다음 microplate reader (UVM-340, Asys Co., Biochrom, Cambridge, UK)를 이용하 여 흡광도 540 nm에서 측정하였다.
L-132 세포를 이용한 세포보호 효과는 Hwang(30)의 방 법을 응용하여 측정하였다. 배양된 L-132 세포를 1×104 cell/well의 농도로 조정하여 96 well plate에 100 μL씩 첨가 하여 24시간 배양하였다. 그 후, 새로운 배지로 교환하고 H2O2(Duksan pure chemicals Co., Ltd., Ansan, Korea) 1 mM 및 시료를 농도별로 처리한 다음 6시간 동안 배양하였다. 배양 완료 후, PBS 완충용액에 녹인 MTT(5 mg/mL, Sigma-Aldrich Co.) 용액을 각 well에 10 μL씩 첨가하고 2시간 동안 배양하여 MTT가 환원되도록 하였다. 이후 상등 액을 모두 제거하고 DMSO(Junsei Chemical Co.) 100 μL를 각 well에 첨가하여 10분간 반응시켜 formazan 결정을 용해 한 다음 microplate reader (UVM-340, Asys Co.)를 이용하여 흡광도 540 nm에서 측정하였다.
RAW264.7 세포를 5×104 cell/well이 되도록 96 well plate 에 각각 100 μL씩 첨가하여 24시간 배양하고, 농도별 시료 및 lipopolysaccharide(LPS, 0.1 μg/mL, Sigma-Aldrich Co.)를 처리하여 24시간 배양하였다. 배양이 완료된 후 상등액 50 μL에 동량의 Griess 시약(Sigma-Aldrich Co.)을 혼합하여 10분간 반응시킨 후 microplate reader(UVM-340, Asys Co.) 를 이용하여 흡광도 540 nm에서 측정하였으며, nitric oxide 생성량은 sodium nitrite(Sigma-Aldrich Co.)의 농도별로 작 성한 표준곡선을 이용하여 계산하였다.
결과 및 고찰
맥문동, 오미자 및 인삼 혼합추출물의 추출수율, 총 폴리 페놀, 총 플라보노이드 및 총 당 함량은 Table 2와 같다. 혼합비율에 따른 추출수율은 25.33-33.87%로 나타났고, 맥 문동, 오미자 및 인삼의 혼합비율에 따른 총 폴리페놀 함량 은 0.65-1.01 g/100 g으로, 동의보감 및 일반적으로 많이 이용하고 있는 생맥산 혼합비율을 대조구로 설정한 MEC(0.65 g/100 g) 추출물보다 오미자의 혼합비율이 높은 ME1(1.01 g/100 g) 추출물이 더 높게 나타났다. 총 플라보노 이드 함량은 대조구 MEC(0.05 g/100 g) 추출물보다 맥문동, 오미자 및 인삼의 혼합비율을 다르게 설정한 실험구 ME1, ME2 및 ME3(0.06-0.07 g/100 g) 추출물에서 높게 나타났으 나, 유의적인 차이는 나타나지 않았다. 오미자는 안토시아 닌, lignan 유도체(schizanrin 및 gomisin 유도체)를 가지며 (31,32), 특히 오미자에서 얻어지는 폴리페놀 화합물은 매 우 높은 항산화능을 가지는 것으로 알려져 있으며, 높은 항산화능은 생체 내 항암 및 면역증진 활성과도 연관이 있다(33).
MEC, Mixed extract of control (Liriope platyphylla : Schizandra chinensis : Panax ginseng C.A. Meyer = 2 : 1 : 1); ME1, Mixed extract 1 (Liriope platyphylla : Schizandra chinensis : Panax ginseng C.A. Meyer = 1 : 2 : 1); ME2, Mixed extract 2 (Liriope platyphylla : Schizandra chinensis : Panax ginseng C.A. Meyer = 1 : 1 : 2); ME3, Mixed extract 3 (Liriope platyphylla : Schizandra chinensis : Panax ginseng C.A. Meyer = 1.34 : 1.33 : 1.33).
혼합비율에 따른 총 당 함량은 21.34-22.83 g/100 g으로, 유의적인 차이는 나타나지 않았으나 맥문동의 혼합비율이 높은 MEC(22.83 g/100 g) 및 ME3(22.41 g/100 g) 추출물에 서 높게 나타났다. Lee 등(34)의 연구에서 생맥산의 구성 약물 추출물의 총 당 함량을 측정한 결과, 맥문동은 1,788.34 mg/100 mL로 가장 높게 나타났으며, 오미자 및 인삼은 각각 297.17 mg/100 mL 및 193.93 mg/100 mL로 나타났다. 이는 맥문동의 혼합비율이 높은 MEC 및 ME3 추출물에서 총 당 함량이 높게 나타난 본 연구와 유사하였 다.
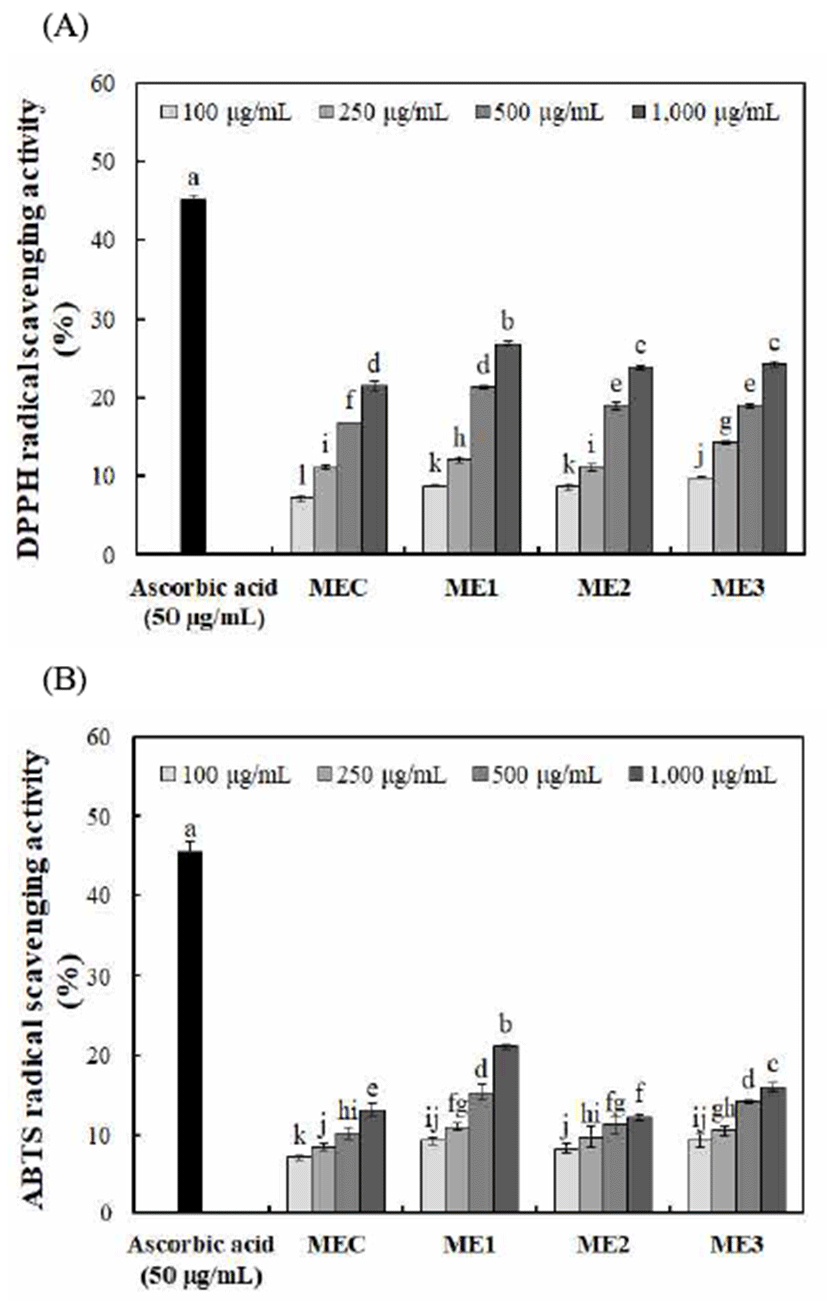
맥문동, 오미자 및 인삼의 혼합비율에 따른 DPPH, ABTS 및 Superoxide radical 소거활성은 Fig. 1 및 2와 같다. DPPH 및 ABTS radical 소거활성에서 각각 7.16-26.79% 및 7.04-21.09%로 농도가 증가함에 따라 모든 시료에서 소거 활성이 증가하였으며, 양성대조구(ascorbic acid, 50 μg/mL) 에서는 각각 45.21% 및 45.50%로 나타났다. 대조구 MEC 추출물(1,000 μg/mL)에서 각각 21.46% 및 13.07%로 나타났 으며, 실험구에서는 오미자의 혼합비율이 높은 ME1 추출 물(1,000 μg/mL)에서 각각 26.79% 및 21.09%로 대조구 MEC 추출물보다 높게 나타났으며, 이는 총 폴리페놀 함량 과 유사한 경향을 나타내었다. Kang 등(35)은 전자공여능 이 phenolic acid, flavonoids 및 그 외 페놀성 물질에 대한 항산화 활성의 지표라고 하였으며, 식물 내 총 폴리페놀 함량은 전자공여능과 밀접한 관계가 있어 총 폴리페놀 함량 이 높을수록 전자공여능이 높다고 보고하였다(36). 본 연구 에서도 오미자의 혼합비율이 높은 ME1 추출물에서 총 폴 리페놀 함량과 DPPH 및 ABTS radical 소거활성이 높게 나타나 유사한 경향을 나타났는데, 이는 Kim 등(37)의 연구 와 같이 오미자의 성분인 schizandrin, schizandran, γ -schizandrin, ethamigrenal, gomisin류 중에서 특히 수종의 gomisin의 항산화 작용에 의한 것으로 사료된다.
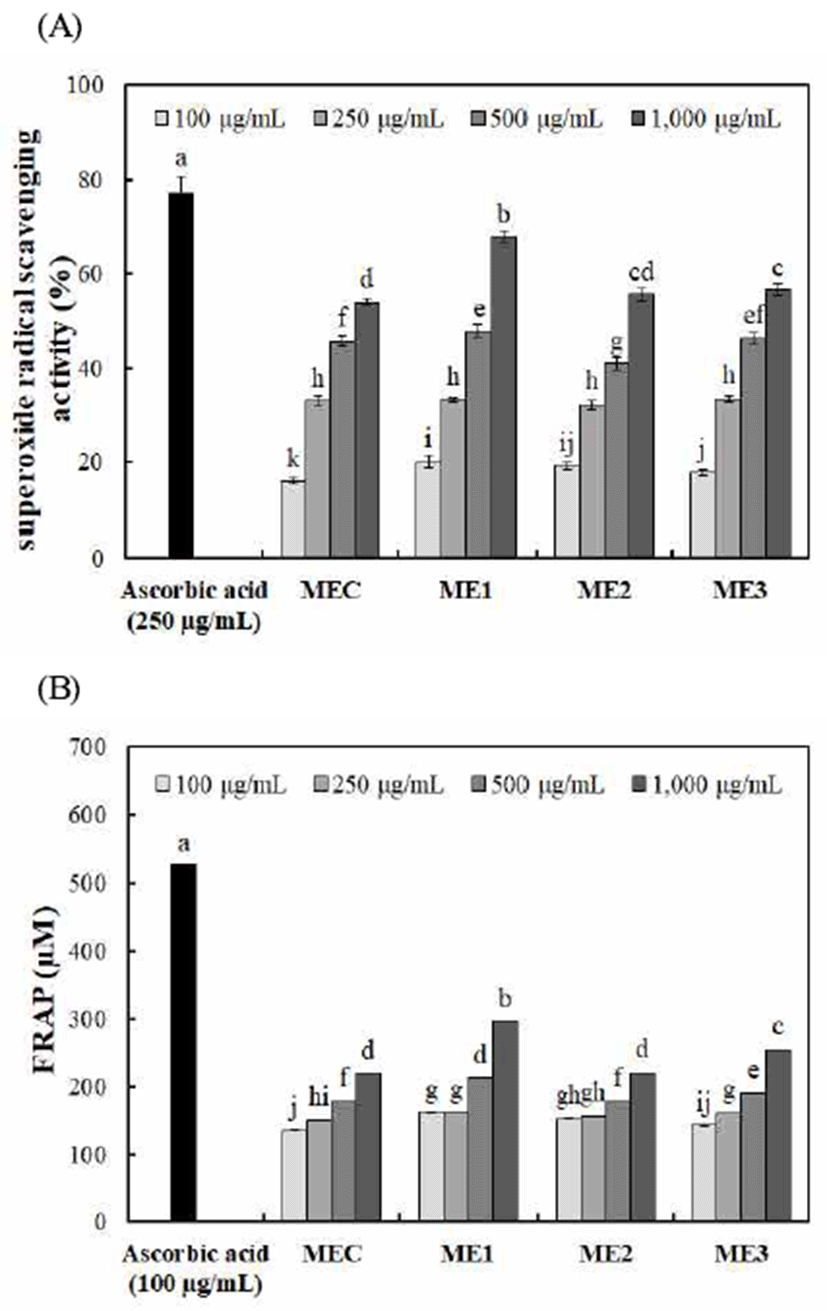
맥문동, 오미자 및 인삼의 혼합비율에 따른 FRAP 활성은 Fig. 2와 같다. FRAP 활성은 각각 15.95-67.83% 및 135.63-295.47 μM로 나타났으며, 농도가 증가함에 따라 모 든 시료에서 소거활성이 증가하였다. Radical 소거활성과 같이 오미자의 혼합비율이 높은 ME1 추출물(1,000 μg/mL) 에서 각각 67.83% 및 295.47 μM로 가장 높게 나타났다. Holasova 등(38)은 페놀화합물의 함량이 높을수록 항산화 활성이 증가한다고 보고한 것과 같이 총 폴리페놀 및 총 플라보노이드 함량에서 가장 높게 나타난 높은 ME1 추출 물의 항산화 활성이 가장 높게 분석되었다.
맥문동, 오미자 및 인삼 혼합추출물(100-2,500 μg/mL)을 처리하였을 때 모든 시료에서 90% 이상의 세포 생존율이 나타나 세포독성이 없음을 확인하였고, 100-1,000 μg/mL 농도로 하여 L-132 세포의 세포보호 효과를 실험한 결과는 Fig. 3과 같다.
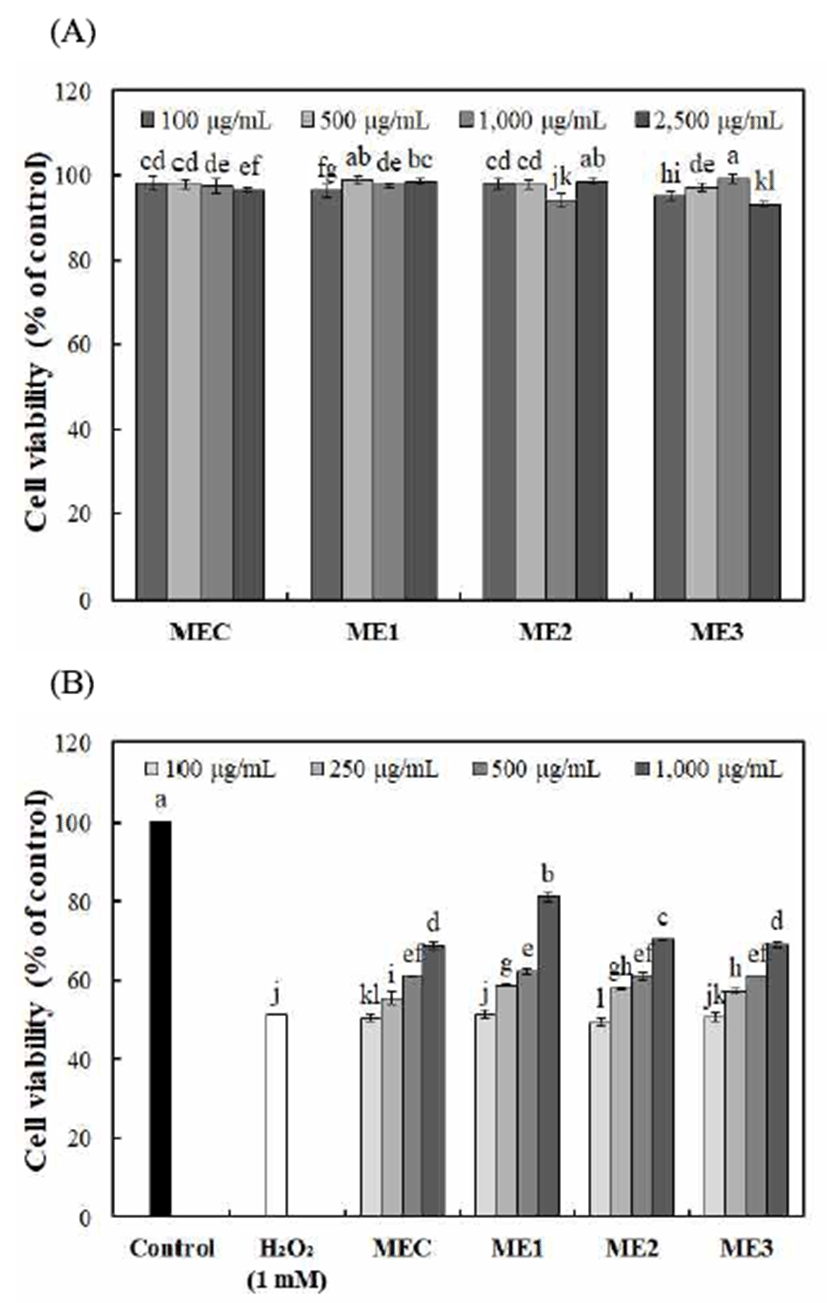
본 실험에서 사용한 H2O2는 산화적 스트레스를 유발하 는 물질로 원형질막 통과가 쉽기 때문에in vitro 및in vivo 실험에서 산화적 손상을 주는 독성 물질로 많이 이용되고 있다(39). H2O2에 의한 L-132 세포 생존율은 51.43%로 나타 났으며, 산화적 손상에 대한 세포보호 효과는 1,000 μg/mL 농도에서 68.89-81.22%로, 대조구 MEC 추출물에서 68.89%로 가장 낮은 생존율을 나타냈으며, 실험구 추출물 은 모두 대조구보다 높은 생존율을 나타내었다. 그 중에서 오미자의 혼합비율이 높은 ME1 추출물(1,000 μg/mL)에서 81.22%로 가장 높은 세포보호 효과를 나타내었는데 이는 총 폴리페놀 함량이 가장 많이 함유되어 있는 오미자의 혼합비율이 높은 ME1 추출물의 폴리페놀 성분이 세포내 산화적 손상에서 세포보호 효과를 보인 것으로 사료된다. Chung 등(40)의 연구에서 추출 용매에 따른 아마란스 종자 추출물의 L-132 세포보호 효과를 실험한 결과 폴리페놀과 탄닌의 함량이 높은 물 추출물에서 H2O2 세포내 보호활성 도가 높게 나타나 본 연구와 유사한 경향을 나타내어 폴리 페놀 성분이 세포보호 효과가 있음을 확인하였다.
맥문동, 오미자 및 인삼 혼합추출물(100-10,000 μg/mL) 을 처리하였을 때 모든 시료에서 90% 이상의 세포 생존율 이 나타나 세포독성이 없음을 확인하고, 100-1,000 μg/mL 농도로하여 RAW264.7 세포의 nitric oxide 생성 억제능을 확인한 결과는 Fig. 4와 같다.
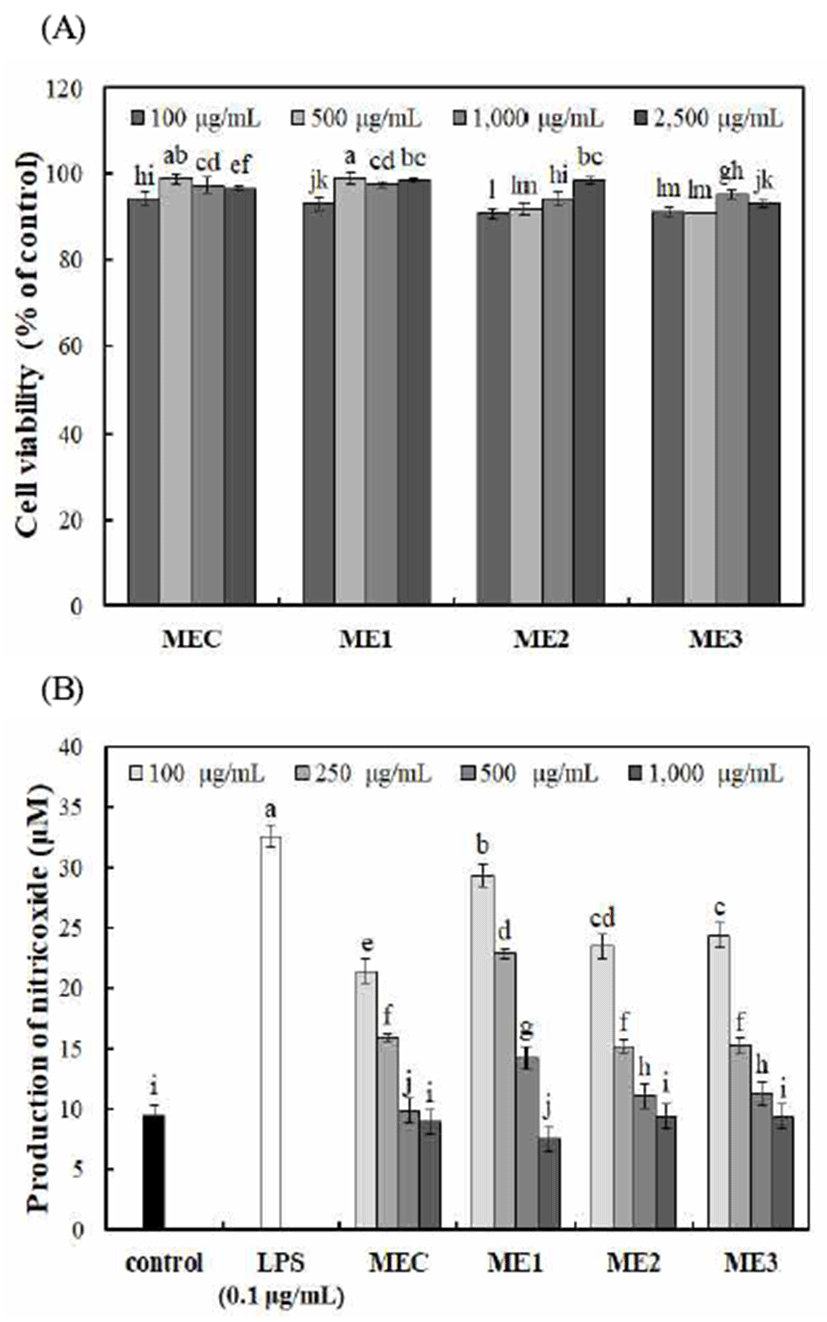
활성산소 중 하나이며, 최근 염증 유발에 중요한 역할을 하는 것으로 알려진 nitric oxide 생성에 대한 맥문동, 오미자 및 인삼 혼합추출물의 효과를 측정한 결과, nitric oxide 생성 량은 LPS(0.1 μg/mL)처리구에서 32.56 μM로 나타났으며, 모든 시료에서 농도 의존적으로 nitric oxide 생성량이 감소 하였다. 1,000 μg/mL 농도에서 대조구 MEC 추출물은 8.92 μM의 nitiric oxide 생성량을 나타내었으며, 실험구에서는 인삼의 혼합비율이 높은 ME2 추출물이 7.48 μM로 대조구 보다 낮은 nitric oxide 생성량을 나타내었다. 홍삼으로부터 분리된 산성 다당체의 대식세포로부터 iNOS 발현 및 NO 생성에 의한 면역 조절작용과 산성 다당체의 신호전달 활성 화를 통한 대식세포 활성화 등 많은 연구결과가 보고되어 있어(41,42), 이 연구결과와 같이 면역체계에 기여한다고 알려져 있는 다당체가 60-70% 이루어진 인삼이 모든 시료 에 혼합되어 있어 시료 간의 유의적인 차이가 나지 않는 것으로 사료된다. 그러나 인삼의 혼합비율이 높은 ME2 추 출물에서 NO 생성량이 가장 적게 나타나 앞선 연구와 유사 한 경향을 나타내었다.
요 약
생맥산 원료인 맥문동, 오미자 및 인삼의 최적 혼합비율 을 설정하고자 맥문동, 오미자 및 인삼 혼합추출물을 제조 하여 이화학적 특성 및 생리활성을 조사하였다. 맥문동, 오미자 및 인삼 혼합추출물의 추출수율은 25.33-33.87%이 었으며, 총 폴리페놀 및 총 플라보노이드 함량은 오미자의 혼합비율이 높은 추출물(ME1)에서 각각 1.01 g/100 g 및 0.07 g/100 g으로 가장 높은 값을 나타내었고, 총 당 함량은 맥문동의 혼합비율이 높은 추출물(MEC)에서 22.83 g/100 g으로 가장 높은 값을 나타내었다. DPPH radical 및 ABTS radical 소거활성은 ME1 추출물에서 각각 26.79% 및 21.09%로 가장 우수한 radical 소거활성을 나타내었으며, superoxide radical 소거활성 및 FRAP 활성 또한 ME1 추출 물에서 각각 67.83% 및 295.47 μM로 가장 우수한 항산화 활성을 나타내었다. 맥문동, 오미자 및 인삼 혼합추출물의 생리활성을 확인한 결과, H2O2에 의해 산화적 손상된 폐상 피세포인 L-132 세포의 생존율은 51.43%를 나타낸 반면 ME1 추출물(1,000 μg/mL)은 81.22%로 가장 높은 세포보호 효과를 나타내었다. LPS로 자극을 유도한 대식세포주인 RAW264.7 세포는 인삼의 혼합비율이 높은 ME2 추출물 (1,000 μg/mL)은 7.48 μM로 가장 적은 nitric oxide 생성량을 나타내어 nitric oxide 생성을 억제하였다. 따라서 본 연구에 서는 동의보감 및 일반적으로 많이 이용하고 있는 MEC 추출물보다 ME1 및 ME2 추출물에서 항산화 활성 및 면역 조절능이 우수함을 확인하여, 새로운 생맥산 혼합비율을 이용한 항산화 활성 및 면역조절용 기능성 식품 소재 개발 이 가능할 것으로 사료된다.