서 론
Citrus속 과일은 전 세계 많은 지역에서 수년 동안 생과일 또는 주스 형태로 인간의 식생활에 포함되어 왔으며, 달콤 하고 상쾌할 뿐만 아니라 영양적인 가치 때문에 도시 및 농촌 거주자 모두 섭취에 대한 관심이 증가하고 있다(1). Citrus속 과일은 아스코르브산과 엽산 및 식이 섬유 등이 풍부하고 다양한 약리효과와 항괴혈병 기능이 있으며, 주 스 산업의 부산물인 과일 껍질의 에센셜 오일은 아로마틱 성질 및 항균 작용으로 제약, 화장품 및 식품 산업의 원료로 사용하기에 안전하다고 알려져 있다(2-4). 한국농촌경제연 구원의 식품수급표에 의하면 매년 한국에 공급되고 있는 과일의 양은 약 250만 톤 이상이며, citrus속 과일은 60 만 톤 이상으로 가장 높은 비율을 차지하고 있다(5). 그 중에 유자(yuzu, Citrus junos Tanaka), 금귤(kumquat, C. japonica), 레몬(lemon, C. limonum) 및 라임(lime, C. aurantifolia) 등은 껍질째 소비가 되고 있다.
유자의 원산지는 중국의 양자강이며, 중국, 한국 및 일본 등지에서 생산되고 있는 과일로 한국에는 신라시대에 전래 되어 제주도, 고흥, 완도, 거창, 강진, 장흥 및 거제 등에서 재배되고 있으며, 약용 및 제수용 식품으로 많이 이용되고 있다. 또한 유자는 차, 음료, 잼, 시럽, 퓌레, 한국 전통 떡에 사용되며, 감기와 기침을 위한 약초로 사용되고 신선한 과 일로는 식품에 거의 사용되지 않는다(6). 금귤은 낑깡이라 고 많이 불리고 있는데 원산지는 중국으로 동아시아에서 재배되고 있으며, 올리브 열매와 비슷한 크기로 보통 씨를 제외하고 통째로 섭취하는데 껍질은 단맛이 강하고 과육은 톡 쏘는 맛과 신맛을 가진다(7). 종류로는 둥근 모양인 영파 금귤(round kumquat, C. japonica)과 타원형 모양인 환실 금귤(oval kumquat, C. margarita) 및 다른 금귤에 비해 크기 가 큰 대금귤(large kumquat, C. obovata) 등이 있으며, 한국 에서는 기온이 따뜻한 남해안 일대와 일조량이 풍부한 제주 지역에서 주로 재배되고 있다(8). 레몬은 동남아시아가 원 산지로 인도 북동부, 미얀마 및 중국, 미국의 캘리포니아, 이탈리아, 스페인 및 오스트레일리아 등에서 주로 재배되 는 과일로 녹색일 때 수확하여 익으면 노란색으로 변한다 (9-10). 라임은 인도, 말레이시아 및 미얀마가 원산지이며, 열대․아열대 지방에서 재배되고 있는 과일로 추위에 약하 다. 또한 과일의 표면이 매끄럽고 색깔은 녹색을 띤 황색으 로 얇은 껍질을 가지고 있으며, 과육은 매우 강한 신맛을 가진다(11). Citrus속 과피에 다량 함유된 플라보노이드는 쓴맛 성분인 헤스페리딘과 나린진이 있으며, 헤스페리딘은 비타민 P의 구성성분으로 혈중 콜레스테롤 농도의 상승억 제, 혈압저하, 항산화, 항알레르기, 항암작용 등 생리활성을 나타내는 물질이다(12). 나린진도 헤스페리딘과 마찬가지 로 콜레스테롤 함량 감소, 유방암 세포 증식억제, 항산화, 항염증, 항균작용 등 다양한 생리 기능성을 가지고 있다고 보고되었다(13). 이에 따라 생물학적으로 중요한 다른 종류 의 활성물질을 섭취하기 위해서는 과일의 껍질도 함께 이용 하는 것이 중요하다. 과일의 껍질에는 상업적으로 많이 이 용되고 있는 에센셜 오일이 다량 함유되어 있다. 이에 소비 자들은 과일의 에센셜 오일에 대해 자세한 정보가 필요하다.
따라서 본 연구는 식품, 음료 및 기타 제품에 사용되는 citrus oil의 성분 조성에 대한 지식을 향상시키기 위해 수행 되었다. 유자, 금귤, 레몬 및 라임의 휘발성 향기성분을 비교 하여 수입종인 레몬 및 라임에 비하여 한국에서 생산되는 유자와 금귤의 경쟁력을 확인하고 이들의 상업적 가치와 정유성분의 폭 넓은 적용 방향에 대한 중요한 기초자료를 제공하고자 이 연구를 수행하였다.
재료 및 방법
유자(고흥), 금귤(제주), 레몬(미국) 및 라임(멕시코)은 각 각의 휘발성 향기성분 분석을 위해 2015년 12월 광주지역 마트 및 재래시장에서 직접 구입하였다. 본 실험에 사용한 시료들은 생과일 상태에서 불순물을 제거하고 증류수로 세척한 후 -70℃의 deep freezer(MDF-U4086S, Sanyo, Tokyo, Japan)에 보관하여 시료로 사용하였다.
본 연구에 사용한 모든 시약은 Sigma사(St, Louis, MO, USA)와 Fisher Scientific(Waltham, MA, USA)으로부터 특 급시약을 구입하였다. Diethyl ether, n-pentane 등의 유기용 매는 HPLC grade를 구입하여, 이를 다시 wire spiral packed double distilling apparatus(Normschliff Geratebau, Wertheim, Germany) 장치로 재증류한 후 휘발성 향기성분을 추출하였 다. 물은 순수재증류장치(Millipore Corporation, Bedford, MA, USA)에서 얻은 이온교환수(ultra pure water)를 사용하 였다. 무수 Na2SO4는 650℃ 회화로에서 하룻저녁 태운 뒤 desiccator에서 방냉하여 유기용매의 탈수에 사용하였다.
유자, 금귤, 레몬 및 라임 등 300 g을 껍질째 ultra turrax로 분쇄하여 이온교환수 500 mL를 혼합하여 1 N NaOH 용액 으로 pH 7.0으로 조정한 후 이를 휘발성 향기성분의 추출용 시료로 사용하였다. 휘발성 향기성분의 추출을 위하여 Schultz 등(14)의 방법에 따라 개량된 연속수증기증류추출 장치(Likens & Nickerson type simultaneous distillation & extraction apparatus, SDE, Normschliff, Wertheim, Germany) (15)에서 n-pentane:diethylether 혼합용매(1:1, v/v) 100 mL 를 사용하여 상압하에서 3시간 동안 추출하였다. 정량분석 을 위한 내부표준물질로 n-butylbenzene 1 μL를 추출용 시료에 첨가하였다. 추출된 휘발성 향기성분의 유기용매 분획 분은 vigreux column(250 mL, Normschliff Geratebau, Wertheim, Germany)을 이용하여 약 3 mL까지 농축한 다음 GC용 vial에 옮겨 질소가스를 이용하여 약 1 mL까지 농축 한 후 GC/MS의 분석시료로 사용하였다.
Simultaneous distillation extraction(SDE)방법을 이용하 여 추출한 후 농축된 휘발성 향기성분은 gas chromatography /mass spectrometry(GC/MS)로 분석하였다. 분석에 사용한 GC/MS는 GCMS-QP2010Plus(Shimadzu, Kyoto, Japan) 기 기를 사용하였다. 분리된 휘발성 향기성분의 이온화는 EI(electron impact ionization)방법으로 행하였다. GC/MS 분 석조건은 ionization voltage를 70 eV로 하였으며, injector의 온도는 250℃로 하였다. 분석할 분자량의 범위는 40-350(m/z)으로 설정하였으며, column은 DB-5(60 m×0.25 mm i.d., 0.25 μm film thickness, J&W, Santa Clara, California, CA, USA)를 사용하였고, 온도 프로그램은 40℃ 에서 3분간 유지한 다음 2℃/min의 속도로 150℃까지 상승시 켜 5분간 유지하고, 동일한 속도로 180℃까지 승온시켜 5분 간 유지하였다. 다시 4℃/min의 속도로 200℃까지 상승시킨 후 10분간 유지한 다음 5℃/min의 속도로 230℃까지 상승시 킨 후 10분간 유지하도록 설정하였다. Carrier gas는 helium 을 사용하여 유속은 1.0 mL/min으로 하였으며, 휘발성 향기 성분은 1 μL를 split ratio 1:30으로 주입하였다.
GC/MS에 의해 total ionization chromatogram(TIC)에 분 리된 각 peak의 성분 분석은 mass spectrum library(NIST 05, WILEY 7 과 FFNSC 2)와 mass spectral data book의 spectrum(16,17)과의 일치 및 GC/MS 분석에 의한 retention index와 문헌상의 retention index(18,19)와의 일치 및 표준 물질의 분석 data를 비교하여 확인하였다. 동정된 휘발성 향기성분의 상대적 정량을 위하여 내부표준물질로 첨가된 n-butyl benzene과 각 휘발성 화합물의 peak area% 비교하여 각 휘발성 화합물의 함유량을 계산하였다.
결과 및 고찰
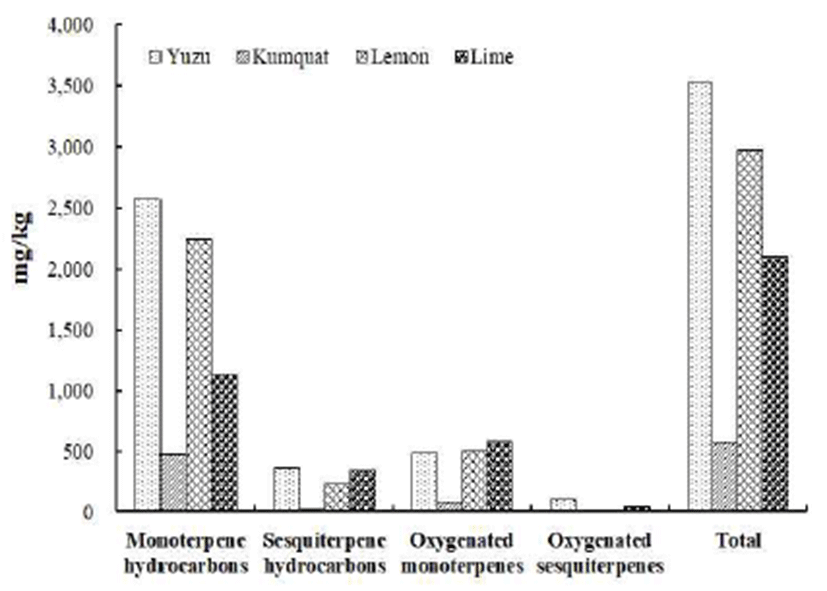
유자의 휘발성 향기성분을 분석하기 위하여 SDE 방법으 로 휘발성 향기성분을 추출한 후 GC/MS로 확인하였다. 동정된 화합물의 chromatogram은 Fig. 1에 도식하였으며, 상대적 농도는 Table 1에 나타내었다. 유자의 휘발성 향기 성분은 총 104종으로 함량은 3,713.02 mg/kg이 확인되었다. 관능기별로는 hydrocarbon류가 33종(82.48%)으로 가장 높 은 비율을 차지하였으며, 그 다음으로는 alcohol류가 24종 (11.54%), ester류 16종(3.78%), aldehyde류 21종(1.23%), oxide류 5종(0.61%) 및 ketone류 5종(0.31%)이 확인되었다. 관능기별 함량은 hydrocarbon류가 3,063.69 mg/kg으로 가 장 높았으며, alcohol류 428.64 mg/kg, ester류140.48 mg/kg, aldehyde류 45.88 mg/kg, oxide류 22.85 mg/kg 및 ketone류 11.48 mg/kg 순으로 나타났다(Table 2). 유자에서는 77종의 terpenoid류가 동정되었으며, 함량은 3,523.50 mg/kg으로 전체의 94.88%를 차지하였다. 그 중에서 monoterpene hydrocarbon류는 69.35%(2,575.27 mg/kg), sesquiterpene hydrocarbon류는 9.79%(363.67 mg/kg)로 확인되었으며, oxygenated monoterpene류가 13.05%(484.58 mg/kg), oxygenated sesquiterpene류는 2.69%(99.98 mg/kg)로 확인 되었다(Fig. 2).
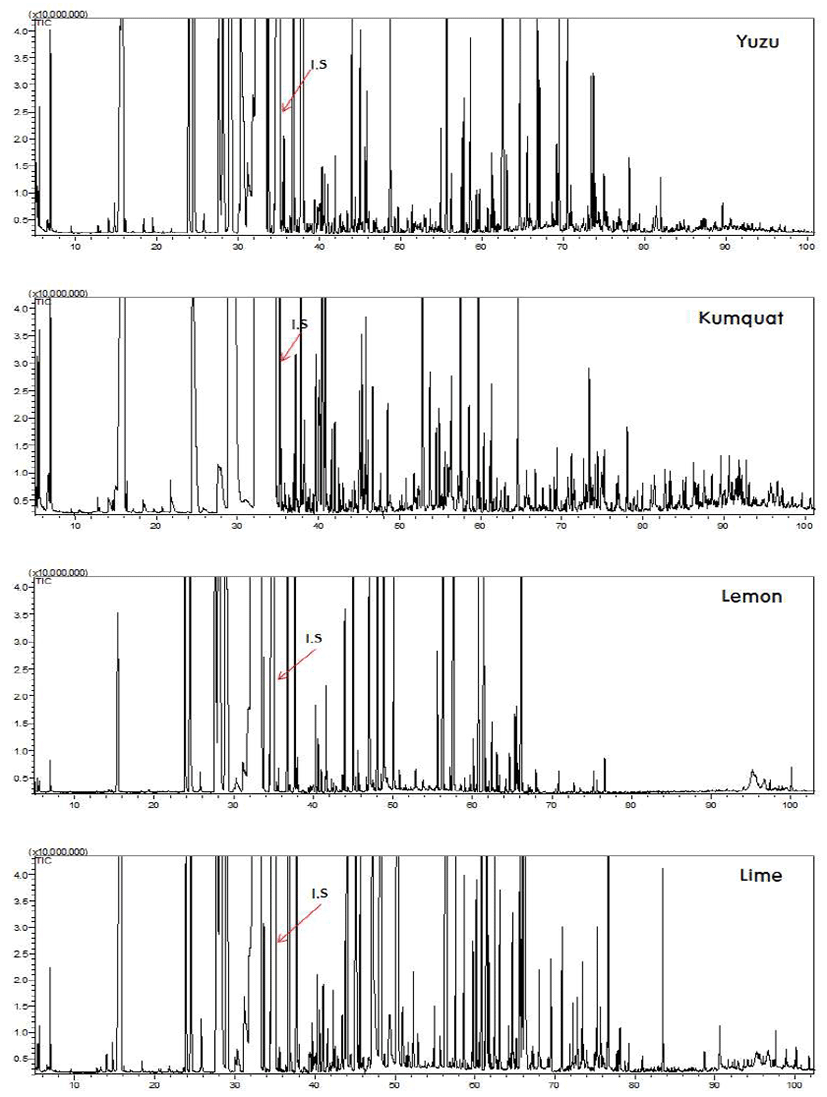
유자에서 확인된 hydrocarbon류 중 함량이 가장 높은 화 합물은 monoterpene인 limonene으로 1,300.68 mg/kg이 동 정되었으며, peak area는 35.03%로 분석되었다. Lee 등(8)의 연구에서는 limonene의 함량이 59.52-74.30%로 보고되었 으며, Kang 등(20)은 추출방법에 따라 과피에서는 78.15-84.13%, 과육은 21.03%-81.19%로 확인되었다고 보 고하였다. 본 연구에서는 유자를 통째로 사용하여 분석한 결과 이들의 연구와 약간의 차이를 보였다고 사료된다.
Limonene 다음으로 확인된 hydrocarbon류는 γ-terpinene (13.46%), β-myrcene(4.56%), (E)-β-farnesene(4.37%), α -pinene(3.80%), β-pinene(3.21%), α-phellandrene(3.09%), (E)-β-ocimene(2.31%) 및 α-terpinolene(2.24%) 순으로 동정 되었다.
Limonene은 citrus속 과일의 정유성분에 70% 이상 함유 되었으며, 항산화 활성이 높은 물질로 알려져 있다. 또한 위암 및 간암세포에서 암세포 성장 저해 율이 매우 높으며, 유방암 세포의 증식억제 및 항돌연변이 효과 등이 있다고 밝혀졌다(21,22). γ-Terpinene의 함량은 Lee 등(8) 및 Kang 등(20)의 연구에서 limonene 다음으로 많이 함유되었다고 보고하였는데, 본 연구 결과와 유사하여 γ-terpinene은 유자 의 특징적인 향기성분임을 확인할 수 있었다. γ-Terpinene 은 limonene의 이성화에 의해 생성되는 성분으로 은은한 감귤 향과 상쾌한 풀 향기를 가지며, peppermint, thyme, spearmint 등 다양한 식품향료 조합에 이용되는 화합물이다 (23,24). 상쾌한 향을 가지고 있는 β-myrcene의 구조는 γ -terpinene 및 limonene과 달리 벤젠고리를 가지고 있지 않아 항산화효과가 떨어지며, 또한 공기 중에서 불안정하여 향 료 산업에서 직접적으로 사용하지 않고 citral, citronellol, citronellal, geraniol, linalool, nerol 및 menthol 등을 제조하기 위한 중간물질로서 매우 핵심적인 화합물이다(25).
Alcohol류 중 가장 높은 비율로 나타난 linalool의 peak area는 7.46%로 함량은 277.17 mg/kg으로 확인되었다. Linalool은 많은 꽃과 향신료 식물에서 발견되는 테르펜 알콜로 꽃향기를 가진다. 이를 바탕으로 방향제, 세제, 샴푸 및 로션을 포함한 향기 제품의 60-80%는 화학 중간체로 사용되며, 벼룩, 초라피 및 바퀴벌레 살충제로도 이용된다 (26).
Lee 등(8)의 연구에서 limonene, γ-terpinene, β-farnesene, sabinene, linalool, β-myrcene 및 terpinolene 7종이 유자 전체 향기성분의 92.4%를 차지한다고 보고하였으나, 본 연구에 서는 68.47%로 확인되었으며, 이들 성분 이외에 α-pinene, β-pinene, α-phellandrene, (E)-β-ocimene 및 germacrene D 등이 유자의 주요 화합물로 확인되었다. 또한 linalyl acetate, α-funebrene, bicyclogermacrene, β-sesquiphellandrene, 4-vinyl guaiacol, α-eudesmol acetate 및 β-sinensal 등은 유자에서만 확인된 화합물이다.
금귤의 휘발성 향기성분을 SDE 방법을 이용하여 추출한 후 GC/MS로 확인한 결과는 Fig. 1 및 Table 1과 같다. 금귤 의 휘발성 향기성분은 총 87종이며, 함량은 621.71 mg/kg으 로확인되었다. 금귤에서검출된화합물의조성은hydrocarbon 류가 22종(83.57%)으로 가장 높은 peak area을 보였으며, 그 다음으로는 oxide류 8종(5.21%), ester류 16종(4.46%), alcohol류 27종(4.43%), aldehyde류 8종(1.63%) 및 ketone류 6종(0.66%)이 확인되었다. 금귤에서 확인된 terpenoid류는 68종으로 전체의 92.26%를 차지하였으며, 함량은 574.12 mg/kg으로 monoterpene hydrocarbon류가 75.83%(471.87 mg/kg), oxygenated monoterpene류가 12.62%(78.53 mg/kg) 로 확인되었다. Sesquiterpene hydrocarbon류는 2.49%(15.50 mg/kg), oxygenated sesquiterpene류는 1.32%(8.22 mg/kg)로 확인되었다(Fig. 2). 금귤의 주요 휘발성 향기성분은 hydrocarbon류는 limonene(63.53%), β-myrcene(12.77%), α -pinene(3.25%), sabinene(0.89%), germacrene D(0.82%) 및 β-elemene(0.47%) 등 순으로 나타났으며, oxide류는 (Z)-limonene oxide(2.42%), (E)-limonene oxide(1.78%), geranyl acetate (1.77%) 등으로 확인되었다. Alcohol류는 linalool(0.67%), (E)-piperitol(0.51%), (E)-ρ-mentha-2,8-dienol (0.50%), α-terpineol(0.46%) 및 (E)-carveol(0.42%) 등 순으 로 분석되었다. Kwang 등(27)의 연구에서 limonene의 peak area를 96.5%로 보고하였는데 본 연구와 많은 차이가 있음 을 알 수 있었다. β-Myrcene는 금귤에서 두 번째로 많이 확인된 성분으로 월계수 잎에 다량 함유되어 있는 물질이 며, 10 ppm 이하 농도일 때는 달콤하면서 온후한 발사믹향 을 내는데 높은 농도에서는 자극적인 쓴맛을 가진다. 또한 냄새를 가리기 위한 masking 효과와 소화를 촉진시켜주는 역할을 한다고 보고된 바 있다(28,29). 금귤에서만 동정된 휘발성 향기성분은 (Z)-linalool oxide(0.07%), (E)-linalool oxide(0.03%), heptyl acetate(0.02%), teresantalol(0.11%), limonen-4-ol(0.03%), butyrophenone(0.01%), ρ-mentha-1,8- dien-4-hydroperoxide(0.25%), β-bourbonene(0.03%) 및 (E,E)- farnesol(0.03%) 등으로 동정되었다.
레몬의 휘발성 향기성분은 SDE 방법을 이용하여 추출한 후 GC/MS로 분석하였다. 동정된 휘발성 향기성분의 상대 적 농도는 Table 1에 나타내었으며, chromatogram은 Fig. 1에 도식하였다. 레몬의 휘발성 향기성분은 총 103종으로 함량은 3,024.69 mg/kg이 확인되었다. 관능기별로는 hydrocarbon류가 35종(82.59%)으로 가장 높은 비율을 차지 하였으며, 그 다음으로는 alcohol류가 20종(5.78%), ester류 21종(7.74%), aldehyde류 17종(3.09%), oxide류 6종(0.63%) 및 ketone류 4종(0.12%)이 확인되었다. 관능기별 함량은 hydrocarbon류가 2,500.19 mg/kg으로 가장 높았으며, ester 류 233.45 mg/kg, alcohol류 175.12 mg/kg, aldehyde류 93.45 mg/kg, oxide류 19.11 mg/kg 및 ketone류 3.37 mg/kg 순으로 나타났다(Table 2).
레몬의 주요 휘발성 향기성분은 hydrocarbon류인 limonene의 함량은 1,221.79 mg/kg으로 가장 많이 함유되어 았으며, peak area는 40.35%로 확인되었다. Hydrocarbon류 는 γ-terpinene(11.57%), β-pinene(7.92%), β-myrcene(5.67%), (Z)-β-bisabolene(2.91%), α-pinene(2.86%), sabinene (2.65%), (E)-β-bergamotene(1.99%), (E)-β-caryophyllene(1.06%) 등 순으로 나타났다. Alcohol류는 nerol(1.34%), geraniol(1.28%), linalool(1.11%) 및 α-terpineol(1.08%) 등 순이며, aldehyde류 는 neral(1.36%), geranial(0.91%) 및 citronellal(0.3%)이 확인 되었다. Eater류는 geranyl acetate (3.54%) 및 neryl acetate (3.29%) 등으로 동정되었다.
Laura 등(30)은 레몬 정유의 주요 향기성분으로 limonene (59.10%), γ-terpinene(9.66%), β-pinene(5.20%), β-bisabolene (3.61%) 및 geranial(2.11%) 등을 보고하였는데, 비록 함량 의 차이는 있지만 본 연구에서도 레몬의 주요 향기성분으로 확인할 수 있었다.
Lemon 오일에 가장 많이 함유된 limonene은 가볍고 색깔 은 투명하고 휘발성이 강한 특징을 가진다. 또한 집중력을 높여주며, 방부작용과 흥분작용이 있다. 다량 사용과 함께 피부에 심한 마찰을 주면 발적 현상과 염증이 유발 될 수 있다. Nerol, geraniol은 장미향이 특징이며 항균, 항염 및 면역강화 작용이 있으며, 효능이 부드러워 가장 안전하다. Neral, geranial 및 citronellal 등은 과일 향을 가지며, 낮은 농도로 희석하여 사용하였을 때 항염, 해열 및 진정작용의 효과가 가장 높다. Geranyl acetate 및 neryl acetate 등은 강한 과일 향을 가지며, 독성이 없어 인체에 무해하며, 긴장 완화 및 신경안정 작용이 있으며, β-pinene은 레몬 오일에 부드러운 그린 향을 부여한다(31).
레몬 오일의 품질에 중요한 영향을 주는 요소는 monoterpenic ester류와 aldehyde류 및 alcohol류 등이다. p-Cymene, p-menthadiene-8-ols 및 p-menthen-1,8-diols 및 carvone은 레몬 오일의 품질을 저하시키는 원인이 되기도 한다(32). Methyl jasmonate는 두 가지 이성체 형태로 존재 하는데 레몬 오일에서는 드물게 확인되며, 신선한 레몬 향 을 나타낸다고 보고되고 있으나, 본 연구에서는 확인되지 않았다(33). 레몬에서만확인된휘발성향기성분은(E)-Sabinene hydrate(0.08%), neryl propionate(0.03%), valencene(0.24%) 및 (Z)-sesquisabinene hydrate(0.02%) 등으로 동정되었다.
라임의 휘발성 향기성분을 SDE 방법으로 추출한 후 GC/MS로 확인하였다. 동정된 화합물의 chromatogram은 Fig. 1에 도식하였으며, 상대적 농도는 Table 1에 나타내었 다. 라임의 휘발성 향기성분은 총 106종, 함량은 2,209.16 mg/kg으로 확인되었다. 관능기별로는 hydrocarbon류가 38 종(69.93%)으로 가장 높은 비율을 차지하였으며, 다음으로 는 alcohol류가 22종(12.38%), aldehyde류 22종(11.52%), ester류 14종(4.83%), oxide류 4종(0.96%) 및 ketone류 6종 (0.40%) 순으로 확인되었다. 관능기별 함량은 hydrocarbon 류가 1,544.83 mg/kg으로 가장 높았으며, alcohol류 273.43 mg/kg, aldehyde류 254.38 mg/kg, ester류 106.47 mg/kg, oxide류 21.12 mg/kg 및 ketone류 8.93 mg/kg 으로 나타났다 (Table 2).
라임에서가장많이확인된휘발성향기성분은hydrocarbon 류인 limonene으로 함량은 553.58 mg/kg이었으며, peak area 는 25.06%로 분석되었다. Lee(34)의 연구에서는 라임 오일 에 limonene이 31.82%로 함유되어 있다고 보고하였다.
Hydrocarbon류 중 limonene 다음으로 γ-terpinene(9.64%), β-pinene(7.74%), (Z)-β-bisabolene(4.84%), (E)-β-bergamotene (3.54%), α-pinene(2.78%), β-myrcene(2.74%), sabinene(2.45%), (E)-β-caryophyllene(2.01%) 및 α-terpinolene(1.66%) 등 순 으로 분석되었다. β-Pinene은 레몬과 비슷한 수준으로 다량 함유되어 있었으며, 향료산업에서 매우 중요한 화합물이 다. 또한 열에 의해 분해되면 myrcene이 생성된다(29).
Aldehyde류 중 neral(4.59%) 및 geranial(4.44%)의 함량이 각각 101.48 mg/kg 및 98.01 mg/kg으로 분석되었는데, 유자, 금귤 및 레몬에 비해 매우 높은 비율로 확인되었다. Alcohol 류는 α-terpineol(3.09%), 4-terpineol(2.52%), nerol(2.50%) 및 linalool(1.96%) 등 순으로 확인되었으며, geraniol은 동정 되지 않았다. Ester류는 neryl acetate(3.81%) 및 geranyl acetate(0.69%) 등이 확인되었다.
Carvacrol (0,21%), thymol(0.06%), D-fenchyl alcohol (0.06%), camphene hydrate(0.02%), herniarin(0.02%) 및 citropten(0.02%)은 라임에서만 확인된 성분이다. Carvacrol 은 맵고 따뜻한 냄새 특징을 가지며, 박하 속 식물인 오레가 노 에센셜 오일에 존재한다. Thymol과 carvacrol은 thyme 오일의 주성분으로 천연 항균제 작용이 있는데, 이 화합물 들이 함께 사용되었을 때 미생물에 대한 살균효과가 강해진 다고 보고되었다(35).
Citropten은 레몬, 라임 및 베르가 못의 오일에서 발견된 화합물로 본 연구에서는 0.54 mg/kg으로 확인되었다. Bisabolene은 hernandulcin을 포함한 천연 감미료 등을 생합 성 하는 과정에서의 중간 생성물이며, β-bisabolene은 발사 믹향의 특징을 가지며, 유럽에서는 식품 첨가제로 승인되 고 있다(36). (Z)-α-Bisabolene, (Z)-β-bisabolene, (Z)-γ -bisabolene, (E)-γ-bisabolene, (E)-α-bisabolene, epi-β-bisabolol 및 α-bisabolol은 라임과 레몬에서만 공통적으로 동정된 향 기성분이며, 이들 화합물의 함량은 모두 레몬 보다는 라임 에서 높게 확인되었다. 또한 라임과 레몬에서만 동정된 휘 발성 향기성분은 tricyclene, (Z)-α-bergamotene, α-santalene, (E)-α-caryophyllene, (E)-α-bergamotene, γ-curcumene, α -curcumene, (E)-β-bergamotene, 7-epi-α-selinene, citronellal, isoneral, isogeranial, (E,Z)-2,6-farnesal, (E,E)-2,6-farnesal, p-cymen-8-ol, citronellyl acetate, dodecyl acetate 및 nootkatone 등이 확인되었다.
요 약
본 연구는 한국에서 재배된 유자와 금귤을 수입되는 레 몬 및 라임과 비교하였을 때 정유성분의 유용적 가치를 확인하고자 하였다. 유자, 금귤, 레몬 및 라임의 휘발성 향기 성분 분석을 위하여 재증류한 n-pentane/diethylether(1:1, v/v) 혼합용매 100 mL를 사용하여 SDE 방법으로 3시간동 안 휘발성 화합물을 추출한 후 GC/MS로 확인하였다. 유자, 금귤, 레몬 및 라임에서는 각각 104종(3,713.02 mg/kg), 87종 (621.71 mg/kg), 103종(3,024.69 mg/kg) 및 106종(2,209.16 mg/kg)의 향기성분이 동정되었다. 4종의 Citrus속 과일의 주요 휘발성 향기성분은 limonene으로 확인되었으며, peak area는 각각 유자 35.03%, 금귤 63.82%, 레몬 40.35% 및 라임 25.06%로 나타났다. Limonene 이외에 유자의 주요 휘발성 향기성분은 γ-terpinene, linalool, β-myrcene, (E)-β -farnesene, α-pinene 및 β-pinene 등이며, 금귤에서는 β -myrcene, α-pinene, (Z)-limonene oxide, (E)-limonene oxide, geranyl acetate 및 limonen-10-yl acetate 등 순으로 동정되었 다. 레몬의 주요 향기성분은 γ-terpinene, β-pinene, β -myrcene, geranyl acetate, neryl acetate 및 (Z)-β-bisabolene 등 순이며, 라임은 γ-terpinene, β-pinene, (Z)-β-bisabolene, neral, geranial 및 neryl acetate 등 순으로 나타났다. 본 연구 결과 4종류 과일의 특징적인 향기성분이 동정되었으며, 휘 발성 향기성분 조성비의 차이를 확인할 수 있었다. 또한 국내산 유자 및 금귤은 향료산업에서 널리 사용되는 레몬과 라임의 대체제로 충분한 활용가치가 있다고 사료된다.