서 론
팽이버섯(Flammulina velutipes)은 분류학적으로 담자균 류 주름버섯목 송이과에 속하며 전 세계적으로 분포하지만 특히 아시아 지역에서 많이 재배되는 식용버섯이다(1). 팽 이버섯은 맛과 향기가 우수할 뿐만 아니라, 단백질, 아미노 산, β-glucan, 비타민 및 미량 원소 등을 함유하고 있다(2). 또한 항암작용이 있는 것으로 보고된 flammulin과 혈압강 하 작용이 있는 flammutoxin을 함유하고 있어 항바이러스 및 항종양, 콜레스테롤 저하작용 등에 도움이 된다고 알려 져 있다(3-6). 일반적으로 버섯은 다양한 효소의 활성이 높 고 조직이 연하기 때문에 색상과 조직의 변화로 인해 저장 에 어려움이 있어 저장성을 향상시키기 위해 버섯을 건조시 켜 식품의 첨가제 및 분말형태로도 사용을 하고 있다(7,8). 최근에는 건강지향적인 소비자들이 조미료 시장에서 화학 복합조미료 보다는 다양한 천연조미료 제품에 높은 관심을 보이면서 버섯류가 각종 조리 및 가공 식품의 조미료 소재 로서 이용이 증가되고 있는 추세이다.
팽이버섯의 품질 및 기능성을 향상시키기 위하여 다양한 연구가 진행되었으며, Lee 등(9)은 녹차를 이용하여 재배한 팽이버섯의 이화학적 특성을 보고하였고, Kim 등(10)은 반 응표면분석에 의한 팽이버섯의 microwave를 이용한 추출 조건 최적화를 보고하였다. 지금까지 가공 및 추출물의 기 능성에 대한 연구가 활발하게 진행된 반면에 발효기술을 이용한 팽이버섯의 기능성 향상을 위한 연구는 미비한 실정 이다.
발효는 동서양에서 저장성과 풍미 등을 개선하기 위해 사용해온 전통기술로써 다양한 유용 미생물이 지역의 고유 한 원료에 작용하여 독특한 맛과 기능성이 강화된 발효식품 을 만드는데 기여하고 있다. 특히 유산균은 대표적인 probiotics로서 당질을 이용하여 발효 산물로 유기산, 알코 올, CO2 등을 생성하며, 정장작용을 통한 장내 기능 향상 및 면역증진 효과가 밝혀지면서 건강소재로 관심이 높아지 고 있다(11).
Lactobacillus plantarum 등의 발효식품 유래 젖산균에 의해 생산이 되는 γ-aminobutyric acid(GABA)는 비단백질 구성 아미노산으로 뇌에서 신경전달물질로서의 역할뿐 아 니라 뇌의 혈류를 개선하고 산소 공급을 증가시켜 중풍과 치매 예방, 기억력 증진, 혈압강하작용, 우울증 완화 등에 효과가 있는 것으로 알려져 있어 brain food라고 한다 (12-14). GABA는 식물체에도 함유되어 있어 발아현미, 녹 차 등을 경구적으로 섭취가 가능하지만, 자연에서 존재하 는 미량의 GABA 섭취를 통해서 생리작용의 효과를 기대하 기는 어렵다(15). 최근 건강소재로 중요하게 인식되는 GABA를 천연소재의 발효 최적화를 통해서 고농도로 생산 하며, 특히 다양한 젖산균을 이용한 발효방법을 통해서 GABA를 대량 생산하는 연구가 보고되었다(16,17).
따라서 GABA를 생산하는 균주인Lactobacillus plantarum EJ2014를 이용하여 기호식품으로 각광 받고 있는 팽이버섯 분말의 젖산발효 최적화를 통해서 고농도 GABA생산을 수행하였으며, 가공 공정을 통하여 고농도 GABA, 식이섬 유, probiotic을 포함하며 항산화 효과를 가진 기능성 팽이버 섯 천연 발효조미료를 개발하는 기초 연구 자료를 제공하고 자 하였다.
재료 및 방법
본 연구에서 사용된 팽이버섯 분말은 농업회사법인 (주) 늘그린(Goryeong, Korea)에서 구입하였고, 팽이버섯 발효 물을 생산하는 배지의 영양성분으로 glucose는 Ducksan (Ducksan pure chemical co., Ansan, Korea)에서 구입하였으며, 생육 촉진제로서 yeast extract(YE)는 조흥(주)(Ansan, Korea)제품을 사용하였다. GABA 생산의 기질로 사용한 monosodium L-glutamate(MSG)는 Yakuri Pure Chemicals Co., LTD.(Kyoto, Japan)에서 구입하였으며, 분석에 사용된 시약은 특급이상 시약들을 사용하였다.
입자크기 분석은 10% 팽이버섯 분말액을 증류수로 10배 희석한 후 Zeta-potential & particle size analyzer ELSZ- 2000(Otsuka Electronics Co., Ltd, Otsuka, Japan)를 사용하 여 측정하였다.
팽이버섯 분말의 수분용해지수(water soluble index, WSI)와 수분흡착지수(water absorption index, WAI)를 측정 하였다. 수분용해지수는 시료 1 g에 증류수 20 mL를 가하여 Intelli mixer로 1시간 교반 후 8,000 rpm으로 20분간 원심분 리 하였다. 원심분리 후 회수된 상등액을 건조기에 105°C에 서 4시간 동안 건조하고 건조된 시료를 무게를 측정하여 건조시료에 대한 백분율로 나타내었다. 수분흡착지수는 상 등액을 제외한 침전물의 무게를 측정하여 건조시료 g당 흡수된 수분량으로 표시하였다.
점조도는 Rheometer system(HAKKE RheoStress 1, Thermo, Karlsruhe, Germany)에 cone plate device(Plate PP35Ti, 3.5 cm diameter)를 장착한 다음 측정하였다. 10% 팽이버섯 분말액 1 mL을 원형 plate에 고루 퍼지게 한 다음 cone plate를 하강시켜 시료와 1 mm 간격으로 유지시켰다. 전단속도(shear rate, 1/s) 변화에 따른 전단응력(shear stress, Pa) 값을 구간 당 10초 동안의 평균값을 측정하여 점조도 값을 평가하였다. 측정 온도는 20°C에서 전단속도(Ѓ)는 1-100 s-1의 범위로 유동특성을 알아보고자 하였고, 점조도 지수는 Power law model로 평가하였다.
σ는 전단응력(shear stress, Pa), K는 점조도 지수 (consistency index, Pa·sn), Ѓ는 전단속도(shear rate, s-1), n은 유동성 지수(flow behavior index)이다.
Lactobacillus plantarum EJ2014는 미강(Uljin, Korea)으 로부터 시료 2 g을 멸균 증류수 18 mL에 혼합한 후 103배까 지 희석하고 Difco™ Lactobacilli MRS broth agar(Becton, Dickinson and Company, Sparks, MD, USA)에 도말하여 30°C 항온배양기(IS-971R, Jeio tech., Kimpo, Korea)에서 24시간 배양하여 균주를 순수 분리하였다(18). 균주의 단일 콜로니를 취하여 1회 MRS agar에서 계대배양한 후, 121°C 에서 15분간 멸균한 MRS broth에 순수 분리된L. plantarum EJ2014를 한 백금이를 접종하여 30°C에서 24시간 정치배양 한 뒤 스타터로 사용하였다.
팽이버섯 분말 10 g과 영양성분인 YE 0.5 g, glucose 1 g, MSG 0-5 g에 증류수 100 mL을 넣은 후 121°C에서 15분간 열처리 하였다. 그 다음 L. plantarum EJ2014 starter를 1% 접종 후 30°C에서 5일간 정치 배양하여 팽이버섯 분말의 발효물을 제조하였다.
pH는 pH meter(model 420+, Thermo Orion, Washington DC, USA)로 측정하였다. 적정 산도는 시료를 1 mL에 증류 수 9 mL을 첨가하여 0.1 N NaOH로 pH 8.3까지 적정한 소비량을 젖산 함량(%, v/v)으로 환산하였다.
생균수는 발효물 1 g에 9 mL의 멸균수를 첨가하여 10배 희석법을 이용하여 104, 105, 106 배로 희석된 것을 MRS agar plate에 20 μL 도말한 다음 30°C 항온배양기에서 24시 간 배양한 후 생균수를 colony forming unit(CFU/mL)로 나 타내었다.
MSG 및 GABA의 정성 분석을 위해 silica gel thin layer chromatography(TLC) plate는 10×20 cm로 잘라서 사용하였 고, TLC 용매 전개는 사각 chamber(30×25×10 cm)에서 수 행하였다. MSG 잔존량과 GABA 함량 비교를 위한 standard 로 MSG 0.25, 0.5, 1, 2%와 GABA 0.25, 0.5, 1, 2%를 사용하 였다. 전개용매는 n-butyl alcohol:acetic acid glacial:distilled water를 3:1:1(v/v)의 비율로 혼합하여 실온에서 4시간 이상 포화시켰다. 발효물 시료와 standard 용액을 TLC plate의 아래에서 15 mm 되는 위치에 2 μL를 점적하였고, 간격은 10-15 mm를 유지하였다. 그 다음 TLC plate의 sample을 건조시켜 전개하였고, 전개가 끝난 TLC plate는 상온에서 건조시킨다. 건조 된 TLC plate에 발색시약인 0.2% ninhydrin 용액을 뿌리고, 100°C 건조기에서 약 5분 동안 발색 시킨 다음 발효물의 MSG와 GABA spot을 확인하였다.
GABA 전환율을 확인하기 위한 유리아미노산 함량을 HPLC로 분석하였다. 건조시킨 시료를 PITC(phenylisothiocyanate) 용액 20 μL(MeOH:H2O:TEA:PITC=7:1:1:1)를 유도체화 시킨 뒤 상온에서 30분간 반응시킨다. 시료를 완 전히 말린 후 200 μL의 A solvent로 녹이고 원심분리 시킨 후 상등액을 0.45 μL syringe filter로 여과한 후 분석하였다. 아미노산 분석은 HPLC 장치(Hewlett Packard 1100 Series, PaloAlto, CA, USA)에 C18 column(Waters Nova-Pak 4 μm)을 장착한 후 mobile 용매는 각각 A(140 mM NaHAc, 0.15% TEA, 0.03% EDTA, 6% CH3CN, pH6.1) 100%로 elution후 25분 동안 B(60% CH3CN, 0.015% EDTA) 100%가 되도록 혼합하면서 분당 1 mL로 흘려주었다. 아미노산 측정은 254 nm에서 UV 흡광도를 측정하였다.
팽이버섯 발효물의 DPPH radical 소거활성 비교를 위해 팽이버섯 분말에L. plantarum EJ2014를 접종하기 전과 후 의 발효물을 원심분리(13,000 rpm, 10 min)하여 얻은 상등 액을 실험에 사용하였다. 팽이버섯 분말 발효 전과 발효 후의 상등액 160 μL와 에탄올에 녹인 0.15 mM DPPH 용액 40 μL를 가하여 실온에서 30분 방치한 후 517 nm에서 흡광 도를 측정하였다. 각 시료 추출물의 유리 라디칼 소거활성 은 시료를 첨가하지 않은 대조구의 흡광도를 2/1로 환원시 키는데 필요한 시료의 농도인 IC50 값으로 나타내었다. 이 때 상대 활성의 비교를 위하여 대조군으로 butylated hydroxy anisole(BHA)를 사용하였다.
7 mM 2,2-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid) 와 2.45 mM potassium persulfate를 최종농도로 혼합하여 실온인 암소에서 24시간 동안 방치하여 ABTS+을 형성시 킨 후 732 nm에서 흡광도 값이 0.70±0.02이 되게 phosphate buffer saline(PBS, pH 7.4)로 희석하였다. 희석된 용액 180 μL에 팽이버섯 분말 발효 전과 후의 발효물을 원심분리 (13,000 rpm, 10 min)하여 얻은 상등액 20 μL를 가하여 정확 히 1분 동안 방치한 후 흡광도를 측정하였다.
결과 및 고찰
팽이버섯 분말의 10% 분산액을 이용하여 팽이버섯 분말 입자 크기를 측정한 결과 52.98±11.56 μm 범위로 나타났으 며 수분흡착지수는 2.58±0.29로, 수분용해지수는 47±0.00% 로 확인되었다. pH는 6.65, 산도는 0.16%, 수용성 고형분 함량은 5.77 °Brix를 나타내었으며 점조도 값은 2.86 Pa·sn 로 나타났다.
젖산균은 정장작용이 있는 대표적인 probiotic으로서 변 비, 설사 등의 각종 특정 질환을 예방하는데 이용되고 있으 며(19), 젖산균을 이용한 식품소재의 발효를 통해서 생산되 는 젖산, 다당류 등은 식품의 풍미, 맛, 조직감 등을 향상시 킬 뿐만 아니라 병원성 미생물의 성장을 억제시킴으로서 식품의 안전성 및 저장성을 부여한다(20,21).
젖산균 생육을 증진시키기 위해 복합 영양성분으로 0.5% yeast extract 첨가 시에 발효과정 중에 배양액의 당도가 크게 감소하면서 젖산발효가 효과적으로 수행된 연구결과 와(18), 젖산발효 시 glucose 1% 수준의 당 첨가가 산 생성을 비롯하여 젖산발효에 도움을 주는 것으로 연구결과가 보고 되었다(22).
이를 바탕으로 팽이버섯 분말을 이용하여 효과적인 GABA생산을 위한 젖산발효의 선행연구로서 0.5% YE, 1% glucose 조건에서 GABA생산을 위한 기질로서 2% MSG를 첨가하여 팽이버섯 분말 함량에 따른 발효를 수행하였다. 팽이버섯 분말 10% 첨가한 조건이 발효 5일째 까지 산도 1.07%, 생균수는 발효 3일까지 1.0×109 CFU/mL로 유지되 다가 5일째 감소하는 것으로 나타났다. 팽이버섯분말의 농 도가 높을수록 생균수는 높게 유지되는 경향을 보였으나 팽이버섯 분말의 농도가 증가함에 따라 점성을 나타내면서 배지의 멸균 시에 끓어 넘치는 현상이 있어 팽이버섯 분말 10% 농도가 젖산발효 시 최적 조건으로 판단되었다. TLC 를 이용하여 GABA 정성분석 한 결과 팽이버섯 분말 10%를 첨가하였을 때 발효 3일째 MSG가 모두 GABA로 전환되는 것을 확인 할 수 있었다(data not shown). 따라서 팽이버섯 분말을 10% 첨가한 조건에서 고농도 GABA 생산을 위한 젖산발효 최적화 연구를 수행하였다.
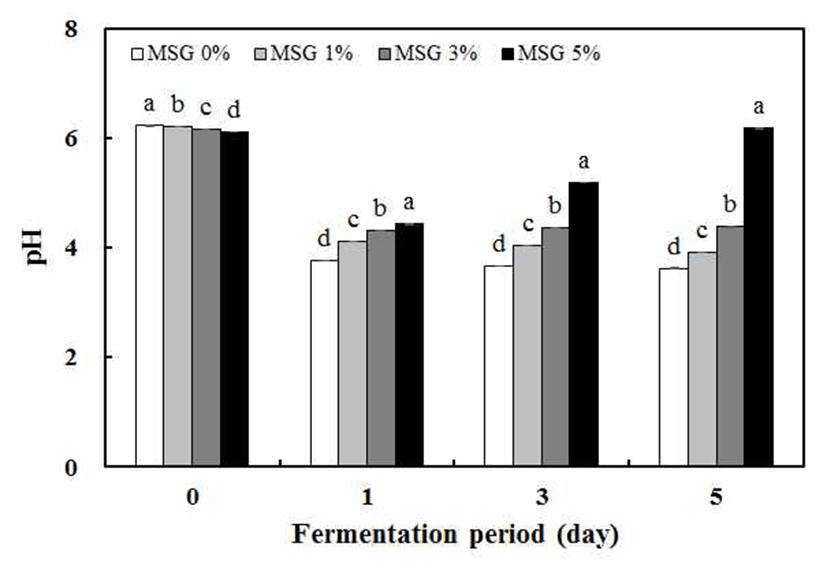
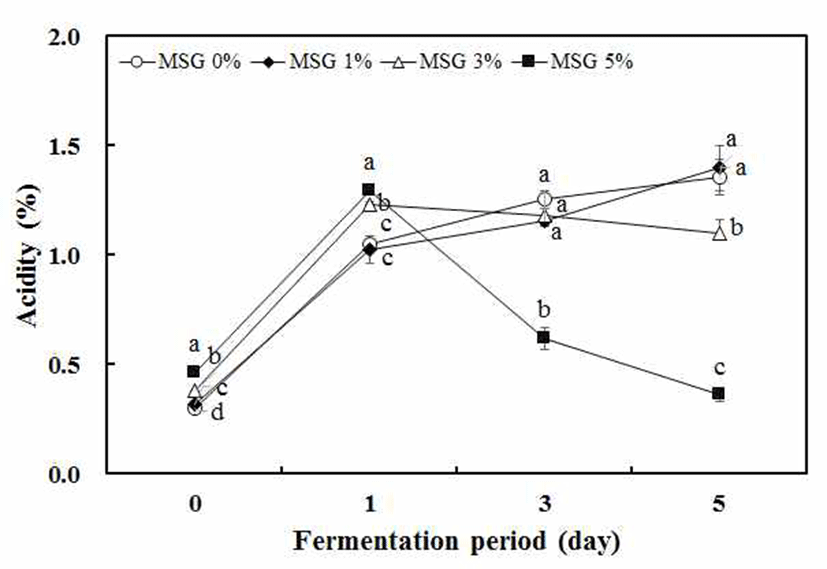
팽이버섯 분말을 10% 함유한 천연 배지조건에 MSG 함 량을 0, 1, 3, 5% 수준으로 첨가하여 정치 배양시킨 후에 발효물의 pH 및 산도를 측정해 본 결과 발효 전의 pH는 MSG 농도와 관계없이 약 pH 6으로 비슷하였다. 그러나 젖산 발효가 진행되면서 0%, 1%, 3% 수준으로 MSG가 첨가된 팽이버섯 발효물은 발효 1일에 pH가 각각 3.7, 4.0, 4.3으로 크게 낮아진 후 발효 3일 동안 유지하는 경향을 보였다. 반면에 5% MSG 첨가는 발효 1일차에 pH 4.4로 떨어진 후 발효 5일째 pH 6.2로 크게 증가하는 것으로 나타 났다(Fig. 1). 이는 김치에서 분리된 젖산균을 이용하여 발 효중에 MSG첨가 없는 배지에서 pH가 크게 감소하는 반면 에 5% MSG를 첨가한 경우에 pH가 상승한다는 연구보고와 유사한 결과를 나타내었다(23). 팽이버섯 발효 전의 산도는 약 0.3%로 나타났으며, 0%, 1% MSG를 첨가한 발효물은 발효 1일에 모두 1.0%로 증가된 후 발효시간이 증가되면서 산도가 점점 증가하여 발효 5일에 각각 약 1.36%, 1.40%를 나타내었다. 3%, 5% MSG를 첨가한 조건에서 젖산 발효물 은 발효 1일차에 산도는 약 1.2%, 1.3%로 증가하다가 발효 5일에 각각 1.1%, 0.4%로 크게 감소하였다(Fig. 2). 따라서 발효시간이 지남에 따라 pH가 급격하게 증가하고, 산도는 급격하게 감소하는 5% MSG를 첨가한 조건에서 GABA가 생산 되었을 것이라고 판단되었다.
L. plantarum은 발효성 당으로부터 젖산만을 생성하는 Homo형 균주로서 발효물의 산도를 높이는 대표적인 젖산 발효 미생물이다. 그러나 팽이버섯 분말의 젖산발효에서 젖산균의 생육에도 불구하고 산도가 감소하는 것은 일반적 인 젖산발효의 결과와는 다른 양상으로 젖산 발효가 진행되 면서 산성을 나타내는 유기산의 일부가 소비되는 것으로 판단되었다.
또한 젖산발효에서 GABA생산을 위해 첨가되는 전구물 질인 MSG는 중성의 아미노산으로서 3% 이상의 농도로 첨가하는 경우에 GABA로 전환 시 발효물의 산도를 유지 또는 감소시키는 경향을 나타내었는데, 이는 미생물의 환 경적인 스트레스를 극복하는 과정에서 젖산균은 높은 산에 대한 내성을 갖기 위해서 배양물에 존재하는 수소이온을 소비하면서 glutamate decarboxylase(GAD)효소작용으로 glutamic acid를 GABA로 전환시키기 때문인 것으로 보고 되었다(24). 젖산균에 의한 산 생성과 이에 따른 pH감소는 일반적인 젖산발효 현상이지만, 젖산균에 의한 GABA생성 이 진행되면 산도가 감소할 수 있으며, 본 연구에서 MSG의 존재하에서 젖산균 발효물은 GABA생성에 따른 산도의 감소를 보이면서 GABA생성 젖산균의 내산성 작용을 나타 내는 것으로 사료되었다.
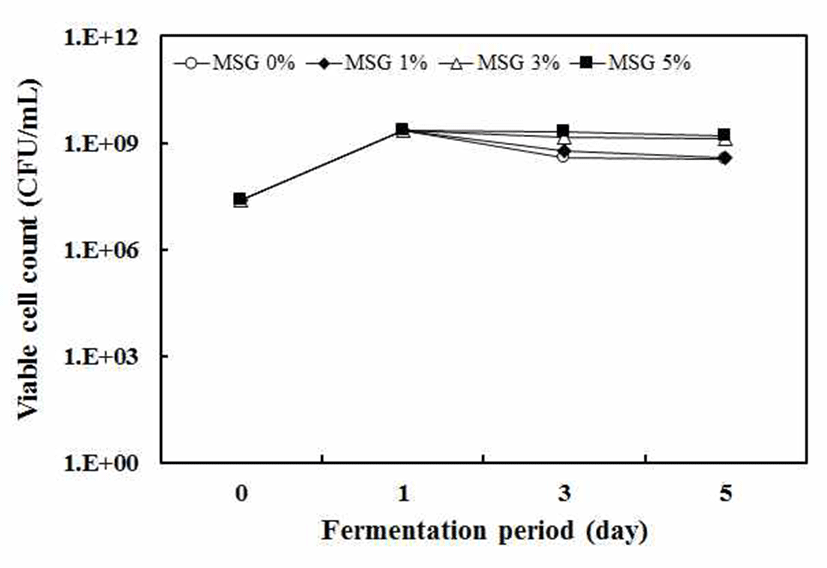
팽이버섯 발효물의 생균수는 초기 젖산균 스타터 2.8×107 CFU/mL에서 발효 1일째 MSG 농도와 관계없이 모든 조건에서 생균수가 2.1×109 CFU/mL으로 가장 높았으 며, 발효 5일째 MSG 0%, 1% 첨가한 발효물은 약 3.6×108 CFU/mL으로 감소하였으나 MSG 3%, 5% 첨가한 발효 물은 생균수가 109으로 계속 유지되는 경향을 보였다(Fig. 3). 이는 MSG존재하에 젖산발효 중에 생성된 유기산이 GABA합성에 의해서 소실되면서 산도가 감소하는 것이 높은 생균수 유지에 영향을 주는 것으로 사료되었다. 일반 적인 젖산균의 생육곡선에서 발효 기간이 증가하면서 발효 산물의 축적과 영양성분의 결핍으로 생균수가 감소하는 경향을 보이는 것과 대조적으로 MSG 3%이상으로 첨가된 팽이버섯 발효물의 경우에 젖산균의 생균수를 높게 유지하 는 것으로 나타났다. 또한, 양식 새우의 사료로서 젖산발효 물을 제조하는 과정에서 열풍건조과정중에 보호제로서 MSG 또는 아카시아 검을 첨가한 경우에 사료 펠렛의 젖산 균 생존률은 75% 이상이었으며, 상온에서 보관 중에도 높 은 생존율을 나타낸다고 보고하였다(25). 이로서 팽이버섯 분말액의 젖산 발효과정에서 질소원인 MSG 첨가는 젖산 균의 생육과 생균수 유지에 효과적이며 GABA와 같은 기능 성 물질을 생산할 수 있는 전구물질로 활용될 수 있음을 확인하였다.
팽이버섯 10% 용액에 첨가된 MSG의 농도에 따른 젖산 균의 젖산발효를 통한 GABA의 함량 변화를 비교하기 위해 발효물을 원심분리 한 후 얻은 상등액을 TLC를 이용하여 분석한 결과 Fig. 4에서 나타낸 것처럼 배지에 첨가된 MSG 농도에 비례하여 GABA spot이 커지는 것을 확인 할 수 있었다. MSG 0%에서는 GABA 함량이 아주 미량이었으나 MSG 5% 첨가한 발효물에서 발효 5일 째 매우 농도가 높은 GABA spot이 나타났다.

팽이버섯 분말액에 YE, glucose, MSG를 첨가한 후 젖산 발효 5일 동안 수행하여 얻어진 발효물의 GABA 함량을 HPLC로 정량 분석 한 결과 발효 전 기질인 glutamic acid는 대부분 이용되면서 초기 함량 3.20%에서 거의 소량만이 잔존하고 2.26%의 GABA로 전환되는 것으로 나타났다 (Table 1). 젖산균에 의한 GABA생산을 위해서 양송이버섯 에서 분리한 젖산균을 이용하여 1% MSG 존재 하에서 0.55% 정도의 GABA를 생산한 연구가 보고되었다(26). 최 근까지 버섯 자체를 배지로 하여 젖산발효에 의한 GABA생 산에 관한 연구보고는 없는 것으로 사료되며, 팽이버섯이 함유한 GAD 효소를 이용하여 GABA생산을 위한 연구에서 1% MSG 수준으로 첨가된 팽이나노분말 용액에서 일부가 GABA로 전환됨을 보고(27)한 연구와 비교할 때 본 실험에 서 유용 젖산균을 이용하여 높은 농도의 전구물질 MSG를 효과적으로 전환시킴으로서 고농도 GABA생산은 매우 유 용한 연구결과라고 판단되었다.
| Fermentation | Glutamic acid (%) | GABA1) (%) |
|---|---|---|
| Before | 3.20±0.482) | 0.01±0.00 |
| After | 0.03±0.00 | 2.26±0.08 |
미생물에 의한 GABA의 생성기작은 세포내에서 glutamic acid가 glutamate decarboxylase(GAD)의 효소에 의하여 탈 탄산이 이루어지면서 생산된 GABA가 세포 밖으로 유출되 는 것으로 보고되었다(28). 따라서 GABA의 미생물을 이용 한 합성을 위해서는 배지성분에 전구물질인 glutamic acid 가 필요하다. 그러나 고농도의 GABA를 함유한 발효소재를 개발하기 위해서는 전구물질인 MSG의 첨가와 이를 효과 적으로 생물 전환시키는 발효조건의 최적화가 필요하다. 다양한 식물소재 및 제한배지에서 전구물질인 MSG를 GABA로 전환시키기 위해서는 발효성 당과 MSG를 포함한 아미노산의 농도가 중요한 인자임을 확인하였다(data not shown).
팽이버섯 분말은 최소한의 발효성당과 5% 수준의 MSG 를 첨가함으로서 GABA전환이 효과적으로 이루어져 고농 도 GABA를 생산할 수 있었다. 팽이버섯은 다른 식용 및 약용버섯에 비해 GABA 함량이 72.17 mg/100 g(dry weight) 로 대체로 높은 함량을 나타내고 있다고 보고되었으나(29), 팽이버섯 분말액에 5% 수준으로 첨가된 MSG는 효과적으 로 젖산균에 의해 GABA로 전환되었으며, 최종 건조된 팽 이버섯 발효물은 약 20배 이상으로 증가된 고농도의 GABA 를 함유할 수 있었다. 팽이버섯 분말을 함유한 요구르트 발효중에 기질로 첨가한 1% MSG로부터 일부가 이용되어 GABA로 전환되는 연구 보고(27)와 비교할 때 전구물질로 높은 농도인 5% MSG를 첨가하여 대부분을 GABA로 전환 시키는 것은 매우 유익한 연구결과로 사료되었다.
DPPH radical 소거 활성법을 이용한 팽이버섯 분말 발효 물의 항산화력을 측정한 결과는 팽이버섯 분말을 발효하기 전 희석배수 10, 50, 100에서 각각 82.22%, 60.74%, 37.78% 의 저해능을 보이는 것을 알 수 있었으며 2.20 mg/mL의 IC50 값을 나타내었다. 팽이버섯 분말 발효 후 radical 소거능 은 희석배수 10, 50, 100에서 각각 76.30%, 58.52%, 43.70% 로 나타났으며 IC50 값은 1.11 mg/mL로 IC50 값이 4.54 μ g/mL인 항산화제 BHA보다는 소거활성이 낮았지만 팽이 버섯 분말 발효물이 더 적은 농도에서 50%의 항산화 활성 을 보이는 것으로 보아 발효 후에 어느 정도의 전자공여능 이 향상되는 것으로 확인되었다(Table 2).
ABTS potassium persulfate를 암소에 방치하여 ABTS+이 생성되면 시료의 항산화력에 의해 ABTS+이 소거되어 radical 특유의 청록색이 탈색 되는데 이를 흡광도 값으로 나타내어 ABTS+의 소거 활성능을 측정할 수 있다. 팽이버 섯 분말을 발효하기 전 희석배수 10, 50, 100에서 각각 90.63%, 50.51%, 35.76%의 저해능을 나타내었으며 IC50 값 은 3.91 mg/mL로 나타나는 것을 확인 할 수 있었다. 팽이버 섯 분말 발효 후 ABTS radical 소거능은 희석배수 10, 50, 100에서 각각 90.63%, 50.51%, 35.76%로 나타났으며 IC50 값은 2.58 mg/mL으로 ABTS 또한 발효 후에 어느 정도의 전자공여능이 높아지는 것을 확인할 수 있었다(Table 3).
Kang(30)의 연구에서 팽이버섯 에탄올 추출물의 DPPH 라디칼 소거능 측정 결과 IC50 값은 0.412 mg/mL로 보고하 였으며, ABTS 라디칼 소거 활성을 분석한 결과 IC50 값은 0.246±0.05 mM Trolox eq./mg extract로 보고하였다. Kang 의 보고와는 다르게 항산화능이 감소한 것처럼 보이나 팽이 버섯 분말액의 경우 팽이버섯 분말 10%를 첨가한 분말액 자체를 항산화 측정 한 것으로서 이는 추출 전처리 과정에 서 차이가 있는 것으로 사료되었다.
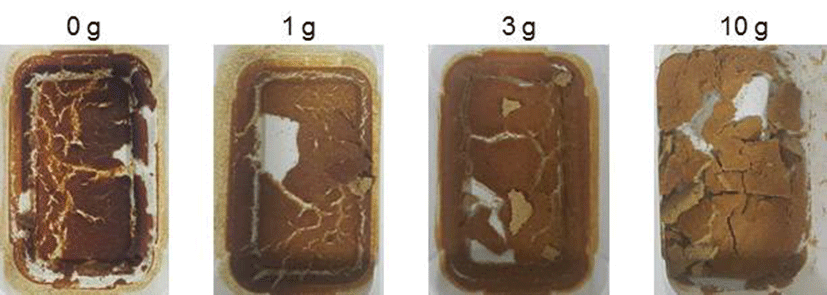
10% 팽이버섯 분말에 0.5% YE, 1% glucose, 5% MSG를 첨가한 후 5일간 젖산발효가 진행되어 고농도 GABA를 함유한 팽이버섯 분말 발효물 30 g에 식이섬유 강화 및 건조분말의 흐름성을 개선시키기 위해 볶은 밀기울 분말을 0, 1, 3, 10 g 각각 첨가하였다. 최종 혼합물은 50°C에서 10시간 열풍건조를 시킨 후 발효 팽이버섯 분말을 제조하 여 발효조미료 소재로 가능성을 평가하였다. 발효 팽이버 섯 분말 제조 시에 볶은 밀기울 분말이 많이 첨가될 수록 볶은 밀기울의 고소한 향은 증가하지만 팽이버섯 분말 발효 물 자체의 조미료 향이 감소하는 것으로 나타났다. 볶은 밀기울을 첨가하지 않고 팽이버섯 발효물 자체만을 열풍 건조하여 조미료를 만들게 되면 풍미는 가장 좋으나 흐름성 이 양호한 분말을 만드는 데는 어려움이 있었다. 이는 팽이 버섯 분말 발효물의 높은 점조성과 수분 흡착능에 따라 건조 발효분말의 흐름이 용이하지 못한 것으로 판단되었 다. 발효 팽이버섯 분말제품의 기호도와 흐름특성을 고려 하였을 때 볶은 밀기울 분말을 1 g 첨가하여 조미료 분말을 만드는 것이 기호성과 물성적 특징이 가장 양호한 것으로 판단되었으며 완성된 조미료 사진은 Fig. 5과 같다.
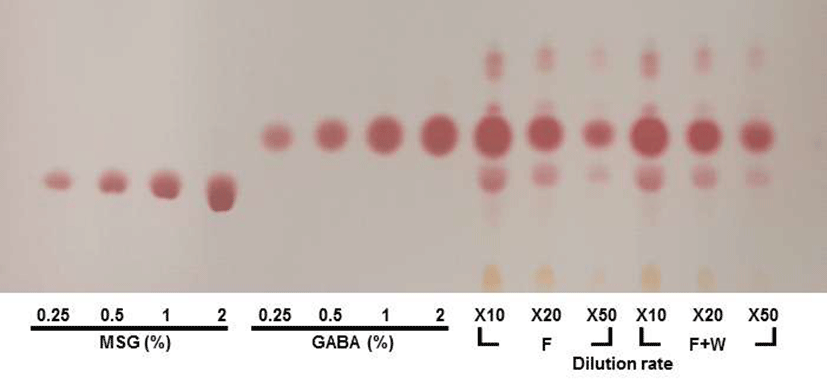
5일 동안 젖산발효 된 팽이버섯 분말 발효물 30 g에 볶은 밀기울을 첨가하지 않은 조건과 흐름성을 위해 볶은 밀기울 분말 1 g 첨가한 조건을 열풍 건조 시킨 천연 발효조미료의 GABA의 함량 차이를 비교하였다. 천연 발효조미료를 10 배, 20배, 50배 배수별로 희석한 다음 원심분리 한 후 얻은 상등액을 TLC를 이용하여 측정 해 본 결과 볶은 밀기울을 첨가하지 않은 조건과 1 g 첨가한 조건 둘 다 비슷하게 GABA 함량이 약 18%로 나타나는 것을 알 수 있었다(Fig. 6). 이상의 결과를 통해 두 조건에서 GABA의 함량 차이가 없어 팽이버섯 젖산 발효물 30 g에 흐름성을 위해 볶은 밀기울 분말 1 g 첨가한 조건을 천연 발효조미료 제조의 최적조건으로 정하였으며, 얻어진 열풍건조 분말을 200배 희석해 유리 아미노산을 HPLC를 이용하여 분석하였다. 그 결과 GABA 함량은 약 17%, glutamic acid는 약 0.8%가 잔존하는 것을 확인할 수 있었으며, 나트륨 함량은 2,666 mg/100 g으로 나타났다. 천연소재 Pharma GABA(Pharma Foods International Co., Ltd., Kyoto, Japan)는 일일 섭취량 100-200 mg 정도에서 3회 섭취를 통해서 긴장완화 및 수면 불안 해소에 도움을 주는 것이 알려졌으며, GABA의 임상 실험을 통해서 긴장완화 및 면역증진에 효과가 있음이 보고 되었다(31).
일본에서는 고농도 GABA함량 소재를 생산하기 위해서 미강 등의 원료를 젖산 발효시켜 15% 이상의 GABA를 함유 한 최종 분말제품을 높은 가격으로 판매하고 있다. 따라서 팽이버섯 분말의 젖산발효를 통해 얻어진 발효물을 이용한 건조분말은 높은 GABA함량을 포함하고 기호성이 우수하 며, probioctic 젖산균을 함유함으로서 천연 발효조미료 원 료로 활용이 가능하다고 판단되었다.
요 약
팽이버섯 분말을 이용하여 기능성물질인 GABA 및 probiotics를 강화시킨 천연 발효조미료를 개발하기 위해서 L. plantarum EJ2014에 의한 젖산발효 최적화 연구를 수행 하였다. 팽이버섯 분말에 영양성분 0.5% YE, 1% glucose, GABA 전구물질인 5% MSG를 첨가한 후 30°C에서 5일간 젖산발효를 진행한 결과 발효 2일 동안 pH는 6.1에서 4.4로 감소하다가 발효 5일에 6.2로 다시 증가하는 경향을 보였으 며 산도는 발효 2일 동안 0.5%에서 1.3%로 증가한 후 발효 5일에 다시 0.4%로 감소하는 경향을 보였다. 생균수는 초기 젖산균 스타터 2.4×107 CFU/mL에서 발효 1일째 2.2×109 CFU/mL로 증가한 후 5일 동안 계속 유지되었다. 전구물질 인 MSG는 발효 4일에 대부분이 이용되면서 약 2.31% 농도 의 GABA로 전환되었으며 DPPH radical 소거 활성은 IC50 값이 1.24 mg/mL로, ABTS radical 소거 활성에서 IC50 값은 1.53 mg/mL로 나타나면서, 발효물의 항산화 효과가 증진되 는 것으로 나타났다. 또한 팽이버섯 발효물 30 g에 볶은 밀기울 1 g을 첨가하여 열풍 건조한 천연 발효조미료의 GABA 함량은 17%로 고농도의 GABA를 함유하여 probiotic 기능성이 강화되며 기호성을 갖는 발효조미료 및 건강소재 의 제조가 가능하였다.