ARTICLE
조, 기장, 수수 추출물의 항산화 효과 및 전립선 암세포주 증식 억제 효능
김정호1, 조현동2, 홍성민3, 이주혜4, 이용석3, 김두현5, 서권일3,*
Antioxidant and antiproliferating effects of Setaria italica, Panicum miliaceum and Sorghum bicolor extracts on prostate cancer cell lines
Jeong-Ho Kim1, Hyun-Dong Cho2, Seong-Min Hong3, Ju-Hye Lee4, Yong-Seok Lee3, Du-Hyun Kim5, Kwon-Il Seo3,*
4농촌진흥청 국립농업과학원 농식품자원부 기능성식품과
1Department of Food and Nutrition, Sunchon National University, Suncheon 57922, Korea
2Department of Food Science and Biotechnology, Kyungpook National University, Daegu 45746, Korea
3Department of Biotechnology, Dong-A University, Busan 49315, Korea
4Functional Food and Nutrition Division, Department of Agro-Food Resource, National Academy of Agricultural Science, Rural Development Administration Wanju 55365, Korea
5Department of Life Resources Industry, Dong-A University, Busan 49315, Korea
© The Korean Society of Food Preservation. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Nov 3, 2016; Revised: Nov 22, 2016; Accepted: Dec 6, 2016
Abstract
In this study, we evaluated antioxidant and antiproliferating effects of Setaria italica extract (SIE), Panicum miliaceum extract (PME) and Sorghum bicolor extract (SBE). Antioxidant effects of these extracts were determined by assessing DPPH radical scavenging activity, ABTS·+ radical scavenging activity, reducing power and superoxide dismutase (SOD)-like activity. From high concentrations (1,000 μg/mL) of each extract at DPPH radical scavenging activities of SIE, PME and SBE were 10.5%, 5.5% and 86.8% respectively, ABTS+ radical activities were 4.92%, 5.9% and 62.3% respectively, reducing powers (OD 700) were 0.15, 0.18 and 1.7 respectively, and SOD-like activities were 17.0%, 15.9% and 38.6% respectively. In addition, SBE significantly decreased the cell viability of androgen-sensitive lymph node metastasis type of prostate cancer (LNCaP) cells in a dose-dependent manner. Morphological study of SBE-treated LNCaP cells revealed distorted and shrunken cell masses. SBE-induced cell death was confirmed by observation of nuclear condensation and increased formation of apoptotic bodies. The antiproliferative effect of SBE seems to be associated with the antioxidant activity of its polyphenol content. The results of this study indicate that SBE can exert antioxidant and antiproliferative effects and may be as a useful food material.
Keywords: antioxidant; antiproliferating; Panicum miliaceum; Setaria italica; Sorghum bicolor
서 론
산화적 스트레스(oxidative stress)는 체내 활성산소 (reactive oxygen species)의 과잉생산에 의해 발생하며 만성 피로, 피부노화, 당뇨, 암, 알츠하이머 질환 등의 생리학적 변화를 유발한다고 보고된 바 있다(1-5). 한편 산화적 스트 레스와 연관된 질병들의 예방 및 치료를 위해 식생활 관리 에 대한 관심이 증가하고 있으며 이에 따라 식품의 생리활 성효능을 탐색하고자 하는 연구도 활발히 진행되는 추세이 다(6).
산화적 스트레스에 기인하는 질병 중 암은 전 세계에서 사망원인 1위로 이를 예방하기 위한 연구들이 다방면으로 진행되고 있다. 최근 서구화된 식생활과 삶의 형태에 따라 우리나라에서 사망률이 높은 암종으로 위암, 대장암, 폐암, 간암 및 전립선암 등이 보고되었다(7). 특히 전립선암은 남성에게 높은 발병률을 보이는 질환으로 통계에 의하면 80대 이상 미국남성의 전립선암 발병률이 80% 이상인 것으 로 보고되었다(8). 전립선암을 치료하기 위해 남성호르몬 인 안드로겐을 차단하는 요법이 사용되고 있으나 안드로겐 비의존적 전립선암에서는 효과가 미비하여 암세포의 성장 이 계속된다는 연구가 보고되었다(9). 또한 방사선 치료 혹은 화학요법은 효과적인 전립선암 치료법이지만 인체적 용에 따른 부작용으로 인하여 최근에는 천연물로부터 암세 포의 사멸을 유도할 수 있는 소재를 발굴하고자 하는 시도 가 각광받고 있는 추세이다(10-12).
최근 식생활에서 식이섬유소, 무기질, 비타민 등과 같은 생리활성 성분이 풍부한 식품들을 다양하게 섭취하여 항산 화, 항암 및 항당뇨 등의 생리활성효능을 증진시키는 방법 이 시도되고 있다(13). 과실류, 채소류 및 곡류를 많이 섭취 할수록 여러 만성질병들을 예방할 수 있다고 보고되었으나 쌀과 함께 보리, 수수, 기장, 옥수수, 귀리, 조 등의 잡곡을 포함하는 곡류는 우리나라에서 주식으로 섭취되었음에도 불구하고 과실과 채소류에 비해 중요성에 대한 인식이나 관심은 상대적으로 낮다. 그러므로 국내에 생산되는 곡류 에 대한 생리활성 연구들이 지속적으로 이루어져야 할 필요 성이 있으며, 국민의 건강한 식생활관리에 도움을 줄 수 있는 정확한 연구를 기반으로 산업적으로도 곡류를 이용한 기능성 소재 개발을 촉진할 필요가 있다고 사료된다. 현재 국내에서는 주로 현미, 율무, 메밀 등에 대한 몇몇의 생리활 성 연구가 있을 뿐, 그 밖의 잡곡류에 대한 생리활성 연구보 고는 미비한 실정이다(14).
건강식품으로 관심을 받고 있는 조(Setaria italica)는 열 매가 작고 원형이며, 종류로는 차조와 메조로 구분되어 있 다. 식이섬유 함량이 2~3%로 입안에서의 맛이나 질감이 뛰어나지는 않지만, 장 운동을 원활하게 하여 변비 및 대장 암 예방 효과가 있다고 알려져 있다(15). 기장(Panicum miliaceum)은 당질이 주성분으로서 쌀보다 소화율은 낮지 만 단백질, 지방질, 무기성분 등이 풍부하며(16), 항염증 (17), 지방세포 분화억제(18), 고지혈증 억제(19) 효능이 밝 혀져 있다. 수수(Sorghum bicolor )는 식이섬유를 비롯하여 페놀화합물과 같은 생리활성물질을 다량 함유하고 있다. 항산화능을 지니는 페놀화합물로는 대부분 플라보노이드 를 함유하고 있는 것으로 보고되어져 있고(20), 이러한 성분 들을 통하여 면역세포에서의 항체 생성능, 항당뇨 및 난소 암세포의 성장 억제에 대한 효능만이 밝혀져 있다(21,22).
이에 본 연구에서는 대표적으로 섭취되는 잡곡인 조, 기 장 및 수수의 항산화 및 암세포 성장 억제 효과를 알아보았 으며, 이들의 총 폴리페놀 함량을 측정하여 생리활성과의 상관관계를 비교분석 하였다.
재료 및 방법
조, 기장, 수수 에탄올 추출물의 제조
본 실험에 사용된 조, 기장, 수수는 ‘황금조’, ‘황금기장’, ‘황금찰’ 품종으로 2015년에 농촌진흥청 국립식량과학원 에서 제공받아 4℃에 냉장보관 후 사용하였다. 각각 분쇄기 로 마쇄한 후 분말 시료의 20배(w/v)량 94% 에탄올(SK Chemicals Co., Ltd., Seongnam, Korea)을 혼합한 후 24시간 추출하여 여과하였다. 이를 3회 반복하여 얻은 여과액을 회전감압농축기(EYELA, Tokyo Rikakikai Co., Tokyo, Japan)로 농축하여 조추출물(Setaria italica ethanol extract, SIE), 기장추출물(Panicum miliaceum ethanol extract, PME) 및 수수추출물(Sorghum bicolor ethanol extract, SBE)을 얻 었다.
총 폴리페놀 측정
총 폴리페놀 함량은 Folin-Ciocalten 방법에 따라 측정하 였다(23). 즉, 시료 0.1 mL에 증류수 8.4 mL과 2 N Folin-Ciocalten 시약(Sigma-Aldrich Co., St. Louis, MO, USA) 0.5 mL를 첨가하고 20% Na2CO3(Junsei Chemical Co., Ltd., Tokyo, Japan) 1 mL를 가하여 2시간 방치하였다. 반응 물의 흡광도는 725 nm에서 UV/Vis-spectrophotometer (U-1800, Hitachi Ltd., Tokyo, Japan)를 사용하여 측정하였 고, gallic acid(Sigma-Aldrich, Co.)를 이용한 표준곡선으로 양을 환산하였다.
DPPH 라디칼 소거활성 측정
각 추출물의 농도별에 대한 1,1-Diphenyl-β-picrylhydrazine (DPPH, Sigma-Aldrich Co.)라디칼에 대한 소거효과는 Blois(24)의 방법에 준하여 측정하였다. 조, 기장, 수수 추출 물 및 양성 대조군(positive control)으로 0.1% dibutylated hydroxytoluene(BHT)와 α-tocopherol(Sigma-Aldrich Co.) 용 액 각각 1 mL을 5×10-4 M DPPH 용액 3mL를 5초 동안 혼합한 후, 암실에서 30분간 반응시켜 UV/Visspectrophotometer( U-1800, Hitachi Ltd.)로 517 nm에서 흡광 도를 측정하였다. Control은 시료 대신 에탄올 1 mL을 첨가 하여 control에 대한 흡광도의 감소비율로 나타내었다.
ABTS+ 라디칼 소거활성 측정
시료에 대한 ABTS+ 소거활성은 Biglari 등(25)의 방법을 변형하여 측정하였다. 7 mM의 2,2'-Azobi(2-aminopropane) dihydrochloride(Sigma-Aldrich Co.)는 2.45 mM의 ABTS와 혼합한 후 23℃의 암소에서 16시간 동안 반응시켰다. ABTS 용액의 농도는 734 nm에서 흡광도가 0.700±0.005 정도가 되도록 조정하였다. 시료 0.1 mL 와 3.9 mL ABTS 용액을 혼합한 후, 23℃에서 6분간 반응시킨 후 734 nm에서 UV/Vis-spectrophotometer(U-1800, Hitachi)로 흡광도를 측정 하였다. ABTS˙+ 라디칼 소거능은 다음의 식에 따라 계산하 였다.
환원력 측정
시료들의 환원력은 Yildirim 등(26)의 방법을 변형하여 측정하였다. 시료 2.5 mL에 2.5 mL의 phosphate buffer(0.2 M, pH 6.6)과 2.5 mL의 potassium ferricyanide(1%, w/v)를 첨가하여 섞은 후, 50℃를 유지하면서 30분간 반응시켰다. 반응액에 2.5 mL의 trichloroacetic acid(10%, w/v)를 첨가하 여 섞은 후, 3,000 rpm으로 10분간 원심분리 하였다. 상층액 의 1 mL 을 취해 시험관에 담고 1 mL의 증류수와 0.2 mL의 FeCl3(0.1%, w/v)을 첨가하여 흡광도 700 nm에서 UV/Visspectrophotometer( U-1800, Hitachi)를 이용하여 환원력을 측정하였다.
SOD-like activity 측정
SOD-like activity는 Marklund(27)의 방법을 약간 변형하 여 실험하였다. 상온에서 2.6 mL의 Tris-HCl buffer(pH 8.5) 에 0.2 mL의 시료와 0.2 mL의 7.2 mM pyrogallol 용액을 첨가하여 10분간 실온에서 반응시킨 후 1 N HCl 0.1 mL을 혼합하여 반응을 정지시키고 반응액 중 산화된 pyrogallol 의 양을 흡광도 420 nm에서 UV/Vis-spectrophotometer (U-1800, Hitachi)를 이용하여 측정하여 시료용액의 첨가구 와 비첨가구와의 흡광도 감소율로 나타내었다.
암세포 배양
본 실험에 사용한 LNCaP 세포 및 PC-3 전립선암세포주 는 한국세포주은행(KCLB)에서 분양받아 100 unit/mL의 Antibiotic Antimycotic(GIBCO®/InvitrogenTM, Gran Island, NY, USA)와 10% FBS(Fetal Bovine Serum)가 첨가된 DMEM(GIBCO®/InvitrogenTM)을 이용하여 37℃, 5% CO2 incubator(Thermo Scientific, Waltham, MA, USA)에서 계대 배양하여 사용하였다.
암세포 증식 억제능 측정
암세포 증식 억제능은 sulforhodamine B(SRB, Sigma Aldrich Co.)법을 이용하여 측정하였다. SRB assay는 생존 세포 내의 단백질 총량을 흡광도로 나타내어세포사멸정도 를 확인하는 방법으로 trichloroacetic acid(TCA, Sigma- Aldrich Co.)에 의해 생존 세포만 well plate에 부착되며 이 세포의 단백질 내 염기성 아미노산 잔기가 SRB와 결합하여 마지막에 처리하는 Tris buffer에 녹아나와 흡광도를 나타낸 다(28). 암세포 증식 억제능은 각각의 세포를 2×104 cells/mL가 되도록 희석하여 48 well plate에 분주한 다음 37°C, 5% CO2 incubator에서 24 시간 배양한 후, SIE, PME, SBE를 농도별로 첨가하고 24 시간 동안 반응시켰다. 24 시간 후 12% TCA 용액을 넣어 4°C에서 세포를 고정시키고 well을 세척한 후 0.4% SRB 용액을 첨가하여 염색하였다. 염색 종료 후 1% acetic acid(Kanto Chemical Co., Inc., Tokyo, Japan)로 세척하고 10 mM Tris buffer(Sigma-Aldrich Co.)를 첨가하여 SRB를 녹여낸 후 상등액을 96 well plate에 옮겨 microplate reader(Titertek Multiscan Plus, Labsystems, Espoo, Finland)를 사용하여 540 nm에서 흡광도를 측정하였 다.
암세포 형태의 관찰
암세포를 1×106 cells/mL가 되도록 희석하여 6 well plate 에 분주한 다음 37℃, 5% CO2 incubator에서 24시간 배양하 여 각각 추출물을 500 μg/mL의 농도로 well plate에 처리하 고 24시간 동안 반응시켰다. 이후 세포의 형태학적 변화는 200배율의광학현미경(Leica Microsystems, Wetzlar, Germany) 으로 관찰하고 사진을 촬영하였다.
Hoechst staining
암세포를 5×105 cells/mL가 되도록 희석하여 6 well plate 에 분주한 다음 37℃, 5% CO2 incubator에서 배양한 후, 시료를 처리하여 24시간 동안 반응시켰다. 반응이 종료된 세포를 수거하여 200 μL Hoechst 33258(bis-benzimide, 1 μg/mL, Sigma-Aldrich Co.)을 첨가하여 실온에서 10분간 염색시킨 후 PBS로 2회 세척하였다. 염색된 핵을 형광현미 경으로 관찰하였다.
통계처리
실험결과는 3 반복에 대한 평균 및 표준편차로 표시하였 으며, 각 실험군을 대조군에 대한 백분율로 나타내었다. 각 군 간의 통계적 유의성에 대한 검증은 Student's t-test를 실시하여 유의성 여부를 판정하였다(*p<0.05, **p<0.01, ***p<0.001).
결과 및 고찰
조, 기장 및 수수 에탄올 추출물의 총 폴리페놀 함량비교
천연물에 함유되어 있는 페놀성 화합물들은 항균, 항산 화, 항암 등 다양한 생리활성 효과가 있으며, 이를 천연 항산화제로 사용할 수 있다고 알려져 있다(29). SIE, PME 및 SBE에 대한 항산화 및 항암효능이 폴리페놀 함량과 연관이 있는지 알아보기 위해 총 폴리페놀 함량을 측정한 결과는 Table 1과 같다. SIE, PME 및 SBE의 폴리페놀 함량 은 각각 2.04, 1.71 및 29.71 mg GAE/g으로 확인되었으며 SBE가 SIE 및 PME보다 폴리페놀 함량이 높은 것으로 나타 났다. Kim 등(30)은 곡류에 약 0.5 mg/g 정도의 페놀화합물 을 함유되어 있다고 보고하였으며, 본 연구에서 측정한 SIE, PME 및 SBE의 폴리페놀 함량이 대체로 높은 수준으로 확인되었다. 이후 항산화 및 항암효능을 평가하여 SIE, PME 및 SBE의 폴리페놀 함량과 생리활성효능의 관련성을 알아보았다.
Table 1.
Analysis of total polyphenol contents of SIE, PME, and SBE
|
|
SIE1) |
PME |
SBE |
|
Total polyphenol contents (mg GAE2)/g ) |
2.04±0.123) |
1.71±0.08 |
29.7± 1.64 |
Download Excel Table
조, 기장 및 수수 에탄올 추출물의 항산화 활성비교
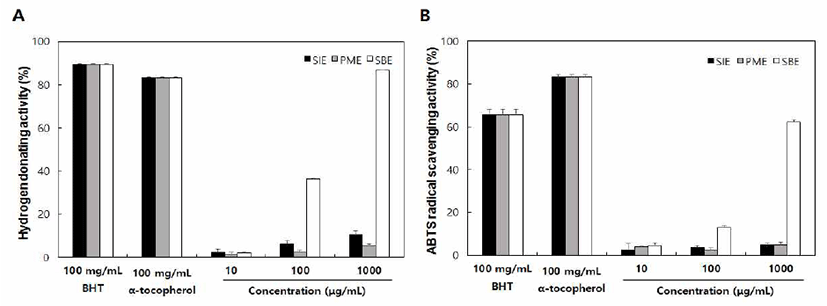
항산화능이란 지질, 단백질, 탄수화물, DNA 등의 생물학 적 분자에 손상을 주는 활성 라디칼에 전자 혹은 수소 원자 를 공여함으로써 안정한 상태로 전환시키는 것이다(31). 본 연구진들의 시료인 SIE, PME 및 SBE의 항산화능을 측정 하기 위해 합성 항산화제인 BHT와 천연 항산화제인 α -tocopherol 및 ascorbic acid를 양성 대조구로 이들의 항산화 활성을 비교분석한 결과를 Fig. 1 및 2에 나타내었다. DPPH 라디칼 소거활성 측정에 사용되는 자색의 DPPH 시약은 비교적으로 안정한 상태의 free radical로써 천연 소재로부 터 항산화 물질 검출에 많이 이용되고 있다(32). 추출물들의 DPPH 라디칼 소거활성은 SBE를 제외하고는 활성을 나타 내지 않았으며, SBE는 농도의존적으로 활성이 증가하여 1000 μg/mL의 농도에서 양성대조구과 유사한 활성을 나타 내었다(Fig. 1A). ABTS·+ radical 소거능은 ABTS·+ free radical이 항산화 물질에 의해 수소를 제공받아 안정한 물질 로 변하여 특유의 푸른색을 잃는 원리를 이용한 방법이다 (33). 본 연구에서 SIE, PME 및 SBE의 ABTS radical 소거능 은 대조구와 비교하여 1,000 μg/mL의 농도에서 각각 4.9%, 4.8%, 62.3%의 활성을 나타내어 SBE가 가장 높게 나타났으 며 이는 DPPH radical 소거활성과 비슷한 경향을 보였다 (Fig. 1B).
Fig. 1.
Radical scavenging activities of SIE, PME, and SBE.
A, DPPH radical scavenging activity; B, ABTS·+ radical scavenging activity.
SIE, Setaria italica extract; PME, Panicum miliaceum extract; SBE, Sorghum bicolor extract.
Date values were expressed as mean±SD (n=3).
Download Original Figure
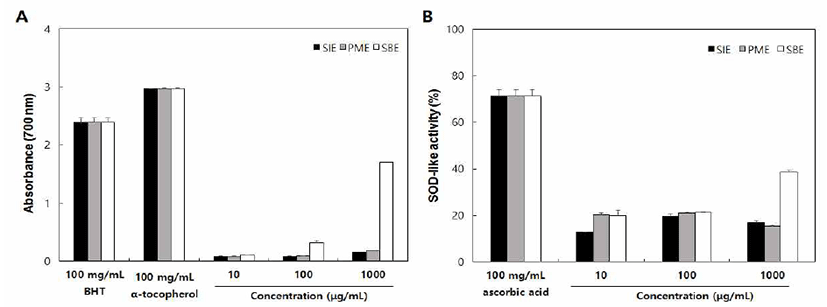
Fig. 2.
Antioxidant activities of SIE, PME and SBE.
A, reducing power effect; B, SOD-like activity.
SIE, Setaria italica extract; PME, Panicum miliaceum extract; SBE, Sorghum bicolor extract. Date values were expressed as mean±SD (n=3).
Download Original Figure
환원력은 시료에 존재하는 reductones에 의해 제공되는 수소가 활성산소를 분해함에 따라 나타나는 항산화능을 측정하는 방법이다(29). 추출물들의 환원력은 양성대조구 와 비교하였을 때 1,000 μg/mL의 농도에서 1.71의 흡광도 값을 나타낸 SBE만이 활성을 보였으며 SIE와 PME의 경우, 각각 0.15, 0.18의 흡광도를 나타내어 환원력의 활성이 매우 낮은 것으로 나타났다(Fig. 2A). SOD는 생체에 유해한 superoxide anion radical과 반응하여 H2O2를 생성하는 효소 로서 대부분의 생물에 존재하며 활성산소에 대한 산화 방어 작용을 하는 대표적인 항산화 효소이다(30). 10 및 100 μ g/mL 농도에서는 SIE, PME 및 SBE 모두 비교적 낮은 활성 을 보였으나, 1,000 μg/mL의 농도에서 SBE가 양성대조군과 비교할 때 39%의 활성을 나타내었다(Fig. 2B). 전반적으로 SIE, PME 및 SBE의 항산화능은 양성대조군들과 비교하여 낮은 수치를 기록하였지만, 폴리페놀 함량이 가장 높았던 SBE가 SIE 및 PME보다 대체적으로 높은 항산화 활성을 보였다. Ko 등(34)은 발아온도에 따른 조, 기장 및 수수 추출물의 항산화 활성을 비교하였을 때, 조 및 기장보다 수수 추출물의 항산화능이 높게 나타났다고 보고하였다. 이는 본 연구의 결과와 유사하였으며 이를 통해 조나 기장 보다 폴리페놀 함량이 높은 수수를 섭취할 때 보다 높은 항산화능을 기대할 수 있을 것으로 판단된다.
조, 기장 및 수수 에탄올 추출물의 암세포 성장억제 효능 비교
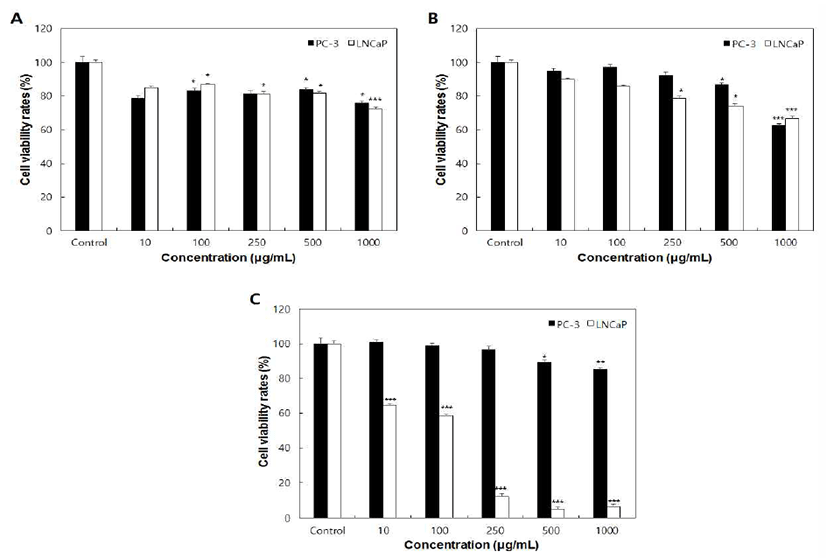
암은 정상조직 내 활성산소의 과도한 축적에 의해 정상 세포 및 DNA 손상이 발생하고 감염, 노화, 유전자 돌연변이 등이 유도되어 세포사멸이 억제됨에 따라 암세포로 변화되 는 것으로 알려져 있다(35,36). 이러한 연구결과들을 바탕 으로 높은 항산화능을 가진 물질이 암세포의 사멸에도 긍정 적인 영향을 미칠 것으로 예상하였다. 이에 본 연구에서는 SIE, PME 및 SBE의 처리가 전립선 암세포의 성장억제에 미치는 영향을 알아보기 위하여 뼈에 전이된 형태인 안드로 겐 비민감성 PC-3 세포와 림프절에 전이된 형태인 안드로 겐 민감성 LNCaP 세포의 성장억제 효과를 SRB assay를 이용하여 확인하였다(Fig. 3). PC-3 및 LNCaP 세포에 각각 의 추출물들을 농도별로 희석하여 처리하였을 때 SIE 및 PME는 대조군과 비교하여 250~1,000 μg/mL의 농도에서 유의적인 세포사멸을 나타내었다(Fig. 3A, 3B). SIE를 가장 높은 농도인 1,000 μg/mL로 처리하였을 때 PC-3 세포에서 76.65%, LNCaP 세포에서 74.25%의 세포생존율을 나타내 었으며 PME는 PC-3 세포에서 62.15%, LNCaP 세포에서 64.41%의 세포생존율을 보였다. 반면 SBE를 농도별로 처 리하였을 때 LNCaP 세포의 경우 비교적 낮은 농도인 10 μg/mL에서부터 유의적인 세포 성장 억제 효과를 나타내었 으며 PC-3세포는 500 μg/mL의 농도에서 유의적인 세포성 장 억제효능을 확인할 수 있었다(Fig. 3C).
Fig. 3.
Effect of SIE, PME and SBE treatment on cell growth of PC-3 and LNCaP human prostate cancer cells.
A, SIE, Setaria italica extract; B, PME, Panicum miliaceum extract; C, SBE, Sorghum bicolor extract.
Cell viability was determined by SRB assay. Data values are expressed as mean±SD of triplicate determinations. Significant differences were compared with control at *p<0.05, **p<0.01 and ***p<0.001 by student t-test.
Download Original Figure
공통적으로 유의적인 세포사멸을 나타내었던 500 μg/mL 의 농도로 SIE, PME 및 SBE를 처리하였을 때 PC-3 및 LNCaP 세포의 형태학적 변화를 확인한 결과는 Fig. 4와 같다. PC-3 및 LNCaP 세포에서 500 μg/mL의 농도로 SIE 및 PME를 처리하였을 때 세포형태가 대조군과 유사하게 유지되는 것으로 확인되었다(Fig. 4A 및 B). 하지만 500 μg/mL의 SBE를 처리하였을 때 안드로겐 비민감성 PC-3 세포는 형태학적 변화가 관찰되지 않았으나 안드로겐 민감 성 LNCaP 세포는 세포막의 수축 및 부유세포의 증가가 관찰되었다(Fig. 4B). Laidler 등(37)에 따르면 안드로겐 민 감성이 다른 전립선 암세포주에 docetaxel을 처리한 결과 안드로겐 민감성 LNCaP 세포의 사멸율이 비민감성 PC-3 세포보다 높게 나타났으며 항암활성을 갖는 물질과 안드로 겐 수용체의 발현유무가 암세포의 사멸에 밀접한 연관이 있다고 보고하였다. 본 연구결과는 SIE, PME 및 SBE 중에 서 SBE가 가장 뛰어난 전립선 암세포 증식억제효능을 가지 는 것으로 나타났다. 특히, SBE에 의한 전립선 암세포 성장 억제효과는 안드로겐 의존성 암세포에서 특이적으로 유도 된다는 결과를 보았을 때 수수의 생리활성 물질이 안드로겐 수용체 의존성 세포사멸과 연관이 있을 것으로 생각된다.
Fig. 4.
Photomicrographs of the (A) PC-3 and (B) LNCaP human prostate cancer cells treated with SIE, PME and SBE.
SIE, Setaria italica extract; PME, Panicum miliaceum extract; SBE, Sorghum bicolor extract.
Morphology of cell was observed by optical microscopy at × 200 magnification.
Download Original Figure
조, 기장 및 수수 에탄올 추출물의 처리가 전립선 암세포 핵의 형태변화에 미치는 영향
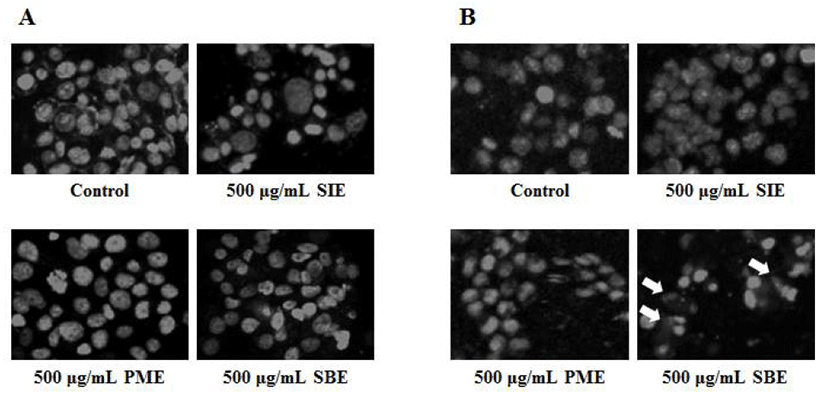
Apoptosis는 정상적인 또는 병리학적 요인에 노출된 후 죽음에 이르게 되는 현상을 말하며 DNA의 절단에 의한 염색질 및 핵의 응축, 세포막 수포화 현상, DNA 단편화 등이 수반된다고 알려져 있다(38,39). SIE, PME 및 SBE에 의한 인체 전립선 암세포 증식억제효과가 apoptosis에 의한 것인지 알아보기 위해 hoechst 33258 염색을 통한 핵 형태의 변화를 관찰한 결과는 Fig. 5와 같다. PC-3 및 LNCaP 세포의 대조군에서는 핵의 형태가 손상이 없이 유지되는 반면, LNCaP 세포에 500 μg/mL의 SBE를 처리하였을 때 핵의 응축, 절편 및 apoptotic body의 형성이 관찰되었다. 이는 세포증식억제 결과와 동일하게 PC-3 세포에 500 μg/mL의 SBE를 처리한 군에서는 핵의 손상이 거의 관찰되지 않았다 (Fig. 5). 또한 LNCaP 및 PC-3 세포에 500 μg/mL 농도의 SIE 및 PME를 처리한 군에서는 유의적인 세포독성이 나타 나지 않았다. Suganyadevi 등(40)은 수수가 유방암 세포에 서 p53 유전자를 통한 증식 억제 효능을 가진다고 하였고, Park 등(41)은 마우스에 이종 이식한 유방암 세포를 이용하 여 수수의 종양 성장과 전이 억제 효과가 있다고 보고한 바 있다. 이러한 연구들과 유사하게 SBE에 의한 안드로겐 의존성 전립선 암세포 성장억제효과는 apoptosis의 유발과 밀접한 연관이 있는 것으로 판단된다. 앞으로 수수의 항산 화 효능과 암 억제 메커니즘에 대한 자세한 연구가 필요하 다고 사료되어지며, 이를 바탕으로 수수를 효과적인 기능 성 식품원료로 이용할 수 있을 것으로 기대된다.
Fig. 5.
Nuclear fragmentation in (A) PC-3 and (B) LNCaP human prostate cancer cells after treatment of extracts.
SIE, Setaria italica extract; PME, Panicum miliaceum extract; SBE, Sorghum bicolor extract. Fluorescent microscopy was performed by Hoechst 33258 staining.
Download Original Figure
요 약
본 논문에서는 조, 기장 및 수수 추출물에 대한 항산화활 성 및 인체 전립선암 세포성장 억제효과를 평가하고자 하였 다. 조, 기장 및 수수 추출물에 대한 항산화 활성을 DPPH 라디칼 소거능, ABTS 라디칼 소거능, 환원력 및 SOD 유사 활성능을 통해 확인한 결과, 수수 추출물에서 농도의존적 인 항산화 활성의 증가를 관찰할 수 있었으며 이는 조 및 기장 추출물보다 높은 효능을 보이는 것으로 나타났다. 두 가지의 다른 형태의 인체 전립선 암세포(PC-3 및 LNCaP)를 이용하여 암세포 증식 억제활성을 확인한 결과, 조 추출물 과 기장 추출물의 처리는 1,000 μg/mL의 농도에서도 큰 억제 효과를 확인할 수 없었으나 LNCaP 세포에 수수 추출 물을 처리한 군에서는 10 μg/mL 의 농도에서부터 유의적인 세포증식 억제효능을 확인할 수 있었다. PC-3 및 LNCaP 세포의 형태학적 변화를 알아본 결과, 수수 추출물을 처리 한 군에서 부유, 사멸 및 증식억제가 관찰되었으나 동일한 농도의 조 및 기장 추출물을 처리한 군에서는 대조군과 유사한 세포형태를 유지하였으며 특이적인 세포독성이 관 찰되지 않았다. Hoechst 염색을 통한 핵 형태 관찰에서도 조 및 기장 추출물과는 대조적으로 수수 추출물에서만 apoptotic body, 세포 및 핵의 응축 등 세포 사멸과 관련된 형태학적 변화가 관찰되었다. 조, 기장, 수수 추출물의 총 폴리페놀 함량은 각각 2.01, 1.71, 29.10 mg GAE/g로 나타났 으며, 총 폴리페놀 함량이 가장 높았던 수수에서 항산화 및 항암 효능이 우수함을 확인할 수 있었다. 결과적으로 조, 기장 및 수수 추출물 중 폴리페놀 함량이 가장 높았던 수수에서 항산화 활성 및 인체 전립선 암세포의 성장 억제 효과가 뛰어난 것으로 확인되었으며, 이를 통해 수수 추출 물을 항산화 및 암세포의 증식억제를 위한 식품원료 및 산업 소재로 활용할 수 있을 것으로 사료된다.
감사의 글
본 연구는 농촌진흥청 아젠다 사업(과제번호: PJ011238) 의 지원에 의해 수행되었으므로 이에 감사드립니다.
References
Shen Y, Zhang H, Cheng L, Wang L, Qian H, Qi X. In vitro and in vivo antioxidant activity of polyphenols extracted from black highland barley. Food Chem. 2016; 194:1003-1012


Niki E. Antioxidant capacity of foods for scavenging reactive oxidants and inhibition of plasma lipid oxidation induced by multiple oxidants. Food Funct. 2016; 7:2156-2168


Maes M, Twisk FNM. Chronic fatigue syndrome Harvey and Wessely's (bio) psychosocial model versus a bio (psychosocial) model based on inflammatory and oxidative and nitrosative stress pathways. BMC Medicine. 2010; 8:1-13.

Rittie L, Fisher GJ. UV-light-induced signal cascades and skin aging. Ageing Res Rev. 2002; 1:705-720


Shen S, Callaghan D, Juzwik C, Xiong H, Huang P, Zhang W. ABCG2 reduces ROS-mediated toxicity and inflammation a potential role in Alzheimer's disease. J Neurochem. 2014; 114:1590-1604.

Lee JH, Shin YJ, Cho DJ, Lim HJ, Choi WE, Lee YK. Antitumor and antimutagenic effect of the proteinpolysaccharides from Poluporus umbellatus. J Korean Soc Food Sci Nutr. 2004; 33:475-479.

Park MS, So JS, Bahk GJ. Antioxidative and anticancer activities of water extracts from different parts of Taraxacum coreanum Nakai cultivated in Korea. J Korean Soc Food Sci Nutr. 2015; 44:1234-1240


Burks DA, Littleton RH. The epidemiology of prostate cancer in black men. Henry Ford Hosp Med J. 1992; 40:89-92.

Panov A, Orynbayeva Z. Bioenergetic and antiapoptotic properties of mitochondria from cultured human prostate cancer cell lines PC-3, DU145 and LNCaP. PLoS One. 2013; 8:e72078


Won YS, Lee JH, Kwon SJ, Ahn DU, Shin DY, Seo KI. Anticancer effects of cultivated Orostachys japonicus on human prostate cancer cells. J Korean Soc Food Sci Nutr. 2014; 43:67-73


Kwon SH, Kwon SJ, Kim JY, Park KW, Shim KH, Seo KI. Protective effect of Corni fructus ethanol extracts against environmental hormones in human prostate cancer cells. J Korean Soc Food Sci Nutr. 2009; 38:663-666


Park SY, Kim EJ, Lim DY, Kim JS, Lim SS, Shin HK, Yoon JH. Inhibitory effect of the hexane extract of Saussurea lappa on the growth of LNCaP human prostate cancer cells. J Korean Soc Food Sci Nutr. 2008; 37:8-15


Hwang EJ, Cha YJ, Park MH, Lee JW, Lee SY. Cytotoxicity and chemosensitizing effect of camellia (Camellia japonica) tea extracts. J Korean Soc Food Sci Nutr. 2004; 33:487-493.

Kwak CS, Lim SJ, Kim SA, Park SC, Lee MS. Antioxidative and antimutagenic effects of Korean buckwheat, sorghum, millet and Job's tears. J Korean Soc Food Sci Nutr. 2004; 33:921-929.

Ha YD, Lee SP. Characteristics of proteins in Italian millet, sorghum and common meillet. Korean J Postharvest Sci Technol. 2001; 8:187-192.

An TK. Illustrated book of Korean medicinal herbs. 1999; Kyohak Publishing Co Ltd. Seoul, Korea: p. 887.

Zhang L, Liu R, Niu W. Phytochemical and antiproliferative activity of proso millet. PLoS One. 2014; 9:e104058


Park MY, Seo DW, Lee JY, Sung MK, Lee YM, Jang HH, Choi HY, Kim JH, Park DS. Effects of Panicum miliaceum L. extract on adipogenic transcription factors and fatty acid accumulation in 3T3-L1 adipocytes. Nutr Res Pract. 2011; 5:192-197


Park MY, Jang HH, Kim JB, Yoon HN, Lee JY, Lee YM, Kim JH, Park DS. Hog millet (Panicum miliaceum L)-supplemented diet ameliorates hyperlipidemia and hepatic lipid accumulation in C57BL/6J-ob/ob mice. Nutr Res Pract. 2011; 5:511-519


Kim KO, Kim HS, Ryu HS. Effect of Sorghum bicolor L. Moench(Sorghum, su-su) water extracts on mouse immune cell activation. J Korean Diet Assoc. 2006; 12:82-88.

Vermont PD, Pangloli P, Jones L, McClureb A, Patel A. Phytochemical concentrations and biological activities of Sorghum bicolor alcoholic extracts. Food Funct. 2016; 7:3410-3420.

Park JH, Lee SH, Chung IM, Park YS. Sorghum extract exerts an anti-diabetic effect by improving insulin sensitivity via PPAR-? in mice fed a high-fat diet. Nutr Res Pract. 2012; 6:322-327


Gao X, Bjork L, Trajkovski V, Uggla M. Evaluation of antioxidant activities of rosehip ethanol extracts in different test systems. J Sci Food Agric. 2000; 80:2021-2027


Blois MS. Antioxidant determination by the use of a stable free radical. Nature. 1958; 181:1199-1200


Biglari F, AlKarkhi AFM, Easa AM. Antioxidant activity and phenolic content of various date palm (Phoenix dactylifera) fruits from Iran. Food Chem. 2008; 107:1636-1641


Yildirim A, Mavi A, Kara AA. Determination of antioxidant and antimicrobial activities of Rumex crispus L extracts. J Agric Food Chem. 2001; 49:4083-4089.

Marklund S, Marklund G. Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase. Eur J Biochem. 1974; 47:469-474


Vichai V, Kirtikara K. Sulforhodamine B colorimetric assay for cytotoxicity screening. Nature Protocols. 2006; 1:1112-1116


Kang HI, Kim JY, Kwon SJ, Park KW, Kang JS, Seo KI. Antioxidative effects of peanut sprout extracts. J Korean Soc Food Sci Nutr. 2010; 39:941-946


Kim DG, Lee BG, Kim HY. Use of Fraxnius rhynchophylla H? ance bark as antioxidant. J Kor For En. 2003; 22:69-76.

Kang SR, Shin MO, Kim SG, Lee SH, Kim MH. Antioxidative activity of pine (Pinus densiflora) needle extracts in rats fed high-cholesterol diet. J Korean Soc Food Sci Nutr. 2009; 38:423-429


Lee JM, Chung H, Chang PS, Lee JH. Development of a method predicting the oxidative stability of edible oils using 2,2-diphenyl-1- picrylhydrazyl (DPPH). Food Chem. 2007; 103:662-669


Berg RVD, Haenen GRMM, Berg HVD, Bast A. Applicability of an improved Trolox equivalent antioxidant capacity (TEAC) assay for evaluation of antioxidant capacity measurements of mixtures. Food Chem. 1999; 66:511-517.

Ko JY, Song SB, Lee JS, Kang Jr, Seo MC, Oh BG, Kwak DY, Nam MH, Jeong HS, Woo KS. Changes in chemical components of foxtail millet, proso millet, and sorghum with germination. J Korean Soc Food Sci Nutr. 2011; 40:1128-1135


Oh YN, Jin SJ, Park HJ, Kwon HJ, Kim BW. Anti-oxidative and anti-cancer activities by cell cycle egulation of Salsola collina extract. Korean J Microbiol Biotechnol. 2014; 42:73-81


Khandrika L, Kumar B, Koul S, Maroni P, Koul HK. Role of oxidative stress in prostate cancer. Cancer Lett. 2009; 282:125-136.

Liu C, Zhu Y, Lou W, Nadiminty N, Chen X, Zhou Q, Shi XB, White RW, Gao AC. Functional p53 determines Docetaxel sensitivity in prostate cancer cells. The Prostate. 2013; 73:418-427


Wyllie AH, Kerr JFR, Currie AR. Cell death the significance of apoptosis. Int Rev Cytol. 1980; 68:251-306.

Fulda S, Debatin KM. Extrinsic versus intrinsic apoptosis pathways in anticancer chemotherapy. Oncogene. 2006; 25:4798-4811


Suganyadevi P, Saravanakumar KM, Mohandas S. The antiproliferative activity of 3-deoxyanthocyanins extracted from red sorghum (Sorghum bicolor ) bran through p
53-dependent and Bcl-2 gene expression in breast cancer cell line. Life Sci. 2013; 92:379-382


Park JH, Darvin P, Lim EJ, Joung YH, Hong DY, Park EU, Park SH, Choi SK, Moon ES, Cho BW, Park KD, Lee HK, Kim MJ, Park DS, Chung IM, Yang YM. Hwanggeumchal sorghum induces cell cycle arrest, and suppresses tumor growth and metastasis through Jak2/STAT pathways in breast cancer xenografts. PloS One. 2012; 7:e40531


Azuma K, Nakayama M, Koshioka M, Ippoushi K, Yamaguchi Y, Kohata K, Yamauchi Y, Ito H, Higashio H. Phenolic antioxidants from the leaves of Corchorus olitorius L. J Agric Food Chem. 1999; 47:3963-3966.

Senter SD, Horvat RJ, Forbus WR. Comparative GLC-MS analysis of phenolic acids of selected tree nuts. J Food Sci. 1983; 48:798-799