ARTICLE
RAW264.7 대식세포에서 Citrus platymamma의 iNOS, COX-2, 염증성 사이토카인 발현 억제 효과
김상숙*, 박경진, 안현주, 최영훈
Citrus platymamma inhibits the expression of pro-inflammatory cytokines, inducible nitric oxide synthase, and cyclooxygenase-2 in RAW264.7 macrophage
Sang Suk Kim*, Kyung Jin Park, Hyun Joo An, Young Hun Choi
Citrus Research Institute, National Institute of Horticultural and Herbal Science, RDA, Jeju 63607, Korea
© The Korean Society of Food Preservation. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Oct 27, 2016; Revised: Nov 28, 2016; Accepted: Nov 28, 2016
Abstract
Citrus platymamma hort. ex Tanaka is widely used in traditional Korean medicine because of its medicinal benefits including an anti-inflammatory effect. This study aimed to evaluate changes in the flavonoid content and anti-inflammatory activities of C. platymamma during its harvest period. Fruit peel samples were obtained between September 2015 and February 2016. The results indicate that C. platymamma peel extract (CPE) was an effective inhibitor of lipopolysaccharide (LPS)-induced NO production in RAW264.7 cells. The inhibitory effects of CPE at 100 μg/mL concentration included dose-dependent decreases in the expression of iNOS and COX-2 proteins. In addition, CPE decreased the expression of pro-inflammatory cytokines TNF-α, IL-1β, and IL-6. The highest anti-inflammatory activity and flavonoid content were observed in CPE of C. platymamma peel harvested during the immature fruit period in September. Further, to assess the suitability of CPE for cosmetic use, we performed MTT assays using HaCaT keratinocytes and observed that CPE did not exhibit any cytotoxicity. To test the potential application of CPE as a cosmetic material, we also performed primary skin irritation tests on normal skin of 30 volunteers and no adverse reactions were observed. The results of this study indicate that CPE may be considered as an anti-inflammatory candidate for inclusion in cosmetic materials.
Keywords: Citrus platymamma; anti-inflammatory; cytokine; iNOS; COX-2
서 론
감귤류의 과피는 동양의학에서 기관지와 천식 환자에게 사용되어 왔으며 최근에는 감염성 질환이나 암 등을 예방한 다고 보고되고 있다. 비타민C, 엽산, 카로티노이드, 리모노 이드 등 다양한 기능성 성분을 함유하는 것으로 알려져 있는 감귤류에는 항산화, 항암, 항염증 등의 효과를 갖는 플라보노이드 60여종이 존재하는 것으로 알려져 있다(1). 플라보노이드는 자연계에 널리 분포하는 담황색 또는 노란 색계통의화합물로flavanones, flavones, flavonols, isoflavones, flavonols과 anthocyanidins으로 구분할 수 있다(2). 감귤에 포함되어 있는 플라보노이드는 narirutin, naringin, hesperidin 등의 배당체와 naringenin과 hesperetin 등의 비배당체 형태 로 존재한다. 이들 대부분 플라보노이드는 과피에 집중적 으로 존재하며, flavanones은 과피의 안쪽 흰색 부위인 알베 도층에 가장 많고, flavones은 과피의 황색부분인 플라베도 조직에 많이 분포한다(3). 특히 감귤류에는 채소나 과일에 서는 보고되지 않은 플라보노이드인 polymethoxylated flavones 중 nobiletin과 tangeretin이 포함되어 있으며, 혈소 판 응집 억제, 임파구 증식 억제, 항 궤양, 항염증 등의 생리 활성을 나타내는 것으로 보고되고 있다(4,5).
생체나 조직에 물리적인 작용이나 화학적 물질, 세균 감 염 등의 침습이 가해지면 국소적으로 histamine, serotonine, bradykinin, prostaglandins과 같은 혈관 활성 물질이 유리되 고 혈관투과성이 증대되며 유발된 염증은 phospholipase A2의 활성으로 인하여 arachidonic acid가 prostaglandin으로 바뀌는 과정 및 nitric oxide(NO) 형성 과정으로 이어지게 된다. 일반적인 NO의 형성은 박테리아를 죽이거나 종양을 제거시키는 중요한 역할을 하지만, 염증상태에서 iNOS 에 의해 과잉 생산된 NO는 혈관 투과성, 부종 등의 염증 반응 을 촉진 시킬 뿐만 아니라 염증 매개체의 생합성을 촉진하 여 염증을 심화시키는 것으로 알려져 있다(6,7). 이러한 만 성염증 질환과 퇴행성 뇌질환 같은 염증 질환을 치료를 위해 염증 매개인자들의 발현을 조절하여 염증 질환의 예방 및 치료제로 쓰일 수 있는 천연물 소재 개발 연구가 활발히 이루어지고 있다(8,9).
병 모양을 닮은 병귤(Citrus platymamma)은 비교적 당도 가 높고, 내한성과 병충해에 특히 강한 것으로 알려져 있다. 각피성 감귤로 순수한 제주 재래종으로 추정되며, 제주재 래 감귤중 향기가 뛰어나고 예로부터 한방요법에 사용될 정도로 기능성 물질을 다량 함유하는 것으로 알려져 있어 (10) 본 연구에서는 시기별 병귤 추출물의 유효물질들이 이러한 염증반응을 효과적으로 억제시키는지 검토하고자 lipopolysaccharide(LPS)를 처리하여 RAW264.7 macrophage 세포에 염증을 일으키고 병귤 추출물을 처리하여 세포가 방출하는 NO 생성량과 iNOS 및 COX-2 단백의 발현과 염증성 사이토카인인 tumor necrosis factor-α(TNF-α)와 interleukin-6(IL-6)의 변화를 통해 항 염증성 활성을 알아보 고자 하였다.
재료 및 방법
실험재료
본 실험에 사용된Citrus Platymamma(병귤)는 국립원예 특작과학원 감귤연구소에서 2014년 9월부터 2015년 2월 시료를 채집하여 실험을 수행하였다. 채집된 식물의 시료 는 건조 후 분쇄하여 70% 메탄올로 3회 반복 추출, 농축하 여 본 실험에 사용하였다.
총 폴리페놀 함량 측정
총 폴리페놀 함량 측정은 Folin-Denis(11)법을 이용하여 비색 정량하였다. 추출물 100 μL에 증류수 900 μL를 넣어 total volume이 1 mL가 되도록 희석하였다. 여기에 Folin- Ciocalteu's phenol reagent 100 μL를 첨가하여 실온에서 약 3분간 반응시키고, Na2CO3 용액(7%, w/v) 200 μL를 가하여 혼합한 후 증류수 700 μL를 넣어 실온에서 1시간 반응시켰 다. 흡광도는 SpectraMaxⓇ M3 Multi-Mode Microplate Reader(Molecular Devices, Sunnyvale, CA, USA)를 이용하 여 720 nm에서 측정하였고, 총 폴리페놀 함량은 gallic acid 를 표준물질로 작성한 표준검정곡선을 이용하여 추출물의 총 폴리페놀 함량을 나타내었다.
DPPH radical scavenging 활성 측정
DPPH(1,1-diphenyl-2-picryhydrazyl) radical scavenging 활성 실험은 Blois 방법(12)을 변형하여 다음과 같이 측정하 였다. 준비된 0.2 mM DPPH와 시료를 섞고 실온에서 10분 간 방치한 후 517 nm에서 흡광도를 측정하였다. 각 시료는 3회 반복실험을 실시하여 평균값을 구하였고, ascorbic acid 를 대조구로 사용하였다.
-
A : DPPH 흡광도
-
B : DPPH와 시료 반응액의 흡광도
-
C : 시료자체의 흡광도
ABTS radical scavenging 활성 측정
ABTS[2,2'-azinobis(3-ethylbenzothiazoline-6-sulfonic acid)-diammonium salt] radical scavenging 활성은 Re 등의 방법(13)에 따라 측정하였다. 7.4 mM ABTS와 2.6 mM potassium persulfate를 혼합 후 실온 암소에서 15시간 동안 방치하여 radical을 형성시킨 후 사용하였다. 미리 준비한 ABTS 용액 180 μL에 추출물 20 μL를 농도별로 처리하여 실온에서 15분 동안 방치한 다음 734 nm에서 흡광도를 측정하였다. 각 시료는 3회 반복하여 실시하였고, 대조구로 는 ascorbic acid를 사용하였다.
-
A : ABTS 흡광도
-
B : ABTS와 시료 반응액의 흡광도
-
C : 시료자체의 흡광도
FRAP법에 의한 항산화 활성 측정
FRAP(ferric reducing antioxidant power)법에 의한 항산화 활성은 Benzie와 Strain(14)의 방법에 따라 실시하였다. 300 mM acetate buffer(pH 3.6), 10 mM TPTZ(2,4,6-tripyridyl -s-triazine)가 용해된 40 mM HCl 용액과 20 mM FeCl3·6H2O 를 각각 10:1:1(v/v/v)의 비율로 혼합하여 FRAP 기질액으로 사용하였다. 96 well plate에 다양한 농도의 시료 40 μL, FRAP 기질액 100 μL와 증류수 200 μL를 차례로 혼합하여 37℃에서 4분간 반응시킨 후 593 nm에서 흡광도를 측정하 였다. 각 시료는 3회 반복하여 실시하였고, FeSO4·7H2O를 표준물질로 하여 얻은 표준검정곡선을 이용하여 분석하 였다.
세포배양
본 실험에 사용된 RAW264.7 murine macrophage cell은 Korean Cell Line Bank(KCLB, Seoul, Korea)로부터 분양받 아 배양하여 사용하였다. 세포 배양은 37℃, 5% CO2 항온기 에서 1% penicillin/streptomycin과 10% fetal bovine serum (FBS)이 함유하는 Dulbecco’s modified Eagle’s minimal essential medium(DMEM, Gifco BRL, Grand Island, NJ, USA) 배지를 사용하여 배양하였으며, 3일에 한번씩 계대하 여 본 실험에 사용하였다.
Nitric oxide(NO) 측정
항염활성 측정 중 RAW264.7 세포에서의 NO 생성을 확 인하기 위해 24 well plate에 1.5×105 cells/mL으로 분주 후 18시간 배양하여 세포를 준비하였다. 준비된 세포에 1 μ g/mL의 lipopolysaccharide(LPS)와 농도별로 준비된 시료를 처리하여 24시간 배양 후 세포 배양 상등액을 이용하여 NO의 생성을 확인하였다. NO의 생성은 Griess reagent를 사용하여 흡광도 540 nm에서 측정하였다.
Pro-inflammatory cytokine 억제 활성 측정
RAW264.6 세포를 24 well plate에 1.5×105 cells/mL으로 분주하여 24시간 배양 후 LPS를 1 μg/mL로 처리하여 cytokine의 생성을 자극하였다. cytokine 생성이 자극된 세 포에 농동별로 시료를 처리하여 24시간 배양 후 상등액을 이용하여 cytokine의 억제 활성을 측정하였다. Mouse TNF- α(Invitrogen Co., Carlsbad, CA, USA), IL-1β(R&D System Inc., Minneapolis, MN, USA), IL-6(Invitrogen Co.) ELISA kit를 사용하여 측정하였다.
Western blotting
배양이 끝난 세포를 수집하여 2~3회 PBS(phosphate buffered saline)로 세척한 후 1 mL의 lysis buffer를 첨가하여 30분간 용해(lysis)시킨 후 12,000 rpm에서 20분간 원심 분 리하여 세포막 성분 등을 제거하였다. 단백질 농도는 BSA(bovine serum albumin)를 표준화하여 Bio-Rad Protein Assay Kit를 사용하여 정량하여 20~30 μg의 lysate를 8~12% mini gel SDS-PAGE로 변성 분리하여, 이를 PVDF (polyvinylidene difluoride) membrane(BIO-RAD, Richmond, CA, USA)에 200 mA로 2시간 동안 transfer 하였다. 그리고 membrane의 blocking은 5% skim milk가 함유된 TTBS(0.1% Tween 20+TBS) 용액에서 상온에서 2시간 동안 실시하였 다. iNOS의 발현 양을 검토하기 위한 항체로는 anti-mouse iNOS(1:1,000)(Calbiochem, La Jolla, CA, USA)를 사용하였 고, COX-2의 발현양을 검토하기 위한 항체로는 anti-mouse COX-2(1:1,000)(BD Biosciences Pharmingen, San Jose, CA, USA)을 TTBS 용액에서 희석하여 상온에서 2시간 반응시 킨 후 TTBS로 3회 세정하였다. 2차 항체로는 HRP(horse radish peroxidase)가 결합된 anti-mouse IgG(Amersham Pharmacia Biotech, Little Chalfont, UK)를 1:5000으로 희석 하여 상온에서 30분 간 반응시킨 후, TTBS로 3회 세정하여 ECL 기질(Amersham Biosciences, Piscataway, NJ, USA)과 1~3분 간 반응 후 Chemidoc(Fusion solo, VILBER LOURMAT, Detschland, Germany)을 이용하여 단백질 발현정도를 확인 하였다.
세포독성 평가
세포독성 평가에는 RAW264.7 세포를 24 well plate에 1.5×105 cells/mL으로분주하여24시간배양후LPS를 1 μg/mL 와 시료를 처리하여 다시 24시간 배양 후 세포 독성을 측정 하였다. 24시간 배양된 세포에 WST-1 reagent(Roche Applied Science, Mannheim, Germany)를 10%(v/v)로 첨가 하여 4시간 추가 배양한 후 440 nm에서 흡광도를 측정하였 다.
통계분석
모든 실험은 3회 이상 반복하여 이루어졌으며, 실험 결과 는 각 항목에 따라 평균과 표준편차로 나타내었다. 실험군 과의 차이는 SAS package(Statistical Analysis Program, version 9.1)을 사용하여 Duncan’s mutiple range test로 평균 을 비교하여 나타내었고, p<0.05 수준에서 통계적 유의성을 검정하였다.
결과 및 고찰
시기별 병귤 추출물(CPE)의 총 폴리페놀 함량과 항산화 활성
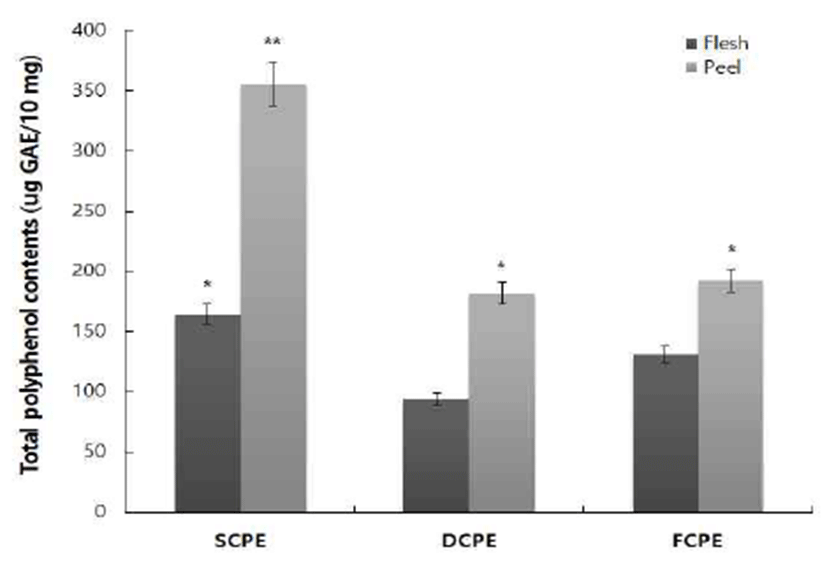
식물계에 널리 분포되어 있는 페놀계 화합물은 다양한 구조와 분자량의 페놀성 화합물의 phenolic hydroxyl기를 통해 항산화, 항암 및 항염 등의 생리활성 기능을 갖는 것으 로 알려져 있으며 폴리페놀 함량이 높을수록 전자공여능이 높은 밀접한 관련이 있다고 알려져 있다(15,16). 시기별 총 폴리페놀 함량을 알아보기 위해 2014년 9월. 12월, 2015년 2월에 채집된 병귤은 과육과 괴피 부분을 분리하여 건조 후 70% 에탄올을 용매로 사용하여 수행하였다. 병귤의 시 기별 추출물인 9월(SCPE), 12월(DCPE), 2월(FCPE) 추출물 에 함유되어 있는 총 폴리페놀 함량 측정을 위해 gallic acid 를 표준물질로 사용하였으며, 그 결과는 Fig. 1에 나타내었 다. CPE의 총 페놀 함량은 시기적으로는 9월, 부위로는 과피에 3.56 g/100 g으로 함량이 가장 높게 나타났으며, SCPE>DCPE>FCPE 순으로 완숙될수록 총 폴리페놀 함량 이 낮아지는 것을 확인할 수 있었다.
Fig. 1.
Total polyphenol contents in the flesh and peel of SCPE, DCPE, and FCPE.
The data represent the mean±SD of triplicate experiments. *p<0.05, **p<0.01.
Download Original Figure
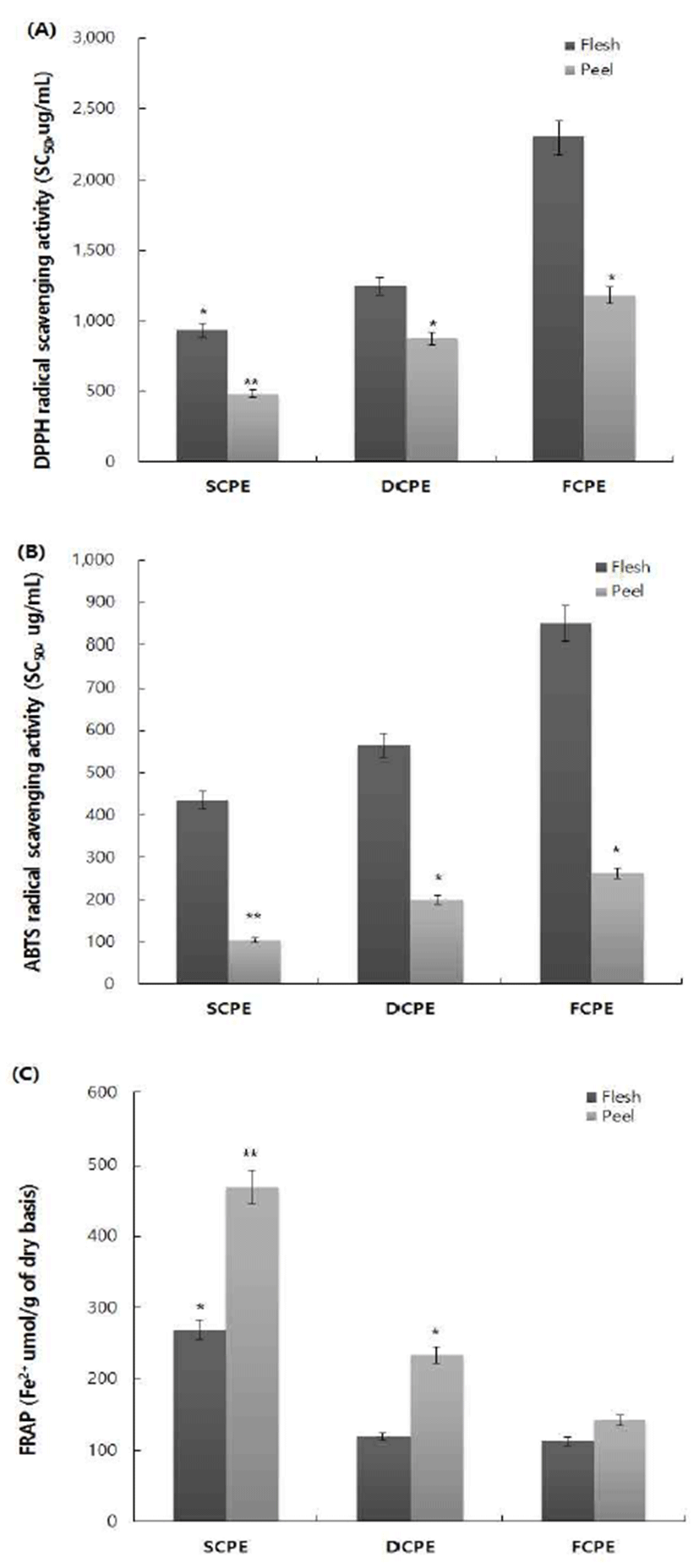
총 폴리페놀 함량과 항산화 활성의 관계를 알아보기 위 해 단순하면서도 간편하게 시료의 전자 공여에 의한 free radical 소거활성을 측정할 수 있는 방법인 DPPH, ABTS free radical 소거활성과 산화 및 환원 반응에 의한 메카니즘 으로 항산화 활성을 측정하게 되는 FRAP를 측정하였다 (Fig. 2). DPPH와 ABTS free radical 소거활성을 측정한 결과 활성이 SCPE에서 가장 높은 항산화 활성을 보였으며 SC50 이 0.48과 0.11 mg/mL로 나타났다. 이는 총 폴리페놀 함량 과 유사하게 시기적으로는 9월과 부위로는 과피에서 가장 활성이 높았고, 산화 환원력을 볼 수 있는 FRAP 측정 결과 역시 SCPE의 과피 추출물에서 469.5 μmol/g의 환원력을 보였다. 환원력은 체내에 생성된 과산화지질 및 활성 산소 를 제거하여 성인병을 예방하는 효과가 있어 환원반응을 통한 체내 향상성을 유지하는 활성이 높을수록 그 이용가치 가 크며, 병귤의 9월 과피 추출물인 SCPE에서 가장 높은 활성을 보여 총 폴리페놀 함량이 높을수록 항산화 활성이 증가하는 비례적 상관관계를 볼 수 있었다.
Fig. 2.
DPPH (A) and ABTS (B) radical scaveging activitie of SCPE, DCPE, and FCPE. Results were expressed the radical scavenging activities as inhibition percent. Reducing power (C) of SCPE, DCPE, and FCPE.
The data represent the mean±SD of triplicate experiments. *p<0.05, **p<0.01, versus control.
Download Original Figure
NO와 염증성 cytokine 생성 억제
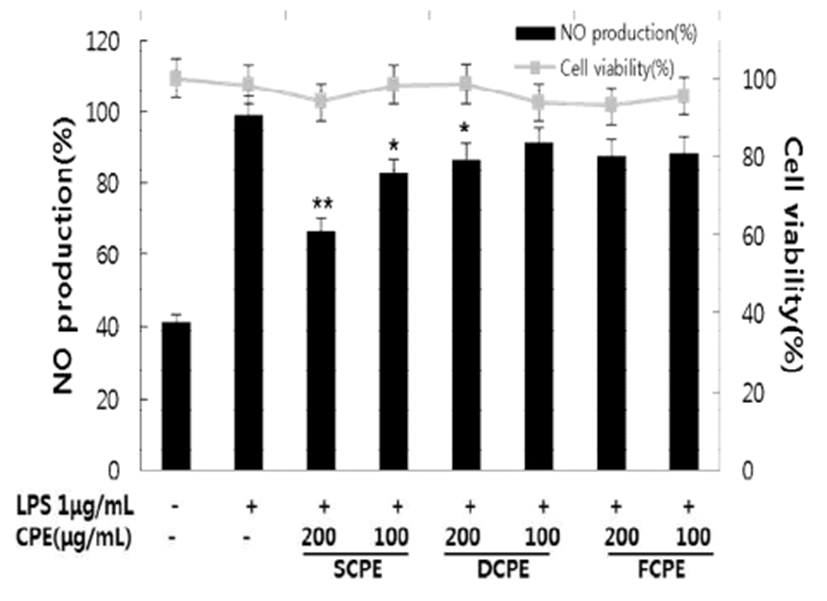
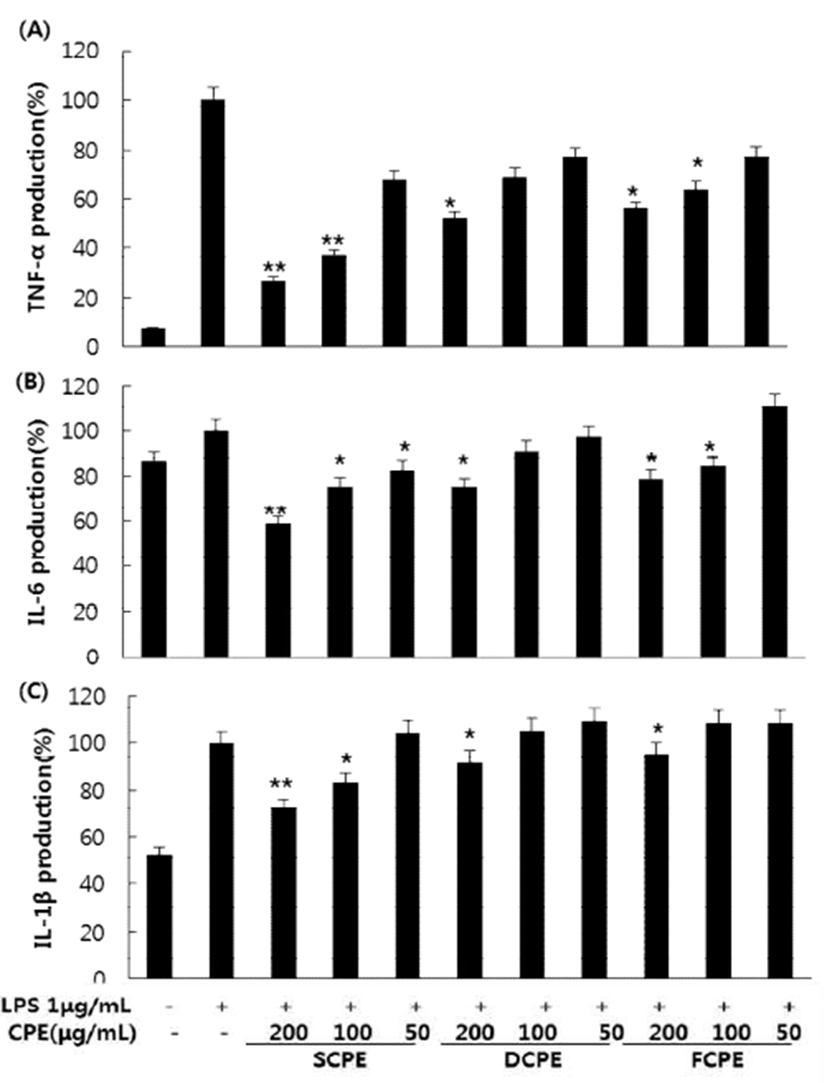
과도하게 생성되는 Nitric oxide(NO)는 염증을 유발시키 는 매개체가 되는 인자로 마우스 대식세포인 RAW264.7 세포에 LPS로 염증 유발 시 생성량이 급격히 증가한다. LPS로 염증이 유발된 RAW264.6 세포에 시기별 병귤 과피 추출물인 SCPE, DCPE, FCPE를 100과 200 μg/mL로 처리하 였을 때 세포독성 없이 농도 의존적으로 NO의 생성이 억제되는 것을 확인할 수 있었고, 항산화 활성과 같이 SCPE 시료에서 약 40%로 NO의 생성을 억제하는 활성이 가장 높았다(Fig. 3). 또한 대식세포는 LPS로 자극시키면 다양한 염증인자들이 증가되는데 그 중 림프구나 대식세포 등에서 생성되는 미량의 생리활성 물질로 염증 반응에 관여하는 것으로 알려진 염증성 cytokine인 TNF-α, IL-6, IL-1β의 생 성 억제 활성을 측정하였다(Fig. 4). 시료가 처리된 RAW 264.7 cell에서는 농도 의존적으로 TNF-α, IL-6, IL-1β 생성 억제 활성을 보였고, 특히 SCPE를 50, 100, 200 μg/mL로 처리하였을 때 TNF-α의 생성이 30, 60, 75% 이상 억제하는 효과를 보였다. 림프구를 활성화로 항체 생산을 증가시켜 염증성 병변에서 증가되는 것으로 알려진 IL-6 생성억제 효과를 확인하기 위해 CPE 처리시 농도 의존적으로 IL-6의 생성을 억제하였고 SCPE를 200 μg/mL로 처리시 40% 정도 의 억제 활성을 보였다. TNF-α, IL-6와 함께 여러 면역학적 작용들과 연관되어 있는 IL-1β 역시 SCPE 200 μg/mL 처리 시 20% 정도의 억제 활성을 보여 CPE 중 미숙과 시기인 9월의 과피 추출물 SCPE에서 항염 활성이 가장 우수한 것을 확인 할 수 있었다.
Fig. 3.
Inhibitory effects of SCPE, DCPS, and FCPE of nitric oxide (NO) in LPS-stimulated RAW264.7 mur ine macrophage cell.
RAW264.7 cells were treated with extracts and LPS (1 μg/mL) for 24 hr. NO production was determined by Griess reagent. LPS (-), PBS without LPS; LPS (+), PBS with LPS. The data represent the mean±SD of triplicate experiments. *p<0.05, **p<0.01, versus LPS alone.
Download Original Figure
Fig. 4.
Inhibitory effects of SCPE, DCPE, and FCPE on the production of TNF-α (A), IL-6 (B), and IL-1β (C) in LPS-stimulated RAW264.7 mur ine macrophage cell.
RAW264.7 cells were treated with extracts and LPS (1 μg/mL) for 24 hr. The concentrations of TNF-α , IL-6, and IL-1β were measured by ELISA. LPS(-), PBS without LPS; LPS (+), PBS with LPS. The data represent the mean±SD of triplicate experiments. *p<0.05, **p<0.01, versus LPS alone.
Download Original Figure
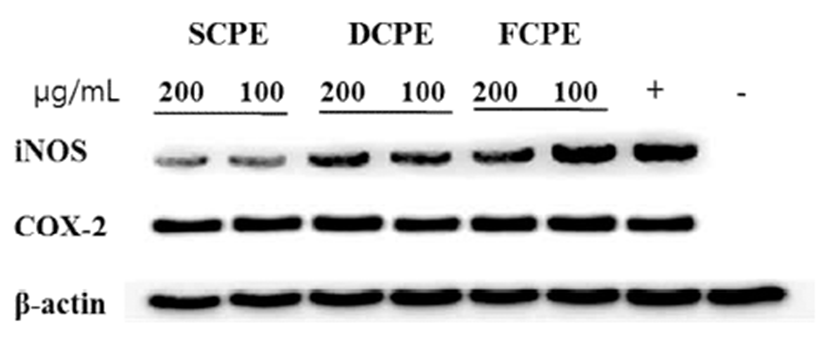
iNOS 및 COX-2 단백질 발현 억제
LPS로 염증이 유발된 RAW264.7 cell에서 염증 유발에 관여하는 단백질인 iNOS와 COX-2의 발현에 미치는 효과 를 Western blotting을 통하여 확인하였다. 시기별 병귤 추출 물 처리군에서는 iNOS 단백질의 발현은 현저히 억제하였 으나 COX-2 단백질의 발현에는 별다른 영향을 미치지 않 는 것으로 보였다. iNOS는 NO의 과잉생산에 관여하여 혈 관 투과성, 부종 등의 염증반응을 촉진 시키고, 염증 매개체 의 생합성을 촉진하여 염증을 심화시키는 것으로 알려져 있다. iNOS 단백질의 발현을 SCPE의 경우 200 μg/mL로 처리하였을 때 세포 독성 없이 80% 이상 억제하였고 시기 적으로 12월 2월로 갈수록 그 활성이 낮아짐을 확인 할 수 있었다(Fig. 5). 그러나 염증반응에서 PGE(prostaglandin) 2의 생성에 관여하는 것으로 알려진 COX-2의 단백질 발현 억제에는 영향을 미치지 못하는 것으로 보인다. 이는 COX-2에 의한 PGE2의 합성 저해 효과 보다는 iNOS의 발현 을 억제하여 염증반응과 관련된 NO의 생성 억제 효과를 나타내는 것으로 여겨진다. 이러한 항염 활성의 차이를 추 출물이 함유하고 있는 성분의 분석으로 알아보고자 HPLC 를 이용하여 병귤 추출물인 SCPE, DCPE, FCPE의 플라보 노이드 성분을 분석하고자 하였다.
Fig. 5.
Inhibitory effects of SCPE, DCPE, and FCPE on the expression of inducible nitr ic oxide synthases (iNOS) and COX-2 in LPS-stimulated RAW264.7 murine macrophage cell line.
RAW264.7 cells were treated with extracts and LPS (1 μg/mL) for 24 hr. Total protein were resolved by SDS-PAGE and protein expressions were determined by Western blot analysis. LPS (-), PBS without LPS; LPS (+), PBS with LPS.
Download Original Figure
CPE의 플라보노이드 성분 분석
CPE의 항염 활성을 측정한 결과 9월 과피 추출물(SCPE) 에서 가장 높았으며 이는 병귤에 함유되어 있는 플라보노이 드 성분에 의한 것으로 여겨진다. CPE의 플라보노이드 성 분 분석은 rutin, narirutin, naringin, hesperidin, neohesperidin, NHDC, quercetin, apignin, naringenin, hesperetin, nobilrtin, tangeretin의 함유량을 분석하였다. 그 결과 모세혈관을 튼 튼하게 하고 출혈을 예방하며, 혈압 조절작용을 하는 것으 로 알려진 rutin(17)이 추출물 100 g 당 4.52 g으로 함량이 가장 높았으며, rutin>hesperidin>narirutin>nobiletin>tangeretin 순으로 함유량이 높은 것을 확인 할 수 있었다(Table 1). 특히 감귤류에 다량 함유되어 있는 polymethoxyflavonoid로 항바이러스, 항암, 항염 등의 활성과, reactive oxygen species(ROS) 또는 염증반응으로부터 피부를 보호하는 역 할을 하는 것으로 알려져 있는 nobiletin(18-21)과 항암 활성 이 있는 것으로 알려진 tangeretin(22,23)의 함량이 SCPE에 서 각각 1.52와 0.76 g%로 높았다. 그러나 일반적으로 과실 이 성숙할 수 록 당도는 높아지고 플라보노이드 함량은 감소하는 것으로 알려져 있는데 특히 polymetoxyflavonoid 인 nobiletin과 tangeretin의 함량이 줄어드는 것을 확인 할 수 있었고(24) 이는 CPE의 항염 활성에도 영향을 미친것으 로 여겨진다. 또한 quercetin, naringenin, hesperetin 등의 비 배당체 플라바논이 다량 함유되어 있어 항산화 활성 역시 높은 것으로 보인다.
Table 1.
Changes of flavonoid contents in the peel of SCPE, DCPE, and FCPE dur ing maturation (unit: g%)
|
|
SCPE |
DCPE |
FCPE |
|
Rutin |
4.52±0.231) |
2.17±0.12 |
1.38±0.07 |
|
Narirutin |
1.65±0.084 |
0.59±0.04 |
0.49±0.03 |
|
Naringin |
0.16±0.065 |
0.047±0.002 |
0.034±0.0014 |
|
Hesperidin |
3.08±0.16 |
1.64±0.41 |
1.51±0.08 |
|
Neohesperidin |
0.56±0.03 |
0.34±0.014 |
0.17±0.01 |
|
NHDC |
0.53±0.02 |
0.038±0.001 |
0.11±0.0043 |
|
Quercetin |
0.17±0.01 |
0.082±0.005 |
0.055±0.003 |
|
Apigenin |
0.11±0.005 |
0.032±0.001 |
0.04±0.002 |
|
Naringenin |
0.047±0.002 |
0.0138±0.007 |
1.037±0.06 |
|
Hesperetin |
0.023±0.001 |
-2) |
- |
|
Nobiletin |
1.52±0.08 |
0.37±0.017 |
0.29±0.01 |
|
Tageretin |
0.76±0.03 |
0.21±0.013 |
0.16±0.004 |
Download Excel Table
따라서 감귤류에만 함유되어 있는 nobiletin과 tangeretin 의 함량이 높은 CPE는 항산화 및 항염 활성이 우수하였으 며, SCPE에서 가장 우수한 활성을 보였다. 이는 병귤을 이용한 항산화 및 항염 활성의 기능성 소재로 개발할 시 9월의 과피를 소재로 활용하면 우수한 천연소재로의 활용 이 가능할 것으로 여겨진다.
요 약
시기별 병귤 추출물의 항산화 활성은 시기적으로 미숙과 시기인 9월에 가장 높았으며, 이 시기에 총 폴리페놀 함량이 가장 높았다. 특히 rutin, hesperidin, nobiletin의 함량이 높았 으며, 이는 항염 활성에 영향을 미치는 것으로 여겨진다. 항염 활성에서는 NO의 생성을 억제하였으며 염증성 cytokine인 TNF-α의 생성 억제 활성이 가장 높았다. 또한 NO 생성을 억제하는 단백질로 알려진 iNOS 단백질의 발현 역시 억제하는 것을 확인 할 수 있었다. 항염 활성에 영향을 미칠 것으로 여겨지는 nobiletin 함량의 경우 12월에 70% 이상 감소하는 것을 확인할 수 있었다. 이러한 시기별 플라 보노이드 함량 분석결과는 병귤을 천연 소재로 활용하기 위한 수확시기를 확립할 수 있을 것으로 여겨진다.
감사의 글
본 성과물은 농촌진흥청 연구사업(세부과제: PJ01025101) 의 지원에 의해 이루어진 것입니다.
References
Horowitz RM, Gentili B. In: Nagy S, Shaw SPE, Veldhuis MK, editors. Flavonoid constituents of citrus. Citrus Science and Technology. 1977; AVI Publishing Co., Inc. Westport, CT, USA: p. 397-426.

Gattuso G, Barreca D, Gargiulli C, Leuzzi U, Caristi C. Flavonoid composition of citrus juices. Molecules. 2007; 12:1641-1673


Nogata Y, Sakamoto K, Shiratsuchi H, Ishii T, Yano M, Ohta H. Flavonoid composition of fruit tissues of citrus species. Biosci Biotechnol Biochem. 2006; 70:178-192


Lee SG, Ra JH, Song JY, Gwak CH, Kwon HJ, Yim SV, Hong SP, Kim JJ, Lee KH, Cho JJ, Park YS, Park CS, Ahn HJ. Extracts from Citrus unshiu promote immune-mediated inhibition of tumor growth in a murine renal cell carcinoma model. J Ethnopharmacol. 2011; 133:973-979


Li S, Pan MH, Lo CY, Tan D, Wang Y, Shahidi F, Ho CT. Chemistry and health effects of polymethoxyflavones and hydroxylated polymethoxyflavones. J Funct Foods. 2009; 1:2-12


Shih MF, Cheng YD, Shen CR, Cherng JY. A molecular pharmacology study into the anti-inflammatory actions of Euphorbia hirta L on the LPS-induced RAW 2647 cells through selective iNOS protein inhibition. J Nat Med. 2010; 64:330-335


Tsatsanis C, Androulidaki A, Venihaki M, Margioris AN. Signalling networks regulating cyclooxygenase-2. Int J Biochem Cell Biol. 2006; 38:1654-1661


Kim MJ, Kim SS, Park KJ, An HJ, Choi YH, Lee NH, Hyun CG. Methyl jasmonate inhibits lipopolysaccharide-induced inflammatory cytokine production via mitogen-activated protein kinase and nuclear factor-?B pathways in RAW2647 cells. Pharmazie. 2016; 71:540-543.

Ham YM, Yoon WJ, Lee WJ, Kim SC, Baik JS, Kim JH, Lee GS, Lee NH, Hyun CG. Anti-inflammatory effects of isoketocharbroic acid from brown alga, Sargassum micracanthum. EXCLI J. 2015; 14:1116-1121.

Koh JS. Citrus Industry. 2001; Jeju Munhwasa. Jeju, Korea: p. 163-172.

Singleton VL, Orthofer R, Lamuela-Raventos RM. Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteu reagent. Methods Enzymol. 1999; 299:152-178.

Blois MS. Antioxidant determination by use of a stable free radical. Nature. 1958; 181:1199-1200.

Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic Biol Med. 1999; 26:1231-1237


Benzie IFF, Strain JJ. The ferric reducing ability of plasma (FRAP) as a measure of "antioxidant power": The FRAP assay. Anal Biochem. 1996; 239:70-76


Harborne JB, Williams CA. Advances in flavonoid research since 1992. Phytochemistry. 2000; 55:481-504


Hertog MGL, Feskens EJM, Hollman PC, Katan MB, Kromhout D. Dietary antioxidant flavonoids and risk of coronary heart disease the Zutphen Eiderly Study. The Lancet. 1993; 342:1007-1011


Chae WP, Xing ZC, Kim YJ, Sang HS, Huh MW, Kang IK. Fabrication and biocompatibility of rutincontaining PHBV nanofibrous scaffolds. Polymer (Korea). 2011; 35:210-215


Guo S, Qiu P, Xu G, Wu X, Dong P, Yang G, Zheng J, McClements DJ, Xiao H. Synergistic anti-inflammatory effects of nobiletin and sulforaphane in lipopolysaccharide-stimulated RAW 2647 cells. J Agric Food Chem. 2012; 60:2157-2164


Suzuki M, Sasaki K, Yoshizaki F, Fujisawa M, Oguchi K, Cyong JC. Anti-hepatitis C virus effect of Citrus unshiu peel and its active ingredient nobiletin. Am J Chin Med. 2005; 33:87-94


Yoshimizu N, Otani Y, Saikawa Y, Kubota T, Yoshida M, Furukawa T, Kumai K, Kameyama K, Fujii M, Yano M, Sato T, Ito A, Kitajima M. Anti-tumour effects of nobiletin, a citrus flavonoid, on gastric cancer include antiproliferative effects, induction of apoptosis and cell cycle deregulation. Aliment Pharmacol Ther. 2004; 20:95-101


Morwood CJ, Lappas M. The citrus flavone nobiletin reduces pro-inflammatory and pro-labour mediators in fetal membranes and myometrium implications for preterm birth. PLoS One. 2014; 9:e108390


Walle T. Methoxylated flavones, a superior cancer chemopreventive flavonoid subclass?. Semin Cancer Biol. 2007; 17:354-362


Bracke ME, Vyncke BM, Van Larebeke NA, Bruyneel EA, De Bruyne GK, De Pestel GH, De Coster WJ, Espeel MF, Mareel MM. The flavonoid tangeretin inhibits invasion of MO4 mouse cells into embryonic chick heart in vitro. Clin Exp Metastasis. 1989; 7:283-300


Park YC, Yang YT, Kim JY, Lee CH, Kang SH, Kang JH. Characteristics of flavonoids in juice and cluster analysis of satsuma mandarin germplasms. Korean J Plant Res. 2015; 28:16-25