서 론
대추나무는 갈매나무과(Rhamnaceae)에 속하는 식물로 서 대추나무속에는 대추나무(Zizyphus jujuba var. inermis (Bunge) Rehder), 묏대추나무(Z. jujuba Mill.), 베르(ber, Z. mauritiana Lam.), 야생대추나무(Z. spina-christi L.) 등 약 40여종이 있으며 남서부 유럽, 인도, 중국, 한국 등 주로 온대, 아열대 지방에 분포되어있다(1-3). 대추나무에는 alkaloids, flavonoids, free amino acids, saponins, terpenoids 등을 함유하고 있는 것으로 알려져 있다(4-6). 대추나무와 묏대추나무 잎의 주요 성분은 quercetin 3-O-rutinoside(rutin) 과 quercetin 3-O-robinobioside로 알려져 있다(7,8). 또한 묏 대추나무 과실에서 (+)-catechin, (+)-afzelechin 등의 flavanol류를 함유하는 것으로 알려져 있다(9). 묏대추나무 의 잘 익은 씨인 산조인(Z. jujuba Mill. var. spinosa)은 불면 증, 불안, 최면 효과 등 약리학적 효과를 갖는 것으로 보고되 어 중국, 한국 등에서 한약재로 사용되어 왔다(10-12). 국내 에서는 대추를 첨가한 고추장, 식초, 머핀, 쿠키 등 다양한 형태의 가공식품으로 이용되고 있다(13-16). 산조인으로부 터 분리된 spinosin은 6-C-glycosylflavone의 형태로 최근 이슈로 대두되고 있는 알츠하이머 등 뇌의 기억력 장애를 개선하는 긍정적인 효과를 갖는 것으로 알려져 있다(17). 또한 vitexin, isovitexin 등 다른 형태의 8-C-glycosylflavone 은 항당뇨, 알츠하이머, 항염증에 대하여 잠재적으로 긍정 적인 효과를 갖는 것으로 알려져 있다(18). 대추나무 잎 추출물의 당뇨병에 효과(19), 열매에서 항산화 효과 등 다양 한 생리활성이 보고되어 있다(20). Flavonoid는 이를 구성하 는 기본 구조와 기본 구조에 결합되어 있는 당 위치와 종류 에 따라 다양한 생리 효과를 갖고 있어 활발히 연구되고 있다(21).
따라서 본 연구에서는 대추나무, 묏대추나무, 야생대추 나무 등 기존에 연구된 문헌 내 flavonoid 화합물 정보를 종합하여 라이브러리를 구축하고 이를 바탕으로 대추나무 의 잎과 열매에 함유되어 있는 flavonoid 배당체를 조사하여 기능성 식품 소재로서 활용하기 위한 가능성과 이를 위하여 필요한 기초자료를 제공하고자 하였다.
재료 및 방법
본 실험에 사용한 대추나무 잎과 열매는 경상남도 합천 군에서 재배된 것으로 잎 1점은 2015년 5월 중순 경에 수확 하였고, 열매는 신선열매(fresh fruits), 일광건조 열매 (sun-died fruits) 2점은 2015년 9월 하순경 수확한 것을 동결 건조한 후 곱게 분말하여 시료로 사용하였다.
대추나무 내 flavonoids는 Kim 등(22)을 참고하여 추출하 였다. 균질화한 시료 분말 1 g을 칭량하여 50 mL conical tube에 넣은 다음 내부표준물질(galangin, 20 ppm)을 포함한 추출용매(methanol: water: formic acid=50:45:5, v/v/v) 10 mL을 넣고 진동혼합(vortex) 한 후 5분간 shaking하였다. 이후 원심 분리(3,000 rpm, 10℃, 15 min)하여 얻어진 상층액 을 0.2 μm syringe filter(25 mm, Whatman International, Maidstone, Kent, UK)로 여과한 후 여과액 0.5 mL에 water 4.5 mL을 넣어 희석하였다. Methanol 2 mL, water 2 mL 순으로 흘려주어 활성화시킨 Sep-pak C18 classic cartridge (Waters, Milford, MA, USA)에 희석한 여과액 5 mL을 로딩 하였다. 불순물을 제거하기 위하여 water 2 mL로 washing 한 다음, methanol 3 mL로 용출하였다. 용출된 flavonoids 타깃 여과액은 N2 가스로 완전히 농축한 다음 추출용매 0.5 mL로 재용해하여 0.2 μm syringe filter(13 mm, Whatman)로 여과한 후 vial에 담아 UPLC-DAD-QTOF/MS (ultra-performance liquid chromatography-diode array detectorquadrupole time of flight mass spectrometry)로 분석하였다.
Table 1에 표기된 선행 연구의 인용문헌을 바탕으로 대추 나무, 묏대추나무, 야생대추나무 내 flavonoid의 화학적 정 보 탐색, 수집 및 정리를 통해 기본정보를 확보하였다. 개별 성분명, 분자량, 단편 이온 패턴, 함유 자원, 관련 인용문헌 등의 정보를 포함하였다. 구축된 flavonoid 라이브러리 및 분석기기(UPLC-DAD-QTOF/MS)를 이용하여 신속 구조 동정을 하였다.
Flavonoid 개별 성분분석은 Waters ACQUITY UPLCTM system(Waters, Milford, MA, USA)와 Xevo G2-S QTOFESI/ MS(Waters MS Technologies, Manchester, UK)를 이용 하여 대추나무 내 flavonoid를 분리 및 동정하였다. 분석 컬럼은Kinetex 1.7 μ XB-C18 100A(2.1×150 mm, Phenomenex, Torrance, CA, USA)이었으며, 컬럼 오븐온도는 30℃, 시료 주입량은 5 μL, 검출파장은 200~400 nm(대표파장: flavonol, 350 nm; chalcone, 280 nm)로 설정하였다. 이동상으로는 용매 A(water:formic acid=99.5:0.5, v/v)와 용매 B(acetonitrile :formic acid=99.5:0.5, v/v)를 사용하였으며, 유량은 0.3 mL/min로 하였다. 용매 구배조건은 B를 5%로 시작하여 3분 동안 유지시켰고, 10분까지 20%, 25분까지 40%, 29분 까지 90%로 증가시킨 다음 31분까지 2분 동안 유지하다 36분까지 5%로 감소시키고 40분까지 4분 동안 유지하였다. Flavonoid 개별 성분의 함량은 내부표준물질(galangin)의 면적과 각 성분의 면적을 1:1로 비교하여 상대적으로 정량 (mg/100 g dry weight(DW))하였다. 질량분석기를 이용한 flavonoid 정성분석은 positive ion mode로 분석하였다. Capillary 전압은 3,500 V, sampling cone 전압은 40 V, extraction cone 전압은 4.0 V로 설정하였다. Ion source 온도 는 120℃, desolvation 온도는 500℃로 설정하였고, desolvation 가스는 1,050 L/hr, cone 가스는 50 L/hr로 설정하였으며, 스캔 범위는 m/z 200~1,200로 설정하였다. Flavonoid 개별 성분은 기존에 보고된 대추나무 flavonoid 배당체에 관련 문헌을 참고하여 각 성분의 이온화 패턴분석 결과와 비교하 여 동정하였다.
결과 및 고찰
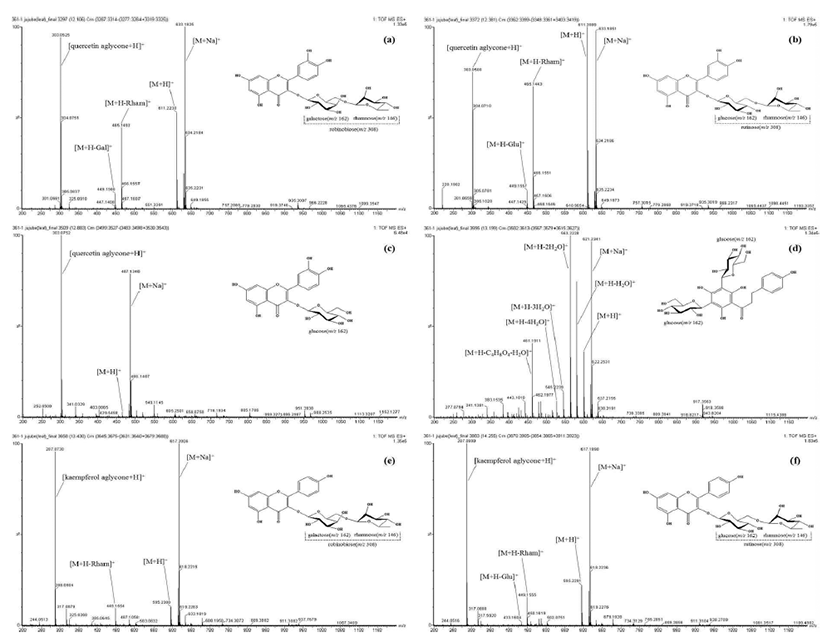
본 연구에서는 대추나무뿐만 아니라 묏대추나무, 야생대 추나무 등 대추나무속 내 flavonoid에 대한 선행 연구결과로 부터 각 화합물의 정보(성분명, 분자량, 단편 이온 패턴, 함유 자원, 관련 인용문헌)를 종합하여 라이브러리를 구축 하여 이를 바탕으로 대추나무뿐만 아니라 대추나무속에 함유되어 있는 flavonoid 배당체의 신속한 동정을 가능하게 하였다(Table 1). 국내산 대추나무의 잎과 열매로부터 flavonol 5종(peak 1, quercetin 3-O-robinobioside; peak 2, quercetin 3-O-rutinoside(rutin); peak 3, quercetin 3-O-glucoside (isoquercitrin); peak 5, kaempferol 3-O-robinobioside, peak 6, kaempferol 3-O-rutinoside(nicotiflorin)과 chalcone 1종 (peak 4, phloretin 3',5'-di-C-glucoside)의 flavonoid 개별성 분을 분리하였다(Fig. 1). 각 성분은 내부표준물질(galangin) 의 피크 면적과 비교하여 relative response factor를 고려하 지 않고 정량하였다. 각 개별 성분은 UPLC-DAD-QTOFESI/ MS를 사용하여 positive ion mode에서 분석하였고 이온 화된 단편 이온의 패턴 특성을 고려하여 동정하였다. 분리 된 5종의 flavonol은 quercetin과 kaempferol을 aglycone으로 하여 3번 탄소의 hydroxyl기에 1개 또는 2개의 당 (robinobiose, rutinose, glucose)이 결합되어 있는 구조를 가 지고 있었다. Peak 1, 2는 quercetin(m/z 303)을 aglycone으로 갖고 pseudomolecular ion peak[M+H]+ m/z 611과 [M+Na]+m/z 633로부터 peak 1과 2의 분자량이 동일할 뿐만 아니라 단편이온의 패턴(m/z 465, 449, 303)도 같았다(Fig. 2a-b). 동일한 분자량을 갖는 quercetin 배당체 중 robinobioside와 rutinoside는 각각 galactose와 glucose에 rhamnose가 1→6 결합되어있는 구조적 차이를 갖고 있으며, 이 차이에 의하 여 peak 용출시간이 다르게 나타났으며 peak 1를 quercetin 3-O-robinobioside로 peak 2를 rutin으로 동정하였다(23,24). 또한 peak 3은 pseudomolecular ion peak[M+H]+m/z 465에 서 glucose(m/z 162)가 제거되는 패턴을 나타내어 isoquercitrin 로 동정하였다(24)(Fig. 2c). Kaempferol 배당체인 peak 5, 6은 pseudomolecular ion peak[M+H]+m/z 595과 [M+Na]+m/z 617로 단편 이온 패턴(m/z 449, 433, 287)도 quercetin 배당체(peak 1, 2)와 마찬가지로 rhamnose(m/z 146), galactose와 glucose(각각m/z 162)가 제거되는 패턴을 나타 내었으며 peak 용출시간을 고려하여 각각 kaempferol 3-O-robinobioside와 nicotiflorin로 동정하였다(2,24)(Fig. 2e-f). 특히 quercetin 3-O-robinobioside 및 isoquercitrin는 대추나무 flavonoid 정보로 구축된 라이브러리를 바탕으로 대추나무 잎에서는 처음 확인되었다. 이처럼 본 연구에서 구조 동정을 위해 제작된 라이브러리는 선행 연구된 대추나 무 flavonoid의 정확한 연구 정보를 미리 제공함으로서 기존 연구와의 차이점 판단을 가능하게 할 것으로 판단된다. Chalcone 1종은 phloretin을 aglycone으로 갖고 있었으며 flavonol과 같이 당이 떨어지는 단편이온 패턴을 나타내지 않았다. Pseudomolecular ion peak(m/z 599, [M+H]+)로부터 물 분자가 하나씩 떨어지는 패턴(m/z 581 [M+H-H2O]+, 563 [M+H-2H2O]+, 545 [M+H-3H2O]+, 527 [M+H-4H2O]+)을 나 타냈었고 m/z 461[M+H-C4H8O4-H2O]+의 이온화 패턴을 나 타내어 Pawlowska 등(24)의 선행연구 결과에 따라 phloretin 3'위와 5'위 탄소에 glucose가 결합한 구조를 갖고 있는 것으로 확인되었다(Fig. 2d).
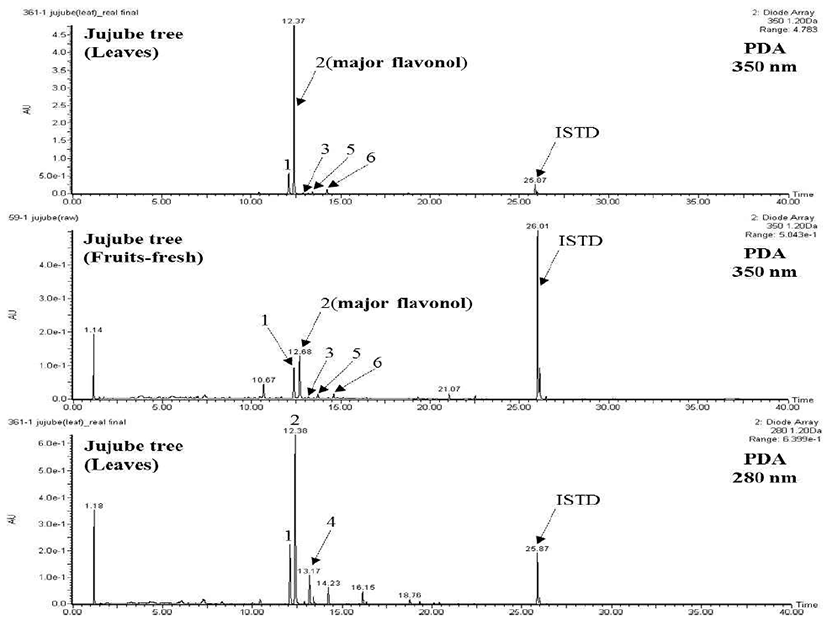
대추나무 잎과 열매의 총 flavonoid 함량 분석 결과, 잎 (8,356.5 mg/100 g DW), 신선열매(13.6 mg/100 g DW), 일광 건조 열매(9.2 mg/100 g DW) 순으로 높았고, 잎에서의 총 flavonoid 함량은 열매 신선열매와 비교하여 약 614배 이상 높게 나타났다(Table 2). 대추나무 열매 내 총 flavonoid 함량 은 신선열매가 일광건조 열매보다 약 48% 높게 나타나 Gao 등(25)의 연구와 마찬가지로 같은 열매에서도 처리에 따른 flavonoid 함량 차이를 보였다. 대추나무 잎의 flavonoid 배당체별 함량 비율은 flavonol류(약 98%), dihydrochalcone류(약 2%)로 나타났다. Flavonol류 중에서 quercetin 배당체(약 94%)는 주요 flavonol 배당체로 나타났 고, kaempferol 배당체가 약 4%를 차지하였다. 대추나무 열매에서는 flavonol류만 검출되었으며, flavonol 배당체별 함량 비율은 신선열매와 일광건조 열매의 quercetin 배당체 가 각각 90, 91%이었고 kaempferol 배당체가 각각 10, 9%로 나타났다. 특히, 대추나무 잎의 flavonoid 개별 성분 중 rutin 은 6,735.2 mg/100 g DW(총 flavonoid 함량 중 81%)로 주요 성분으로 확인되었다. Guo 등(7)의 연구에 보고된 대추나 무 잎의 rutin 함량(2,425.0 mg/100 g DW)보다 약 2.7배 높게 나타났다. 유럽 남동부에서 재배된 대추나무와 마찬 가지로 rutin이 잎의 주요 성분임을 확인하였고 국내산 대추 나무의 함량이 약 23배 높게 나타났다(26). 또한 브라질산 대추나무(Z. joazeiro Mart.) 잎의 rutin 함량(972.0 mg/100 g DW)보다도 약 7배 높게 나타났다(27). Rutin 함량이 높다 고 알려진 메밀 잎(269.2 mg/100 g DW)과 뽕나무 잎의 함량(573.0 mg/100 g DW)보다도 각각 약 25, 12배 높은 것으로 나타났다(8,28). Gao 등(25)의 보고와 같이 대추나무 열매의 rutin 함량이 신선열매는 6.9 mg/100 g DW(51%), 일광건조 열매는 4.9 mg/100 g DW(53%)로 가장 높게 나타 나 분리된 flavonol 개별 성분 중에서 주요 성분임을 확인하 였다. 그러나 보은대추(Z. jujuba forma hoonensis C.S.Yook) 과 매추(Mechu, Z. jujuba var. intermis) 열매 추출물의 rutin 함량(295.5, 707.5 mg/100 g DW)보다는 낮게 나타났다(5). 다음으로 quercetin 3-O-robinobioside가 잎에서 1,054.1 mg/100 g DW(총 flavonoid 함량 중 13%), 신선열매에서 5.2 mg/100 g DW(38%), 일광건조 열매에서 3.4 mg/100 g DW(37%) 순으로 나타났다. Isoquercitrin은 잎에서 40.4 mg/100 g DW(총 flavonoid 함량 중 0.4%)로 신선열매에서 0.2 mg/100 g DW(1%), 일광건조 열매에서 0.1 mg/100 g DW(1%) 보다높았다. 산조인, 베르에서주요C-glycosylflavone 로 알려진 spinosin과 isospinosin, 아실화(coumaric acid, ferulic acid, sinapic acid, vanillic acid)된 spinosin가 보고되 어있으나, 본 연구에 사용된 대추나무에서는 검출되지 않 았다. 이는 대추나무속(Ziziphus)에 따라 함유하고 있는 기 능성 성분의 차이가 있는 것으로 보여 진다(2,29). 이외에도 quercetin 3-O-arabinosyl(1→2)rhamnoside, quercetin 3-O-xylosyl(1→2)rhamnoside, quercetin 3-O-xylosyl(1→ 2)rhamnoside-4'-O-rhamnoside 등 quercetin 배당체, flavanol 류(catechin, epicatecin, procyanidin B2) 등 다수의 flavonoids 가 보고된 바 있으나, 본 연구에서는 검출되지 않았다 (24,30-32).
대추나무잎에서nicotiflorin과kaempferol 3-O-robinobioside 는 각각 215.8 mg/100 g DW(총 flavonoid 함량 중 3%), 105.2 mg/100 g DW(1%)를 나타냈다. 열매의 nicotiflorin과 kaempferol 3-O-robinobioside 함량은 신선열매가 0.7 mg/100 g DW(총 flavonoid 함량 중 5%), 0.6 mg/100 g DW(4%)이었고 일광건조 열매는 0.4 mg/100 g DW(4%), 0.4 mg/100 g DW(4%)로 신선열매가 일광건조 열매보다 높게 나타나 quercetin 배당체와 비슷한 경향을 나타내었다. 그리고 phloretin 3',5'-di-C-glucoside는 기존에 보고된 문헌 과 마찬가지로 대추나무 잎에서만 검출되었으며, 205.8 mg/100 g DW로 총 flavonoid 함량 중 2%를 차지하였다 (4,31).
대추나무에서 분리된 flavonoid는 개별 성분의 종류는 잎과 열매에서 비슷하였으나 부위에 따라 큰 함량 차이를 나타내었다. 특히 대추나무 잎은 flavonoid를 풍부하게 함유 하고 있는 자원으로 산화적 스트레스를 낮춤으로 고혈압 등 심혈관질환에 효과가 있다고 알려진 rutin을 풍부하게 함유하고 있다(15,33). Rutin이 풍부한 것으로 알려져 있는 농식품 중 메밀은 볶으면 고소한 향뿐만 아니라 기능성 때문에 차, 등 식품소재로 이용되고 있다(34). 국내에서 대 추는 구기자, 상엽 등 한약재와 함께 성인병 예방을 위한 기능성 차로 사용되고 있으나, 대추나무의 품종, 지역 등 재배 환경에 따른 기능성 성분과 관련된 연구가 필요하다고 판단된다(35). 이를 통하여 rutin 함량이 풍부한 대추나무 잎 선발은 기능성 차를 포함한 우수한 식품 소재 및 부소재 로서 활용 가능성이 있을 것으로 판단된다.
요 약
본 연구에서는 국내산 대추나무의 잎과 열매의 flavonoid 배당체를 조사하기 위하여 선행 연구된 인용문헌을 바탕으 로 대추나무, 묏대추나무, 야생대추나무 등 대추나무속 (Zizyphus)에 따른 flavonoid의 화학적 정보 수집 및 정리하 여 대추나무속의 flavonoid 라이브러리를 제작하였다. 각 flavonoid 개별성분은 UPLC-DAD-QTOF-ESI/MS를 사용 하여 분석하였으며 제작된 라이브러리의 정보를 이용하여 국내산 대추나무로부터 총 6종의 flavonoid를 확인하였다. 이를 통하여 국내산 대추나무 잎의 주요 성분은 quercetin 배당체인rutin임을확인하였고, 특히quercetin 3-O-robinobioside 및 isoquercitrin는 구축된 라이브러리를 바탕으로 대추나무 잎에서는 처음 확인된 것을 알 수 있었다. 본 연구와 같이 대추나무속 flavonoid의 화합물 정보를 포함하여 제작한 라이브러리는 선행된 연구와의 차이점 판단을 가능하게 할 것으로 사료된다.