서 론
산업발달과 함께 고령화 시대가 되면서, 더 나은 삶의 질을 위한 질병 예방이나 건강증진을 목적으로 천연물 유래 생리활성물질 및 건강기능식품에 대한 관심이 높아지고 있다. 버섯이나 효모 등의 균류는 예로부터 식용 및 약용으로 꾸준히 이용되어 왔고, 특히 버섯은 기능성 식품으로써 다양한 질병을 예방하고 치료하기 위하여 사용되어 왔다(1,2). 버섯의 질병예방 및 치료효과는 주로 β-glucan에 의한 면역기능 향상 효과에 기인하는 것으로 알려져 있으며(3,4), 면역 활성 증가뿐만 아니라 항동맥경화, 혈당저하의 효과를 보이는 것으로도 알려져 있다(5). 또한, Mice에서 A/Puerto Rico/8/34(PR8; H1N1) 인플루엔자 감염의 예방과 xylene에 의해 유도된 급성 염증이 상당히 감소한다는 연구내용도 보고되어 있다(6,7). β-glucan은 이러한 건강기능 증진 및 질병 예방 효과뿐 만 아니라, 안전성에 있어서 미국식품의약국안전청(FDA)에서 GRAS(General Recognized as Safe, GRN No. 413, GRN No. 309)로 인정받았기 때문에, 전 세계적으로 식품첨가물뿐만 아니라 기능성 식품 및 화장품의 원료 등으로 널리 이용되고 있다(8,9,10).
β-Glucan이란 포도당(glucose)이 β-1,3결합, β-1,4결합, 또는 β-1,6결합 등으로 구성된 다당류를 총칭하며, 버섯, 효모 등 미생물의 세포벽 또는 세포외의 다당류에 포함되어 있거나(11,12), 보리, 귀리와 같은 곡물의 식이섬유에 포함되어있다고 알려져 있다(13). 하지만 식물 유래의 β-glucan 은 대량 생산에 제한이 있고, 버섯의 β-glucan 또한 추출과정의 어려움과 높은 가격으로 인하여 많은 제약이 있어왔다(14,15).
Aureobasidium pullulans는 흑효모라고 알려져 있는 균류로 수용성이고 낮은 점도를 갖는 분자량이 작은(약 100 kDa) β-1,3/1,6-glucan을 생성하는데, 이 β-1,3/1,6-glucan은 암세포 생장과 간 전이를 억제하는데 효과가 있다고 보고되어 있다(16,17). β-glucan이 면역체계에 미치는 근본적인 영향에 대한 연구는 β-glucan의 특이적 수용체인 dectin-1 (DC associated C-type Lectin-1)이 보고되면서 가속화 되었다(18). Dectin-1은 선천면역에 관여하는 pattern recognition receptors(PRRs)에 속하며 외부 항원물질의 특이적 패턴을 인식하여 결합하는 특징을 갖고 있어 항원이 갖는 종의 특성은 구분하지 않고 다양한 범위의 병원체를 빠르게 인식할 수 있다(19). 그러므로 Dectin-1은 식물이나 세균, 곰팡이 등 다양한 외부항원에서 생성되는 β-glucan에 대한인지가 가능하다(20). Dectin-1 receptor는 neutrophils, natural killer(NK) 세포, B-세포 및 T-세포 등의 면역 세포에서 발현이 확인되었고 그 외에도 다양한 세포 및 조직에서 광범위하게 발현됨이 보고되었다(19,21,22,23). 항원을 인지했을 경우 cytokine과 chemokine의 생성을 통하여 주변의 다른 dendric cell(DC), 대식세포 또는 NK 세포의 활성을 촉진시켜 세포성 면역과 체액성 면역에 직간접적으로 관여함으로서 외부 항원에 대한 면역체계가 민감하고 정교하게 반응할 수 있게 만든다(24,25).
LP-BM5 레트로바이러스는 MAIDS(murine acquired immunodeficiency syndrome AIDS)을 유도하여 복합적 질병을 일으키는데(26), human AIDS의 특징과 매우 유사하기 때문에 이를 연구하기 위한 모델로 널리 사용되어 왔다(27,28). LP-BM5 레트로바이러스가 감염되고 증식하게 되면, human AIDS와 유사하게 CD4+ T-세포(helper T-cell)의 기능을 잃게 만들고, 감염감수성을 증가시켜 일반적으로 비병원성인 미생물에 노출되었을 때도 치사율을 증가시킨다(21).
따라서 본 연구는 흑효모로 알려진 A. pullulans 로부터 추출된 β-1,3/1,6-glucan이 면역 활성에 미치는 영향을 알아보기 위하여, β-1,3/1,6-glucan 처리 후 면역 활성에 관여하는 NK 세포과 대식세포의 활성도를 조사하였다. 또한 이 β-1,3/1,6-glucan 처리 후 면역 불균형을 초래하는 LP-BM5 바이러스의 복제 정도의 변화를 조사하였다.
재료 및 방법
β-1,3/1,6-glucan은A. pullulans로부터 Kim 등(29)의 연구 내용에 따라 추출하여 사용하였다. β-1,3/1,6-glucan의 추출은 Czapek 액체 배지 20 mL이 함유된 100 mL 삼각플라스크에 접종하여 30℃에서 72시간 배양하였다. 배양된 변이균주 10 mL을 각각 15 mL 원심분리용 튜브에 취하여 4,000 rpm으로 10분간 원심분리하여 세포를 침전시킨 후, 상등액 5 mL를 15 mL 원심분리용 튜브에 취하였다. 여기에 5 mL의 에탄올을 첨가하여 1분간 진탕한 후, 반응액을 여과하여 여과막에 존재하는 폴리머를 추출하여 사용하였다.
본 실험에서는 6주령 Balb/C female 마우스를 중앙실험동물(주)(Seoul, Korea)에서 구입하여 명암 12시간, 온도는 23±2℃, 상대습도 50±5℃인 조건에서 1주 동안 적응기를 거쳐 실험에 이용하였다. 실험기간 동안 AIN-93G 식이와 음용수는 자유롭게 섭취하도록 하였다. 비장세포는 마우스 비장으로부터 추출하여 사용하였다. 마우스 비장을 무균적으로 적출하여 Roswell Park Memorial Institute medium 1640(RPMI1640)용액으로 씻은 다음 가볍게 분쇄하여 세포를 유리시켰다. 분리된 세포 현탁액으로부터 lysing buffer(Tris-buffered ammonium chloride; 0.87% NH4Cl, pH7.2)를 이용하여 적혈구를 제거하고 다시 RPMI1640용액으로 세척 한 후, 10% fetal bovine serum(FBS)(Hycolone laboratories, Logan, UT, USA)가 첨가된 RPMI1640에 현탁하여 사용하였다. 실험에 사용한 Yac-1 세포, SC-1 세포 그리고 RAW 264.7 세포는 American Type Cultured Collection(ATCC; Rockuille, MD, USA)에서 분양 받아 사용하였고, YAC-1 세포는 10% FBS, 100 mg/L penicillinstreptomycin(Hycolone laboratories, Logan, UT, USA), 2 mmol/L L-glutamine(Hycolone laboratories, Logan, UT, USA), sodium pyruvate(Hycolone laboratories, Logan, UT, USA)이 포함된 RPMI1640을 이용하였고, SC-1 세포와 RAW 264.7 세포는10% FBS, 100 mg/L penicillin- streptomycin, 2 mmol/L L-glutamine, sodium pyruvate가 포함된 Highglucose Dulbeco’s modified Eagle’s medium(DMEM)을 이용하여 37℃, 5% CO2에서 배양하였다.
96 well plate에 비장세포와 대식세포를 각 well당 1×104 cells/well씩 분주한다. β-1,3/1,6-glucan을 각각 0, 10, 50, 100, 200, 400 μg/mL 농도로 처리하여 37℃, 5% CO2에서 24시간 동안 배양하였다. EZ-cytox cell viability kit(대일바이오, Korea) 의 Ez-Cytox용액 20 uL를 첨가하고 ELISA reader(VERSAMAXSL-20 Molecular Devices, Sunnyvale, CA, USA)를 이용하여 450 nm에서 흡광도를 측정하였다.
NK 세포 활성평가는 기본적으로 Vetvicka(30)와 Seo(31)에 의해서 보고된 방법에 의해 수행하였다. 방법을 간단히 정리하면, 비장세포는 96 well plate에 각 well당 5×105 cells/well씩 분주하고 표적 세포는 Yac-1 세포로 1×104 cells/well씩 분주하였다. β-1,3/1,6-glucan은 각각 0, 10, 50, 100, 200 μg/mL 농도로 처리하여 37℃, 5% CO2 조건 하에서에서 4시간 동안 배양하였다. 배양 후 상층액 50 uL을 새로운 plate에 분주하고 Cytotox 96 Non-radioactive Cytotoxicity assay kit(Promega Corporation, Madison, WI, USA)를 이용하여 ELISA reader를 이용하여 450 nm에서 흡광도를 측정하여 NK 세포의 활성도를 확인하였다.
대식세포를 96 well plate에 각 well당 8×104 cells/well씩 분주한 후, β-1,3/1,6-glucan을 각각 0, 10, 50, 100, 200 μg/mL 농도로 처리하여 37℃, 5% CO2에서 24시간 동안 배양하였다. Cytoselect 96-well phagocytosis assay(zymosan substrate) kit(Cell Biolabs, INC, USA)를 이용하여 450 nm에서 흡광도를 측정하여 대식세포의 활성도를 확인하였다.
SC-1/LP-BM5 세포주를 6 well plate에 8×104 cells/well씩 분주하여 4시간 안정화 후 β-1,3/1,6-glucan을 각각 0, 10, 50, 100, 200 μg/mL 농도로 처리하여 37℃, 5% CO2에서 24시간 동안 배양하였다. RNA 추출을 위하여 RNeasy extraction kit(Qiagen, Gaithersburg, Maryland, USA)로 제조사의 protocol에 따라 실험을 진행하였으며, cDNA 합성을 위하여 iScript cDNA synthesis kit(Bio-Rad Laboratories Headquarters, Hercules, CA, USA)를 사용하였다. 유전자들의 발현을 측정하기 위하여 SYBR Green(iQ SYBR Green Supermix, Bio-Rad Laboratories Inc., PA, USA)을 이용한 실시간 정량 PCR을 실시하였고, 기기는 Real-Time PCR (Applied Biosystems, Foster City, CA, USA)을 사용하였다. 각 유전자의 발현은 GAPDH 유전자 발현양을 통해 비교분석하였고 실험에 사용된 PCR primer의 염기서열은 Table 1과 같다. Real time PCR 반응은 총 20 μL 내에 cDNA 2 μL와 2X SYBR mix 10 μL 첨가하였다. Forward primer와 reverse primer는 각각 100 pmol/μL를 1 μL씩 첨가하였으며, 나머지는 H2O로 채워주었다. 증폭 cycle은 40 cycle을 실시하였으며, 증폭 단계는 다음과 같다. Hot start를 위해 95℃에서 10분, 증폭 단계의 denaturation을 95℃에서 15초, annealing을 60℃에서 1분 30초, extension을 72℃에서 30초간 반복하며, 각 cycle의 extension 후에 값이 기록되었다. 모든 cycle이 완료된 후 primer의 특이성을 확인하기 위해 melting curve 분석을 실시하였다. 결과의 분석은 Applied Biosystems에서 제공하는 One step system software v2.1로 분석하였다.
| Primer names | Primer sequences |
|---|---|
| GAPDH-g | 5’ CAT GGC CTT CCG TGT TCC TA 3’ |
| GAPDH_R | 5’ GCG GCA CGT CAG ATC CA 3’ |
| LP-BM5-g | 5’ CCA ATG TGT CCA TGT CAT TT 3’ |
| LP-BM5_R | 5’ GCG ATG AGC AGA GAG AGA AAG 3’ |
결과 및 고찰
환경의 오염, 신규 바이러스의 출몰 등 외부적인 요인 뿐만 아니라 인간의 수명이 증가하면서 건강한 삶을 위해서 면역력을 강화하고자 하는 욕구는 증가하고 있다. 또한 암과 같은 인간 생명을 위협하는 질환 등을 치료하는 과정에서 발생하는 부작용으로 정상세포에 영향을 주기 때문에 이를 극복하기 위해서도 면역증강에 관한 연구는 더욱 중요해 질 것이다. 그러나 버섯으로부터의 β-glucan 생산은 여러가지 어려움이 따르기 때문에, A. pullulans를 이용하여 보다 수용성인 β-glucan을 생산하고, 이 효능에 대한 연구는 진행되어 왔다(16). 이 연구에서 우리는A. pullulans로부터 생산된 β-1,3/1,6-glucan이 면역세포에 미치는 영향을 측정하였다.
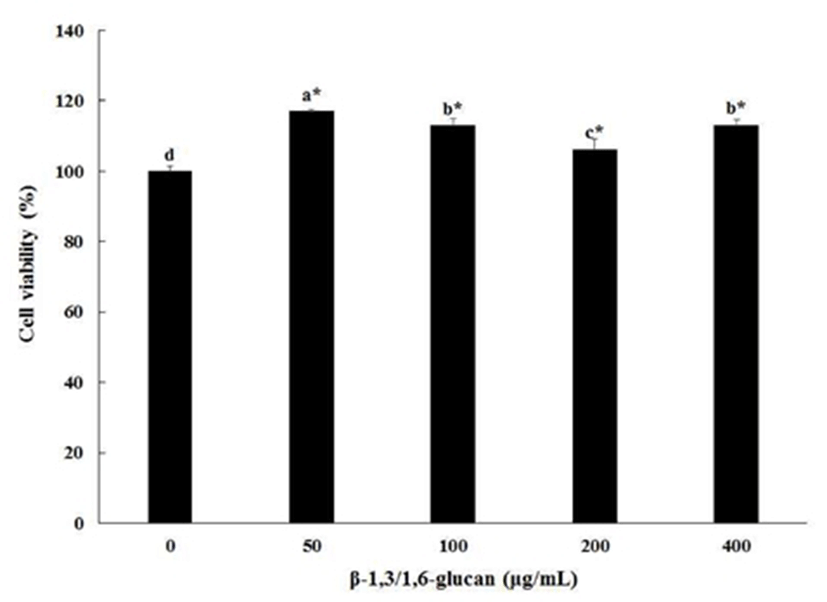
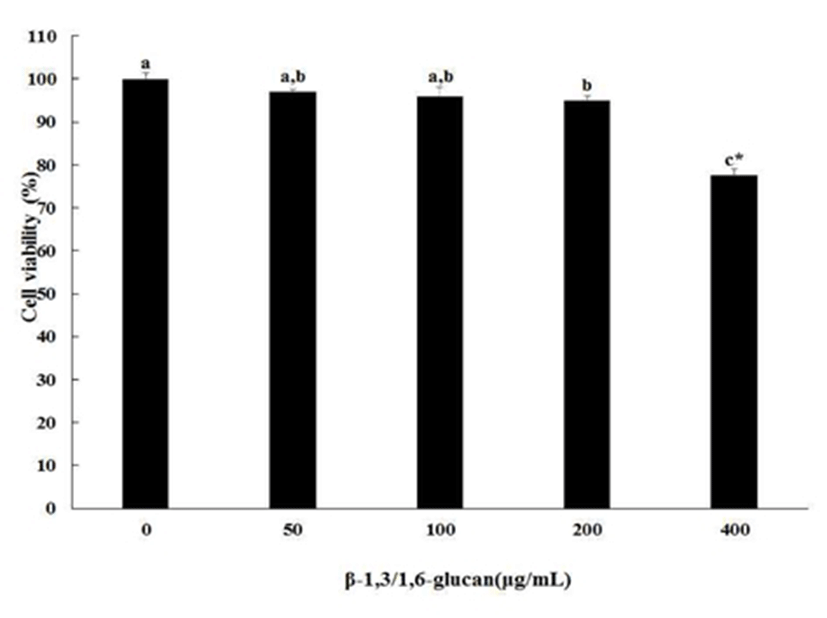
β-1,3/1,6-glucan을 비장세포와 대식세포에 24시간 처리하여 세포 생존율을 측정한 결과를 Fig. 1과 Fig. 2에 나타내었다. β-1,3/1,6-glucan을 각각 50, 100, 200, 400 μg/mL을 처리한 결과, 0 μg/mL을 100%로 보았을 때 비장세포에서는 각각 117.3±0.9%, 113.5±2.9%, 107.8±3.7%, 113.8±2.4%로 세포 생존율이 오히려 증가하는 경향을 나타내었으며 세포독성이 나타나지 않았다. 대식세포에서는 50과 100 μg/mL 처리한 결과 각각 99.0±0.3%와 97.7±1.9%로 0 μg/mL군과 유의적인 차이를 보이지 않았다. 하지만 200 또는 400 μg/mL에서는 96.4±1.1% 또는 76.9±1.7%로 유의적인 차이를 보였다. 좀 더 정확한 결과분석을 위해 t-test를 수행하였다. 그 결과, 200 μg/mL에서는 0 μg/mL과 비교하였을 때 오차범위가 약 4%로 크게 차이가 없어 독성이 없는 범위로 보기에 무리가 없는 것으로 확인되었고, 400 μg/mL에서는 여전히 유의적인 차이를 보였으므로 세포독성이 있는 것으로 판단하였다. 따라서 본 연구에서는 세포 독성이 나타나지 않은 범위인 200 μg/mL을 최대농도로 이용하여 면역 활성 측정을 검정하였다. Hoffman(32)등의 연구에 따르면 fungal β-glucan을 500 μg/mL 이하의 농도로 처리했을 때 tumor necrosis factor-alpha(TNF-α)가 활성화되고, 그 이상 고농도로 처리하면 오히려 TNF-α의 활성을 저해한다고 하였다. 대식세포에 많은 양의 β-glucan을 처리하여도 viability에는 효과를 나타내지 않았기 때문에, 이러한 저해가 β-glucan의 독성 때문은 아니라고 하였지만, 본 연구 결과에서는 대식세포에 고농도의 β-glucan의 처리가 viability에 영향을 미치는 것으로 나타났다. 이 결과는 β-glucan의 정제 방법이나 세포에 처리방법 등의 차이에서 기인한 것으로 판단된다.
NK 세포와 Yac-1 세포를 같이 배양하여 β-1,3/1,6-glucan 의 처리에 따라 NK 세포 활성에 미치는 영향을 관찰하였다(Fig. 3). β-1,3/1,6-glucan을 처리하지 않은 대조군은 Yac-1 세포의 사멸률이 32.6±3.6%로 나타났다. 반면 β-1,3/1,6-glucan을 각각 10, 50, 100, 200 μg/mL 처리한 군은 각각 53.1±2.6%, 51.2±4.8%, 51.6±2.6%, 45.3±3.6%로 나타났다. 즉, Yac-1 세포의 사멸율이 대조군에 비하여 각각 63.1%, 57.2%, 58.4% 그리고 39.3% 증가하였음을 보여준다. 이 결과는 β-1,3/1,6-glucan의 처리농도에 의존적인 결과를 보인 것은 아니지만, β-1,3/1,6-glucan의 처리에 의해 대조군에 비해 유의적으로 활성이 증가하였음을 보여준다. 그러나 10, 50, 또는 100 μg/mL로 처리한 군은 평균 약 52%로 대조군에 비해 63-58% 증가한 결과를 나타냈지만, 200 μg/mL처리한 결과에서는 약 45%로 대조군에 비해 단지 약 39.3% 증가함을 보였다.
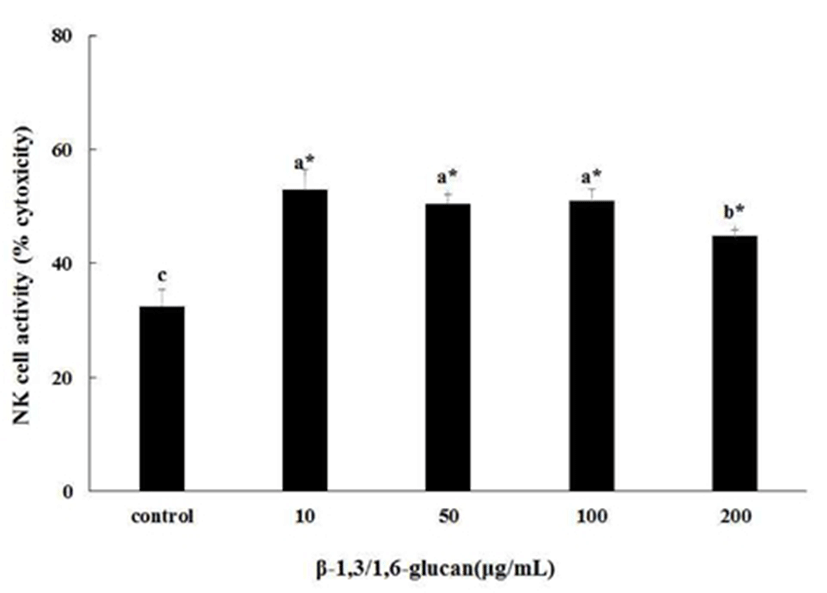
NK 세포의 활성도 분석을 위한 Yac-1 세포의 사멸율 조사에서, β-1,3/1,6-glucan의 처리에 의해 유의적으로 대식세포의 활성도가 대조군에 비하여 약 39~63% 증가했음을 보여주었다. 이는 β-glucan이 NK 세포에서 발견되는 수용체의 활성화에 의해 그 활성이 증가한다는 이전의 보고와도 일치하는 결과를 나타낸다(1,12). 그러나 10~100 μg/mL로 처리한 군은 Yac-1 세포의 사멸율이 평균 약 52% 정도로 대조군에 비하여 59% 증가된 사멸율 보였고, 200 μg/mL에서는 약 45%로 사멸율이 단지 39%만 증가하였다. 이 결과는 β-1,3/1,6-glucan의 처리는 전체적으로 대조군과 비교하여 NK 세포을 활성화 시키지만, 10~100 μg/mL로 처리한 군과 비교하면 200 μg/mL 처리한 군에서는 약 13% 감소한 활성을 보여주었으므로, 10~100 μg/mL의 농도로 처리하였을 때 보다 200 μg/mL의 농도로 처리했을 때 NK 세포 활성이 저해되는 것을 의미하며, NK 세포를 활성화 하는데 있어 실질적인 효과는 10 μg/mL에서 포화되었음을 보여준다.
β-1,3/1,6-glucan을 대식세포에 각 농도별로 처리하였을 때 대식세포의 탐식작용을 관찰하였다(Fig. 4). 먼저 대식세포를 활성화 시키는 것으로 알려진 zymosan을 대조군으로 이용하기 위하여, 대식세포에 zymosan을 처리하여 zymosan의 대식세포 탐식능 활성화를 조사하였다. 또한, zymosan과 inhibitor를 같이 처리한 군(zy+in) 에서는 zymosan을 처리한 군(zy)과 비교한 결과 탐식능이 억제되는 것으로, 대식세포의 탐식능 활성화는 zymosan에 의한 것임을 확인 하였다. zymosan을 처리한 군에서의 활성을 100%라 하고 β-1,3/1,6-glucan을 각각 10, 50, 100, 200 μg/mL 처리한 군과 비교하였을 때, 탐식작용은 각각 115.1±0.8%, 117.3±1.4%, 120.0±1.1%, 121.5±0.9%로 유의적으로 증가하였음을 확인하였다. β-1,3/1,6-glucan의 처리농도 10~100 μg/mL까지는 농도 의존적이었고, 100 μg/mL 농도와 200 μg/mL 농도 간에서는 유의적인 차이를 보이지 않았다.
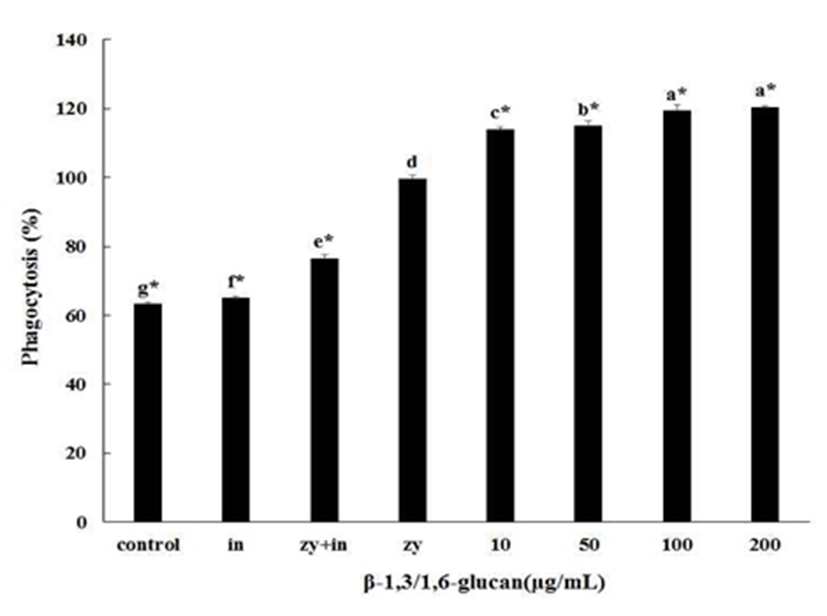
대식세포의 활성도는 10, 50 100 및 200 μg/mL의 β-1,3/1,6-glucan을 처리한 결과 처리농도에 따라 각각 약 15.1%, 17.3%, 20.0% 그리고 21.5% 증가하였다. 그러나 10~100 μg/mL의 농도에서는 비례하게 활성도가 증가하였지만, 200 μg/mL의 농도에서는 증가율이 낮았다. 이것은 실질적인 효능은 100 μg/mL 처리한 군에서 포화된 상태임을 나타낸다. 따라서 200 μg/mL 농도로 처리한 군에서 가장 대식세포의 탐식능이 뛰어났지만 처리농도 100 μg/mL을 이용하는 것이 산업적인 이용 가치 측면에서 나을 것으로 판단된다.
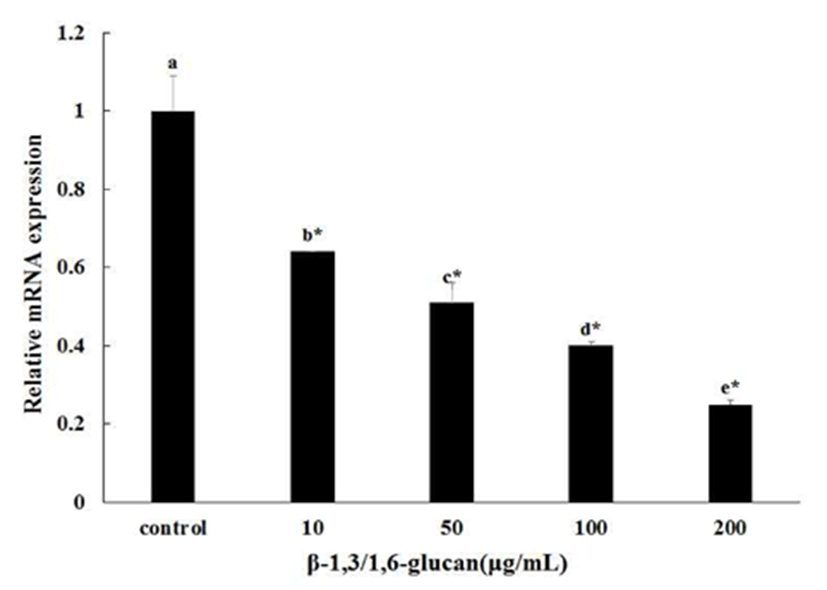
SC-1/LP-BM5 세포주를 이용하여 β-1,3/1,6-glucan 처리 시 LP-BM5 바이러스 복제 억제능 결과를 Fig. 5에 나타내었다. LP-BM5 발현은 GAPDH 발현양과 비교하여 정량화하였다. β-1,3/1,6-glucan을 처리하지 않은 대조군의 발현을 1로 하였을 때, β-1,3/1,6-glucan을 각각 10, 50, 100, 200 μg/mL 처리한 군에서 각각 0.64±0.00, 0.51±0.05, 0.40±0.00, 0.26±0.00으로 유의적으로 발현이 감소하였다. 특히 농도 의존적으로 발현이 감소하여 LP-BM5 바이러스 복제의 억제기능은 200 μg/mL 농도로 처리 시 가장 큰 효과를 나타내었다. LP-BM5 바이러스의 복제능은 β-1,3/1,6-glucan의 처리에 따라 크게 감소함을 보였다. 대조군의 바이러스 복제능을 1로 보았을 때, β-1,3/1,6-glucan을 10, 50, 100, 200 μg/mL 처리한 군에서 각각 36%, 49%, 60%, 그리고 74%씩 감소하였다. 이 결과는 β-1,3/1,6-glucan이 면역불균형을 초래하는 LP-BM5 바이러스 감염에 대한 방어막 효과로서 200 μg/mL 농도가 가장 효과적임을 알 수 있다. 이전의 연구결과에서도 식물성 β-glucan이 LP-BM5가 감염된 mice 에서의 효과에 대해 연구된 적이 있다(33). 하지만 A. pullulans로부터 분리된 β-1,3/1,6-glucan의 효과는 본 연구가 처음 보이는 것으로, 학술적 가치뿐 만 아니라 대량생산이 가능하기 때문에 상업적응용에 있어서도 가치가 높다고 판단된다.
요 약
β-Glucan은 효모나 버섯의 세포벽이나 곡물의 섬유에 들어있는 천연 화합물이며, 면역 시스템을 활성화 한다고 알려져 있다. Aureobasidium pullulans 수용성의 β-1,3/1,6-glucan을 생성한다. 본 연구에서는A. pullulans 로부터 생성된 β-1,3/1,6-glucan의 면역활성에 관한 효과를 조사하기 위하여, 면역활성에 관여하는 NK 세로의 활성과 대식세포에 미치는 영향을 관찰하였다. NK 세포에 의한 Yac-1 세포의 사멸율은 β-1,3/1,6-glucan을 처리한 군은 처리하지 않은 대조군에 비하여 63-39% 증가하는 것으로 나타났고, 대식세포의 탐식작용은 zymosan을 처리한 군보다 15-21% 증가함을 보였다. LP-BM5 바이러스 복제 억제능을 확인하기 위하여 SC-1/LP-BM5 세포주에 β-1,3/1,6-glucan을 처리한 결과 200 μg/mL 처리에서 LP-BM5 바이러스 복제능이 최대 74% 유의적으로 감소하였다. 이 결과는 β-1,3/1,6-glucan이 면역활성에 관여하는 NK 세포와 대식세포를 활성화하여 면역체계가 민감하게 반응할 수 있도록 만들고, LP-BM5 바이러스 복제를 억제하여 면역력을 증진할 수 있다는 것을 보여준다.