Article
수확시기별 까마중 전초의 성분, 항산화활성 및 항염증 활성
최성규1, 서경순3, 김용두2, 윤경원1, 최봉석3, 진성우3, 강경윤4, 조인경5, 김경제3,*
The chemical constituents, antioxidant activity and anti-inflammatory activities of Solanum nigrum Linne by different harvest time
Seongkyu Choi1, Kyoung-Sun Seo3, Yong-Doo Kim2, Kyeong-Won Yun1, Bong-suk Choi3, Seong-Woo Jin3, Kyeong-Yun Kang4, In-Kyung Cho5, Kyung-Je Kim3,*
1Department of Oriental Medicine Resources, Sunchon National University, Sunchon 57922, Korea
2Department of Food Science and Technology, Sunchon National University, Sunchon 57922, Korea
33Jangheung research institute for mushroom industry, Jangheung 59338, Korea
4Department of Pharmacy, Sunchon National University, 57922, Korea
5Department of Food and Nutrition, Nambu University, Gwangju 62271, Korea
*Corresponding author. E-mail:ookingoo@empas.comPhone:82-61-862-8877, Fax:82-61-862-8847
Korean Journal of Food Preservation. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Jun 13, 2016; Revised: Jul 19, 2016; Accepted: Oct 05, 2016
Abstract
In this study, we investigated the variation in free sugars, amino acids, antioxidant activity, and anti-inflammatory activity of Solanum nigrum Linne based on harvest time. Major amino acids identified by HPLC analysis were proline, histidine, and serine. The highest content of total amino acids were found in S. nigrum aerial parts and roots harvested on July 10th and August 10th. Four kinds of free sugars (fructose, glucose, sucrose, maltose) were detected in S. nigrum, and the free sugar content varied significantly with harvest time. The fructose content of S. nigrum decreased with as harvest time increased. The total polyphenol content of S. nigrum was highest in those harvested on August 30th. The antioxidant activity of ethanol extract from S. nigrum collected at different harvest times were measured by DPPH and ABTS radical scavenging assays. The anti-inflammatory activity of these extracts were assayed via nitric oxide suppression in C6 glioma cells with a lipopolysaccharide (LPS)-induced inflammatory response. The anti-inflammatory activity and antioxidant effects were the highest in the extract from S. nigrum collected on August 30th. Good correlations were observed between antioxidant and anti-inflammatory activities in ethanol extract of S. nigrum roots harvested on August 30th.
Keywords: amino acids; antioxidant; anti-inflammatory; Solanum nigrum; harvest time
서 론
까마중(Solanum nigrum L.)은 가지과(Solanaceae)에 속하는 1년생 초본(草本)으로 전국 각지의 길가 및 야산에 분포되어 있다(1). 우리나라에 자생한 까마중의 형태는 초장 30~90 cm 정도이며, 가지가 많고 줄기에는 능선이 있으며, 잎자루가 길고, 잎은 호생하며 난형으로 길이 6~10 cm, 폭 4~6 cm, 가장자리는 밋밋하거나 물결 모양의 톱니가 있다(2).
까마중의 한약명은 용규(龍葵)라 하며, 한방에서 까마중의 전초를 여름과 가을사이에 채취하여 햇볕에 말린 후 약용으로 이용한다(3). 동의보감(東醫寶鑑)에 ‘용규’는 성질이 차고, 맛은 쓰다고 한다. 또한 피로한 것을 풀어주고 잠을 적게 하며, 열로 부은 것을 치료한다고 기록되어있다(4).
까마중에 관한 연구로는 Choi와 Seo(5)는 까마중의 생산조건에 대한 연구결과를 발표한 바 있다(6). 천연원료인 약용식물의 활용은 식물체 고유의 색소, 향 등을 이용하는 경우가 대부분이었으나, 점차 활용도가 증가하고 있다(7). 까마중은 식용, 약용 및 염료 등의 다양한 기능성을 가지고 있어서 앞으로 개발 가능성이 매우 큰 약초로 생각된다(8).
한편 인구 고령화와 더불어 항산화 및 면역효과에 대한 관심이 증대 되고 있다(9). Superoxide(O2) 및 hydroxyl radical(OH) 등의 활성 산소종은 일반적으로 식세포에 의한 박테리아 제거를 비롯하여 생체방어에 중요한 역할을 수행하지만, 과량의 활성 산소종은 생체내 DNA와 단백질 및 세포막 등과 반응하여 이들의 활성을 저하시키거나 기능의 변화(10,11)를 가져와 암, 노화, 뇌졸중, 심근경색, 류마치스성 관절염 및 폐기종 등 각종 질병을 유발하는 것으로 보고되어 있다(12). 이와 같이 생체내의 free radical의 유해성에 대하여 많이 알려지면서 이러한 free radical을 제거해주는 항산화계 효소의 활성을 촉진시키는 물질을 식품과 천연물에서 찾으려는 연구가 활발히 진행되고 있다(13,14,15).
까마중의 항산화 및 생리활성에 관한 연구들로는 까마중 잎의 acetone, methanol 및 물로 추출하여 항산화 효과를 비교한바 있으며(32), 까마중의 항산화 효과를 나타내는 phenol성 물질이 2,6-methano-3-benzozocin-11-ol, 2-hydroxy-5-methyl -benzaldehyde로 보고한 바 있다(36). 까마중은 흑적색 색소를 함유하고 있는 자원으로서의 잠재력이 있으나, 최적 수확시기 정립을 위한 성분분석 및 생리활성 연구는 미진한 상황이다. 또한 까마중을 비롯한 가지과 식물들의 수확시기별 아미노산 조성 및 함량에 관한 연구가 수행된 바 없어, 유용성분 및 생리활성을 기반으로 한 적정 수확시기 설정에 어려움이 있다(33).
따라서 본 실험은 우리나라 남부지역인 전남 순천에서 까마중을 재배하여 전초를 시기별로 구분하여 채취한 후 지상부와 뿌리로 시료를 구분하여 아미노산, 유리당 및 polyphenol 함량은 분석하였다. 또한 수확시기별 까마중의 DPPH radica 소거능, ABTS radical 소거능 및 NO 생성 억제효과를 검정하여 까마중의 식의약품 개발을 위한 기초 자료로 활용하고자 한다.
재료 및 방법
재료 및 방법
본 실험에 사용한 까마중은 2014년 10월에 나주에서 채종한 자생종의 까마중 종자를 2015년 4월 20일에 순천대학교약초원에 파종하였으며, 국내에서 생산되는 까마중의 초장, 엽수 등 생육이 활발하게 이루어진다고 알려진 7월부터 9월까지 4회 채취하였다(42). 까마중 1주당 중량을 측정한 후 동결건조 한 후 마쇄한 분말을 100 mesh 체로 걸러서 통과한 분말만을 시료로 사용하였다(Table 1, 2).
Table 1.
The weight of Solanum nigrum par ts depending on harvest time
|
Harvest time (date) |
Fresh weight (g/plant) |
Dry weight (g/plant) |
Dry/fresh weight ratio (%) |
Root weight (g/plant) |
|
Jul. 10 |
273±251)b2)
|
68.1±5.1b
|
24.9±2.4a
|
79±4.7b
|
|
Aug. 10 |
324±21ab
|
77.3±4.8ab
|
23.9±2.7a
|
94±6.4a
|
|
Aug. 30 |
352±31a
|
84.8±5.6a
|
24.1±2.6a
|
98±5.9a
|
|
Sep. 10 |
310±34ab
|
76.5±4.3ab
|
24.6±2.1a
|
89±6.1ab
|
Download Excel Table
Table 2.
The harvesting time and parts of Solanum nigrum for this test
|
Samples |
Parts |
Harvest time |
|
A |
Aerial part |
July 10th |
|
B |
August 10th |
|
C |
August 30th |
|
D |
September 10th |
|
E |
Root |
July 10th |
|
F |
August 10th |
|
G |
August 30th |
|
H |
September 10th |
Download Excel Table
시약 및 용매
본 실험에 사용한 시약은 Sigma-aldrich(St. Louis, MO, USA)에서 구입하여 사용하였으며, 아미노산 분석은 AccQ-Tag amino acids assay kit(Waters, Milford, MA, USA)를 사용하였다. 추출 및 분석에 사용한 용매는 시판 특급 및 일급 시약을 사용하였다.
유리당 분석
유리당 함량은 Wilson 등(16)의 방법에 준하여 분석하였다. 즉, 시료 5 g에 증류수를 가하여 교반시킨 후 100 mL로 정용하여 원심분리(50,000 rpm, 30 min)하고 상징액을 취하여 여과(Whatman No. 2)하였다. 여과한 여액을 Sep-pak C18으로 정제시킨 다음, 0.45 μm membrane filter(Millipore Co, USA)로 여과 후 HPLC system(1200 series, Agilent, Palo Alto, CA, USA)을 이용하여 수행하였으며, 검출기는 ELSD(1200 series, Agilent, Les Ulis, France), column은 carbohydrate column(250×4.6 mm, Agilent, Richardson, TX, USA)을 사용하였고, 이동상은 75% acetonitrile을 사용하였다. 유속은 분당 1.0 mL였으며, 시료 주입량은 10 μL로 하여 실험을 진행하였다.
구성아미노산 분석
시료의 구성아미노산은 Daniel 등(17)의 방법으로 분해하고, AccQ-TagTM method(AccQ-Tag amino acids assay kit, Waters, Milford, MA, USA)에 따라 유도체화 과정을 거친 후 분석하였다. 시료를 6 N HCl 용액으로 110℃에서 24시간 가수분해 시켜서 얻은 여액을 원심분리하고, 상등액을 50℃에서 농축하여 염산과 물을 완전히 증발시킨 후, 20 mM HCl 5 mL로 조절한 다음 0.22 μm membrane filter(Millipore Co., USA)로 여과하였다. 그 여액을 20 μL 취한 후 AccQ․ Fluor borate buffer 60 μL, AccQ․Fluor borate reagent 20μL와 혼합하여 10분간 가열 반응시킨 후 분석시료로 사용하였다.
전처리된 시료의 분석은 HPLC system(1200 series, Agilent)으로 수행하였으며, column은 AccQ-tag column(3.9×150 mm, AccQ-TagTM, USA)을 사용하였고, column 온도는 37℃, 유동상은 solvent A(acetate-phosphate buffer) 40% : solvent B 60%(acetonitrile 99%)를 혼합하였다. 유속은 분당 1.0 mL였으며, 검출기파장은 248 nm, 시료 주입량은 5 μL로 하여 실험을 진행하였다.
에탄올 추출물 제조
동결건조된 시료 1 g을 absolute ethanol 50 mL에 침지하고 상온에서 3시간동안 150 rpm으로 교반하여 추출하였다. 교반은 Obital shaker(VS-201D, Vision scientific Co., Korea) 를 사용하였으며 추출이 끝난 추출물은 Whatman paper No. 2로 filter 하였다. 시료에 에탄올을 증발시키기 위해 진공회전증발농축기(N-1000S-W, Tokyo rikakikai Co., Tokyo, Japan)를 이용하여 감압 농축하였다. 각 시료는 conical tube 에 넣어 초저온냉장고(MDF-794, Sanyo electric Co., Tokyo, Japan)에서 동결한 후 동결건조기(PVTFD10R, Ilshin lab Co., Korea)로 건조하여 추출물의 분말을 얻었다. 까마중 에탄올추출물 동결건조 분말들은 아래 Table 3와 같은 수율을 나타내었으며, 실험에 시료로 사용하였다.
Table 3.
Soluble solid content in ethanol extract of Solanum nigrum depending on harvest time
|
Item |
Samples |
|
A |
B |
C |
D |
E |
F |
G |
H |
|
Soluble solid (mg/g) |
73.2±4.31)
|
84.3±4.8 |
86.2±5.5 |
81.7±4.1 |
32.4±3.1 |
38.2±3.4 |
37.6±4.2 |
39.4±3.6 |
Download Excel Table
폴리페놀 함량측정
페놀함량 측정은 Velioglu 등의 법을 변형한 방법(18)으로 측정하였다. 1 mg/mL에 시료 5 μL에 10배 희석한 Folin-Ciocalteau 시약을 100 μL씩 첨가한 후 상온에서 5분간 둔다. 반응 후 각 tube에 7.5% Na2CO3를 500 μL씩 첨가하고 30℃에 90분간 반응한 다음 흡광도 725 nm 측정한다. 총 페놀함량은 100, 300, 500, 1,000 μg/mL gallic acid를 이용하여 표준검량선을 작성하여 총 폴리페놀 함량을 시료 1 mg중에 ug gallic acid로 equivalent 하였다.
DPPH radical 소거활성
전자공여능 측정은 Blois의 방법(19)을 수정하여 측정하였다. 10, 50, 100, 500 μg/mL 농도의 sample 10 μL에 2×10-4 mM DPPH 용액(dissolved in absolute methanol)을 90 μL 첨가하고 상온에서 30분간 반응한 후 517 nm에서 흡광도를 측정하였다. 전자공여능은 아래의 식과 같이 백분율(%)을 계산한 후 IC50(50% Inhibitor concentration)값은 50% DPPH free radical을 제어시키는 시료농도를 계산하였다.

ABTS radical 소거활성
ABTS radical을 이용한 항산화력 측정은 ABTS+• cation decolourisation assay 방법(20)으로 시행하였다. 7 mM 2,2'-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid)와 2.45 mM potassium persulfate를 혼합하여 4℃인 암소에서 overnight 동안 반응하여 ABTS+•을 형성시킨 후 734 nm에서 흡광도 값이 0.70(±0.02)이 되도록 phosphate buffer saline(PBS, pH 7.4)로 희석하였다. 시료 10 μL에 희석된 용액 90 μL를 첨가하여 정확히 5분 후 734 nm에서 흡광도를 측정하였다. ABTS radical 소거활성은 DPPH scavenging activity 계산방법과 동일하게 백분율(%)로 계산한 후 IC50(Inhibitor concentration 50%)로 표현하였다.
C6 glioma 세포배양
C6 glioma 세포는 10% FBS와 1% antibiotics가 첨가된 DMEM 배지를 사용하여 37℃, 5% CO2 배양기에서 배양하였다. 세포는 culture dish에 80~90% 정도 자랐을 때 계대배양하였고 cell passage number는 20을 넘기지 않은 세포로만 실험하였다.
세포독성 측정
시료의 세포독성을 측정하기 위해 Green 등(43)의 방법에 따라 3-(3,4-dimethyl- thiazolyl-2)-2,5-diphenyl tetrazolium bromide(MTT) assay를 실시하였다. C6 glioma 세포가 1×105 cells/mL의 농도가 되도록 96-well plate에 100 μL씩 분주하고 37℃, 5% CO2 incubator에서 18시간 동안 배양하였다. LPS와 시료처리는 0.5% FBS가 첨가되어 있는 DMEM에 희석하여 24시간 처리하고 0.5 mg/mL의 MTT 용액을 포함하는 배지로 교체하여 incubator에서 4시간 배양하였다. 배양 종료 후 상등액을 제거하고 각 well에 150 μL DMSO를 첨가하여 formazan 결정을 용해시켜 microplate reader(BioTek, Winooski, VT, USA)로 흡광도 540 nm로 측정하였다. 세포독성은 시료 무처리군의 흡광도에 대비하여 백분율로 나타내었다.
Nitric oxide (NO) 생성량 측정
C6 glioma 세포로부터 생성되는 활성 질소종인 nitric oxide(NO)의 양은 Green 등(21)의 방법을 이용하여 세포배양액 중 존재하는 NO2-형태를 Griess Reagent와 반응시켜 측정하였다. C6 glioma cell을 1×105 cells/mL 농도로 96-well plate에 분주한 후 시료를 농도별로 처리하여 24시간 배양하였다. 세포배양 상등액 100 μL와 Griess 시약(A reagent: 1% sulfanilamide, B reagent: 0.1% naphthylethylendiamine in 25% phosphoric acid) 각 50 μL를 혼합하여 96-well plate에서 10분간 반응시킨 후 microplate reader를 이용하여 540 nm에서 흡광도를 측정하였다. NO2- 표준곡선은 NaNO2를 농도별로 조제하여 사용하였다.
통계분석
모든 실험은 3회 반복하였으며, 실험결과를 SPSS 통계프로그램(ver. 12.0, SPSS Inc., USA) 을 이용하여 평균값과 표준편차를 산출하였으며 Duncan's multiple test를 통해 그 유의성(p<0.05)을 확인하였다.
결과 및 고찰
유리당 함량
까마중의 수확 시기와 부위별 유리당 함량을 측정한 결과는 Table 4와 같다. 총 4종의 유리당이 검출되었으며, 부위별 유리당 함량을 살펴보면 fructose 함량은 까마중 열매가 1.85%로 가장 높게 나타났고, 지상부(1.14~1.35%)가 지하부(0.33~0.71%)보다 높게 나타났다. Glucose 함량은 열매가 0.95%로 가장 높게 나타났으며, 지상부(0.60~0.72%)가 지하부(0.02~0.52%)보다 높게 나타났다. Sucrose와 maltose 함량은 전반적으로 fructose와 glucose의 함량에 비하여 낮게 나타났다. 수확시기별 까마중 지상부의 fructose, glucose, maltose의 함량은 7월 10일(A)부터 8월 30일(C)까지는 증가하였으나, 9월 10일 수확한 까마중 지상부(D)에서는 감소하였다. Sucrose는 까마중 지상부와 뿌리에서 8월 10일(B, F)과 8월 30일(C, G)에 수확한 시료들에서만 검출되었다. 까마중의 유리당 구성비를 살펴보면 모든 시료구에서 fructose>glucose>maltose>sucrose 순으로 높은 나타났다. 기존 연구에서 인삼잎의 유리당 함량은 수확시기가 늦어질수록 증가한다고 보고한바 있고(22), 까마중과 같은 전초이용식물인 섬애약쑥에서도 수확시기에 따른 유리당 함량차이는 없다고 보고된바 있으며(23), 유리당은 항산화 활성과 관련성이 있는 것으로 알려져 있다(45). 본 연구결과 유리당은 수확시기가 늦어질수록 감소하는 현상을 보였는데 이는 기존 수확기 연구들에서 사용한 식물들과 까마중 의 생육기간 및 식물학적 특성이 다른데 기인한 것으로 보인다.
Table 4.
Free sugar content in water extract of Solanum nigrum depending on harvest time (%)
|
Sample |
Fructose |
Glucose |
Sucrose |
Maltose |
|
A |
1.24±0.171)
|
0.72±0.16 |
ND2)
|
0.20±0.06 |
|
B |
1.35±0.20 |
0.60±0.09 |
0.19±0.07 |
0.30±0.07 |
|
C |
1.14±0.06 |
0.64±0.09 |
0.34±0.07 |
0.13±0.04 |
|
D |
0.97±0.11 |
0.44±0.04 |
ND |
ND |
|
E |
0.71±0.09 |
0.02±0.01 |
ND |
0.19±0.04 |
|
F |
0.71±0.10 |
0.52±0.11 |
0.03±0.01 |
0.06±0.01 |
|
G |
0.33±0.03 |
0.33±0.04 |
0.13±0.04 |
0.11±0.04 |
|
H |
0.18±0.04 |
0.08±0.03 |
ND |
ND |
Download Excel Table
구성아미노산 함량
까마중의 수확 시기와 부위별 구성아미노산 함량을 측정한 결과는 Table 5와 같다. 부위별 총 구성 아미노산 함량은 시기와 상관없이 상부(1,167.92~1,929.05 mg%)에서 하부(434.00~854.90 mg%)보다 높은 함량을 나타냈다. 시기별로는 8월 10일에 수확한 까마중 지상부에서 1,929.05 mg%로 가장 높은 함량을 나타내었고, 수확 시기가 경과할수록 함량이 점차 낮아졌다. 뿌리의 초기에 수확한 시료구 813.46 mg%에서 중기에 수확한 시료구 854.90 mg%로 약간 증가한 후 점차 감소하는 경향을 나타내었다. 주요 아미노산으로는 proline, histidine 및 serine으로 나타났다. 체내에서 합성할 수 없는 필수아미노산의 함량의 경우도 총 아미노산과 같이 수확 시기가 경과할수록 점차 감소하였다. Proline 은 항균활성, 항바이러스 활성 및 항말라리아 활성을 가지는 아미노산으로 알려져 있으며(24,25), 동물실험에서 근육생성을 촉진하는 효과가 인정된 바 있다(26). Histidine은 필수아미노산의 하나로 대사질환 조절기능이 연구된 바 있으며(27), 어린아이들에게 절대적으로 필요한 아미노산으로 알려져 있다(28). 또한 serine은 중추신경계에서 다양한 조절기능을 하는 중요한 아미노산이다(29). 수확시기에 따른 섬오가피의 아미노산 분석 결과 5월과 7월에 수확할 때 보다 9월에 수확한 아미노산 함량이 높았다는 보고(44), 및 와 같이 아미노산 함량은 식물들의 수확시기의 영향이 큰 것으로 생각된다. 본 연구결과 까마중 지상부와 지하부 모두 생육이 왕성한 7월부터 8월초에 수확했을 때 아미노산 함량이 높음을 확인하였다.
Table 5.
Amino acid contents in Solanum nigrum depending on harvest time (mg%)
|
Amino acids |
A |
B |
C |
D |
E |
F |
G |
H |
|
Aspartic acid |
9.85±2.301)
|
14.32±4.35 |
54.28±8.50 |
48.63±8.30 |
28.10±2.36 |
54.40±6.88 |
46.05±3.28 |
34.31±2.65 |
|
Serine |
137.48±22.65 |
229.61±21.36 |
423.00±36.57 |
327.51±46.32 |
132.04±21.42 |
209.56±26.30 |
44.75±2.50 |
54.74±8.32 |
|
Glutamic acid |
55.75±6.22 |
41.14±9.52 |
94.84±6.30 |
89.38±8.90 |
34.78±12.12 |
107.55±10.62 |
77.64±4.64 |
34.13±1.50 |
|
Glycine |
50.50±6.94 |
50.82±7.38 |
26.36±4.82 |
28.62±5.63 |
9.00±3.55 |
7.87±0.34 |
20.15±1.85 |
3.80±0.08 |
|
Histidine |
180.52±22.64 |
230.56±27.56 |
144.32±12.65 |
132.68±20.64 |
110.14±13.36 |
122.38±10.54 |
13.34±2.00 |
15.94±3.36 |
|
Arginine |
71.88±18.02 |
95.37±18.24 |
35.74±6.71 |
27.39±4.56 |
46.17±6.40 |
34.42±3.62 |
35.84±3.42 |
12.41±1.28 |
|
Threonine |
42.82±5.71 |
54.37±11.16 |
23.17±2.33 |
16.60±1.60 |
25.44±2.22 |
19.75±4.80 |
19.49±2.18 |
7.88±0.50 |
|
Alanine |
103.28±16.66 |
120.79±8.66 |
72.68±10.10 |
43.34±6.80 |
46.56±4.34 |
73.86±6.32 |
74.95±6.02 |
19.37±2.70 |
|
Proline |
170.60±13.20 |
250.35±17.01 |
76.49±13.23 |
52.17±15.36 |
143.87±15.34 |
67.14±7.20 |
30.63±1.64 |
188.38±22.40 |
|
Cystine |
31.92±2.88 |
39.87±4.36 |
20.61±3.66 |
15.82±3.45 |
7.44±1.80 |
8.27±1.04 |
2.19±0.12 |
3.41±0.08 |
|
Tyrosine |
90.40±15.42 |
101.15±7.65 |
36.60±8.54 |
37.65±7.32 |
20.63±2.66 |
7.11±1.46 |
8.92±2.82 |
2.96±0.10 |
|
Valine |
109.34±11.55 |
141.48±33.66 |
90.06±10.50 |
79.21±10.70 |
47.96±3.48 |
32.66±3.05 |
46.21±3.64 |
16.04±3.64 |
|
Methionine |
35.52±4.85 |
38.69±5.90 |
20.31±2.42 |
20.40±4.88 |
8.84±1.40 |
6.50±0.22 |
6.95±1.42 |
2.05±0.08 |
|
Lysine |
70.29±12.74 |
95.46±12.12 |
33.41±7.02 |
16.34±0.94 |
32.69±3.86 |
23.35±3.10 |
27.62±2.94 |
7.84±1.54 |
|
Isoleucine |
76.36±7.68 |
92.20±14.30 |
61.16±8.08 |
58.72±6.38 |
34.65±3.30 |
23.34±4.68 |
31.82±2.54 |
9.68±0.76 |
|
Leucine |
136.23±8.65 |
157.49±15.80 |
89.37±16.30 |
70.63±9.42 |
52.96±4.05 |
38.31±2.10 |
48.76±6.12 |
13.59±1.30 |
|
Phenylalanine |
138.76±17.20 |
175.39±26.61 |
109.03±18.54 |
102.83±8.54 |
32.19±5.08 |
18.43±4.28 |
29.40±3.44 |
7.47±0.65 |
|
TAA2)
|
1,511.49 |
1,929.05 |
1,411.42 |
1,065.09 |
813.46 |
854.90 |
562.51 |
434.00 |
|
EAA3)
|
789.83 |
985.64 |
570.82 |
497.41 |
344.87 |
284.73 |
223.58 |
80.50 |
|
EAA/TAA (%) |
52.26 |
51.09 |
40.44 |
42.59 |
42.40 |
33.31 |
39.75 |
18.55 |
Download Excel Table
총 polyphenol 함량측정
각 시료의 총 polyphenol 함량을 측정한 결과, 다음의 Table 6과 같은 결과가 나왔다. 8월 30일에 채취한 까마중 뿌리 ethanol 추출물의 총 polyphenol 함량은 401.22±15.41 μg/mg으로 가장 높게 나타났고, 9월 10일에 채취한 까마중 지상부 ethanol 추출물(367.53±18.33 μg/mg), 7월 10일 채취한 까마중 뿌리 ethanol 추출물(45.93±19.69 μg/mg), 8월 10일 채취한 까마중 지상부 ethanol 추출물(310.99±15.63 μg/mg), 8월 30일 수확한 까마중 뿌리 ethanol 추출물(289.25±17.62 μg/mg), 9월 10일 채취한 까마중 뿌리 ethanol 추출물(275.72±12.87 μg/mg) 순으로 높은 총 polyphenol 함량이 나타났다. 폴리페놀성 화합물은 식물계에 널리 분포되어 있는 2차 대사산물 중 하나로 항산화 활성, 항암 및 항균 작용을 하는 생리활성물질로 알려져 있다(30). 까마중에 함유된 폴리페놀 화합물들은 gallic acid, chlorogenic acid, catechin류, quercein을 비롯하여 다수의 성분들이 포함된 것으로 보고된 바 있다(31).
Table 6.
Total polyphenol content in ethanol extract of Solanum nigrum based on harvest time
|
Samples |
Content (μg GA/mg extract) |
|
A1)
|
262.90±10.312)
|
|
B |
310.99±15.63 |
|
C |
289.25±17.62 |
|
D |
275.72±12.87 |
|
E |
345.93±19.69 |
|
F |
240.50±15.41 |
|
G |
401.22±16.81 |
|
H |
367.53±18.33 |
Download Excel Table
본연구결과 8월 30일에 채취한 까마중 뿌리, 9월 10일에 채취한 지상부, 7월 10일에 채취한 뿌리 및 8월 10일에 채취한 지하부(소)는 Jimoh 등(32)이 보고한 까마중 잎추출물의 total polyphenol 함량보다 높으며, polyphenol 성분 중 하나인 tannin이 다량함유된 율피의 80% 메탄올 추출물(138.62 mg, GAE/g)보다 높은 것으로 확인되었다(33).
DPPH radical 소거능
각 시료의 DPPH radical의 소거능을 확인한 결과는 Table 7과 같다. 수확시기에 따른 까마중 ethanol 추출물들의 DPPH radical 소거활성은 지상부와 뿌리 모두 8월 30일에 채취한 시험구들(C, G)에서 활성이 높게 나타났다. 부위별로는 뿌리 ethanol 추출물들(E-H)이 지상부 ethanol 추출물들(A-D)에 비하여 동일한 수확시기에 낮은 IC50값을 나타내어, 뿌리 ethanol 추출물들(E-H)의 항산화 효과가 높음을 확인하였다. 시료별로는 8월 30일에 채취한 뿌리의 ethanol 추출물(G)이 137.90±3.17의 가장 낮은 IC50값을 나타내었으며, 9월 10일 수확한 까마중 뿌리 ethanol 추출물(H), 8월 30일에 채취한 까마중 지상부 ethanol 추출물(C), 8월 10일 수확한 까마중 뿌리 ethanol 추출물(F), 9월 10일 수확한 까마중 지상부 ethanol 추출물(D) 및 8월 10일 수확한 까마중 지상부 ethanol 추출물(B) 순으로 낮은 IC50값이 나타났다. 일반적으로 항산화 효과는 flavonoid 등 phenol화합물이 풍부한 식물체의 지상부위에서 활성이 높은 것으로 기대되나(34), 식물의 종류에 따라 뿌리부위의 항산화 활성이 지상부 보다 높게 나타난 연구결과들도 다수 소개된 바 있다(35). 까마중 부위별 메탄올 추출물의 항산화효과 연구에서 뿌리에서 62.65 μg/mL, 줄기에서 119.58 μg/mL, 잎에서 187.62 μg/mL의 IC50값이 나타났다연는 보고(36)와 비교하여 본 연구에 사용한 까마중 ethanol 추출물들의 IC50값이 높았으나 부위별 항산화 활성 순서는 유사하였다(36). 따라서 항산화 효과가 가장 높은 까마중의 수확기는 8월 30일이었으며, 항산화효과가 뛰어난 부위는 뿌리로 판단하였다.
ABTS radical 소거능
각 시료의 ABTS 라디칼의 소거능을 확인한 결과는 아래 Table 7과 같다. 수확시기에 따른 까마중 ethanol 추출물들의 ABTS radical 소거능은 8월 30일에 채취한 까마중 뿌리 ethanol 추출물(G)에서 가장 낮은 IC50값(48.10±1.19)을 나타내었으며, 9월 10일 수확한 까마중 지상부 ethanol 추출물(D), 7월 10일 수확한 까마중 지상부 ethanol 추출물(D), 7월 10일 수확한 까마중 뿌리 ethanol 추출물(E), 9월 10일 수확한 까마중 뿌리 ethanol 추출물(H) 순으로 낮은 IC50값을 보였다. 대조구인 ascorbic acid는 1.21±0.12 μg/mL의 IC50값을 나타냈으며, BHT는 1.08±0.09 μg/mL의 IC50값을 보였다. 본 연구결과 8월 30일 수확한 까마중 뿌리 ethanol 추출물에서 가장 높은 ABTS radical 소거능이 나타나, 까마중 잎에서 가장 높은 항산화 활성이 나타났다는 기존 연구결과(37)와 약간의 차이를 나타내었다. 이는 본 연구에서도 확인된 바와 같이 시료를 채취하는 시기에 따라 항산화 효과가 부위별로 차이를 나타내는 것이 원인으로 생각된다.
Table 7.
DPPH radical-scavenging activity and ABTS radicalscavenging activity of ethanol extract of Solanum nigrum depending on harvest time
|
Samples |
DPPH radical |
ABTS radical |
|
scavenging activity (IC50, μg/mL) |
|
Ascorbic acid |
5.27±0.471)
|
1.21±0.12 |
|
BHT |
14.82±1.03 |
1.08±0.09 |
|
A |
184.89±2.49c2)
|
76.48±2.16c
|
|
B |
167.10±4.12b
|
97.67±3.43d
|
|
C |
159.62±3.14b
|
106.62±4.50e
|
|
D |
164.90±4.57b
|
67.48±3.07b
|
|
E |
179.87±5.82c
|
81.14±2.57c
|
|
F |
164.68±4.33b
|
92.86±2.33d
|
|
G |
137.90±3.17a
|
48.10±1.19a
|
|
H |
145.84±3.43ab
|
84.14±3.82c
|
Download Excel Table
세포독성 및 C6 glioma 세포의 염증억제 효능
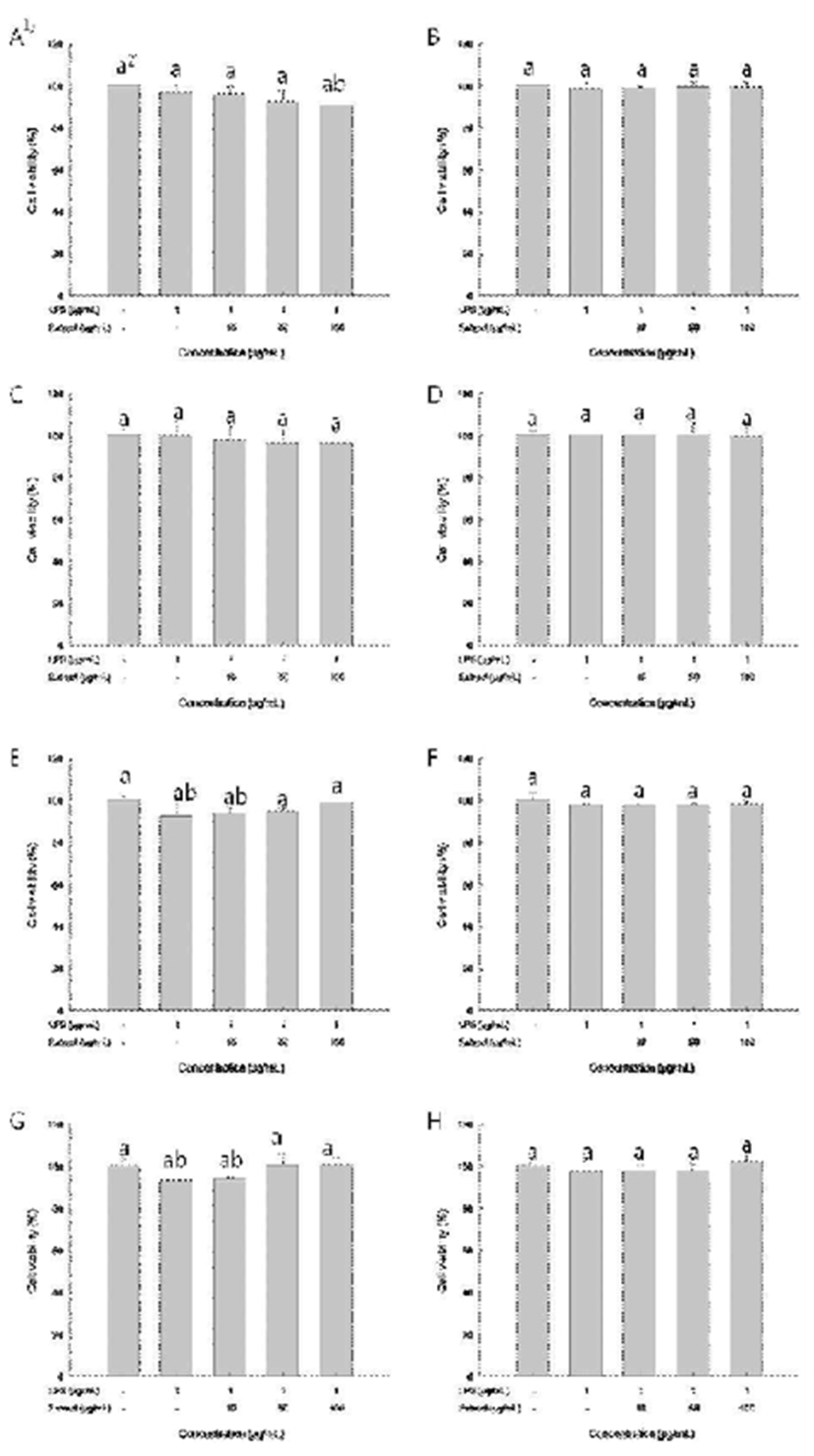
흰쥐의 신경교세포주인 C6 glioma는 산화적 스트레스에 대한 세포보호효과 및 염증을 유발하는 lipopolysaccharide (LPS)나 sodium nitroprusside(SNP) 등에 방어 기작 연구에 사용되는 세포주이다(38,39). 항염증 활성평가에 앞서 수행한 세포독성 평가에서 까마중 수확시기와 부위에 따른 ethanol 추출물들을 10, 50, 100 μg/mL의 농도로 처리한 시험구들에서 까마중 수확시기 및 부위별 ethanol 추출물100 μg/mL의 농도에서도 C6 glioma cell의 세포생존율이 90%이상을 나타내어, 세포독성은 없는 것으로 확인하였다 (Fig. 1).
Fig. 1.
The effect of Solanum nigrum ethanol extracts on the cell viability of C6 glioma cells.
1)A, Ethanol extract from S. nigrum aerial part harbested on Jul. 10th; B, Ethanol extract from S. nigrum aerial part harbested on Aug. 10th; C, Ethanol extract from S. nigrum aerial part harbested on Aug. 30th; D, Ethanol extract from S. nigrum aerial part harbested on Sep. 10th; E, Ethanol extract from S. nigrum root harbested on Jul. 10th; F, Ethanol extract from S. nigrum root harbested on Aug. 10th; G, Ethanol extract from S. nigrum root harbested on Aug. 30th; H, Ethanol extract from S. nigrum root harbested on Sep. 10th.
2)Mean with different superscripts (a,b) are significantly different at p<0.05 by Duncan's multiple range test.
Download Original Figure
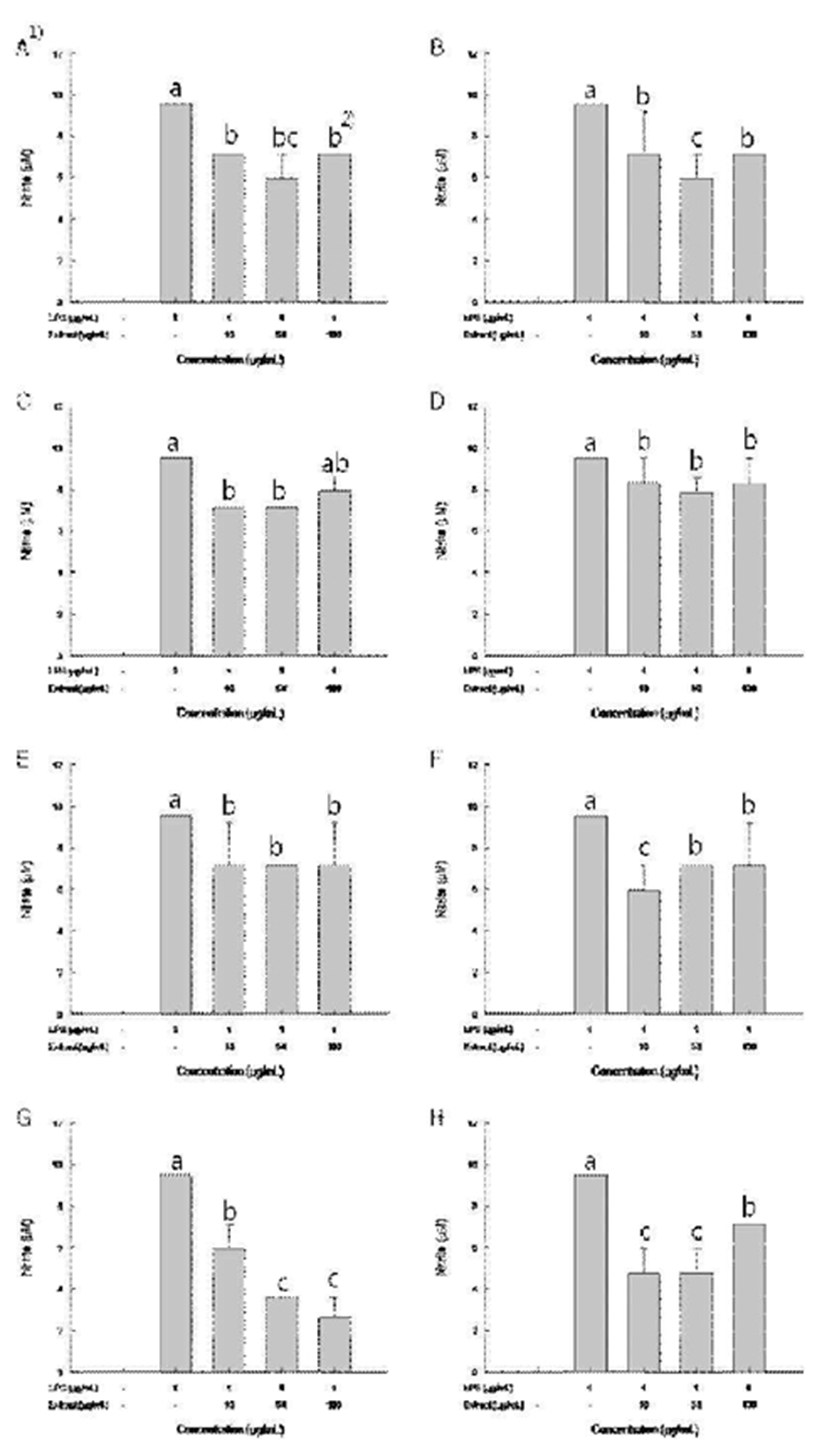
C6 glioma cell에 1 μg/mL LPS를 처리하여 NO의 함량이 9.52 μM로 증가됨을 확인하였으며, 7월 10일에 채취한 까마중 지상부 ethanol 추출물을 10, 50, 100 μg/mL의 농도로 LPS와 동시 처리한 배지에서 NO의 함량을 측정한 결과 7.1, 5.9, 7.1 μM로 나타났다(Fig. 2A). 8월 10일에 채취한 까마중 지상부 ethanol 추출물을 처리한 결과는 7.1, 5.9, 7.1 μM의 NO 함량을 보였으며(Fig. 2B), 8월 30일에 채취한 까마중 지상부 ethanol 추출물을 처리군의 NO 함량은 8.3, 7.9, 8.3 μM로 약간 감소하였다(Fig. 2C). 그리고 9월 10일에 채취한 까마중 지상부 ethanol 추출물의 처리군에서 NO 함량은 7.1, 7.1, 7.9 μM로 나타났다(Fig. 2D).
또한, 뿌리 부위 추출물의 경우 7월 10일 채취한 시료에서 NO 함량은 7.1, 7.1, 7.1 μM로 시료의 농도 변화에 비의존적으로 일정한 NO의 함량이 측정되었으며(Fig. 2E), 8월 10일에 채취한 까마중 뿌리 추출물을 10, 50, 100 μg/mL로 처리한 군의 NO 함량은 5.9, 7.1, 7.1 μM로 약간 감소하였다(Fig. 2F). 8월 30일에 채취한 까마중 뿌리 추출물을 처리한 군의 NO 함량은 5.9, 3.6, 2.4 μM로 확인되었으며, 이는 추출물의 농도에 의존적으로 NO 함량이 감소되는 것을 보였다(Fig. 2G). 마지막으로 9월 10일에 채취한 까마중 뿌리 추출물의 NO 함량을 4.8, 4.8, 7.1 μM로 약간 감소되었지만 시료 농도와는 무관하였다(Fig. 2H).
Fig. 2.
Anti-inflammation effect of Solanum nigrum ethanol extract LPS-induced on C6 glioma cells.
1)A, Ethanol extract from S. nigrum aerial part harbested on Jul. 10th; B, Ethanol extract from S. nigrum aerial part harbested on Aug. 10th; C, Ethanol extract from S. nigrum aerial part harbested on Aug. 30th; D, Ethanol extract from S. nigrum aerial part harbested on Sep. 10th; E, Ethanol extract from S. nigrum root harbested on Jul. 10th; F, Ethanol extract from S. nigrum root harbested on Aug. 10th; G, Ethanol extract from S. nigrum root harbested on Aug. 30th; H, Ethanol extract from S. nigrum root harbested on Sep. 10th.
2)Mean with different superscripts (a,b) are significantly different at p<0.05 by Duncan's multiple range test.
Download Original Figure
전초이용식물인 Glossogyne tenuifolia 추출물들의 면역효과 실험결과 뿌리부위가 지상부보다 높은 활성을 나타내었다는 보고(40)와 같이 까마중 뿌리 ethanol 추출물의 항염증 활성이 우수함을 확인하였다. 부위별 운향과 식물인 Ruta graveolens의 항염증과 항산화효과를 검정한 실험에서도 항산화 효과와 항염증 효과는 양적인 상관관계를 가진다는 보고가 있어(41), 본 실험의 폴리페놀 함량, 항산화효과, 항염증 활성간의 연관성과 유사하였다. 위 결과를 종합해 볼 때, 8월 30일에 채취한 까마중 뿌리 추출물이 항염증 효능이 가장 높게 측정되었으며, 시료의 농도에 의존적으로 NO의 함량이 낮아짐을 확인할 수 있었다. 다른 추출물들도 NO의 함량이 약간씩은 감소하였으나, 유효성은 보이지 않았다.
요 약
본 연구는 까마중 수확시기에 따른 성분변화, 항산화효과 및 항염증 효과를 분석하여 최적 수확시기를 구명하고자 수행하였다. 까마중의 주요 아미노산은 수확시기에 관계없이 proline, histidine 과 serine으로 나타났으며, 구성아미노산 함량은 7월 10일과 8월 10일 수확한 까마중 지상부와 지하부에서 높게 나타났다. 4가지 유리당이 검출되었으며, 유리당 함량은 수확시기에 따라 편차를 나타내었다. 유리당 중 fructose는 수확시기가 늦어짐에 따라 감소하였으며, 총 폴리페놀 함량은 8월 30일 수확한 까마중 뿌리에서 가장 높게 나타났다.
수확기별 까마중 ethanol 추출물들의 항산화효과와 항염증효과 검정을 위하여 DPPH radical scavenging assay와 ABTS radical scavenging assay를 수행하였으며, 항염증 효과 측정을 위하여 lipopolysaccharide(LPS)로 염증을 유발시킨 C6 glioma cells을 NO 저해실험에 사용하였다. 항산화효과와 항염증 효과는 8월 30일 수확한 까마중 뿌리 ethanol 추출물에서 가장 높은 활성을 나타내었다. 8월 30일 수확한 까마중 뿌리는 총 폴리페놀 함량, 항산화 효과 및 항염증효과간의 양적인 상관관계를 나타내었다.
감사의 글
이 논문은 2015년 순천대학교 학술연구비 공모과제로 연구된 결과의 일부임.
References
Euk CS. 1997; Flora of medicinal herbs..Kyeongwon Publishing CoSeoul, Korea p. 80


Lee YN. 1997; Korean Flora. .Kyohak. Publishing CoSeoul, Korea p. 700


Yun KY, Kim MY. 2010; Flora of Korean medicinal plant..Shinkwang Publishing CoSeoul, Korea p. 332-333


Huh J. 2007; Dong-eu-bo-gam.Bubin Publishing CoSeoul, Korea p. 1945


Choi SK, Seo KS. 2012; Studys on growth charcateristics and yield of Solanum nigrum L.. Korean J Plant Res. 25 p. 596-602


Oh SJ, Koh SC. 2012; Adventitious shoot formation and plant regeneration from explants of Solanum nigrum L... Korean J Plant Res. 25 p. 227-284


Edmonds JM, Chweya JA. 1997; Black nightshades, Solanum nigrum L. and related species..International Plant Genetic Resources InstituteRome, Italy p. 28


Atanu FO, Ebiloma UG, Ajayi EI. 2011; A review of the pharmacological aspects of Solanum nigrum Linn... Biotechnol Mol Biol Rev. 6 p. 1-7


Joo SY. 2013; Antioxidant activities of medicinal plant extracts.. J Korean Soc Food Sci Nutr. 42 p. 512-519


Ahn BS, Kim JW, Kim HT, Lee SD, Lee KW. 2010; Antioxidant effects of Hovenia Dulcis in the streptozotocininduced diabetic rats.. J Vet Clin. 27 p. 366-373


Oh SI, Lee MS. 2005; Antioxidative and antimutagenic effects of Ganoderma lucidum Krast extracts.. Korean J Food Nutr. 18 p. 54-62


Kim MJ, Chu WM, Park EJ. 2012; Antioxdant and antigenotoxic effects of Shiitake mushrooms affected by different drying methods.. J Korean Soc Food Sci Nutr. 41 p. 1041-1048


Choi Y, Lee SM, Chun J, Lee HB, Lee J. 2006; Influence of heat treatment on the antioxidant activities and polyphenolic compounds of Shiitake (Lentinus edodes) mushroom.. Food Chem. 99 p. 381-387


Cheung LM, Cheung CK. 2005; Mushroom extracts with antioxidant activity against lipid peroxidation.. Food Chem. 89 p. 403-409


Wilson AM, Work TM, Bushway AA, Bushway RJ. 1981; HPLC determination of fructose, glucose and sucrose in potatoes.. J Food Sci. 46 p. 300-301


Strydom D, Cohen SA. 1993; Sensitive analysis of cystine/cysteine using 6-aminoquinolyl-N -hydroxysuccinimidyl carbamate (AQC) derivatives.. Tech Protein Chem. 4 p. 299-306


Velioglu YS, Mazza G, Gao L, Oomah BD. 1998; Antioxidant activity and total phenolics in selected fruits, vegetables, and grain products.. J Agric Food Chem. 46 p. 4113-4117


Blois MS. 1958; Antioxidant determinations by the use of a stable free radical.. Nature. 181 p. 1199-1200


Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C. 1999; Antioxidant activity applying an improved ABTS radical cation decolorization assay.. Free Radical Biol Med. 26 p. 1231-1237


Green LC, Wagner DA, Glogowski J, Skipper PL, Wishnok JS, Tannenbaum SR. 1982; Analysis of nitrate, nitrite, and [15N]nitrate in biological fluids.. Anal Biochem. 126 p. 131-138


Chang HK. 2000; Changes in chemical compositon of Panax ginseng leaves by different harvesting months.. Korean J Food Nutr. 13 p. 6-12


Choi MH, Kang JR, Sim HJ, Kang MJ, Seo WT, Bae WY, Sin JH. 2015; Physicochemical characteristics and antioxidant activity of Sumaeyaksuk depending on harvest times and processing methods.. Korean J Food Preserv. 22 p. 399-407


Ji Y, Wu Z, Dai Z, Sun K, Wang J, Wu G. 2016; Nutritional epigenetics with a focus on amino acids: implications for the development and treatment of metabolic syndrome.. J nutrition biochem. 27 p. 1-8


Semba RD, Shardell M, Sakr A, Moaddel R, Trehan I, Maleta KM, Ordiz MI, Kraemer K, Khadeer MA, Ferrucci L, Manary MJ. 2016; Child stunting is associated with low circulating essential amino acids.. EBioMedicine. 6 p. 246-252


Montesinos Guevara C, Mani AR. 2016; The role of D-serine in phripheral tissues.. Eur J Pharmacol. 780 p. 216-223


Ferreres F, Gomes D, Valentano P, Goncalves R, Pio R, Chagas EA, Seabra RM, Andrade PB. 2009; Improved loquat (Eriobotrya japonica Lindl.) cultivars: variation of phenolics and antioxidantive potential.. Food Chem. 114 p. 1109-1027


Jeong HR, Kim JH, Jo YN, Jeong JH, Heo HJ. 2011; Characterization as cosmetic substances of chestnut inner skin extracts with antioxidant activity.. J Agri Life Sci. 45 p. 183-191


Lee JH, Jhoo JW. 2012; Antioxidant activity of different parts of Lespedeza bicolor and isolation of antioxidant compound.. Korean J Food Sci Technol. 44 p. 763-771


Lim JK, Chung GY, Jeong HJ. 2001; Evaluation of the antioxidant potential and identification of active principles of Solanum nigrum L. on antioxidant defense systems.. Korean J Life Sci. 11 p. 509-516


Jeong KS, Lee NG. 2009; Functional properties and antioxidant effects of Solanum nigrum-ethanol extract.. J Environl Sci. 18 p. 1207-1214


Jo JJ, Shin MG, Kim ES, Lee YS, Shin YJ, Jeon SY. 2014; Cytoprotective effects of Platycodon grandiflorus (Jacq.) A.DC on C6 glioma cell apoptosis by oxidative stress.. Korean J Oriental Physiology Pathology. 28 p. 396-402


Tsai YD, Hsu HF, Chen ZH, Wang YT, Huang SH, Chen HJ, Wang CP, Wang SW, Chang CC, Houng JY. 2014; Antioxidant, anti-inflammatory, and anti-proliferative activities of extracts from different parts of farmed and wild Glossogyne tenuifolia.. Ind Crop Prod. 57 p. 98-105


Oh JS. 2012; Seed germination and plant growth characteristics of Solanum nigrum Linne influenced by seed soaking and chilling treatments. MS Thesis. Sunchon National University, Korea p. 17-20


Jwa CS, Yang YT, Koh JS. 2000; Changes in free sugars, organic acids, free amino acids and minerals by harvest time and parts of Acanthopanax koreanum.. J Korean Soc Agric Chem Biotechnol. 43 p. 106-109