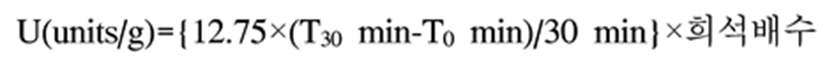Article
탁주용 곰팡이 고체종국 제조 및 품질 특성
백창호, 백성열, 문지영, 최한석, 강지은, 정석태, 여수환*
Quality characteristics and preparing of solid starter using fungal strains for Takju
Chang-Ho Baek, Seong Yeol Baek, Ji-Young Mun, Han-Seok Choi, Ji-Eun Kang, Seok-Tae Jung, Soo-Hwan Yeo*
농촌진흥청 국립농업과학원 농식품자원부 발효식품과
Fermented Food Science Division, Department of Agro-food Resource, NAAS, RDA, Wanju 55365, Korea
*Corresponding author. E-mail:yeobio@korea.krPhone:82-63-238-3610, Fax:82-63-238-3843
Korean Journal of Food Preservation. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Sep 23, 2016; Revised: Nov 22, 2016; Accepted: Nov 25, 2016
Abstract
In this study, we investigated the effect of fermentation conditions on the amylolytic and proteolytic activities of Aspergillus luchuensis strain 74-5 and Aspergillus oryzae strain 75-2, which are used in the preparation of the starter culture, for Takju (Korean traditional rice wine). The starter culture was optimized using different conditions, such as inoculum size, inoculation temperature, and incubation time. The enzyme activities under each condition were measured. In the A. luchuensis strain 74-5 starter culture, the α-amylase and glucoamylase activities increased, however the activity of acidic protease decreased as the diluent to starter culture ratio increased. In the A. oryzae 75-2 starter culture, all enzyme activities were maintained at a higher level even at 5% inoculation ratio. Higher enzyme activities were observed in the middle range of inoculation temperature (35, 40℃), than in the lower range (20, 30℃). Enzyme activity in the starter culture varied with incubation time, however it was the highest at 144 and 120 hr, respectively, for A. luchuensis strain 74-5 and A. oryzae strain 75-2. The spore count of the starter culture was approximately 2×107 during fermentation, out of which contamination by aerobic bacteria was about 3×103. The results suggested that the starter culture of each strain could be used as an inoculum for fermentation. However, we needs to conduct further research for the selection of suitable diluting agents as well as drying methods to reduce the contamination by aerobic bacteria, while retaining the enzyme activity.
Keywords: solid; starter culture; enzyme activity; Takju; fermentation
서 론
우리나라의 전통주는 고려시대를 거쳐 조선시대에 다양한 양조법이 정착되어 탁·약주 및 소주 등 다양한 형태의 가양주로 발전하여 현재까지 전해져 왔으며(1), 일반적으로 자연계의 미생물(곰팡이, 효모 및 유산균 등)을 이용한 전통누룩으로 곡물의 전분을 당화시킨 후, 알코올을 생성하는 병행복발효 방식으로 술을 빚었다(2,3).
누룩은 제조방법에 따라 자연계 미생물을 이용한 전통누룩과 살균한 전분질 원료에 순수 배양한 곰팡이를 접종하여 만든 개량누룩이 알려져 있으며(4,5,6), 전통누룩은 지역별, 원료별로 다양하며 이들 누룩으로 빚은 탁주는 독특한 맛과 풍미를 가진 것이 특징이다(7,8).
전통누룩은 제조시기에 따라 당화력 차이로 술을 빚을 때 마다 주질이 균일하지 않아 고급화 및 표준화에 어려움이 있어(9,10,11), 이에 일부 양조장에서는 전통누룩을 대신하여 단일균으로 만든 개량누룩으로 탁·약주를 생산하고 있다(12). 개량누룩은 전통누룩으로 빚은 발효주에 비해 신맛과 시큼한 냄새만 강할 뿐, 특유의 향과 맛을 가진 고품질의 발효주를 빚지 못하는 것으로 평가되고 있다(13,14).
전통누룩에 분포하는 다양한 Aspergillus속 균주는 식품 산업뿐만 아니라 의약품의 소재로써 폭넓게 이용되고 있으며, 이들 균주는 산업적으로 유용한 전분가수분해효소를 많이 분비하는 것으로 보고되어져 있다(15,16,17,18).
우리나라는 선진국보다 생물자원과 종균개발에 대한 연구와 인프라 투자가 부족하여 외국산 종균을 수입하여 발효식품을 제조하고 있어 많은 비용을 로열티로 지불하고 있는 실정이며(19), 나고야의정서 체결에 따라 선진국의 발효종균 시장의 규모가 급격히 증가하고 있는 추세이다(20).
따라서, 수입종균을 대체하기 위해, 국내산 토착 발효종균 발굴과 자원화와 더불어 종균제조기술 개발이 무엇보다도 절실히 필요하다(21). 국내산 전통누룩의 미생물학적 연구는 1906년 Uyeno(22)에 의한 사상균 연구가 시작되었고 유 등(23)은 1906년부터 1945년까지 사상균 12속 59종을, 1945년 이후에는 사상균 12속 38종을 추가적으로 보고하였다(24). 1990년대 중반 이후, 미생물의 분류 및 동정기술 발달로 세분화된 종들이 추가적으로 보고되었다(9,25,26,27).
국내 탁주 및 막걸리 제조에 널리 사용되는 수입산 A. kawachii 균주의 유전자 재분석을 통해A. luchuensis로 종명이 바뀐 것이 최근의 연구 결과이다(28). 위와 같이 누룩과 관련하여 많은 연구가 보고 되었음에도 불구하고 종균제조의 실용화가 이루어지지 못한 것은 시설, 장비 및 유지 등의 초기 인프라 투입 비용이 많고 우수한 특성을 가진 종균을 안정적으로 유지, 공급하는 기술 개발을 해결하지 못한 관계로 한국형 토착 발효종균으로 발전시키지 못하고 외국산 종균을 수입하여 사용하고 있는 실정이다(19).
따라서 본 연구에서는 전분 및 단백질 분해력이 우수한 A. luchuensis 74-5 및A. oryzae 75-2 종균을 사용하여 탁주용 고체종국 제조조건과 이들의 품질특성을 규명하여 한국형 토착 발효종균으로서의 가능성을 비교·검토하였다.
재료 및 방법
재료 및 사용균주
본 연구에 사용한 쌀은 경기도 여주에서 생산된 경기미(추청미, 2013년)를, 사상균은 전국에서 수집한 전통누룩으로부터 분리하여 농촌진흥청 발효식품과에서 보관한 Aspergillus luchuensis 74-5(KACC93235P)와 Aspergillus oryzae 75-2(KACC93236P) 종균을 Malto extract agar(MEA) (Beton, Dickinson and company(BD), Sparks, MD, USA) 배지에 계대배양한 후, 4℃에 보관하면서 사용하였다.
액체종국 제조
탁주제조에 적합한 고체종국은 Malto extract broth(ME)배지에 2종류의 서로 다른 양조용 곰팡이(A. luchuensis 74-5, A. oryzae 75-2)를 각각 접종하여 3일간 배양(30℃, 120 rpm)한 전 배양액 5%를 본 배양배지에 접종하여 4일간 배양(30℃, 120 rpm)하고 여과한 것을 액체종국으로 사용하였다.
고체종국 제조
2 종류 곰팡이를 이용한 고체종국 제조는 잡균 오염 등을 방지하기 위해서 소형 제국기(Mini-15, Yaegaki Food Co.,Hyogo, Japan)를 사용하였다. 먼저 쌀을 씻어 3시간 동안 침지한 후, 1시간 물 빼기를 하고, 110℃에서 40분간 증자한 후, 40℃가 되도록 고두밥을 냉각시켰다. 각각의 액체종국을 접종하고 40℃에서 제국하여 12시간 후에 1차 뒤집기를 하고, 배양 48시간째 뒤섞기를 하여 12시간 간격으로 확인하면서 곰팡이 포자를 충분히 형성한 후, 제국 120시간에 출국하여 45℃에서 24시간 건조하였다. 이때 액체종국은 쌀 중량(dry base)에 대하여 2, 5, 10% (v/w) 농도별로 접종하여 고체종국을 제조한 후, 이들의 품질 특성을 비교하였다. 또한 고두밥에 최적화된 5% 액체종국을 접종하여 온도별(20, 30, 35, 40℃)로 발효시켜 4종류의 고체종국을 제조하였다.
pH, 적정산도 및 아미노산도 측정
pH는 제조된 고체종국 20 g에 증류수 100 mL를 가하고 실온에서 3시간 침출한 그 여액을 측정하였으며, 적정산도는 시료 10 mL에 phenolphthalein 지시약(1%) 2~3방울 떨어뜨린 후, 0.1 N NaOH로 중화적정하고 소비된 용액의 양을 산도로 표시하였다(25). 아미노산도는 여과지로 여과한 검체 10 mL를 100 mL 삼각 플라스크에 넣고 0.1 N NaOH로 중화시킨 후, 중성 포르말린 용액 5 mL를 넣어 혼합하고 여기에 0.1 N NaOH용액으로 적정하여 pH 8.3이 될 때까지 소요된 0.1 N NaOH의 mL로 표시하였다(29).
포자수 측정
제조된 각각의 고체종국 1 g을 Tween 80 용액(5%) 10 mL에 현탁하고 methylene blue용액(1%) 2~3방울을 가하여 묽게 희석 한 후, Hemocytometer에 떨어뜨려 현미경(Axio Imager A2, Carl Zeiss Microimaging GmbH, Gottingen, Germany)으로 검경하였다(30).
효소활성 분석
효소활성 분석은 일본 국세청 소정분석법(30)에 따라 분석하였으며, α-amylase 활성은 검체 10 g에 NaCl용액 50 mL를 넣고 실온에서 3시간 진탕·추출한 후, 여과액을 희석하여 조효소액을 제조하였다. 전분용액(1%) 2 mL를 시험관에 취해, 40℃에서 5분간 예열한 후, 효소액 0.1 mL를 넣고, 반응액 중에서 0.1 mL를 1분 간격으로 iodine 용액 10 mL를 넣어둔 시험관에 넣어 혼합하였다. 생성된 색을 25℃에서 유지하다가 10 mm 비색관을 사용하여 670 nm에서 색을 비교하고 투과율 T%를 측정하였다. 효소활성은 Wohlgemuth value에 준한 다음 식으로 산출하였다.
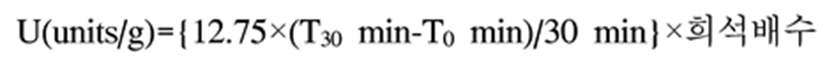
T30 min : 30분간 효소반응을 시킨 후의 투과도
T0 min : 효소반응을 시키기 전의 투과도
Glucoamylase 활성은 40℃에서 20분간 반응시킨 효소-기질 반응액에 1 mL를 사용하여 Somogi-Nelson법(32)으로 반응액 내에 생성된 포도당량을 측정하였으며, 다음 식에 준하여 효소 활성도를 산출하였다.

Acidic protease 활성은 Anson 개량법(33)에 준하여 측정하였다. pH 3.0으로 조정한 0.6% casein 용액을 기질로 하고, 조효소액으로 40℃에서 20분간 효소반응을 시킨 후, 생성된 Folin 발색성 비단백성 물질의 양을 Folin 비색법으로 측정하였다. 효소활성 단위는 37℃에서 효소액 1 mL가 1분에 1 μg의 tyrosine을 유리시키는 것을 1 unit로 하였다.
위해 미생물의 오염유무
시료 10 g을 취하여 멸균 백에 넣고 90 mL의 멸균 생리식염수를 가한 다음 균질기로 현탁하고 멸균 생리식염수로 단계별로 희석한 후, PCA배지에 도말하여 나타난 균체수를 CFU/g로 표시하였다(34).
결과 및 고찰
액체종국 접종량에 따른 고체종국의 이화학적 특성
양조용 곰팡이 Aspergillus luchuensis 74-5와 A. oryzae 75-2로 제조한 탁주용 고체종국의 품질 특성을 Table 1에 나타내었다. 누룩 현탁액의 pH를 조사한 결과, A. luchuensis 74-5는 각각 3.85, 3.84, 3.82로, A. oryzae 75-2는 각각 5.64, 5.75, 5.78 인 것으로 보아 각각의 곰팡이 종균으로 제조한 액체종국(액국) 접종량에 따른 pH 변화는 없는 것으로 보인다. A. luchuensis 74-5를 10% 접종한 고체종국의 적정산도는 8.86 mL로 가장 높게 나타났고 A. oryzae 75-2를 10% 접종한 고체종국은 2.12 mL로 가장 낮게 나타났다. 또한, 아미노산도는 액국 5% 접종한A. luchuensis 74-5 종국에서 2.7로, A. oryzae 75-2의 1.38보다 2배 더 높이 나타난 것으로 보아 A. luchuensis 74-5 균주로 술을 빚으면 아미노산이 풍부한 탁주를 제조할 수 있을 것으로 판단되며 액국의 아미노산도가 3.0 이하로 주류 제조시 느끼한 맛은 없을 것으로 보고한 최 등(35)의 내용과 유사한 결과를 보였다.
Table 1.
Properties of solid starter on inoculating concentration of liquid starter
|
Strain |
Inoculating rate of liquid starter (%) |
pH |
Titratable acidity (0.1 N NaOH mL/10 mL) |
Amino acidity (0.1 N NaOH mL/10 mL) |
|
A. luchuensis 74-5 |
2 |
3.85±0.091)
|
8.54±0.42 |
2.66±0.21 |
|
5 |
3.84±0.11 |
8.68±0.33 |
2.73±0.39 |
|
10 |
3.82±0.09 |
8.86±0.37 |
2.83±0.32 |
|
A. oryzae 75-2 |
2 |
5.64±0.11 |
2.12±0.22 |
1.15±0.24 |
|
5 |
5.75±0.12 |
2.14±0.32 |
1.38±0.51 |
|
10 |
5.78±0.14 |
2.21±0.15 |
1.34±0.42 |
Download Excel Table
액체종국에 따른 효소활성 변화
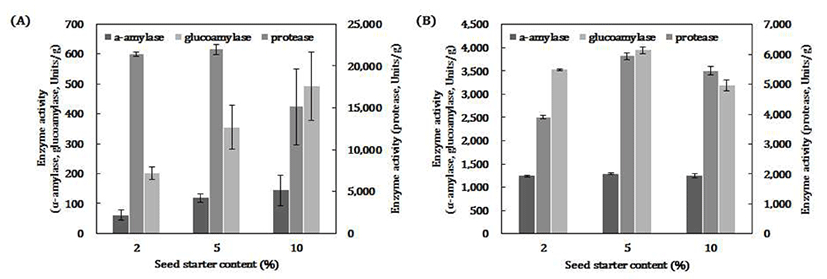
액국 접종량(2, 5, 10%)에 따라 제조한 2종류 고체종국의 효소활성을 분석한결과, 각각의 효소(α-amylase, glucoamylase, acidic protease) 활성은 곰팡이 종류에 따라 다른 양상을 나타내었다(Fig. 1). 백국균인A. luchuensis 74-5를 액국 5% 이하로 접종하였을 때, acidic protease 활성이 높은 반면에, 액국 10% 경우는 glucoamylase 활성이 높았고 상대적으로 protease 활성은 낮게 나타났다. 황국균인A. oryzae 75-2로 만든 액국 5%을 접종하였을 때 모든 효소활성이 가장 높은 것으로 나타났고, glucoamylase 활성은 액국 10%로 접종한 고체종국에서 효소활성이 가장 낮게 나타났으며, α-amylase의 활성은 액국 접종량의 농도에 따른 차이가 거의 없는 것으로 확인되었다. 액국을 농도별(5, 10%)로 접종하였을 때 가장 높은 효소활성을 보인 최 등(35)의 결과와는 차이가 있었는데 이러한 것은 사용하는 곰팡이 종균에 따라 효소 생성능의 차이가 있는 것을 알 수 있다.
Fig. 1.
Effects of enzyme activity on various inoculation rate of liquid starter .
A, A. luchuensis 74-5; B, A. oryzae 75-2.
Download Original Figure
발효온도에 따른 효소활성 변화
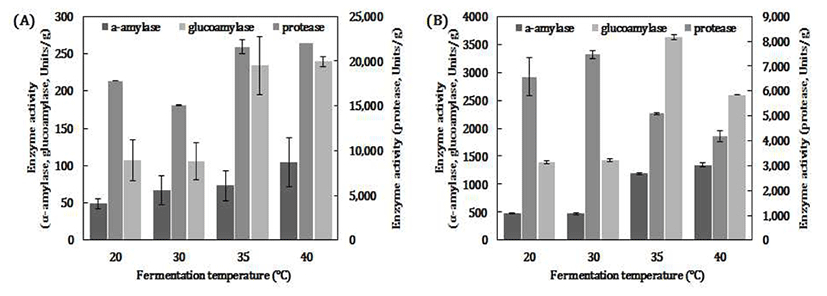
탁주 제조용 곰팡이 고체종국을 제조하기 위해, 제국기의 습도를 70%로 일정하게 유지시킨 후, 온도에 따른 고체종국의 효소활성 변화를 조사하였다(Fig. 2). 백국균인 A.luchuensis 74-5로 만든 종국은 낮은 온도보다 중온(35℃, 40℃)에서 glucoamylase와 acidic protease의 활성이 높았지만 이들 온도에 따른 효소활성 차이는 크지 않았다(Fig 2A).
황국균인A. oryzae 75-2로 제조한 종국은 낮은 온도(20, 30℃)보다 중온(35, 40℃)에서 α-amylase와 glucoamylase 활성이 높은 것으로 보아 A. luchuensis 74-5보다 당화력이 우수한 종균임을 알 수 있다(Fig 2B).
Fig. 2.
Effects of enzyme activity on various fermentation temperature of solid star ter .
A, A. luchuensis 74-5; B, A. oryzae 75-2.
Download Original Figure
발효시간에 따른 효소활성 변화
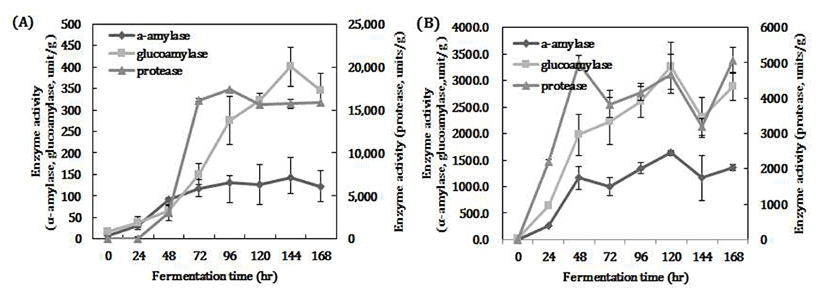
토착 곰팡이 종균을 이용한 종국제조의 최적 발효시간을 구명하기 위해, 7일간(168 hr) 발효하면서 각각의 효소활성변화를 조사하였다(Fig. 3). 누룩에서 분리한 백국균(74-5)과 황국균(75-2) 2종류 곰팡이는 발효기간이 경과됨에 따라 효소활성은 증가하는 경향이었으나 효소 종류에 따른 증감패턴이 다르게 나타났다. 종균별로 살펴보면 A. luchuensis 74-5가 생산하는 α-amylase 활성은 발효시간이 길어지면서 조금씩 증가하다 144시간 이후부터 감소하는 것으로 나타났다(Fig. 3A). Glucoamylase도 발효시간에 따라 48시간 이후부터 급격히 상승하다가 144시간부터 효소활성이 감소하였고, acidic protease는 24시간부터 급격히 증가하여 72시간부터 효소활성이 안정하게 유지되는 것으로 확인되었다(Fig. 3A).
황국균인 A. oryzae 75-2 종균은 발효시간이 경과함에 따라 효소활성이 서서히 증가한 후, 감소되는 것으로 나타났다(Fig. 3B). Glucoamylase 및 acidic protease는 발효 120시간까지는 상승하다 이후부터 감소하였다. 이상의 결과에서 높은 효소활성을 가지기 위해, 2종류 곰팡이 종균을 이용한 고체종국 제조시간은 120시간(5일)을 경과하지 않는 것이 효소활성 최적조건으로 확인되었다. 또한 이들 2종류 곰팡이 종균(A. luchuensis 74-5, A. oryzae 75-2)의 발효시간에 따른 효소활성 차이를 이용하여 탁주용 조제종국도 제조할 수 있다.
Fig. 3.
Change of enzyme activity on fermentation time of solid starter .
A, A. luchuensis 74-5; B, A. oryzae 75-2.
Download Original Figure
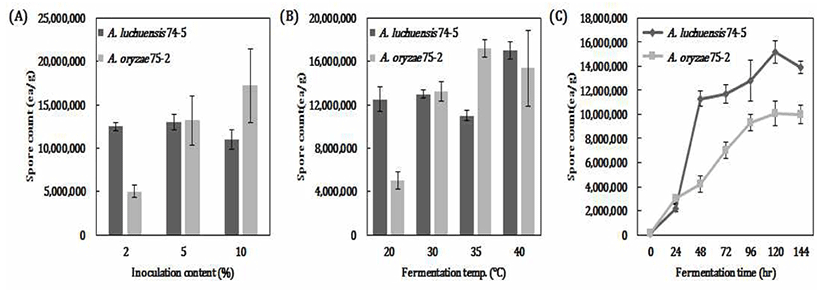
발효조건에 따른 고체종국의 포자수 변화
2종류 곰팡이로 제조한 고체종국의 포자수를 Fig. 4에 나타내었다. 첨가하는 액국 접종량이 증가할수록A. oryzae 75-2 포자수는 증가하는 것으로 나타났으나 A. luchuensis 74-5는 5% 접종이 1.3×107으로 가장 많은 포자수가 검출되었고 A. oryzae 75-2는 10% 접종한 종국에서 1.7×107으로 가장 많은 포자수를 나타내었다. 발효온도에 따른 곰팡이 포자수를 측정한 결과, 2종류 곰팡이 모두 낮은 온도보다 높은 중온(40℃)에서 각각 1.7×107, 1.5×107로 포자가 많이 만들어졌다. 또한, 발효시간에 따른 포자수 변화는 35℃에서 제국한 고체종국의 포자수를 분석한 결과, 발효시간이 경과함에 따라 포자수는 점차적으로 증가하다가 서서히 감소하는 것으로 나타났다.
Fig. 4.
Comparison in spore count of various fermentation conditions on solid starter.
A, Inoculation ratio (%); B, Fermentation temp. (℃); C, Fermentation time (hr).
Download Original Figure
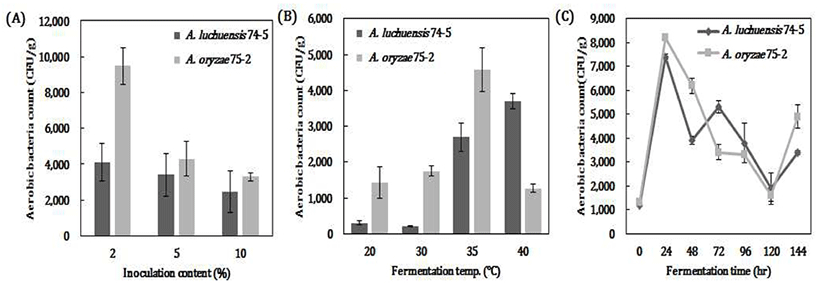
세균에 의한 오염유무
제조된 고체종국에서 잡균의 오염 유무 등의 위생 상태를 조사하기 위해, 세균수를 조사하였다(Fig. 5). 세균의 오염 수치는 3.0×102~103이었고, 액국 접종량이 증가할수록 세균 오염은 낮은 것으로 나타났다(Fig. 5A). 다양한 발효온도에서 제국한 고체종국의 오염유무를 살펴본 결과, 황국균은 35℃에서 가장 높았고, 백국균은 40℃에서 세균오염이 가장 높게 나타났다(Fig. 5B). 발효시간은 24시간 이후에는 세균수가 감소하는 것으로 나타났다(Fig. 5C). 제조된 2종류 고체종국의 세균 오염도 저감화 및 효소활성을 유지하기 위하여, 종국 제조시 발효 초기(24 hr)에 소량의 구연산 첨가와 더불어 건조방법 및 부형제 선택 등의 추가적인 연구수행이 필요하다.
Fig. 5.
Comparison in aerobic bacteria count of various fermentation conditions on solid starter .
A, Inoculation ratio (%); B, Fermentation temp. (℃); C, Fermentation time (hr).
Download Original Figure
요 약
본 연구에서는 전분 및 단백질 분해력이 우수한 토착 발효종균 Aspergillus luchuensis 74-5 및 Aspergillus oryzae 75-2로 제조한 고체종국의 품질 특성을 조사하였다. 액체종국 접종량 5%와 10% 접종하였을 때, pH는 각각 5.78 및 3.85 이하로, 적정산도는 2.12와 8.54 이상, 아미노산도는 1.15 및 2.66 이상으로 균주에 따라 차이를 보였다. 효소활성의 변화는 발효종균에 따라 증감 패턴이 특징적으로 나타났고, 액국 접종량에 따라 A. luchuensis 74-5는 접종량이 증가할수록 α-amylase와 glucoamylase 활성은 증가하나 acidic protease활성은 감소하였고, A. oryzae 75-2는 5% 접종하였을 때 모든 효소활성이 가장 높게 나타났다.
발효온도는 저온보다 중온(35, 40℃)에서 효소활성이 우수한 것으로 나타났고, 발효시간은 종균에 따라 차이는 있지만 각각 144시간과 120시간일 때 효소활성이 높은 것으로 나타났다. 발효조건에 따른 고체종국의 포자수는 약 2.0×107, 세균의 오염은 약 3.0×103으로 나타났으며, 세균에 의한 오염도 저감화 및 효소활성을 유지하기 위하여, 구연산, 종국의 건조법 및 부형제 등의 추가적인 연구가 필요하다.
감사의 글
This work was carried out with the support of ‘Cooperative Research Program for Agriculture Science & Technology Development (Project No. PJ00999803)’ Rural Development Administration, Republic of Korea.
References
Lee SJ, Ahn BH. 2010; Sensory profiling of rice wines made with Nuruks using different ingredients.. Korean J Food Sci Technol. 42 p. 119-123


Lee SS, Kim KS, Eon AH, Sung CK, Hong IP. 2002; Production of Korean traditional rice-wines made from cultures of the single fungal isolates under laboratory conditions.. Korean J Microbiol. 30 p. 61-65


Lee DH, Kang HY, Lee YS, Cho CH, Kim SJ, Lee JS. 2011; Effects of yeast and Nuruk on the quality of Korean Yakju.. Korean J Microbiol Biotechnol. 39 p. 274-280


Park CS, Lee TS. 2002; Quality characteristics of Takju prepared by wheat flour Nuruks.. Korean J Food Sci Technol. 34 p. 296-302


Bae SM, Lee YH, Lee MK, Kang SA, Cheong C. 2008; Effect of traditional Nuruk ratio and yeast on the fermentation and quality of Yakju.. J East Asian Soc Dietary Life. 18 p. 41-48


Han EH, Lee TS, Noh BS, DS LEE. 1997; Quality characteristics in mash of Takju prepared by using different Nuruk during fermentation.. Korean J Food Sci Technol. 29 p. 555-562


Yu TS, Kim J, Kim HS, Hyun JS, Ha HP, Park MG. 1998; Bibliographical study on microorganisms of traditional Koran Nuruk (since 1945).. J Korean Soc Food Sci Nutr. 27 p. 789-799


Lee HH, Lee JH, Ko YJ, Park MH, Lee JO, Ryu CH. 2009; Changes in allergenicity and quality of Nuruk during fermentation.. J Korean Soc Food Sci Nutr. 38 p. 76-82


Kim HS, Hyun JS, Kim J, Ha HP, Yu TS. 1998; Enzymological characteristics and identification of useful fungi isolated from traditional Korean Nuruk.. Kor J Appl Microbiol Biotechnol. 26 p. 456-464


Choi JS, Jeong ST, Choi JH, Choi HS, Baek SY, Yeo SH. 2012; Quality Characteristics of wheat Nuruk by storage conditions of liquid starters using Rhizopus oryzae N174.. Korean J Microbiol Biotechnol. 40 p. 319-324


Kim MS, Jeon JA, Jeong ST, Choi JH, Choi HS, Yeo SH. 2011; Characteristics of Byeo-Nuruk according to the mixing ratio of wheat and the addition rate of moisture.. J East Asian Soc Dietary Life. 21 p. 897-904


So MH. 1991; Improvement in the quality of Takju by the combined use of Aspergillus kawachii and Aspergillus oryzae.. Korean J Food Nutr. 4 p. 115-124


Mun JY, Baek SY, Park HY, Ro HS, Yeo SH. 2016; Cultural characteristics of fungi strains isolated from Korean Nuruk.. J East Asian Soc Di Life. 26 p. 125-140


So MH, Lee JW. 1996; Takju brewing by combined use of Rhizopus japonicus-Nuruk and Aspergillus ryzae-Nuruk.. J Korean Soc Food Nurt. 25 p. 157-162


DA MacKenzie, Jeenes DJ, Gou X, Archer DB. 2000; Molecular basis of glucoamylase overproduction by a mutagenised industrial strain of Aspergillus niger.. Enzyme Microbial Technol. 26 p. 193-200


Thenmozhi M, Kannabiran K, Kumar R, Khanna VG. 2013; Antifungal activity of Streptomyces sp. VITSTK7 and its synthesized Ag2O/Ag nanoparticles against medically important Aspergillus pathogens.. J Mycol Med. 23 p. 97-103


Park IS, Chung YH. 1989; Some factors affecting glucoamylase production from Aspergillus sp... Kor J Appl Microbiol Bioeng. 17 p. 519-523


Lee SH, Jung HJ, Yeo SH, Kim HS, Yu TS. 2004; Characteristics of α-amylase of, a new species, Aspergillus coreanus NR 15-1.. Korean J Biotechnol Bioeng. 19 p. 301-307


SO MH. 1993; Characteristics of Koji molds isolated from Koji-starters for brewing in Korea and Japan.. Korean J Food Nutr. 6 p. 1-7


Marketsandmarkets 2014; Starter culture market by type (yeast, bacteria, molds), application [alcoholic beverages (beer, wine, whisky), non-alcoholic beverages (dairy-based, cereal-based, kombucha)] & geography-Global Trends & Forecast to 2018..Magarpatta city, Pune, India p. 1-240


Jeon CO. 2014; Industrial application and starter development for traditional fermentation food using lab evolution method.. E-bioindustry. 27 p. 1-4


Uyeno K. 1906; Report of examination of Corean “Koji” (Ⅰ). Yakugaku Zasshi. 277 p. 203-212


Yu TS, Kim HS, Hong J, Ha HP, Kim TY, Yoon IH. 1996; Bibliographical study on microorganisms of nuruk (until 1945). J Korean Soc Food Sci Nutr. 25 p. 170-179


Yu TS, Kim J, Kim HS, Hyun JS, Ha HP, Park MG. 1998; Bibliographical study on microorganisms of traditional Koran Nuruk (since 1945).. J Korean Soc Food Sci Nutr. 27 p. 789-799


Park JW, Lee KH, Lee CY. 1995; Identification of filamentous molds isolated from Korean traditional Nuruk and their amylolytic activities.. Kor J Appl Microbiol Biotechnol. 23 p. 737-746


Kim HS, Hyun JS, Kim J, Ha HP, Yu TS. 1997; Characteristics of useful fungi isolated from traditional Korean Nuruk.. J Korean Soc Food Sci Nutr. 26 p. 767-774


Jo GY, Lee CW. 1997; Isolation and identification of the fungi from Nuruk.. J Korean Soc Food Sci Nutr. 26 p. 759-766


Hong SB, Yamada O, Samsone RA. 2014; Taxonomic re-evaluation of black Koji molds.. Appl Microbiol Biotechnol. 98 p. 555-561


Joung EJ, Paek NS, Kim YM. 2004; Studies on Korean Takju using the by-product of rice milling.. Korean J Food Nutr. 17 p. 199-205


NTS liquors license support center 2014; Liquors Analysis Code..12th edOsongKorea p. 18


Brewing society of Japan 1993; The Annotation of the official method of analysis of the national tax administration agency. .4th edTokyo, Japan p. 218-226


Somogyi M. 1952; Notes on sugar determination.. J Biol Chem. 195 p. 19-23


So MH, Lee YS. 2010; Effects of culture conditions of Rhizopus sp. ZB9 on the production of protease during preparation of rice Koji.. Korean J Food Nutr. 23 p. 399-404


Atlas RM, Park LC, Brown AE. 1995; Laboratory manual of experimental microbiology.Mosby PubllishersSt. Louis, MO, USA p. 119-127


Choi JS, Jeong ST, Kim JY, Choi JH, Choi HS, Yeo SH. 2011; Quality characteristics of wheat Nuruk and optimum condition of liquid starters of Aspergillus sp... Korean J Microbiol Biotechnol. 39 p. 357-363