서 론
커피는 세계 물동량의 2위를 차지하며 세계적으로 하루 약 5천 만잔 이상이 소비되는 대중적인 음료이다(1). 커피나무는 에티오피아가 원산지이며 현재 아프리카, 남아메리카, 베트남, 인도네시아 등지에서 널리 재배되고 있다(2). 커피는 인류가 가장 많이 마시는 기호음료로 식물 중 가장 풍부한 휘발성 향기성분을 함유하고 있으며, 지금까지 확인된 커피의 향기성분은 800가지 정도이며 비극성 물질에서 극성 물질까지 폭넓게 분포하고 있다(3,4). 커피의 섭취는 각성효과 및 기분전환 등의 정신적인 효과(5)가 있으며, 커피의 항산화효과에 대한 연구로 다양한 음료에서 페놀화합물의 함량을 측정한 결과 레드와인보다 커피의 페놀함량이 높은 것으로 나타났다(6). 생리적인 효과에 대한 연구도 진행되었는데 췌장염의 위험을 감소시킨다는 보고(7), 당뇨의 발병을 낮춘다는 보고(8)가 있었다. 또한 알츠하이머나 파킨슨병 등의 신경학적 질환과 산화적 스트레스로 인한 대사성 질환의 위험을 감소시키는 것으로 보고되었다(9). 이러한 커피의 품질에 영향을 미치는 여러 가지 요소 중에서 Farah A등(10) 의 연구에서는 결점두 함량은 그 양이 많이 발견된 생두일수록 향미에 부정적인 영향을 미친다고 보고하였다. 결점두란 생두 중에서 결함이 있는 것으로 로스팅 후 커피의 맛과 향 등의 품질에 악영향을 미칠 수 있는 것들을 지칭한다(11). 결점두의 종류로는 black, sour, broken과 같이 가공 시 생성되는 것과 돌, 나뭇가지 등과 같은 외부물질이 유입되는 경우가 있다(12). Immature bean은 주로 미숙한 과실에서 유래되며 떫은맛을 증가시키는 것으로 알려져 있다(13). Sour bean은 노르스름한 갈색을 띤 발효된 콩으로 성장기간 중 물의 결핍이나 비정상적인 발효에 의해 발생하며 식초같은 시큼한 냄새을 낸다(14). Broken bean은 깨진 생두로써 로스팅 과정 시 골고루 열이 전달되지 않아 전체적인 향미에 부정적인 영향을 미친다고 보고되었다(15). 현재 커피의 성분분석에 관한 연구로는 커피의 종류에 따른 이화학적 성분 및 GC에 의한 향기성분 분석(16), 로스팅 및 추출조건에 따른 품질분석(17), 커피의 추출방법에 따른 이화학적 특성(18) 등 많은 연구가 보고된 바 있으나 결점두에 대한 연구는 아직 미흡한 실정이다.
따라서 본 연구에서는 정상두와 결점두의 생두와 로스팅 후 이화학적 특성, 항산화능, HPLC를 통한 trigonelline, caffeine, chlorogenic acid의 기능 성분 분석을 통하여 로스팅 유무에 따른 정상두와 결점두의 차이를 알아보고 결점두의 활용가능성을 검토하고자 하였다.
재료 및 방법
본 실험에 사용한 커피빈은 에티오피아에서 생산된 시다모 G4 등급을 ㈜우성엠에프(Seoul, Korea)에서 구입하여 사용하였다. 시다모 G4 등급은 Arabica 품종이며, 커피빈은 미국 스페셜티 커피협회(SCAA, Specialty coffee Association of America)의 기준에 의하여 정상두와 결점두(Immature, Fungus, Broken, Sour)로 분류하였다. Immature는 익지 않은 상태에서 수확한 것으로 은피가 단단히 붙어있으며 크기가 작고 오목하며, Fungus는 곰팡이에 의해 푸른색을 띠며, Broken은 가공 시 깨진 커피빈이며, Sour는 발효된 노르스름한 커피빈으로 분류하였다.
커피빈의 로스팅은 로스터기(Sample roaster Type PRG 1 Z, Probat Co., Ingolstadt, Germany)를 이용하였다. 본 실험에서는 로스팅 강도를 medium roast로 설정하였으며, 이 강도는 SCAA Agtron Roast Color Classification #55 disk 기준에 따르면 원두가 첫번째 팽창이 있은 후부터 두번째 팽창을 하기 전까지의 단계를 의미한다. 예비실험을 통해 이 단계에 부합하는 온도 및 시간은 180℃에서 9분이었으므로 이것을 로스팅 조건으로 하였다. 로스팅 후 즉시 air cooler로 원두가 실온으로 식을 때까지 냉각 후 포장지에 담아 포장 후 암소에 보관하며 실험에 사용하였다. 커피빈 분말은 분쇄기(NSG-1002SS, Hanil Inc., Seoul, Korea)를 사용하여 분쇄 후 20 mesh체에 걸렀으며. 추출액은 Kim(19)의 추출액 제조 조건을 변형하여 생두와 원두 커피빈 분말 8.25 g에 92℃의 3차 증류수 150 mL을 가하여 4분 동안 추출 후 여과지(No 2, Advantec, Tokyo, Japan)로 여과한 후, 이화학적 품질특성 및 항산화 활성 및 기능성 성분 분석에 사용하였다.
pH는 pH meter(pH 510, Oakion, Singapore)을 이용하여 측정하였으며, 적정 산도는 AOAC 방법(20)에 따라 0.1 N NaOH로 적정하여 citric acid 함량으로 나타내었다. 가용성 고형분 함량은 굴절 당도계(Master-α, Atago, Tokyo, Japan)를 이용하여 측정하였으며, 색도는 표준 백색판(L=97.79, a=-0.38, b=2.05)으로 보정된 colorimeter(CR-400, Konica Minolta Co., Osaka, Japan)를 사용하였다.
1,1-diphenyl-2-picrylhydral(DPPH) 라디칼 소거능 측정은 Blois의 방법(21)을 변용하여 측정하였다. 추출액을 40배 희석한 것을 시료용액으로 사용하였으며, 0.4 mM DPPH 용액을 흡광도 값이 0.95~0.99가 되도록 ethanol로 보정한 후 시료 용액 0.2 mL과 반응시킨 후 10초 동안 진탕하고 암소에 10분간 방치한 뒤 517 nm에서 흡광도를 측정하였다. 라디칼 소거능은 다음의 식을 이용하였다.
FRAP 활성은 Benzie 등의 방법(22)을 변용하여 측정하였다. 반응용액은 acetate buffer(pH 3.6, 300 mM), 10 mM TPTZ[2,4,6-tris (2-pyridyl-s-triazine)], 20 mM FeCl36H2O를 10:1:1 비율로 혼합하여 37℃를 유지하면서, 추출액을 20배 희석한 시료 25 μL에 반응용액 175 μL를 혼합한 뒤 암실에서 30분간 방치한 후, 590 nm에서 흡광도를 측정하여 trolox equivalent(TE) mM로 나타내었다. 총 페놀성 화합물은 Folin-Ciocalteu법(23)을 응용하여 정량하였다. 추출액을 120배 희석한 것을 시료용액으로 하였으며, 시료용액 1 mL을 Folin-Ciocalteu reagent 1 mL와 혼합하여 15분간 방치한 후 10% Na2CO3 1 mL을 가하여 60분 동안 반응시켜 760 nm에서 흡광도를 측정하였으며, gallic acid를 표준물질로 하여 총 페놀성 화합물의 함량을 gallic acid equivalent (GAE) mg%로 나타내었다.
Trigonelline, caffeine, chlorogenic acid 함량을 분석하기 위하여 커피빈 추출액 시료를 0.45 μm membrane filter로 여과하였으며, HPLC로 분석하였다. Trigonelline, caffeine, chlorogenic acid를 동시에 분석할 수 있는 Bradbury 등의 방법(24)에 준하여 측정하였으며. 분석조건은 Table 1과 같다.
| Items | Operating conditions |
| Instrument | ShimadzuProminence |
| Column | C18(4.6mm×150mm,5μm) |
| Columntemp. | 40℃ |
| Mobilephase | 10mMHCl:MeOH=90:10 |
| Injectionvolume | 10μL |
| Flowrate | 1.0mL/min |
| Detector | DiodeArraydetector |
결과 및 고찰
정상두와 결점두의 로스팅 전후에 얻은 추출액의 pH, 적정산도, 가용성 고형분 함량, 색도를 분석한 결과는 Table 2에 나타내었다. 생두 추출액의 pH는 원두 추출액보다 높았으며 적정산도는 Sour bean의 생두 추출물이 가장 높았는데 이는 품질이 낮은 커피는 발효된 생두에 의해 산도가 높다고 한 Mazzafera(25)의 결과와 유사하였다. 가용성 고형분 함량은 생두 추출물이 원두 추출물보다 다소 높은 경향을 보였으며 Immature의 생두 추출물이 2.30 °Brix로 가장 높았으며, Broken의 원두 추출물이 1.17 °Brix로 가장 낮았다. L* value는 로스팅 공정 후 감소하는 경향을 보였으며, 정상두의 생두 추출물이 62.97로 가장 높았다. 이는 로스팅에 따라 명도가 감소하는 Lee 등(29)의 결과와 일치하였다. a* value와 b* value는 로스팅 과정을 거친 후 증가하였다. a* value 값은 정상두의 원두 추출물이 9.83으로 가장 높았으며 Fungus의 생두 추출물이 -2.50으로 가장 낮은 수치를 나타냈다. b* value 값은 Broken의 원두 추출물이 23.21으로 가장 높았고, 정상두의 생두 추출물이 2.49으로 가장 낮은 것으로 나타냈다.
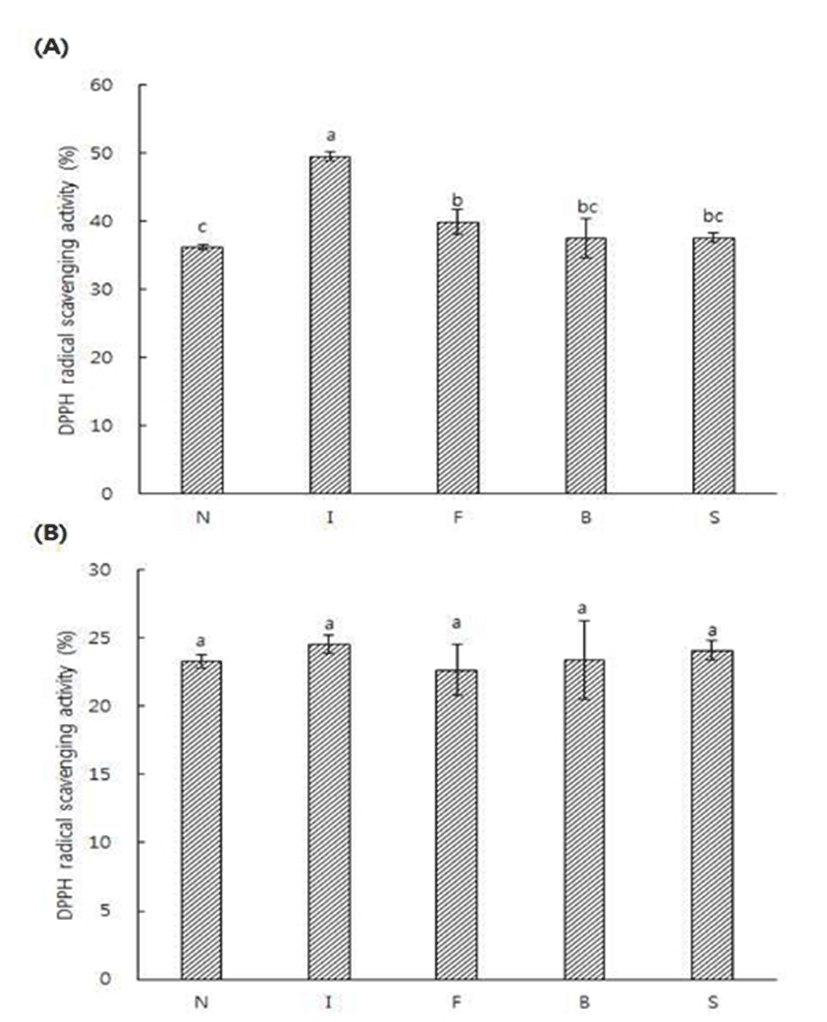
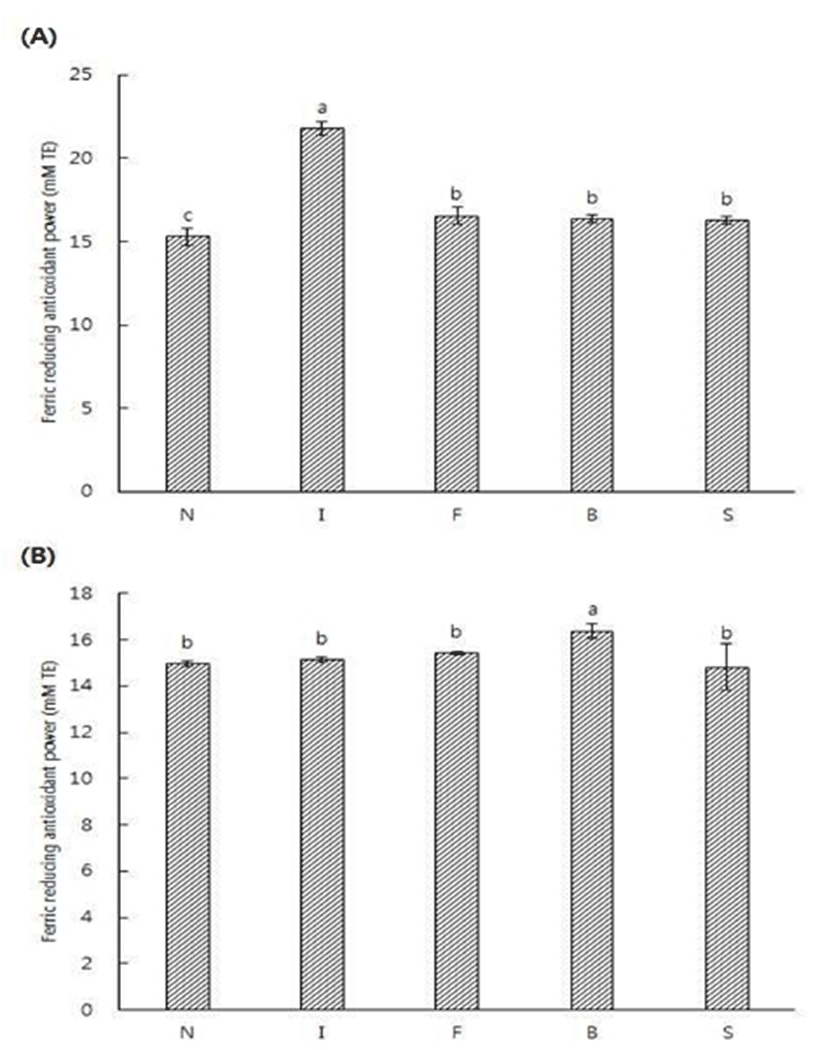
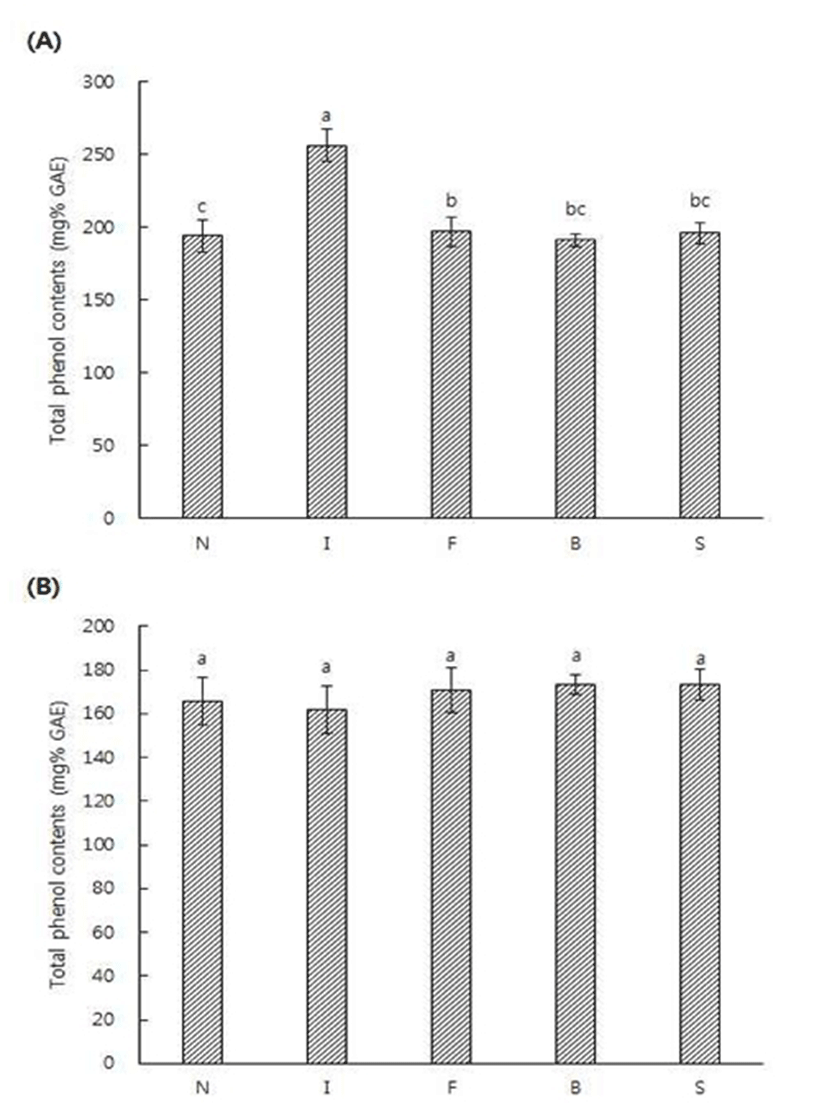
정상두와 결점두의 로스팅 전후에 얻은 추출액의 DPPH 라디칼 소거능 결과는 Fig. 1에 제시하였다. 라디칼 소거능에 사용된 DPPH는 안정한 자유라디칼로 517 nm 부근에서 최대 흡광도를 나타내며 전자 또는 수소를 받으면 517 nm 부근에서 흡광도가 감소하며(26), 방향족 아민류 및 방향족 화합물 등에 의해 환원되어 짙은 자색이 탈색되는 것으로 항산화능을 측정하는 방법이다(27). 추출물의 라디칼 소거능은 로스팅을 한 후 감소하는 경향을 보였는데 이는 로스팅 후 라디칼 소거능이 감소한다는 Cheong 등의 결과(28)와 일치하였다. 또한 생두 추출물에서는 정상두보다 결점두의 라디칼 소거능이 높았으며 특히 Immature의 생두 추출물의 DPPH 라디칼 소거능이 49.54%로 가장 높게 나타났으며, 정상두가 36.17%로 가장 낮은 수치를 나타냈다. 로스팅을 한 후 추출물간에는 유의적인 차이를 보이지 않았으며 Fungus의 원두 추출물이 22.66%로 가장 낮게 나타났다. 정상두와 결점두의 로스팅 전후에 얻은 추출액의 FRAP 활성을 분석한 결과는 Fig. 2에 제시하였다. FRAP assay는 colored ferrous tripyridyl triazine complex에 의해 ferric ion이 ferrous로 전환되어지는 과정을 분석함으로써 시료 내의 총 항산화력을 측정하는 방법이다(29). Broken을 제외한 생두 추출물은 원두 추출물보다 FRAP 활성이 높았으며, 이는 로스팅 후 FRAP 활성이 감소한 Cheng 등(28)의 결과와 일치하였다. 생두 추출물에서는 모든 결점두 추출물이 정상두 추출물에 비해 높은 활성을 나타내었다. 또한 Immature의 생두 추출물이 21.80 mM TE로 활성이 가장 높았으며, Sour의 원두 추출물이 14.81 mM TE로 가장 낮은 활성을 나타내었다. 식품에 존재하는 폴리페놀 물질은 산화환원반응을 기본으로 항산화, 항암 및 항균효과 등의 생리활성을 나타낸다고 보고되고 있다(30,31). 정상두와 결점두의 로스팅 전후에 얻은 추출액의 총 페놀성 화합물 함량 측정 결과는 Fig. 3과 같다. 총 페놀성 화합물 함량은 Immature의 생두 추출물이 256.25 mg% GAE 로 가장 높았으며 이는 페놀성 화합물의 함량이 커피의 항산화력과 밀접한 관련을 보인다고 보고한 Lee 등(32)의 결과와 유사하였다. 생두 추출물은 원두 추출물에 비해 페놀 화합물 함량이 높았으며 원두 추출물간에는 유의적인 차이를 보이지 않았으며 Immature의 원두 추출물이 161.91 mg% GAE 로 가장 낮게 나타났다.
커피의 주요 화학 성분인 trigonelline, caffeine, chlorogenic acid의 로스팅 전 후의 함량을 측정한 결과는 Table 3과 같다. Trigonelline은 퓨린-알칼로이드로서 매우 약한 쓴맛을 지니고 있으나 로스팅 공정 중 급격히 분해되어 주요 휘발성 성분들을 생성하며, 이 성분들이 커피품질에 많은 영향을 미치므로 중요한 화학성분으로서 역할을 한다고 알려져 있다(33,34). Trigonelline 함량은 Immature의 생두 추출물에서 895.20 mg/L로 가장 높은 수치를 나타냈으며 로스팅 공정 후 전반적으로 함량이 낮아졌으며 Sour의 원두 추출물이 330.81 mg/L로 가장 낮았다. Caffeine은 퓨린 염기의 일종으로 평활근의 이완작용, 이뇨작용 중추신경 자극, 혈관 확장 뿐 아니라 최근 라디칼 소거 및 항산화 작용 등의 기능도 보고되는 기능성 성분이다(35-37). Caffeine의 함량은 Immature의 생두 추출물에서 825.85 mg/L로 가장 높았으며 Broken의 원두 추출물이 431.75 mg/L로 가장 낮은 수치를 나타냈다. 로스팅 공정 후 정상두와 Fungus, Sour는 caffeine 함량이 증가하였는데 이는 Kim 등(16)의 결과와 유사하였다. Chlorogenic acid는 커피 속에 다량 함유되어 있는 폴리페놀 성분의 일종으로서 커피의 착색 및 쓴맛의 원인물질로 알려져 있다(38). 또한 생체 내에서 항산화작용은 물론 항균활성 및 항암성 물질로 작용하여 기능성 소재의 성분으로 보고되어 왔다(8,35). Chlorogenic acid 함량은 Immature의 생두 추출물에서 3,836.94 mg/L로 가장 높았으며 Sour의 원두 추출물이 392.44 mg/L로 가장 낮은 수치를 나타내었다. 모든 샘플에서 로스팅 후 함량이 급격하게 감소하였는데 이는 Franca 등(39)과 Kim 등(40)의 결과와 유사하였다. 세 가지 기능성분 함량 모두에서 Immature의 생두 추출물에서 가장 높은 함량을 나타내었는데 이런 영향으로 Immature의 생두 추출물이 가장 높은 항산화능을 보이는 것으로 사료된다.
요 약
커피의 풍미와 기호에 부정적인 영향을 미친다고 알려진 결점두의 활용가능성을 알아보고자 생두와 원두상태의 정상두와 결점두의 이화학적 특성을 분석하였다. 추출액의 pH와 가용성 고형분 함량은 로스팅 공정을 거친 후 감소하는 경향을 보였으며 색도는 L* value는 감소하고 a* value와 b* value는 증가하였다. DPPH radical 소거능은 로스팅 공정을 거친 후 감소하였으며 생두 추출물에서 결점두의 radical 소거능이 정상두보다 높았으며 Immature의 생두 추출물이 49.54%로 가장 높은 소거능을 나타냈다. 로스팅을 한 후 DPPH radical 소거능 원두 추출물간에는 유의적인 차이를 보이지 않았다. FRAP 활성 또한 생두 추출물이 15.28~21.80 mM TE 로 14.81~16.38 mM TE 의 활성을 나타낸 원두 추출물보다 높았으며 Sour의 원두 추출물을 제외하고 정상두에 비해 결점두의 FRAP 활성이 높게 나타났다. 총 페놀성 화합물 함량은 생두 추출물이 191.06~256.25 mg% GAE의 범위로 161.91~173.44 mg% GAE 의 범위를 나타낸 원두 추출물보다 높은 함량을 보였으며 Immature의 생두 추출물이 256.25 mg%로 가장 높게 나타났다. Trigonelline, caffeine, chlorogenic acid 함량은 Immature의 생두 추출물이 각각 895.20 mg/L, 825.85 mg/L, 3,836.94 mg/L로 가장 높은 수치를 나타내었고, 로스팅 공정을 거친 후 감소하였으며 특히 chlorogenic acid의 함량은 급격히 감소하였다. 이상의 실험결과로 미루어 보아 결점두의 항산화능과 기능성을 활용할 수 있을 것으로 판단되며 특히 활용할 시 생두의 형태가 더 적합하다고 판단된다.