Article
갈색계 천연색소 추출물의 항산화 특성
김연순, 권오준, 서화진, 박신*
Antioxidant properties of brownish natural dyeing agents from medicinal plant
Yeon-Soon Kim, O-Jun Kwon, Hwa-Jin Suh, Shin Park*
Division of Life and Environment, Daegu University, Gyeongsan 38453, Korea
Evaluation team, Gyeongbuk Institute for regional program evaluation, Gyeongsan 38891, Korea
*E-mail:spark@daegu.ac.kr, Phone:82-53-850-6751, Fax:82-53-850-6759
Korean Journal of Food Preservation. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Jan 27, 2016; Revised: Mar 21, 2016; Accepted: Mar 30, 2016
Abstract
The antioxidant activities of brownish natural dyeing agents, extracted from seven kinds of plants, were tested. Total polyphenol content, DPPH and ABTS radical scavenging activities, and singlet oxygen quenching effect were determined for hot water extracts and floral waters of plants. DPPH and ABTS radical scavenging activites increased with increasing amounts of the extracts from Uncaria gambir R. and Terminalia chebula R. displayed remarkable scavenging effects at concentrations below 0.1 mg/mL, in comparison with the positive control, ascorbic acid. However, antioxidant effects of the floral water, obtained from steam distillation of tested plants, were inefficient at concentration below 0.2 mg/mL. In particular, the natural dyeing agent effectively suppressed singlet oxygen induced by photosensitizer in in vitro assay systems. The concentrations (IC50) required to exert 50% of singlet oxygen were 120 and 190 μg/mL for hot water extracts from Uncaria gambir R. and Phellinus linteus, respectively. Among all the tested samples, the Uncaria gambir R. and Phellinus linteus extracts contained higher amount of total phenolic contents. The results suggest that naturally occurring dyeing agents are beneficial as natural antioxidants, encouraging further extensive studies.
Keywords: antioxidant; floral water; natural dyeing agents; singlet oxygen quenching
서 론
현재 지구상에는 약 300,000여 종의 식물이 있는 것으로 알려지고 있으며, 이 식물들이 생합성하는 물질은 20,000여 종으로 알려져 있다. 이들로부터 매년 약 1,500여 종의 물질 이 추출·분리되어 인간에게 유용한 물질로서 개발 가능한 생리활성을 지닌 것으로 평가되고 있으며, 또한 아직도 연 구 활용되지 않은 많은 식물이 존재한다(1).
식물체내 존재하는 플라보노이드 성분들은 건강증진과 질병에 대한 예방과 같은 다양한 역할을 하고 있으며, 대부 분의 플라보노이드 성분들은 생체 내에서 항산화활성, 혈 소판응집 억제, 항염증활성 및 항암작용 등을 도와주는 것으로 알려져 있다(2). 또한 과일과 야채 등과 같은 식물들 은 암을 억제하는 등의 다양한 건강에 도움이 되는 성분인 isoprenoid 성분을 함유하고 있다. 이 화합물들은 tocotrienols 과 monoterpenes을 함유하는 mevalonate pathway로부터 야 기되어 진다. Terpenoids와 tocotrienols는 암 잠복기간을 늘 리고 전이성을 억제하는 것으로 알려져 있다(3).
오랫동안 전 세계적으로 사용되어온 합성 항산화제인 BHA 및 BHT는 효력은 매우 우수하나 체내 에너지 생산과 세포대사 및 호흡작용을 방해하며 발암성 및 독성에 대한 우려가 보고되고 있다(4,5). 현재 우리 주변에서 접할 수 있는 천연 항산화제는 비타민E, 비타민C, 탄닌, 안토시아 닌, 카로티노이드류, 플라보노이드류 등이 있으며 생체 내에서 노화를 억제시키거나, 동맥경화, 염증, 퇴행성질환 및 암을 예방하는데 아주 효과적인 것으로 보고되어 있다(6,7). 이러한 천연 항산화제는 대부분 색을 띄고 있으며 전통적으 로 사용되어져 온 천연염색의 소재인 천연염료의 주성분과 일치한다. 최근에 안토시아닌류, 탄닌류, 커큐민류, 라이코 펜 등 26종의 천연색소가 미국에서 사용허가를 받았다고 알려져 있으며, EU에서는 40여종의 색소가 첨가제로 등록 이 되어 있다(8). 이러한 천연색소는 온도, 빛, 산화제, 환원 제, 산도 및 보관성 등과 같은 요인에 의해 영향을 받을 수 있어 아직까지는 합성색소에 비해 산업적 적용성이 낮다 고 할 수 있다. 일반적으로 천연에서 유래된 색소는 섬유 및 종이 염색에 사용하는 것으로 알고 있었으나 이들 색소 성분의 다양한 기능성 및 안전성에 대한 연구를 통해 새로 운 천연 항산화제로서의 가치 연구가 필요하다.
본 연구에서는 전통 천연염색에서 주로 사용되어져온 갈색계 색소를 함유하고 있는 식물 추출물이 산화적 스트레 스를 경감시켜 줄 수 있는 소재로 활용 할 수 있는지에 대한 기초연구를 수행하였으며, 폴리페놀성 색소화합물을 함유하고 있는 7종의 식물(한련초, coumestan; 상황, ellagic acid/protocatechuic acid; 아선약, catechin; 자단향, santalin; 유백피, tannin; 종대황, chrysophanol; 가자, myrovalan/ tannin)로부터 열수추출물과 정유성분을 함유하고 있는 플 로럴워터의 항산화 활성에 대한 가치와 유용성에 대한 연구를 수행하였다.
재료 및 방법
추출 및 분획
본 실험에 사용된 시료(한련초, 상황, 아선약, 자단향, 유백피, 종대황, 가자)는 2014년 3월에 경북 영천시에서 구입하여 사용하였으며, 시료의 학명, 일반명 및 사용된 부위에 대해서는 Table. 1에 나타내었다. 열수추출물과 플 로럴워터 2종류의 시료를 준비하기 위하여 증류장치를 변 형하여(Clevenger type apparatus) 건조된 시료 20g에 2L의 증류수를 넣고 3시간 동안 추출하였으며 이때 발생되는 증기를 플로럴워터 원액 시료로 사용하였으며 남아 있는 추출액을 다시금 2 L로 부피를 맞춘 후 Whatman No. 2 여과지로 여과하여 고형분을 제거하고 동결 건조하여 사용 하였다. 실험에 사용된 용매 및 시약은 Dukan(GR grade), sigma-Aldrich Co.(St. Louis, MO, USA) 제품을 사용하였다.
총 페놀 함량 분석
추출된 시료의 총 폴리페놀 함량을 평가하기 위해 Folin-Ciocalteu법(9)을 이용하였다. 즉 시료 100 μL와 Folin- Ciocalteu 시약 50 μL, 20% Na2CO3 850 μL를 혼합한 후 2시간 동안 암실에서 보관한 후, 분광광도계(UV-1800 Shimadzu, Japan)를 이용하여 765 nm에서 측정하였다. 총 페놀 함량은 gallic acid를 이용하여 표준 검량선을 작성하여 총 폴리페놀 함량을 시료 1 mg 중의 mg gallic acid로 계산하 였다. Gallic acid의 농도는 10~500 mg/mL가 되도록 하여 위와 같은 방법으로 765 nm에서 흡광도를 평가하여 작성하였다.
Table 1.
Plants and their parts used in this study
|
Sample |
Part used |
|
Scientific name |
Common name |
|
Eclipta prostrata L. |
False daisy |
Whole |
|
Phellinus linteus
|
Phellinus linteus 상황버섯 |
Whole |
|
Uncaria gambir Roxburgh
|
Catechu 아선약 |
Leaf |
|
Terminalia chebula Retzius
|
Myrovalan 가자 |
Fruit |
|
Ulmus macrocarpa Hance
|
Ulmaceae 유백피 |
Root Peel |
|
Rheum officinale Baillon
|
Rhubarb 종대황 |
Root |
|
Pterocarpus santalinus L. |
RoterSandelbaum 자단향 |
Heartwood |
Download Excel Table
DPPH radical 소거활성 측정
Brand-Williams 등의 방법(10)에 따라 DPPH(2,2-diphenyl- 1-picrylhydrazyl) 라디칼 소거 활성을 평가하였다. 6×10-5 M DPPH를 methanol에 녹인 후, DPPH 라디칼 용액 900 μL와 시료 100 μL를 혼합한 후 5분간 반응시킨 후 분광광도 계(UV-1800 Shimadzu, Japan)를 사용하여 517 nm에서 흡광 도를 평가하였다. DPPH 라디칼의 소거능은 아무 것도 첨가 하지 않은 대조군과 시료 첨가 후 흡광도의 변화로 하여 다음 식으로 계산하였다.
시료의 농도별 DPPH 라디칼 소거능(전자공여능, %)을 도식화하여 전자공여능 50%일 때의 시료 농도를 50% inhibition concentration(IC50)로 나타내었다.
ABTS radical 소거활성 측정
ABTS(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt) 라디칼 소거활성을 이용한 항산화 력 측정은 ABTS cation decolorization assay 방법(11)에 의하 여 측정하였는데, 7 mM ABTS와 2.4 mM potassium persulfate를 섞어 12시간 이상 암소에 방치하여 청록색의 ABTS 라디칼을 형성시켜 냉장 보관하였으며, radical stock solution은 734 nm에서 흡광도 값이 0.70(±0.02)이 되도록 에탄올로 희석하였다. 이 용액 0.9 mL에 농도별로 제조한 각 시료용액 0.1 mL를 가한 후 실온에서 7분간 반응시킨 후, 반응액의 흡광도 변화를 734 nm에서 측정하였다. ABTS radical cation decolorization 정도는 시료용액 첨가군과 무첨가군의 흡광도 감소율로 나타내었다.
단일항산소 측정
Rose bengal(RB)의 광증감 반응에 의해 생성된 단일항산 소를 측정하기 위하여 imidazole-RNO bleaching 방법(12)을 이용하였다. 단일항산소 분석은 2 μM rose bengal, 5 mM imidazole 그리고 4 μM RNO를 녹인 20 mM Tris-succinate buffer(pH 6.5) 반응액이 빛에 노출되기 전후 흡광도 변화를 440 nm에서 측정하여 나타내었다. 시료는 150 W halogen-lamp(Osram, Augsburg, Germany)로부터 백색광( λ>400 nm, 100 W·m-2)에 4분간 노출되어졌으며, 모든 분석 은 25℃에서 이루어졌다. 대조군으로는 L-ascorbic acid를 사용하였다.
통계처리
모든 실험은 3회 반복으로 행하여 평균치와 표준편차로 나타내었고, 각 군간의 차이는 Student’s t-test를 사용하여 평가하였으며, p<0.05 수준일 때 통계적으로 유의하다고 판단하였다.
결과 및 고찰
총 페놀 함량
본 실험에서 분석된 폴리페놀성 화합물 함량(total phenolic contents, TPC) 분석 결과는 Table. 2에 나타난 바와 같다. 각 시료로부터 얻어진 열수 추출물의 TPC는 0.015~ 0.142 mg GA/mg extract의 범위를 나타내었는데 그중 아선 약, 자단향, 가자 추출물이 월등히 높은 수준으로 분석되었 다. 일반적으로 페놀성 화합물은 자연계에 널리 분포하는 2차 대사산물로서 대부분 그 함량은 항산화력과 정의 상관 관계를 나타내며(13), 본 실험 결과 천연색소 추출물에 따른 총 페놀 함량이 아선약, 가자, 자단향, 유백피, 종대황, 상황, 한련초의 순으로 분석되었다.
Table 2.
Extraction yields and total phenolic contents of water extracts
|
Sample |
Yield (%) |
TPC (mg GA/mg ext) |
|
Eclipta prostrata L. |
19 |
0.015±0.001 |
|
Phellinus linteus
|
6 |
0.036±0.002 |
|
Uncaria gambir Roxburgh
|
64 |
0.142±0.011 |
|
Terminalia chebula Retzius
|
52 |
0.120±0.009 |
|
Ulmus macrocarpa Hance
|
16 |
0.051±0.002 |
|
Rheum officinale Baillon
|
44 |
0.044±0.003 |
|
Pterocarpus santalinus L. |
3 |
0.117±0.006 |
Download Excel Table
DPPH radical 소거활성
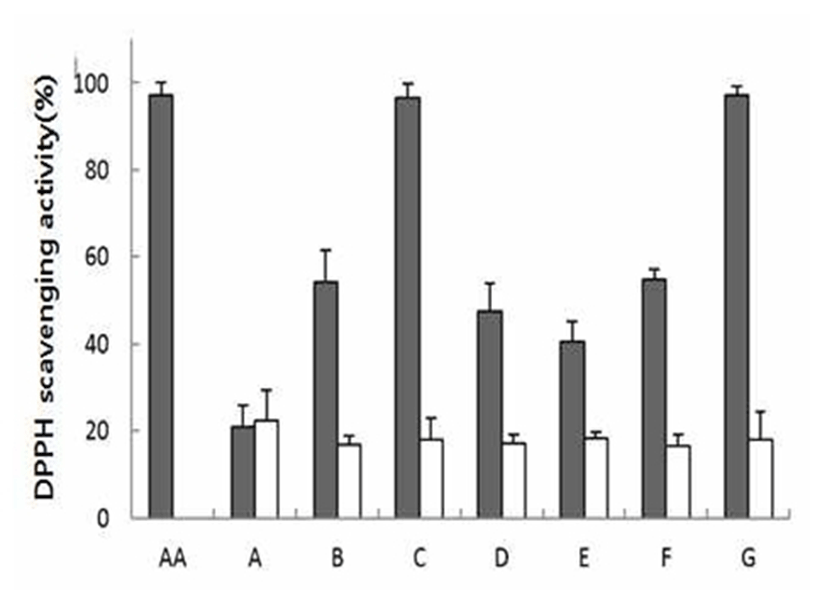
DPPH는 화학적으로 안정화된 자유라디칼을 가지고 있 는 물질로 ascorbic acid, tocopherol, polyhydroxy 방향족 화 합물 등에 의해 환원되어 짙은 자색이 탈색되는데, 이것은 다양한 천연 소재로부터 항산화물질을 검색하는데 많이 이용되고 있다(14). 천연색소로부터 얻어진 열수추출물과 플로럴워터의 전자공여능을 측정한 결과 Fig. 1과 같은데, 색소 시료의 열수추출물 0.1 mg/mL 농도에서 DPPH 라디칼 을 아스코빅산 97.1%, 자단향 97.3%, 아선약 96.7%, 종대황 54.9%, 상황 54.4%, 가자 47.7%, 유백피 40.5%, 한련초 추출 물이 20.8%를 소거하는 것으로 나타났으며, 반응 시약에 10%의 플로러워터(0.1 mL)를 처리했을 때 DPPH 소거 활성 은 열수추출물에 비해 효과적이지 못한 결과를 보였다. 비 교 물질로 사용된 ascorbic acid 0.1 mg/mL 처리 시와 비교해 볼 때 아선약과 자단향 열수 추출물의 DPPH 라디칼 소거능 력은상당히높은수준의항산화력을가지는것을확인하였다.
Fig. 1.
DPPH radical scavenging activity of water extract (dark gray bars) and floral water (open bars) of brownish natural pigment.
The data are expressed as mean±SD of triplicate experiments.
AA, ascorbic acid; A, Eclipta prostrata L.; B, Phellinus linteus.; C, Uncaria gambir Roxburgh; D, Terminalia chebula Retzius; E, Ulmus macrocarpa Hance; F, Rheum officinale Baillon; G, Pterocarpus santalinus L.
Download Original Figure
ABTS radical cation 소거활성
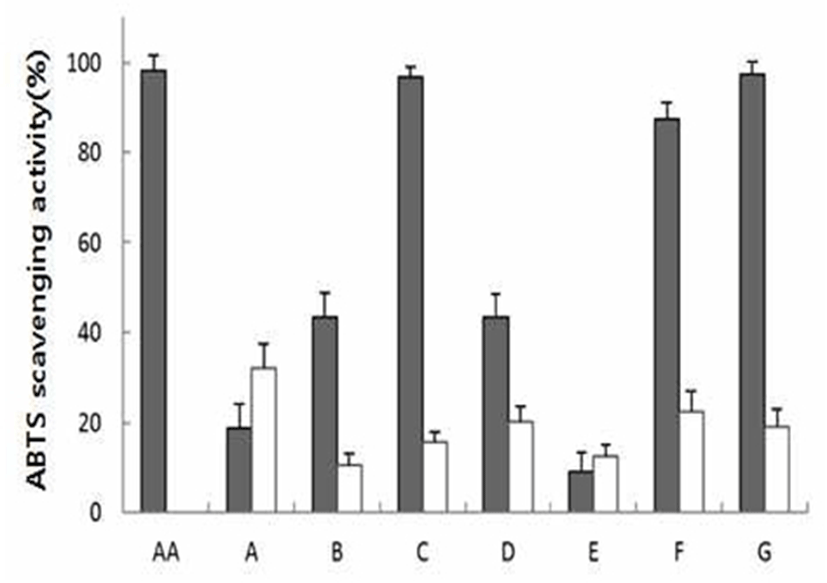
ABTS와 potassium persulfate를 암소에 방치하면 ABTS 라디칼이 생성되는데 추출물의 항산화력에 의해 ABTS 라 디칼이 소거되어 라디칼 특유의 색인 청록색이 탈색된다. 이와 같이 ABTS 라디칼 탈색반응은 이미 생성된 자유라디 칼의 제거 정도를 흡광도로 나타내어 ABTS 라디칼의 소거 활성능을 측정하는 방법으로 ABTS 라디칼 탈색반응이 1분 안에 종료되므로 단시간 측정할 수 있고, 소수성과 친수성 모두에 적용 가능하다(15). 갈색계 천연색소 열수 추출물 및 플로럴워터의 ABTS 라디칼 소거 활성을 측정한 결과는 Fig. 2에 나와 있는바와 같이, 열수추출물(0.1 mg/mL) 처리 시의 ABTS 라디칼 소거능은 DPPH 소거능에서의 결과와 동일하게 아선약, 자단향 및 종대종에서 가장 우수한 활성 을 나타내는 것으로 확인이 되었고, 10% 플로랄워터(0.1 mL) 처리시의 ABTS 라디칼 소거능은 한련초에서 가장 우수한 활성을 나타내는 것으로 확인되었다. 또한 DPPH 라디칼 저해 활성이 ABTS 라디칼 저해 활성보다 높게 나온 경향을 볼 수 있는데 이는 ABTS 라디칼이 DPPH 라디칼 보다 좀 더 강력한 산화물질이기 때문인 것으로 사료된다 (16).
Fig. 2.
The ABTS cation radical scavenging activity of water extract (dark gray bars) and floral water (open bars) of brownish natural pigment.
The data are expressed as mean±SD of triplicate experiments.
AA, ascorbic acid; A, Eclipta prostrata L.; B, Phellinus linteus.; C, Uncaria gambir Roxburgh; D, Terminalia chebula Retzius; E, Ulmus macrocarpa Hance; F, Rheum officinale Baillon; G, Pterocarpus santalinus L.
Download Original Figure
단일항산소 억제 효과
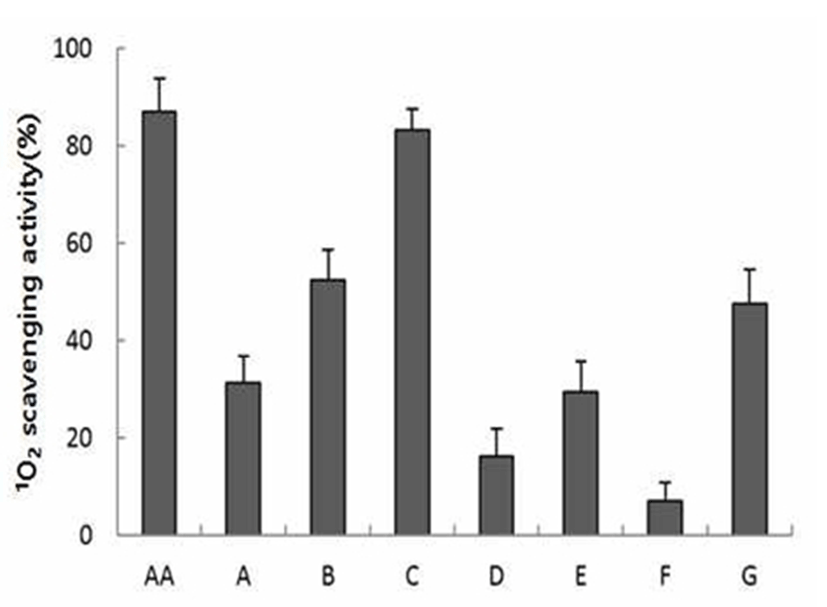
다양한 천연색소 열수추출물에 대한 단일항산소 억제 효과를검증하기위하여광증감반응(Type-II photosensitization) 에 의해 발생되는 활성산소(1O2)의 억제 효과를 분석하였 다. 0.2 mg/mL 시료 처리에 따른 단일항산소 억제 효과는 Fig. 3에 나타내었는데, 단일항산소 억제 효과는 아선약, 상황 및 자단향에서 유의성을 보였으며 이러한 결과는 앞서 기술한 DPPH 및 ABTS 라디칼 소거능의 결과 유사하게 나타났다. 반면 플로랄워터의 단일항산소 소거능은 아주 낮은 수준으로 분석되었다.
Fig. 3.
Singlet oxygen quenching capacity of water extract of various brownish natural dyeing agents.
The data are expressed as mean±SD of triplicate experiments.
AA, ascorbic acid; A, Eclipta prostrata L.; B, Phellinus linteus.; C, Uncaria gambir Roxburgh; D, Terminalia chebula Retzius; E, Ulmus macrocarpa Hance; F, Rheum officinale Baillon; G, Pterocarpus santalinus L.
Download Original Figure
결론적으로, Table 3에서 전자공여능 50%일 때의 처리시 료 농도를 50% 억제 농도값(50% inhibition concentration, IC50)으로 하여 7종의 천연색소 추출물에 대한 비교를 나타 내었다. 3가지 방법에 의해 얻어진 결과 동일하게 catechin 성분을 함유한 아선약 추출물과 santalin 성분을 함유한 자 단향의 천연색소 추출물에서 우수한 항산화 활성을 보이는 것으로 확인되었으며 이들은 Ascorbic acid의 DPPH 라디칼 소거능 IC50(9.5 μg/mL)와 비교해 볼 때 매우 우수한 항산화 활성을 나타내었다. 뿐만 아니라 빛에 의해 야기되는 단일 항산소 소거능 결과로 보아 광에 노출되었을 때 일어날 수 있는 생체기관의 광피해로부터 생명체를 보호하는 중요 한 반응을 할 것이라고 판단한다(17). 향후 식품 및 향장산업 소재화를 위해서는 in vivo 실험 및 순물질 정제를 통해 심도 깊은 연구가 필요하다.
Table 3.
Antioxidant activities of plant-der ived pigments
|
Sample |
DPPH (IC50) |
ABTS (IC50) |
Singlet oxygen (IC50) |
|
Eclipta prostrata L. |
239.4±12.61)/245.8±21.22)
|
265.2±11.6/154.9±13.2 |
320±22.8/>2000 |
|
Phellinus linteus
|
91.9±4.5/297.7±16.9 |
114.9±10.8/474.3±36.2 |
190±16.5/>2000 |
|
Uncaria gambir Roxburgh
|
24.2±2.3/274.2±21.4 |
21.3±1.5/322.0±28.1 |
120±11.4/>2000 |
|
Terminalia chebula Retzius
|
104.7±6.3/289.4±26.3 |
115.4±7.8/249.0±18.6 |
620±45.6/>2000 |
|
Ulmus macrocarpa Hance
|
123.2±5.9/272.4±36.1 |
542.9±27.6/397.1±33.2 |
340±30.8/>2000 |
|
Rheum officinale Baillon
|
91.1±8.4/300.3±18.2 |
51.3±3.6/223.6±20.1 |
1420±72.8/>2000 |
|
Pterocarpus santalinus L. |
12.4±1.8/276.4±18.4 |
16.2±2.0/263.1±18.9 |
210±14.1/>2000 |
Download Excel Table
요 약
이 연구의 목적은 이종산업인 섬유산업에서 사용되고 있는 천연염색의 원료인 천연염료의 항산화 활성을 확인하 는 것으로 이를 위해 총 페놀 함량 분석, DPPH 라디칼 소거능, ABTS 라디칼 소거능 및 단일항산소 억제 효과를 분석하였다. 7종의 천연염료 열수추출물에서 DPPH 라디 칼 소거 활성을 나타내는 IC50 값은 0.012~0.239 mg/mL를 나타내어 일부 색소 추출물의 DPPH 소거 활성이 우수하다 는 것을 알 수 있었다. 특히 폴리페놀함량이 높은 자단향과 아선약 추출물의 IC50 값이 각각 12.4 μg/mL, 24.2 μg/mL로 높은 DPPH 라디칼 소거 활성을 확인하였다. 단일항산소 억제 효과 역시 아선약, 자단향 추출물에서 각각 0.19, 0.21 mg/mL을 나타내어 높은 소거 활성을 띄는 것으로 강한 빛에 의해 야기되는 단일항산소(singlet oxygen)를 억제할 수 있는 것을 알 수 있었다. 총 페놀 함량도 열수추출물에서 높은 수준을 나타내었다. 반면, 플로라워터의 항산화 활성 은 열수추출물 대비 미비한 효과를 보였으나 한련초의 경우 열수추출물 보다 우수한 결과를 나타내었다. 플로라워터의 경우 액상시료를 첨가하여 수행되는 실험 방법에 의해 정량 적 수치를 명확히 나타내기 어렵기 때문에 연구 방법적 측면에서 개선이 필요할 것으로 판단된다. 결론적으로 일 부 천연색소 추출물은 생물체의 산화적 스트레스로부터 야기되는 활성산소를 억제하는 중요한 역할을 하며, 보다 심도 깊은 연구를 진행한다면 새로운 생물 소재로 활용성이 높을 것으로 사료된다.
감사의 글
본 연구는 2013년도 대구대학교 학술연구비 지원에 의한 논문이며, 이에 감사드립니다.
References
Allan EJ, Fowler MW. 1985; Biologically active plant secondary metabolites perspectives for the future.. Chemistry and Industry. 39 p. 408-410.

Craig WJ. 1997; Phytochemicals: Guardians of our health.. J Am Diet Assoc. 97 p. S199-S204


Heo SI, Wang MH. 2008; Antioxidant activity and cytotoxicity effect of extracts from Taraxacum mongolicum H... Korean J pharmacogn. 39 p. 255-259.

Joung YM, Park SJ, Lee KY, Lee JY, Suh JK, Hwang SY, Park KE, Kang MH. 2007; Antioxidative and antimicrobial activites of lilium species extracts prepared from different aerial parts.. Korean J Food Sci Technol. 39 p. 452-457.

Ali KA, Abdelhak M, George B, Panagiotis K. 2005; Tea and herbal infusions: Their antioxidant activity and phenolic propolis.. Food Chem. 89 p. 27-36


Elzaawely AA, Xuan TD, Tawata S. 2005; Antioxidant and antibacterial activites of Rumex japonicus Houtt.. Biol Pharm Bull. 28 p. 2225-2230


Dabas D, Elias RJ, Lambert JD, Ziegler GR. 2011; A colored avocado seed extract as a potential natural colorant. J Food Sci. 76 p. C1335-C1341


Sato M, Ramarathnam N, Suzuki Y, Ohkubo T, Takeuchi M, Ochi H. 1996; Varietal differences in the phenolic content and superoxide radical scavenging potential of wines from different sources.. J Agric Food Chem. 44 p. 37-41


Szabo MR, Iditoiu C, Chambre D, Lupea AX. 2007; Improved DPPH determination for antioxidant activity spectrophotometric assay, Institute of Chemistry.. Slovak Aca Sci. 61 p. 214-216


Roberta R, Nicoletta P, Anna P, Ananth P, Min Y, Catherine RE. 1999; Antioxidantactivity applying an improved ABTS radicalcation decolorizationassay.. Free Radi Biol Medi. 26 p. 1231-1237


Jung J, Kim HJ, Cho MJ. 1990; Action spectra for the generation of singlet oxygen from mitochondrial membranes from soybean (Glycine max) hypocotyls.. Photochem Photobiol. 52 p. 561-566


MR Al-sereiti, KM Abu-Amer, Sena P. 1999; Pharmacology of rosemary (Rosmarinus officinalis Linn) and its therapeutic potentials.. J Indian Exp. 37 p. 124-131.

Lee YM, Lee JJ, Choi MY. 1998; Antioxidative effect of Pimpinella brachycarpa ethanol extract.. J Life Sci. 18 p. 467-473


Choi YM, Kim MH, Shin JJ, Park JM, Lee JS. 2003; The antioxidant activites of the some commercial teas.. J Korean Soc Food Sci. 32 p. 723-727.

Suh HJ, Lee KS, Kim SR, Shin MH, Park SG, Park S. 2011; Determination of singlet oxygen quenching and protection of biological systems by various extracts from seed of Rumex crispus L.. J Photochem Photobiol B. 102 p. 102-107