서 론
산업화 이후 계속적으로 증가하는 각종 환경오염물질, 흡연, 알코올 및 방사선 등은 인체에 산화적 스트레스를 가중시키며, 이러한 산화적 스트레스가 제거되지 못 하면 생체막의 손상, 고분자 단백질 및 DNA의 변형과 기능 상실 등으로 인한 동맥경화증, 암, 신경퇴행성 질환, 노화 등 여러 질병이 유발될 수 있으므로 산화적 스트레스를 해결하기 위한 항산화제에 대한 관심이 집중되고 있다(1). 또한, 현대인들은 과잉의 영양섭취로 인한 비만(2)에 기인된 고지혈증, 당뇨병, 고혈압 등의 만성질환에 대한 우려가 확산되면서 체중조절을 위한 식품의 필요성이 증대되고 있으나, 과학적으로 증명된 식품이나 소재의 개발이 미흡한 상태이다(3). 우리나라의 식단은 주로 곡류 즉, 탄수화물 위주로 구성되어 있어 지방은 물론 탄수화물 및 단백질의 흡수 억제 활성까지 있어야 비만을 억제할 수 있는 식품 소재로 활용가치가 있다.
해조류는 각종 미네랄과 비타민 및 섬유소, 단백질 등이 풍부하게 함유되어 있을 뿐만 아니라 고압, 저온, 저산소, 고염 등의 독특한 환경 속에서 서식하기 때문에 육상생물과는 다른 대사계나 생체방어계를 가지고 있는 것으로 보고(4)되어져 있으며, 항암(5), 항돌연변이(6), 항염증(7), 고지혈증 및 고혈압 예방(8)과 멜라닌 생성 억제(7) 등 다양한 생리활성을 갖는 물질들을 함유하고 있다. 그 중 갈조류는 건물기준으로 탄수화물을 약 30~67%까지 함유하고 있으며, 갈조류가 함유하는 다당류는 대부분이 알긴산, 라미나린 및 후코이단 등으로 구성되어 있다(9). 대황(Eisenia bicyclis)은 다시마목(Laminariales) 미역과(Alariaceae)에 속하는 다년생 식물로 주로 한국과 일본의 태평양 연안에서 널리 서식하고 있다. 대황은 다른 갈조류의 알긴산과 달리 함황당류인 laminarin을 함유하고 있으며, 이차 대사산물인 phlorotannin 유도체는 항산화(10), 항알러지(11), α-glucosidase 억제(12), 항콜레스테롤(13) 및 항바이러스(14) 등의 생리활성이 있는 것으로 알려져 새로운 기능성 소재로서 부각되고 있다. 본 연구에서는 국내 연안에 자생하는 대황의 이용성 확대와 식품 소재로써 활용 가능성을 구명하고자 추출 방법을 달리한 대황 추출물의 항산화 활성과 단백질 및 탄수화물 소화효소 저해 효과를 비교 검토하였다.
재료 및 방법
대황(Eisenia bicyclis)은 울릉도산을 사용하였으며, 흐르는 물로 세척하여 염분을 제거한 뒤 건조하여 분쇄기(IKA® A11 basic, IKA® Werke GmbH & Co., KG, Staufen, Germany)를 이용 40 mesh 이하로 분쇄한 후 -20℃에서 보관하면서 실험에 사용하였다.
대황의 추출은 분쇄시료 100 g에 20배의 증류수를 가한 후 환류냉각추출(reflux extraction)은 냉각관을 부착하여 80℃의 항온수조에서 3시간 3회 반복 추출하였고, 초음파추출(ultrasonification extraction)은 시료를 넣은 유리병이 초음파 수조(NXPC -4020P, KODO, Hwaseong, Korea) 바닥에 닿지 않도록 하여 40 kHz로 2시간 3회 반복 추출하였다. 고온가압추출(autoclave extraction)은 autoclave(JSAC-100, JS Research Inc., Gongju, Korea)를 이용하여 121℃에서 15분 동안 3회 반복 추출하였다. 저온고압추출(low temperature high pressure extraction)은 저온고압추출기(FT110, benchtop rapid extractor, ARMFIELD, Ringwood, Hampshire, England)를 이용하여 실온에서 2시간 동안 8.0 bar의 압력하에서 3회 반복 추출하였다. 각각의 추출물은 여과지(Whatman No. 2, Maidstone, England)로 여과한 후 회전진공농축기(WB2000, Heidolph, Schwabach, Germany)로 농축한 후 동결 건조하여 사용하였다. 수율은 동결건조 시킨 건물량을 원료 건물량에 대한 백분율로 나타내었다.
상기 제조한 4종의 대황 추출물 시료 각각 1 g을 50 mL의 증류수에 녹이고, CaCl2를 2%(w/v)가 되도록 첨가하여 상온에서 12시간 동안 반응시켜 조 라미나린(crude laminarin)을 분리하였다. 반응 후 원심분리(Centrifuge 5810R, Eppendorf, Hamburg, Germany)하여 그 상등액에 3배(v/v)의 에탄올을 첨가하여 침전물을 회수한 다음 acetone으로 수 회 처리한 후 건조하여 조 후코이단(crude fucoidan)을 얻었다. 각 추출물들의 조 알긴산 및 라미나란 함량은 분리된 다당류를 건조시킨 건물 중량을 원료 건물량에 대한 백분율로 나타내었다(15).
총 폴리페놀 함량 측정은 Folin-Denis 법(16)에 따라 시료 1 mL에 0.2 N Folin-Ciocalteu's phenol reagent(Sigma- Aldrich Co., St. Louis, MO, USA) 1 mL를 가하여 실온에서 3분간 방치 후, 7.5% Na2CO₃1 mL을 가하여 암소에서 1시간 동안 반응 시킨후 후 765 nm에서 흡광도(Ultrospec 1000, Pharmacia Biotech Inc., Cambridge, UK)를 측정하였다. 총 폴리페놀 함량은 gallic acid를 표준물질로 한 표준곡선에 의하여 산출하였다.
플라보노이드 함량은 Abdel-Hameed의 방법(17)에 따라 시료 1 mL에 5% sodium nitrite 0.15 mL를 가한 후 25℃에서 6분간 방치한 다음 10% aluminium chloride 0.3 mL를 가하여 25℃에서 5분간 방치 후 1 N NaOH 1 mL를 가하고 교반하여 510 nm에서 흡광도를 측정하였으며, rutin hydrate(Sigma-Aldrich Co.)의 검량선에 의하여 함량을 산출하였다.
DPPH radical 소거능의 측정은 Blois의 방법(18)을 변형하여 시료 0.4 mL에 0.4 mM DPPH(α,α-diphenyl-β-picrylhydrazyl, Sigma-Aldrich Co.) 에탄올 용액 0.8 mL을 진탕 혼합하고, 10분간 방치 후 525 nm에서 흡광도를 측정하여 계산식, DPPH radical scavenging ability(%)=100-[(OD of sample/ OD of control)×100]에 의하여 활성을 산출하였다.
ABTS radical 소거능은 ABTS radical cation decolorization assay(19)를 이용하여 측정하였다. 7.4 mM의 ABTS[2,2´- azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt, Sigma-Aldrich Co.]와 2.6 mM potassium persulfate를 혼합하여 실온·암소에서 24시간 동안 radical을 형성시킨 다음 실험 직전에 ABTS 용액을 732 nm에서 흡광도가 0.700±0.030(mean±SD)이 되도록 phosphate-buffered saline (pH 7.4)으로 희석하여 사용하였다. 추출물 50 μL에 ABTS 용액 950 μL를 첨가하여 암소에서 10분간 반응시킨 후 732 nm에서 흡광도를 측정하여 계산식, ABTS radical scavenging ability(%)=100-[(OD of sample/ OD of control)×100]에 의하여 활성을 산출하였다.
아질산염 소거능은 Kato 등(20)의 방법에 따라 각 추출물 1 mL에 1 mM sodium nitrite 1 mL를 가하고 0.1 N hydrogen chloride를 가하여 총 부피를 10 mL로 하였다. 이 용액을 37℃에서 1시간 반응시킨 후 1 mL를 취하여 2% acetic acid 4 mL와 30% acetic acid로 용해한 Griess reagent(1% sulfanilic acid : 1% naphthylamine = 1:1) 0.4 mL를 가하고 실온에서 15분간 방치한 후 520 nm에서 흡광도를 측정하여 계산식, nitrite scavenging ability(%)=100-[(OD of sample/ OD of control)×100]에 의하여 산출하였다.
α-Amylase 저해효과는 Lim 등의 방법(21)을 변형하여 측정하였다. 시료 20 μL에 1 unit/mL porcine pancreas 기원의 α-amylase 5 μL와 50 mM potassium phosphate buffer(pH 6.9) 25 μL를 혼합하여 37℃에서 20분간 전 처리한 후 0.5% starch를 25 μL 첨가하여 37℃에서 20분간 반응시켰다. 그 반응액에 48 mM 3,5-dinitrosalicylic acid(DNS) 발색시약을 100 μL 넣고 100℃에서 10분간 끓여 발색시킨 후 충분히 냉각시킨다. 이 반응액에 1 mL 물을 가하고 잘 교반한 후 540 nm에서 흡광도를 측정하였다. α-Amylase 저해효과(%)는 [1-(CAbs-SAbs)/(CAbs-BAbs)]×100: CAbs, 대조구 흡광도; SAbs, 시료 흡광도; BAbs, 시료 무첨가구의 흡광도에 의하여 산출하였다.
Kim 등의 방법(22)에 따라 추출물 0.05 mL, 0.2 unit/mL α-glucosidase 0.05 mL와 200 mM potassium phosphate buffer(pH 7.0) 0.05 mL를 혼합하여 37℃에서 10분간 전처리한 다음 3 mM ρNPG(ρ-nitrophenyl α-D-glucopyranoside) 0.1 mL를 가하여 37℃에서 10분간 반응시킨 후 0.1 M sodium carbonate 0.75 mL로 반응을 정지시켜 405 nm에서 흡광도를 측정하였다. α-Glucosidase 저해효과(%)는 [1-(CAbs-SAbs)/ (CAbs-BAbs)]×100: CAbs, 대조구 흡광도; SAbs, 시료 흡광도; BAbs, 시료 무첨가구의 흡광도에 의하여 산출하였다.
Trypsin 및 α-chymotrypsin 저해효과는 Jang 등의 방법(23)에 따라 10 mM sodium acetate buffer(pH 7.5)에 0.01% trypsin 및 α-chymotrypsin을 용해하여 효소액으로 사용하였다. Trypsin 및 α-chymotrypsin 효소액 0.015 mL에 시료 0.185 mL을 혼합하여 37℃에서 10분간 전 처리 후 10 mM potassium phosphate buffer(pH 7.5)에 용해한 3% azocasein 0.8 mL을 첨가하여 37℃에서 30분간 반응시킨 뒤 110 mM trichloroacetic acid(TCA) 1.0 mL을 첨가하여 반응을 정지시켰다. 상온에서 15분간 반응액을 정치하여 단백질을 침전시키고 10,000×g에서 20분간 원심분리(Wisespin CF-10, Daihan Scientific Co., Wonju, Korea)한 뒤 상등액 1.2 mL에 1 N NaOH 1.4 mL을 혼합하여 440 nm에서 흡광도를 측정하였다. Trypsin 및 α-chymotrypsin 저해효과(%)는 [1-(CAbs- SAbs)/(CAbs-BAbs)]×100: CAbs, 대조구 흡광도; SAbs, 시료 흡광도; BAbs, 시료 무첨가구의 흡광도에 의하여 산출하였다.
결과 및 고찰
Table 1에서 보는 바와 같이 추출방법을 달리한 대황 열수추출물의 수율, 라미나린, 후코이단, 폴리페놀 및 플라보노이드 함량은 추출방법에 따라 유의적인 차이를 나타내었다(p<0.05). 환류냉각추출물(RE), 초음파추출물(SE), 고온가압추출물(AE), 저온고압추출물(LE)의 수율과 주요 성분 함량은 AE, RE, SE, LE 순으로 높았다. 그중 고온가압추출물(AE)의 수율, 라미나린, 후코이단, 폴리페놀, 플라보노이드 함량이 각각 55.21%, 39.03%, 24.75%, 115.68 mg GAE/g, 36.67 mg RHE/g으로 추출물 중 가장 높았다. AE와 RE가 높은 수율을 나타내는 것은 열처리 공정에 의하여 불용성 세포벽의 수용화에 의해 수용성 식이섬유가 증가하게 되고, 수용화 과정 중에 불용성 식물세포벽으로부터 식이섬유 성분이 용해되며, 또한 고압 하에서는 단백질이 변성되거나 세포막이 비가역적으로 분해되어 막 투과성이 증가(24)됨에 따라 물질 이동이 용이하게 되어 보다 많은 성분이 세포 밖으로 용출된 것이라 판단된다. 추출물에 함유된 라미나린과 후코이단은 해조류에 존재하는 주요 기능성 다당류로 항암활성, 면역증강 효과(25)가 있어 기능성 식품소재로서의 활용이 가능할 것으로 판단된다.
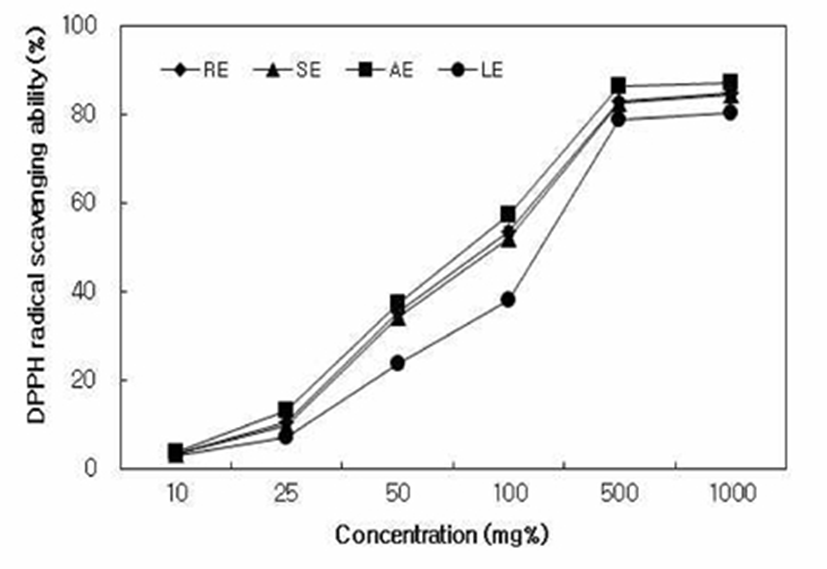
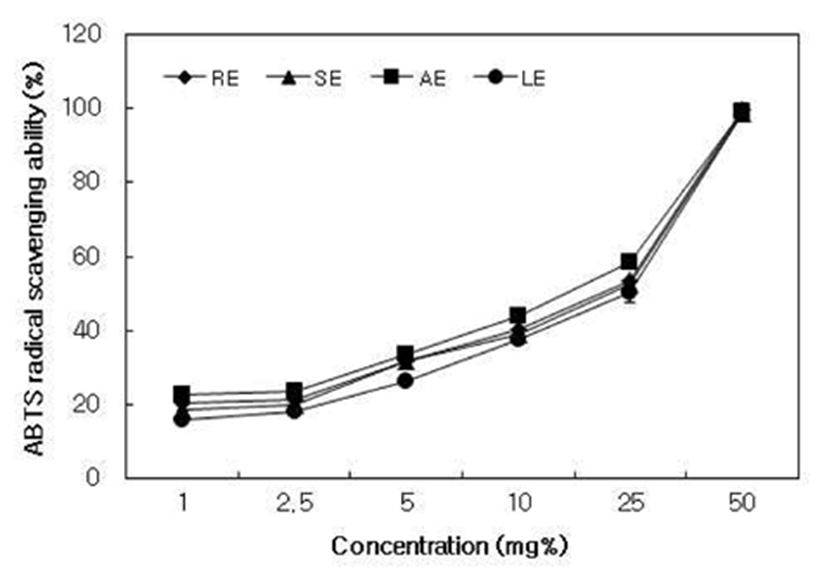
추출방법을 달리하여 제조한 대황 추출물의 DPPH radical 소거능 측정 결과는 Fig. 1과 같이 모든 시료에서 농도 의존적으로 증가하였으며, 500 mg% 농도에서 AE(86.60%), RE(84.41%), SE(83.09%), LE(80.45%) 순으로 총 폴리페놀 및 플라보노이드 함량(table 1)이 높은 AE에서 가장 우수한 DPPH radical 소거능을 나타내었다. 대황 추출물의 ABTS radical 소거능(Fig. 2)은 DPPH radical 소거능과 동일하게 모든 시료에서 농도 의존적으로 증가하였고 50 mg% 농도에서 모두 98% 이상의 높은 활성을 나타내었으며, AE, RE, SE, LE 순으로 높았다. 항산화 물질은 심혈관 질환, 동맥 경화증, 관상 동맥 심장질환, 인슐린 저항성을 포함한 많은 질병 프로세스에 관여하는 활성산소종(reactive oxygen species)을 감소하여 건강을 유지하도록 도와준다(26). Butylated hydroxytoluene(BHT) 및 butylated hydroxy- anisole(BHA)는 강력한 합성 항산화제로 알려졌지만, 동물에 대한 독성 및 발암을 일으키는 것으로 보고되고 있다(27). 따라서 천연 항산화 물질을 찾아내는 것이 무엇보다 중요하게 인식되고 있으며, 대황 추출물은 항산화 활성이 우수한 천연소재로서 활용이 가능할 것으로 판단된다.
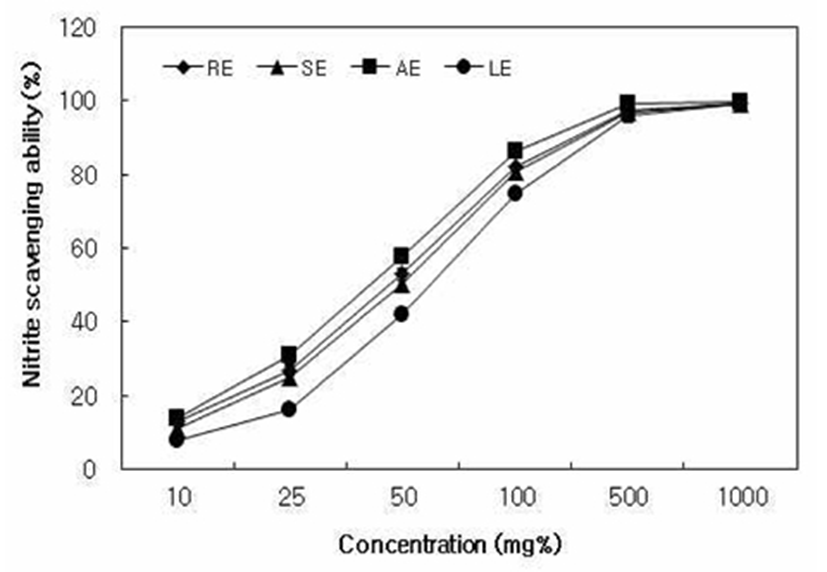
추출방법에 다른 대황 추출물의 아질산염 소거능의 변화는 Fig. 3과 같다. 대황 추출물의 아질산염 소거능은 모든 실험군에서 농도 의존적으로 증가하였고 AE, RE, SE, LE 순으로 높았으며, 500 mg% 농도에서 모두 98% 이상의 높은 활성을 나타내었다. 발암성 물질인 N-nitroso화합물의 전구체의 하나인 아질산염은 미량이기는 하나 야채, 곡류를 비롯한 각종 농산물에 널리 함유되어 있고, 육제품이나 기타 식품의 보존과 발색 안정을 위해 식품 첨가물로도 사용되고 있다. 특히 아질산염은 그 자체가 지니는 독성 때문에 일정농도 이상 섭취하게 되면 각종 중독 증상을 일으키며(28), polyphenol과 flavonoid 화합물은 종류에 따라 차이는 있으나 아질산염을 효과적으로 분해하여 nitrosamine의 생성을 억제한다고 보고되었다(29). 그러므로 대황 추출물을 식품첨가물로 사용할 경우 아질산염에 기인된 가공과정 중 nitrosamine 생성을 억제할 수 있을 것으로 판단된다.
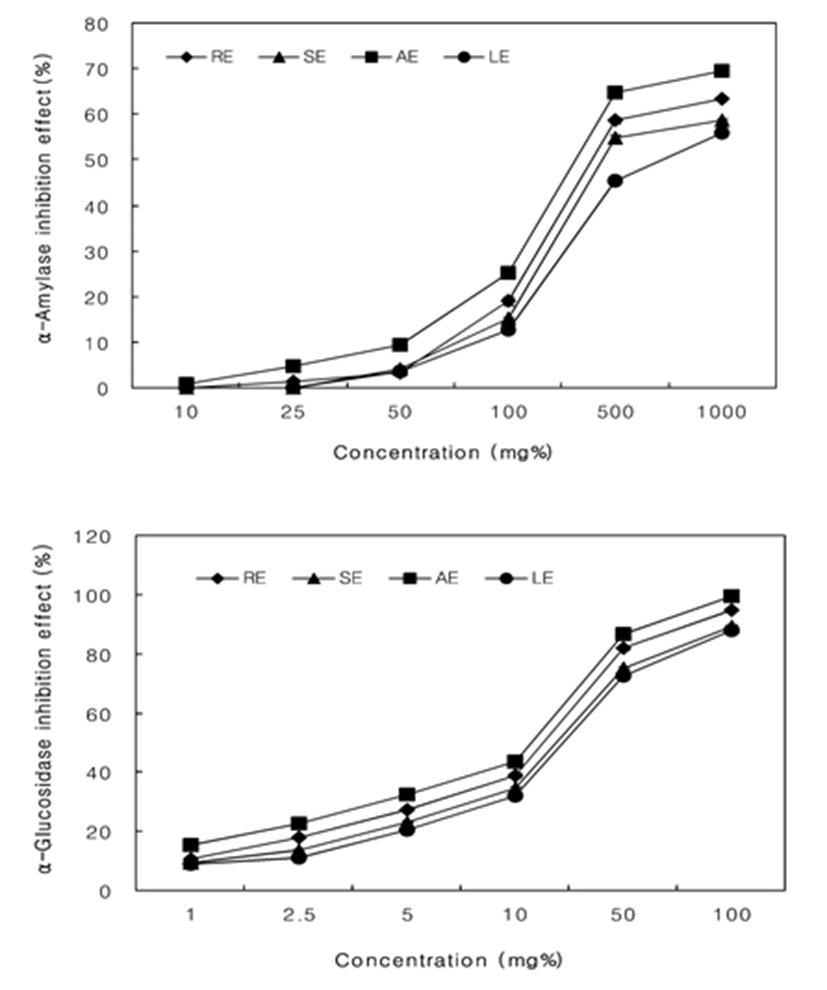
α-Amylase는 녹말(amylose 및 amylopectin)이나 glycogen과 같은 다당류에 작용하여 포도당과 엿당으로 분해하는 소화효소이다. 또한 α-glucosidase는 α-amylase에 의해 분해된 당질 중 엿당을 단당류인 포도당으로 전환시키는 소화효소이다. 이러한 효소의 활성 저해는 당질 가수분해와 흡수과정을 지연시킴으로 식후 당 농도를 제한한다(30). 추출방법을 달리한 대황 추출물의 탄수화물 분해효소 저해 효과를 측정한 결과는 Fig. 4와 같다. 탄수화물 소화효소 중 amylase 저해 효과는 50 mg% 농도에서 AE(64.76%), RE(58.57%), SE(54.76%), LE(45.48%)순으로 나타났으며, α-glucosidase 저해효과는 5 mg% 농도에서 AE(86.71%), RE(81.87%), SE(75.21%), LE(72.65%) 순으로 나타났다. 이러한 결과는 121℃에서 15분간 고온가압 추출법을 이용한 대황 열수 추출물(AE)이 가장 우수한 탄수화물 소화효소 저해효과를 나타내었다. 체내에서 과량의 당질은 지방으로 전환되어 체중증가를 유발하므로 대황 추출물을 이용하여 탄수화물 분해효소의 활성을 억제할 경우 비만을 예방 할 수 있을것으로 판단된다. 특히 α-glucosidase는 식후 혈당치 증가에 밀접한 관계가 있으므로 이를 저해한다는 것은 혈당조절식품개발의 소재로 활용이 가능할 것으로 판단된다.
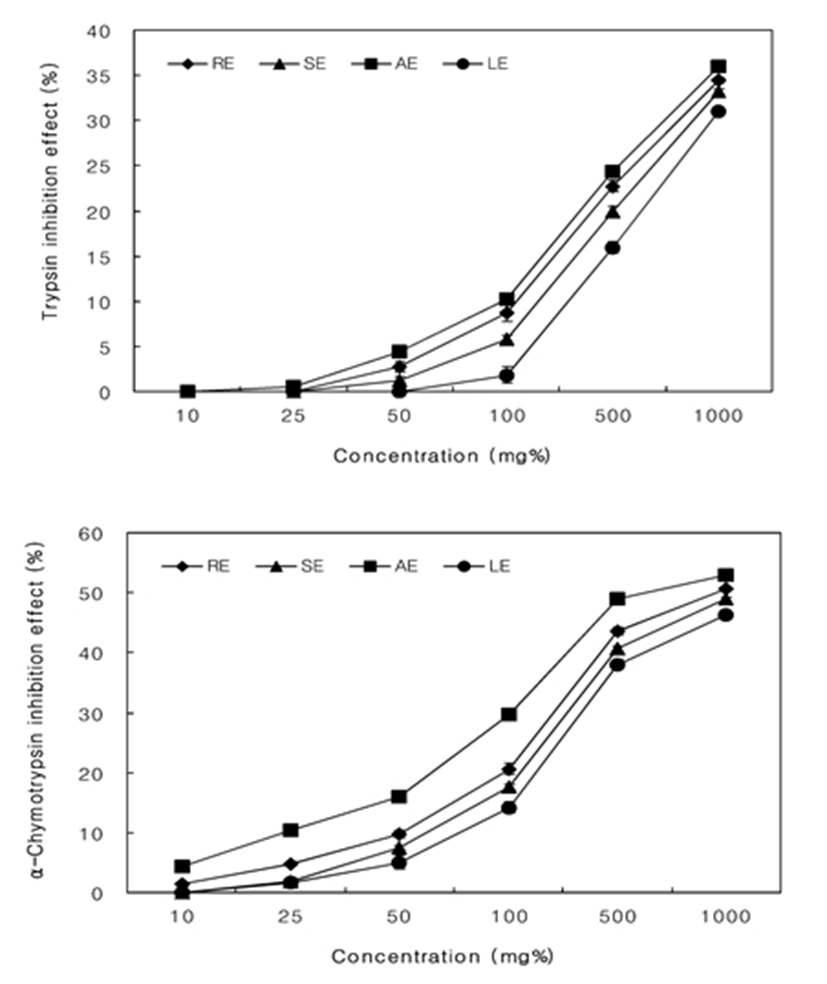
단백질분해에 관여하는 효소인 trypsin은 췌장에서 trypsinogen 형태로 만들어져 소장에 운반되어 enterokinase 또는 trypsin 자체에 의해 활성화되어 단백질을 분해하게 된다. α-Chymotrypsin은 역시 췌장에서 활성이 없는 전구물질인 chymotrypsinogen의 형태로 소장에 분비되고, trypsin이나 chymotrypsin 자체에 의하여 활성화되어 단백질을 분해한다(31). 대황 추출물의 단백질 분해 효소 중 trypsin 저해 효과(Fig. 5)는 50 mg% 농도에서 AE(24.37%), RE(22.76%), SE(19.97%), LE(15.95%)순으로 나타났으며, α-chymotrypsin 저해효과는 50 mg% 농도에서 AE(49.05%), RE(43.60%), SE(40.63%), LE(38.10%) 순으로 나타내어 대황 추출물은 단백질 분해효소 저해효과가 있음을 알 수 있으며, 이러한 효과를 나타냄으로써 체내에서 분해되는 단백질의 양을 감소시켜 단백질의 과잉 흡수를 방지하여 체중조절 및 비만 예방에 효과 있을 것으로 판단된다.
이상의 결과 대황 추출물은 해조류 유래의 기능성 다당류인 라미나린과 후코이단이 풍부하고, 식물체의 주요 생리활성 성분인 폴리페놀 및 플라보노이드를 충분히 함유하고 있어 항산화활성이 우수할 뿐 아니라 탄수화물, 단백질 소화효소 저해효과가 있어, 대황 추출물을 이용한 항당뇨, 항비만 효과가 있는 식품 개발을 유도할 수 있는 소재로서의 활용이 가능할 것으로 판단되며, 대황 추출방법은 121℃에서 15분간 열처리하는 고온가압 추출방법이 가장 효과적인 것으로 판단된다. 아울러 이러한 생리활성을 가진 소재로서의 활용에 앞서 동물실험이나 간이 임상실험을 통해 실제 체내에서 항산화, 항비만, 항당뇨 효과를 확인하는 보다 광범위한 연구가 필요할 것으로 판단된다.
요 약
미역과에 속하는 대황 물 추출물의 항산화활성과 탄수화물 및 단백질 소화효소 저해능을 추출방법을 달리하여 비교 검토하였다. 환류냉각추출물(RE), 초음파추출물(SE), 고온가압추출물(AE), 저온고압추출물(LE)의 수율과 주요 성분 함량은 AE, RE, SE, LE 순으로 높았다. 고온가압추출물(AE)의 수율, 라미나린, 후코이단, 폴리페놀, 플라보노이드 함량은 각각 55.21%, 39.03%, 24.75%, 115.68 mg GAE/g, 36.67 mg RHE/g을 나타내었다. DPPH radical 소거능 모든 시료에서 농도 의존적으로 증가하였으며, 500 mg% 농도에서 AE(86.60%), RE(83.09%), SE(84.41%), LE(80.45%) 순이었다. ABTS radical 소거능은 50 mg% 농도에서 모두 98% 이상의 높은 활성을 나타내었다. 아질산염 소거능은 모든 실험군에서 농도 의존적으로 증가하였고 AE, RE, SE, LE 순으로 높았으며, 500 mg% 농도에서 추출방법에 관계없이 98% 이상의 높은 활성을 나타내었다. 탄수화물 소화효소 중 amylase 저해 효과는 50 mg% 농도에서 AE(64.76%), RE(58.57%), SE(54.76%), LE(45.48%)순으로 나타났으며, α-glucosidase 저해효과는 5 mg% 농도에서 AE(86.71%), RE(81.87%), SE(75.21%), LE(72.65%) 순으로 나타났다. 단백질 분해 효소 중 trypsin 저해 효과는 50 mg% 농도에서 AE(24.37%), RE(22.76%), SE(19.97%), LE(15.95%)순으로 나타났으며, α-Chymotrypsin 저해효과는 50 mg% 농도에서 AE(49.05%), RE(43.60%), SE(40.63%), LE(38.10%) 순이었으며, 대황 추출방법은 121℃에서 15분간 열처리하는 고온가압 추출방법이 가장 양호하였다.