서 론
히카마는 열대 콩과의 덩굴식물로 ‘멕시칸 감자’, ‘멕시 칸 순무’, ‘콩감자’라고 불리우며, 학명은 Pachyrhizus erosus이고 얌빈(yam bean)으로도 알려져 있다. 주원산지는 멕시코 전역이며 브라질, 미국, 중국, 인도네시아, 필리핀, 나이지리아 등에서 생산된다고 한다. 히카마의 덩굴은 수 직으로 5 m이고, 열매의 크키는 6~12 cm, 무게는 500~3,000 g이며, 껍질은 갈색이고 속은 아삭하고, 달콤하다고 한다 (1,2). 히카마의 주요성분은 과당이 β(2→1) glycosidic bond 에 의하여 연결된 형태인 이눌린으로 알려져 있다(3). 히카 마에 함유된 이눌린은 소화효소에 의해 소화되지 않는 난소 화성으로 배변활동, 식후혈당 상승억제, 혈청 콜레스테롤 조절 등에 효능이 있다고 보고된바 있으며(4), 탄수화물대 사에 관여하여 영양소의 소화와 흡수를 지연하는 물질로 이용되고 있다(5). 이눌린 외에도 vitamin A, vitamin C, 칼륨 등이 다량 함유되어있고(6,7), 항암효과(8), 면역능(7), 혈당 강하(9)에 효능이 있다고 보고되었다.
한편, 한국에서도 기후 온난화로 인해 점차 아열대 기후 로 변화하고 있어, 재배가능 지역이 증가됨에 따라 히카마 의 재배를 시도하는 농가가 증가하고 있다. 이처럼 활용도 가 매우 높은 히카마 감자는 한국에서 매우 생소한 작물일 뿐만 아니라 생리활성 및 가공특성에 대한 연구는 전무한 실정이다.
따라서 본 연구에서는 건조방법을 달리한 국내산 히카마 감자의 일반성분, 총당 및 아밀로오스의 함량을 분석하고, 색도와 갈색도를 측정하여 히카마의 식품가공시 활용될 수 있는 기초자료를 제공하고자 하였다.
재료 및 방법
본 실험에 사용한 히카마는 2014년도에 재배한 것으로, 강원도 삼척시 농업기술센터로부터 제공받아 사용하였다. 히카마를 물로 잘 씻어 흙이나 먼지 등의 이물질을 제거한 후 겉껍질을 제거한 다음 3~5 mm 두께로 절편하였다. 이를 동결건조(FD5510, Ilshin Lab, Co., Ltd., Seoul, Korea) 및 60℃의 열풍건조(NB-901M, N-BIOTEK, Gyeonggi, Korea) 를 이용해 건조한 후 food-mixer를 이용하여 40 mesh 입도 로 분쇄하여 사용하였다. 제조한 시료를 이용하여 일반성 분, 색도, 갈색도, 총당 및 아밀로오스 함량을 측정하여 비교 분석하였다.
히카마 열풍건조물과 동결건조물의 일반성분 분석은 AOAC법(10)에 따라 실시하였다. 수분함량은 105℃ 상압가 열건조법으로 측정하였고, 조회분은 550℃ 회화건조법, 조 단백질은 Kjeldahl법, 조지방은 Soxhlet법에 의해 측정하였 다. 탄수화물의 함량은 100에서 수분, 조회분, 조단백질 및 조지방을 뺀 함량으로 표시하였다.
갈색도는 Yilmaz 등(11)의 방법을 변형하여 시료 1 g을 증류수 40 mL와 진탕한 후 10% trichloroacetic acid 40 mL을 첨가한 후 2시간 동안 반응 시켰다. 반응 후 원심분리기 (416G, Gyrogen, Co., Ltd., Daejeon, Korea)를 이용하여 4,000×g에서 20분간 원심분리 후 상등액만 취해 420 nm에 서 흡광도로 갈색도를 나타내었다.
색도는 색차계(CR-400, Minolta Co., Tokyo, Japan)를 사 용하여 Hunter’s L값(lightness, 명도), a값(redness, 적색도) 및 b값(yellowness, 황색도)을 3회 측정하였다. 이때 사용한 표준백색판은 L=93.6, a=0.31, b=0.32 였다.
총당 측정은 phenol-sulfuric acid법(12)을 이용하여 측정 하였다. 분석시료를 농도별로 제조하여 100 mL volumetric flask에 넣고 증류수를 가하여 정용한 후, 희석된 용액 2 mL를 conical tube에 분주하였다. 그 후 5% phenol 1 mL과 95% sulfuric acid 5 mL를 첨가하여 상온에서 30분간 반응시 킨 후 microplate reader(spectraMax i3, Molecular Devices, LLC, Sunnyvale, CA, USA)를 이용해 490 nm에서 흡광도를 측정하였다. 표준물질로는 glucose를 사용하였고, glucose 표준곡선(y=5.1277x-0.003, R2=0.999)을 이용하여 총당 함 량을 mg/g으로 나타내었다.
아밀로오스 측정은 Juliano(13)의 방법으로 측정하였다. 농도별 시료 100 mg에 95% ethanol 1 mL과 1 N NaOH 9 mL씩 첨가하여 100℃에서 10분간 호화시켰다. 그 후 100 mL volumetric flask에 옮겨 증류수로 정용하였다. 이중 5 mL을 취하여 100 mL volumetric flask로 옮긴 후 1 N acetic acid 1 mL와 요오드 용액 2 mL를 첨가하고 증류수로 정용하 였다. 상온에서 20분간 반응시킨 후 microplate reader를 이 용해 620 nm에서 흡광도를 측정하였다. 표준물질로는 amylose(from potato)를 사용하였고, 표준곡선(y=0.0578x +0.0024, R2=0.999)을 이용하여 amylose 함량을 구하였다.
Abdille 등(14)의 방법을 변형하여 DPPH free radical 소거 능을 측정하여 시료의 항산화 활성을 비교하였다. 시료 0.2 mL와 ethanol에 녹인 4 mM DPPH 시약 0.8 mL를 혼합한 후 25℃ 암소에서 10분간 반응시켰으며, blank는 DPPH 시 약을 이용하여 흡광도를 517 nm에서 측정하였다. 또한 다 음 식에 의하여 DPPH free radical 소거능을 나타내었고, positive control로 L-ascorbic acid를 사용하였다.
결과 및 고찰
히카마 열풍건조물의 수분함량은 13.26±0.26%, 동결건 조물의 수분함량은 11.34±0.19% 이었다. 히카마 열풍건조 물 및 동결건조물의 일반성분은 수분을 제외한 고형분을 기준으로 하였고, Table 1과 같다. 히카마 열풍건조물의 조단백질 함량은 2.85±0.27%, 조지방 함량은 0.79±0.08%, 조회분 함량은 7.93±0.52%이고, 탄수화물은 조단백질, 조 지방, 조회분의 함량을 제한 값으로 88.44±0.63%로 나타났 다. 히카마 동결건조물은 조단백질 함량은 3.93±0.65%, 조 지방 함량은 0.83±0.02%, 조회분 함량은 7.92±0.33%, 탄수 화물 함량은 87.32±0.36%로 나타났으며, t-test 결과 열풍건 조물과 동결건조물은 유의적 차이를 보이지 않았다. 본 연 구의 결과는 Fernandez 등(15)이 분석한 일반성분과 비교하 여, 조단백질 함량은 1.62%, 조지방 함량은 0.86% 조회분 함량은 1.09%로 조회분 함량에서 차이를 보였지만 이는 히카마의 원산지 및 재배시기에 따른 차이로 생각된다. 또 한 Choi 등(16)이 분석한 수미감자의 일반성분과 비교하여, 히카마의 조회분과 탄수화물은 더 높은 수치를 나타내었 다. 또한 조지방은 유사한 수치를 보였으며, 조단백질은 더 낮은 것으로 분석되었다.
| Proximate composition | Crude protein | Crude fat | Crude ash | Carbohydrate |
|---|---|---|---|---|
| Hot air-dried Jicama | 2.85±0.271) | 0.79±0.08 | 7.93±0.52 | 88.44±0.63 |
| Freeze-dried Jicama | 3.93±0.65 | 0.83±0.02 | 7.92±0.33 | 87.32±0.36 |
히카마 열풍건조물의 갈색도는 0.107±0.004으로 동결건 조물의 갈색도 0.029±0.002보다 높게 나온 것을 보아 열풍 건조가 갈변에 미치는 영향이 크다는 것을 볼 수 있었다. 이는 Jeong 등(17)의 연구에서 단마(Dioscorea aimadoimo) 의 열풍건조 시 갈변 억제 방안을 연구와 같이 열풍건조가 갈변을 증가시키는 경향을 나타내는 것과 일치한다. 또한 Hunter's value는 색입체를 통해 시각적으로 균일한 색의 측정을 제공하기 위한 것으로 L값은 명도, a값은 적색도, b값은 황색도을 나타내며, 히카마 열풍건조물 및 동결건조 물의 색도 측정 결과는 Table 2와 같다. 열풍건조물의 L값은 88.01±0.67, a값은 0.43±0.11, b값은 11.96±1.50으로 나타났 으며, 동결건조물은 L값은 92.86±0.11, a값은 -0.67±0.11, b값은 3.21±0.31으로 갈색도, 명도, 적색도, 황색도 모두 건조방법에 따른 유의적 차이를 볼 수 있었으며, 시료간의 색도 차이를 나타내는 ΔE값은 10.06으로 색도 차이가 큰 것으로 나타났다. 이는 열풍건조의 갈변으로 인한 것으로 생각되며 Lee 등(18)의 연구에서도 천마의 열풍건조물이 L값은 감소되고, a값과 b값은 증가하는 경향을 보여 본 연구에서의 결과와 유사한 경향을 나타내었다. Table .3
| Samples | Brown index | Hunter’s values | ΔE | ||
|---|---|---|---|---|---|
| L | a | b | |||
| Hot air-dried Jicama | 0.107±0.004*1) | 88.01±0.67 | 0.43±0.11* | 11.96±1.50* | - |
| Freeze-dried Jicama | 0.029±0.002 | 92.86±0.11* | -0.67±0.11 | 3.21±0.31 | 10.06 |
| Samples | Total sugar content (mg/g) | Amylose content (%) |
|---|---|---|
| Hot air-dried Jicama | 46.49±3.001) | 5.66±0.21 |
| Freeze-dried Jicama | 45.11±3.24 | 6.63±0.15* |
당류는 화학적으로 환원성을 갖는 환원당과 환원성을 갖지 않은 비환원당으로 나눌 수 있으며 이를 합하여 총당 이라고 하며(19) 건조방법을 달리한 히카마의 총당 측정 결과 열풍건조물이 46.49±3.00 mg/g 이며 동결건조물이 45.11±3.24 mg/g으로 열풍건조물과 동결건조물의 총당 함 량은 유의적 차이가 없는 것으로 볼 수 있었다. 또한 히카마 의 아밀로오스 함량 측정 결과는 Table 5와 같으며 열풍건 조물에서는 5.66±0.21%이고, 동결건조물에서는 6.63± 0.15%으로 amylose 함량이 약간의 차이가 나타났다. 하지 만 Stevenson 등(20)이 보고한 히카마의 amylose함량과 크 게 다르지 않았다.
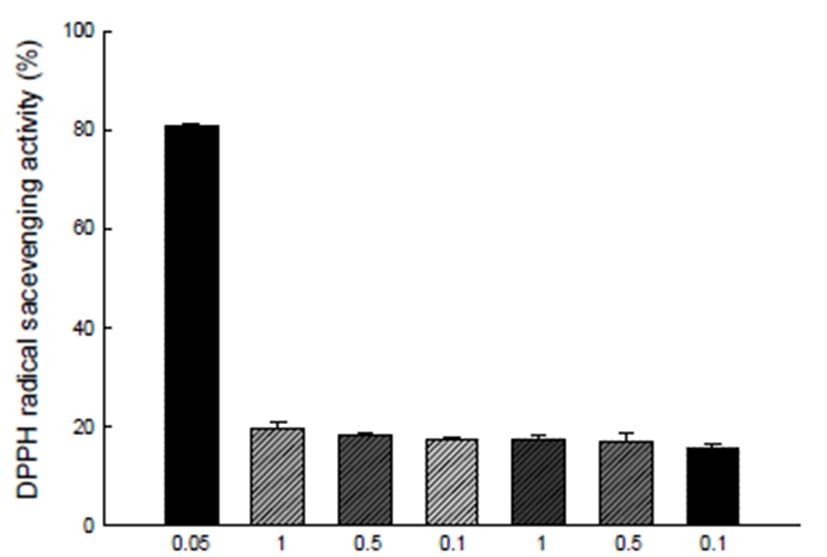
DPPH assay는 페놀성 화합물, 방향족 아민류 및 아스코 르빈산 등에 의해 수소나 전자를 받아 환원되어 보라색이 탈색되는 원리를 이용하여 항산화 활성을 측정하는 방법으 로 비교적 간단하고 짧은 시간 내에 항산화 활성을 측정할 수 있으며, 식물체의 항산화 활성과도 높은 연관성을 가지 기 때문에 널리 사용되는 방법이다(21). Ascorbic acid와 비교하여 히카마의 열풍건조물과 동결건조물의 농도에 따 른 DPPH free radical 소거능을 나타냈으며, Fig. 1과 같다. 열풍건조물과 동결건조물 시료 1 mg/mL, 0.5 mg/mL 0.1 mg/mL에서 각각 19.74, 17.61, 18.23%와 17.18, 17.54, 15.88%로 열풍건조물에서 높게 측정되었으나, ascorbic acid와 비교하였을 때 미비한 수준으로 나타났다. 또한 Jang 등(22)이 보고한 수미감자와 유색감자 6종의 DPPH 소거능 을 비교한 결과 수미감자보다는 높고 유색감자 중 Jasim과 비슷한 수준의 DPPH free radical 소거능을 볼 수 있었다.
요 약
본 연구에서는 히카마의 식품성분들을 분석하고 건조방 법에 따른 특성들을 비교하여 식품 가공시 활용될 수 있는 기초자료를 제공하고자 하였다. 히카마의 수분함량은 81.81%이었으며, 열풍건조물과 동결건조물의 수분함량은 13.26±0.26, 11.34±0.19% 이었다. 수분을 제외한 고형분의 조단백질, 조지방, 조회분, 탄수화물은 열풍건조물에서 2.85±0.27, 0.79±0.08, 7.93±0.52, 88.44±0.63% 이었으며, 동결건조물에서 3.93±0.65, 0.83±0.02, 7.92±0.33, 87.32± 0.36% 이었다. 열풍건조물과 동결건조물의 색도에서는 명 도(L값) 는 88.01±0.67와 92.86±0.11으로 동결건조물이 더 높았으며, 적색도(a값), 황색도(b값)는 각각 0.43±0.11와– 0.67±0.11, 11.96±1.50와 3.21±0.31으로 열풍건조물이 더 높았다. 건조방법에 따른 갈변을 살펴본 결과 열풍건조물 이 0.107±0.004, 동결건조물이 0.029±0.002으로 열에 의한 갈변이 나타났다. 총당 측정은 열풍건조물이 46.49±3.00 mg/g, 동결건조물이 45.11±3.24 mg/g으로 유의적 차이를 보이지 않았으나, 아밀로오스의 경우는 열풍건물이 5.66± 0.21%, 동결건조물이 6.63±0.15%으로 차이를 보였다. DPPH free radical 소거능은 열풍건조물과 동결건조물 시료 1 mg/mL, 0.5 mg/mL 0.1 mg/mL에서 각각 19.74, 17.61, 18.23%와 17.18, 17.54, 15.88%로 열풍건조물에서 높게 측 정되었으나, 아스코르빈산과 비교하였을 때 낮은 수준을 보였다.