서 론
최근 현대인들은 생활수준의 향상과 더불어 건강에 대한 관심도 높아지고 있으며, 건강 증진을 위해 장내 균총을 새롭게 형성하거나 면역계 활성 등을 목적으로 프로바이오 틱스(probiotics)라는 미생물 유래 식품 보충제가 널리 사용 되고 있다(1,2). 현재, 프로바이오틱스로는 Lactobacillus acidophilus, Bacillus polyfermenticus, Bacillus subtilis, Bacillus amyloliquefaciens 등이 주로 연구되었다. 그 중 Bacillus 속은 산업적으로 중요한 종으로 오랜 기간 식품, 의약품 및 각종 발효 산업에서 사용되어 안전성이 확립되어 있다. Bacillus 속 미생물은 다양한 소화효소를 분비하거나 생리활성을 가지는 펩타이드를 생산할 수 있는데, 대표적 인 소화효소에는 protease와 xylanase가 있다(3,4).
Protease는 다른 단백질의 아미노산간 peptide 결합을 가 수분해하는 효소이며 전 세계적으로 공업효소 판매량의 60%를 차지하고 있다. 단백질 구조와 기능 등의 기초연구 분야 뿐만 아니라 조미료 제조, 식육의 연화, 주류의 혼탁방 지, 치즈숙성, 제빵 등의 식품산업, 소화제 등의 제약산업, 세제, 피혁, 환경에 관련된 각종 산업분야에서 그 요구도가 증가하고 있다. Protease는 모든 생물체에서 생성되며, 세 균, 곰팡이, 효모 등 미생물에 의해 다량 생산되지만 특히 Bacillus 속 균주가 산업적 생산을 위해 사용되고 있다(5,6). 미생물에 의해 생산되는 protease는 대량배양을 통해 안정 적으로 생산 가능하다. 이는 미생물 배양조건을 통해 공정 을 최적화하여 생산성과 경제성을 높일 수 있으므로 산업적 측면에서 매우 유용하게 용도와 기능에 따라 지속적으로 개발되고 있다(6). 현재까지 효소를 생산하는 미생물들이 보고되어져 있는데 protease를 생산하는Bacillus 속 균주는 콩을 발효한 식품인 청국장(7,8), 된장(9), 간장(10) 등으로 부터 분리되어 연구되고 있으며 이러한 미생물 중에도 특 히, 안전성이 확보된 생물자원으로서 다양한 바이오산업 에 활용 가치가 높아 주목을 받고 있다(11).
소장에 존재하는 α-glucosidase는 식이 중에 함유된 탄수 화물을 단당류로 전환시켜 흡수를 가능하게 하는 탄수화물 소화에 필수적인 효소이다. α-Glucosidase 저해제는 섭취한 탄수화물의 흡수를 막고 바로 배출시켜 식후 혈당을 저하시 키는 효과를 가지며(12,13) typeⅡ 인슐린 비의존성 당뇨, 비만과 고지혈증 등의 대사성 질환 치료제로서의 개발 가능 성에 대해 관심을 받고 있는 물질이다(14,15). α-Glucosidase 저해제는 주로 식물 또는 식품에서 유래되어 개발되었는데 천연물 기원의 물질은 대량생산의 어려움이 있기 때문에 미생물에 의한 저해제가 최근 많이 연구되고 있다(16). 대표 적인 예로 Actinoplanes spp.의 발효산물에서 분리한 acarbose가 있으며(17), 중국의 비지(okara)와 국내 토양 등 에서 유래된 미생물으로부터 α-glucosidase 저해물질 탐색 이 이어지고 있다(17-19).
따라서 본 연구에서는 새로운 프로바이오틱스를 선발하 고자 국내 된장 및 청국장으로부터 protease 활성이 우수하 면서 GRAS(generally recognized as safety)균주로 안전성이 확보된 Bacillus 속 균주를 분리, 동정하였으며 protease 생 산 특성 및 α-glucosidase 저해활성에 대해 조사하였다.
재료 및 방법
Protease 생산 균주를 분리하기 위하여 4개지역(구미, 김 천, 대구 및 포항) 각 가정에서 제조한 된장16종 및 청국장 5종을 수집하고 2014년 11월에 80종을 분리하여 시료로 사용하였으며, 그 중 protease분비능이 있는 균주를 다음과 같이 분리하였다. 0.85% sodium chloride(Duksan pure chemicals Co., Ltd., Seoul, Korea)용액 9 mL를 혼합하여 10배 희석법으로 희석한 다음, 각각에 희석액 100 μL를 nutrient agar(Difco, Detroit, MI, USA)에 접종하여 37℃ 배양 기(IB-25G, Jeio tech Co., Ltd., Seoul, Korea)에서 24시간 배양한 다음 형성된 colony를 skim milk가 2% 포함된 nutrient agar 배지에 균주를 접종한 뒤 37℃에서 24시간 배양한 후 형성되는 투명환의 크기를 측정하여 protease 활성이 높은 균주를 분리하였고 CDD5, CPD4, CGD3로 명명하였다.
된장 및 청국장으로부터 분리된 protease 생산균주가 식 품에 적용가능 한 미생물인지 확인하기 위하여 16S ribosomal RNA 유전자 염기서열 분석을 통한 균주동정을 ㈜솔젠트(Solgent Co., Daejeon, Korea)에 의뢰하여 동정하 였다.
균주의 생균수 측정은 배양액 1 mL에 0.85% sodium chloride(Duksan pure chemicals.)용액 9 mL를 혼합하여 10 배 희석법으로 희석한 다음, 각각의 희석액 100 μL를 nutrient agar(Difco.)에 접종하여 37℃ 배양기에서 24시간 배양한 다음 형성된 colony 수를 계측하고, colony에 희석배 수를 곱하여 시료 mL당 colony forming unit(CFU)로 나타내 었다. Protease 활성은 Kunitz법(20)을 변형하여 측정하였 다. 시료 0.5 mL와 50 mM sodium phosphate 완충용액(pH 7.0)을 이용한 0.6% casein 용액(w/v, Duksan pure chemicals.) 0.5 mL를 가하고 진탕 항온수조(BS-31, Jeio tech.)를 이용하 여 37℃, 100 rpm에서 30분간 반응시킨 후 0.44 M trichloroacetic acid(Acros organics, Geel, Belgium) 1.0 mL를 넣어 37℃에서 30분간 반응을 중지시키고 반응액을 원심분 리기(1236MG, GYROZEN Co., Ltd., Daejeon, Korea)를 이 용하여 3,000 rpm에서 10분간 원심분리 하였다. 상등액 1 mL를 취하여 0.55 M sodium carbonate anhydrous (Duksan pure chemicals.) 2.5 mL와 1/3 희석한 folin ciocalteu 용액 (Sigma-Aldrich Co., St. Louis, MO, USA)을 0.5 mL를 가하 여 37℃에서 30분간 발색반응을 시킨 다음 분광광도계 (Ultraspec-2100pro, Amersham Co., Uppsala, Sweden)로 660 nm에서 흡광도를 측정하였다. Protease 활성은 tyrosine (Sigma-Aldrich Co.)을 정량하여 작성한 표준곡선으로부터 계산하였으며, 활성단위(unit)는 1분당 1 μg의 tyrosine을 생성하는 효소의 양으로 정의하였다.
Protease 활성에 영향을 미치는 pH, 온도 및 기질특이성 은 37℃에서 24시간 동안 180 rpm으로 진탕 배양한 후 배양 액을 3,000 rpm, 10분간 원심분리 하여 배양 상층액을 조효 소액으로 사용하였고, 가장 높은 protease 효소활성을 100% 로 하여 각 균주의 효소활성의 pH, 온도, 기질특이성을 나타 내었다. 효소 활성에 미치는 pH의 영향을 확인하기 위하여 50 mM 완충용액(pH 3.0~7.0, citrate-phosphate buffer; pH 6.0~8.0, phosphate buffer; pH 8.0~9.0, Tris-HCl buffer; pH 10.0, carbonate-bicabonate buffer)을 이용하여 기질을 제조 하였으며, 온도의 영향은 20℃~70℃ 범위에서 확인하였다. 효소활성에 따른 기질특이성은 0.6%의 bovine serum albumin, casein, egg white, elastin, skim milk를 기질로 하여 protease활성을 측정하였다.
분리 동정된 미생물의 생육조건을 확인하기 위해 초기 pH, NaCl 및 glucose 조건을 달리하여 균의 생육 정도를 600 nm에서 흡광도로 측정하였다. Nutrient broth(Difco.)의 pH를 3.0~11.0로 조정 후, 1%(v/v)의 전배양 균주를 각 배지 에 접종하여 24시간 배양을 진행하면서 균 생육을 관찰하 였다. 그리고 균 생육에 있어서 NaCl 및 glucose 농도의 영향을 확인하기 위하여 NaCl은 3~15% 농도를 달리한 Nutrient broth(Difco.)를 제조하였고, glucose는 5~40% 농도 를 달리하여 1%(v/v)의 전배양 균주를 각각의 배지에 접종 한 후 24시간 배양을 진행하면서 균 생육을 관찰하였다.
α-Glucosidase 저해활성은 Watanabe 등(21)의 방법에 따 라 측정하였다. 각 균주의 배양 상층액 60 μL에 0.2 Unit/mL α-glucosidase 효소액 50 μL, 0.1 M potassium phosphate buffer(pH 6.8) 50 μL를 혼합하여 37℃에서 20분 동안 전 배양 한 후 3 mM ρ-nitrophenyl α-D-glucopyranoside(ρNPG) 50 μL를 첨가한 다음 37℃에서 20분간 반응시키고 0.1 M sodium carbonate 500 μL로 반응을 정지시켰다. 405 nm에서 흡광도를 측정하고 시료용액과 동량의 완충용액을 넣은 대조군을 기준으로 효소 저해 활성을 아래의 식으로 계산하 였다.
AbSample, blank, control : Absorbance of the sample, blank, and control
α-glucosidase Inhibition rate (%)=1-(AbSample–AbSblank)/AbScontrol〕×100
결과 및 고찰
된장 및 청국장으로부터 protease 생산균주를 분리 한 결과 skim milk(2.0%)를 첨가한 nutrient agar배지에서 우수 한 활성환을 나타내면서 GRAS 미생물인 3개의 protease 생산균주를 선정하였다(Table 1). 최종적으로 16S ribosomal RNA 유전자 염기서열을 이용하여 BLAST 분석한 결과 분리 한 세 균주는 모두 Bacillus amyloliquefaciens와 98~99%의 유사성을 보였으며 각각Bacillus amyloliquefaciens CDD5, Bacillus amyloliquefaciens CPD4 및 Bacillus amyloliquefaciens CGD3로 명명하였다. Jung(22)은 B. amyloliquefaciens를 이용하여 콩 종류와 발효온도를 달리 한 청국장을 제조하였고, Lee 등(23)은 된장으로부터 분리 한B. amyloliquefaciens KHG 19를 이용하여 시판 된장보다 우수한 단백질 분해능과 혈전용해능을 가지는 기능성된장 을 제조에B. amyloliquefaciens를 활용하여 연구한 바 있다.
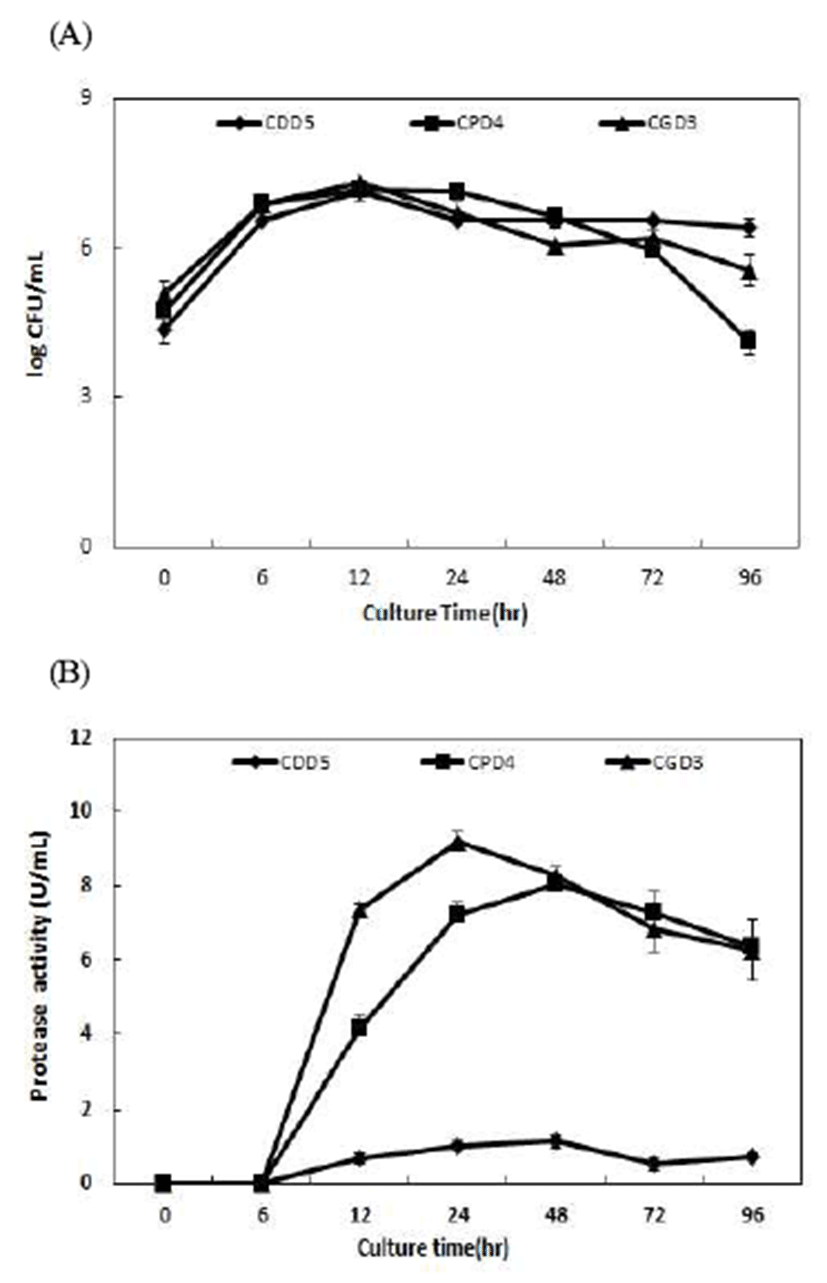
분리된 B. amyloliquefaciens CDD5, B. amyloliquefaciens CPD4 및B. amyloliquefaciens CGD3의 배양시간별 생육도 와 protease활성은 Fig. 1과 같다. 각 균주의 생육도는 12시 간 배양하였을 때 B. amyloliquefaciens CDD5, B. amyloliquefaciens CPD4 및 B. amyloliquefaciens CGD3가 각각 7.13, 7.18, 7.32 log CFU/mL로 최대 생육도를 보였으 며 protease활성은 0~6시간까지는 protease활성이 나타나지 않다가 6시간이후 protease활성이 점차 증가하는 경향을 보여주었다. 생균수는 12~24시간 배양시 최고생육이 유지 되다가 24시간 이후부터 생육이 감소하였다. Protease 활성 또한최고생육을유지하는24시간배양시B. amyloliquefaciens CGD3는 9.21 U/mL로 가장 높은 활성을 나타내었고, B. amyloliquefaciens CPD4는 6시간 이후 지속적으로 생육이 증가하다가 48시간 배양시 8.02 U/mL로 높은 활성을 나타 내었다. 이는 Ahn 등(8)이 청국장으로부터 분리한 Bacillus strains 중 B. subtilis를 24시간 배양 시 가장 높은 protease 활성이 약 8.00 U/mL이었으며, B. amyloliquefaciens 5종은 24시간 배양 시 약 2.00~6.00 U/mL의 활성을 나타내었다. 이에 따라 본 연구에서 분리한 B. amyloliquefaciens 균주 중 B. amyloliquefaciens CGD3균주가 우수한 protease활성 을 갖는 균주임을 확인하였다. 이러한 결과를 종합하여 보 면, 12시간 이상 배양이 요구되며 protease 효소 활성도 우수 한 것으로 사료되며 Lim 등(24)의 연구결과에 따르면 최대 활성이 검출된 시점이 exponential phase의 말기시점으로서 균체량과 효소생산량과의 상관관계가 약간의 차이를 보이 며 균주의 grow pattern과 효소활성과는 반드시 일치하는 것은 아니나 정체기 시점에서부터 활성이 감소하는 현상이 일반적인 현상이라고 보고하였는데 이는 본 실험결과와 유사하였다. B. amyloliquefaciens CDD5는 7.13 log CFU/mL 까지 생육하였지만 protease 활성이 0.55~1.14 U/mL로 낮았 고B. amyloliquefaciens CPD4 및B. amyloliquefaciens CGD3 의 균주는 우수한 protease활성을 가지는 균주임을 확인하 였다.
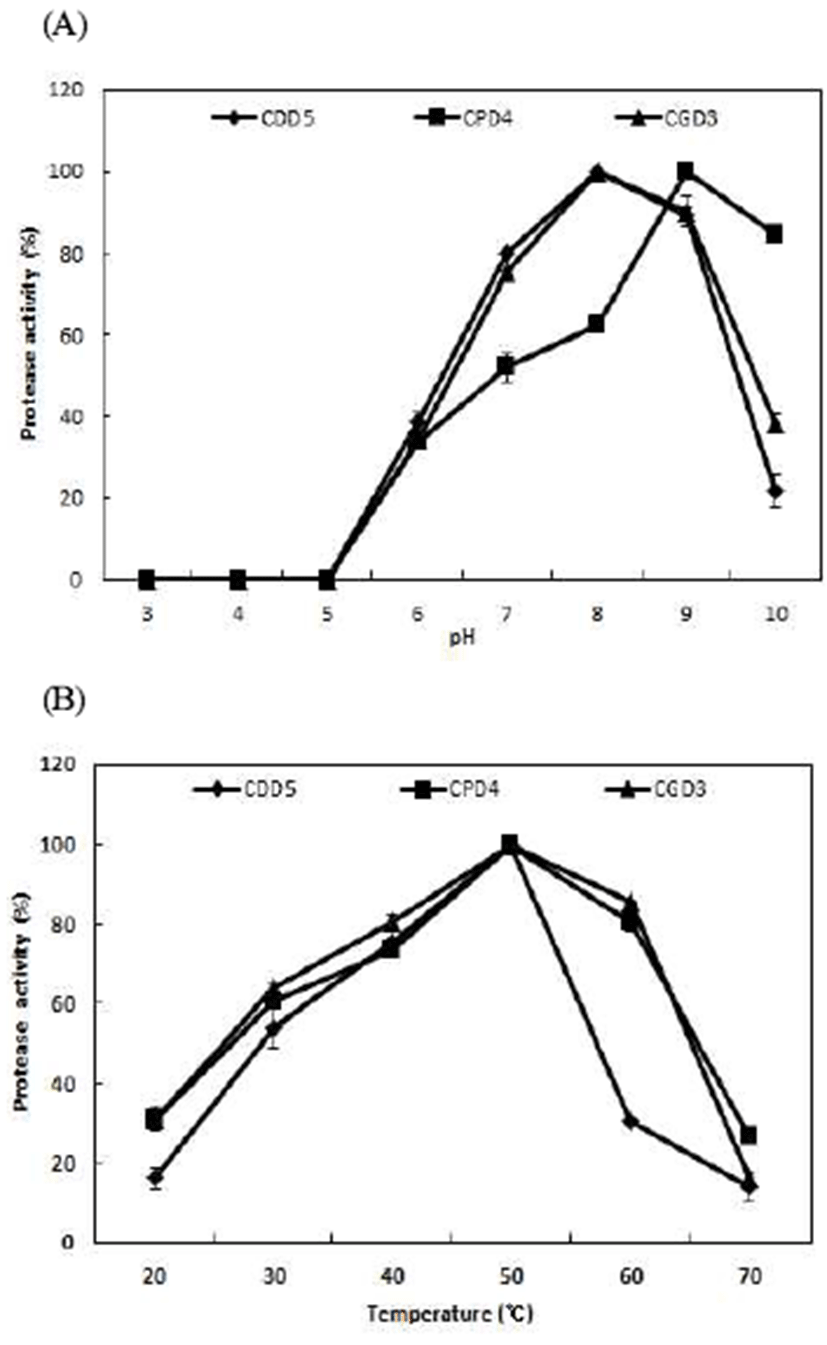
B. amyloliquefaciens 균주를 pH와 온도를 달리하면서 protease 활성을 분석한 결과는 Fig. 2와 같다. 그 결과 최적 pH는B. amyloliquefaciens CDD5에서pH 8.0, B. amyloliquefaciens CPD4가 pH 9.0, B. amyloliquefaciens CGD3는 pH 8.0으로 나타났다. 이는 Kim(25), Hwang 등(26), Moon 등(27), Kim 등(28)이 Bacillus sp.의 alkaline protease의 최적 pH가 9.0~10.0인 연구결과와 비교하여B. amyloliquefaciens CDD5 는 pH 7.0~9.0범위에서 78% 이상, B. amyloliquefaciens CPD4는 pH 8.0~10.0범위에서 protease 활성이 62% 이상, B. amyloliquefaciens CGD3는 pH 7.0~9.0 의 범위에서 protease 활성이 75% 이상의 활성을 나타냄으로써 유사한 경향을 보였다. 특히 B. amyloliquefaciens CPD4가 pH 10.0 에서 84.54% protease 활성을 보였으며, pH 8.0 이하에서 활성이 급격히 감소하여 alkaline protease로 판단한 Bang 등(29)의연구와유사하게pH 8.0이하에서B. amyloliquefaciens CPD4의 protease 활성이 52.09%로 감소하는 경향으로 나타 나 alkaline protease로 사료된다. B. amyloliquefaciens의 protease의 최적 활성 온도를 확인한 결과 분리된 B. amyloliquefaciens CDD5, B. amyloliquefaciens CPD4, B. amyloliquefaciens CGD3 균주 모두 50℃에서 최적 온도를 나타내었다. B. amyloliquefaciens CDD5는 40~50℃에서 75% 이상, B. amyloliquefaciens CPD4는 40~60℃에서 73% 이상, B. amyloliquefaciens CGD3는 40~60℃에서 80% 이상 높은 효소활성을 보였다. 이 결과는 protease 활성의 최적온 도가 30℃인 Kim 등(28)의 연구와 비교하면 본 연구의 균주 가 다소 높은 최적 온도를 나타냈으며, Kim(25)이 청국장으 로부터 분리한Bacillus subtillis JK-1의 최적 온도가 55℃인 결과와 유사하였다. 이러한 결과로 볼 때 분리된 균주는 알칼리범위인 pH 8.0~9.0, 50℃에서 최대 protease 활성을 나타내는 특성을 보였으며, Bang 등(29)의 연구결과에서 pH 10.0, 50℃의 조건에서 최대 활성을 나타낸 alkaline protease의 특성과 유사하였다. protease의 기질에 대한 특이 성을 확인한 결과 Table 2와 같으며 B. amyloliquefaciens CDD5, B. amyloliquefaciens CPD4, B. amyloliquefaciens CGD3 세 균주 모두 casein을 기질로 사용하였을 때 가장 높은 protease활성을 보였으며 skim milk를 기질로 사용하 였을 때 45.34, 57.24 및 67.12%의 활성을 확인하였다. 이는 Lim 등(30)이 메주에서 분리한 단백질분해 효소생산하는 Rhizopus stolonifer, Rhizopus oryzae 및Absidia corymbifera 와 같은 접합균모두 Hammastein casein에 대한 기질특이성 이 가장 높아 유사한 경향을 나타내었으며, Byun 등(31)이 전통메주에서 분리한Bacillius subtillis YG-95는 soy protein isolate(SPI)가 casein보다 높게 나와 상이한 결과를 나타내 었다.
| Substrate | Relative activity (%) | ||
|---|---|---|---|
| CDD5 | CPD4 | CGD3 | |
| Bovine serum albumin | 0 | 0 | 0 |
| Casein | 100 | 100 | 100 |
| Egg white | 3.47 | 17.44 | 1.95 |
| Elastin | 0 | 0 | 0 |
| Skim milk | 45.34 | 57.24 | 67.12 |
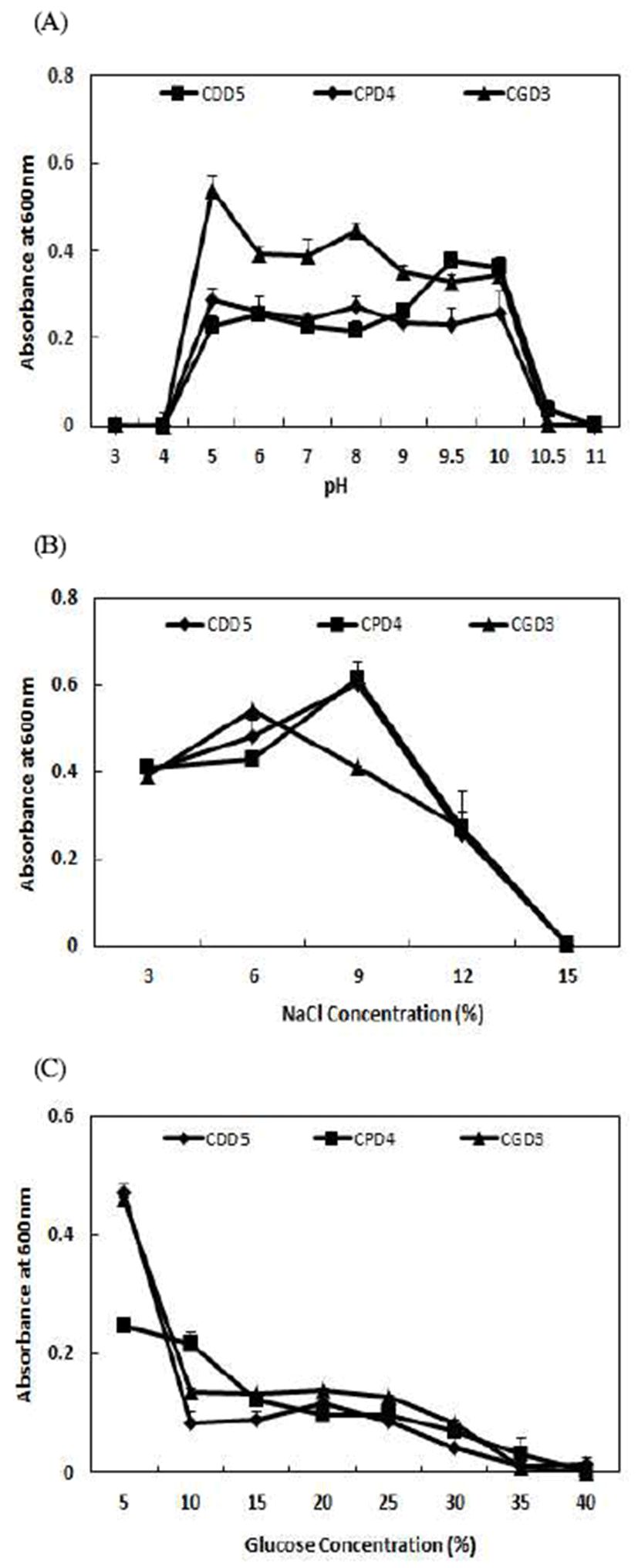
된장 및 청국장으로부터 분리된 B. amyloliquefaciens CDD5, B. amyloliquefaciens CPD4, B. amyloliquefaciens CGD3의 최적 생육특성을 확인하기 위해 초기 pH, NaCl, glucose를 달리한 배지에서 균주를 배양하여 생육특성을 확인하였다(Fig. 3). 그 결과 세 균주 모두 초기 pH 5.0~10.0 의 배지조건에서 고르게 생육하였다. 이는 Bae 등(32)이 맥아에서 분리한B. amyloliquefaciens CNL-90는 pH 6.0~9.0 범위에서 95% 생존율을 나타낸 결과와 비교하여 분리균주 가 더 넓은 pH 범위에서 생육함을 확인할 수 있었다. 특히 B. amyloliquefaciens CGD3가 pH 5.0에서 가장 안정적으로 생육함을 알 수 있었고 pH 5.0 이하, pH 10.0 이상의 조건에 서는 분리된 모든 균주가 생육이 현저하게 저하되어 pH 3.0, pH 11.0의 조건에서 균 생육은 거의 확인되지 않았다. B. amyloliquefaciens의 내염성을 확인하기 위해 NaCl을 농 도별로 첨가한 배지에서의 생육특성을 확인한 결과 B. amyloliquefaciens CGD3는 6% 농도에서 배양 시 흡광도 값이 0.54±0.05로 가장 높은 생육을 보였으며, 동일한 농도 에서B. amyloliquefaciens CDD5, B. amyloliquefaciens CPD4 의 흡광도는 각각 0.48±0.03, 0.43±0.01를 보였고 9% 농도 에서 가장 높은 생육을 보여 각각 0.60±0.01, 0.61±0.03의 흡광도 값을 나타내었고 분리 세 균주 모두 12% 농도까지 느리지만 증식하였으며 15% 농도에서는 생육하지 못하였 다. 이는 Lee 등(33)의 연구결과에도 유사하게 12%의 NaCl 농도에서도 균생육이 양호하다는 보고하였으며 이러한 결 과를 종합하여 볼 때, B. amyloliquefaciens CDD5, B. amyloliquefaciens CPD4는 B. amyloliquefaciens CGD3는 내 염성이 높은 균주임을 확인하였다. Glucose를 농도별로 첨 가한 배지에서 B. amyloliquefaciens 내당성을 확인한 결과 B. amyloliquefaciens CDD5, B. amyloliquefaciens CPD4, B. amyloliquefaciens CGD3 모두 5% 농도까지 균이 생육하였 으나 10% 이상에서는 현저하게 생육이 낮아짐을 확인할 수 있었으며, 특히B. amyloliquefaciens CPD4는 5% 농도에 서 B. amyloliquefaciens CDD5, B. amyloliquefaciens CGD3 균주들 보다 생육이 저조하여 내당성이 낮은 것을 확인 할 수 있었다. 이러한 결과로 볼 때 넓은 범위의 pH에 생육 이 가능하고 저염장류들의 식염농도가 통상 12% 부근인 점을 고려할 때 장류등의 염을 포함한 조건하에서 발효하여 산업용 미생물로서 적용가능하리라 사료된다.
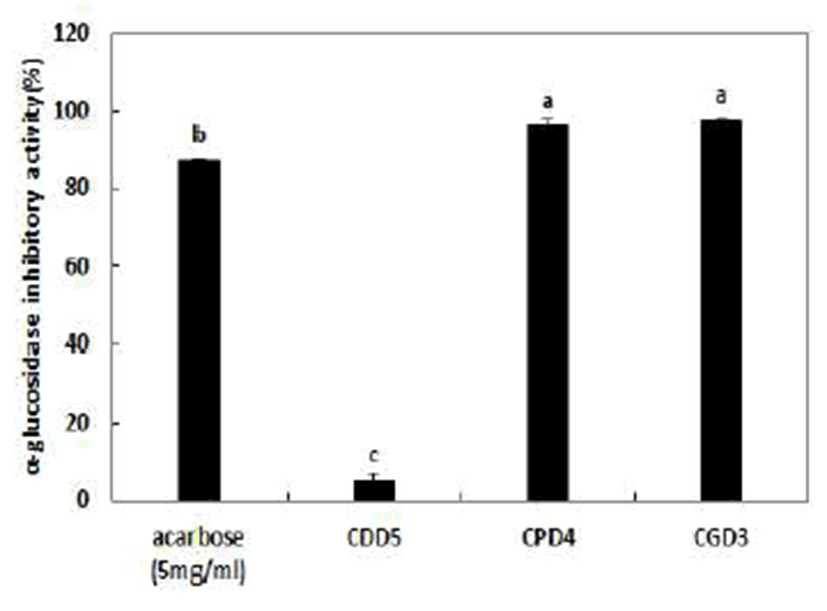
분리한 3종의 균주가 생산하는 α-glucosidase 효소활성 저해능을 각 균주의 배양 상층액으로 측정한 결과 B. amyloliquefaciens CPD4 및B. amyloliquefaciens CGD3 균주 에서 양성대조군인 acarbose만큼 우수한 억제효과를 나타 냄을 확인하였다(Fig. 4). B. amyloliquefaciens CDD5의 경우 α-glucosidase 저해활성을 거의 나타내지 않았지만 B. amyloliquefaciens CPD4 및 B. amyloliquefaciens CGD3에서 는 각각 96.65% 및 97.85%의 높은 저해활성을 나타내었다. Myoung 등(19)이 전통식품에서 분리하여 항당뇨 물질로서 이용가능성을 보고한 B. subtillis Y3-7의 배양액의 α -glucosidase 저해능이 80.01%의 결과와 비교하여 본 실험 에서분리한B. amyloliquefaciens CPD4 및B. amyloliquefaciens CGD3가 α-glucosidase 저해 활성이 우수함을 확인하였다. Kim(34)이 청국장에서 분리한 B. subtillus가 α-glucosidase 저해제활성을 가지며 in vivo상에서도 현저한 혈당감소효 과를 보여B. subtillus를 경구혈당강하제로서 이용가능성을 확인하여 본 연구에서도 분리한 균주 또한 탄수화물 대사 이상 질환의 증상개선에 유용한 물질로 개발 가능성이 있는 것으로 사료된다. 또한 Kim 등(35)은 α-glucosidase 저해 활성과 α-glucosidase 저해제인 DNJ(1-deoxynojirimycin)를 가지는B. subtillus MORI 균주를 분리하였는데 α-glucosidase 저해제인 DNJ는 최초로 L-sorbofuranose로부터의 합성 또 는 nojirimycin의 환원 등과 같은 화학적인 방법에 의해 얻어 졌으나, 이후Bacillus sp.나Streptomyces sp. 등과 같은 미생 물의 배양액 등으로부터 정제되어 이용되고 있으므로 본 연구에서 α-glucosidase 저해 효과를 가지고 있어 당뇨예방 용 기능성식품 소재로의 활용가능성이 기대된다.
요 약
본 연구에서는 새로운 프로바이오틱스를 선발하고자 protease를 생산하는 GRAS균주를 된장 및 청국장으로부터 분리하고 그 특성을 조사하였다. 분리한 균주를 분리 동정 한 결과 각각B. amyloliquefaciens CDD5, B. amyloliquefaciens CPD4 및B. amyloliquefaciens CGD3로 명명하였다. 분리균 주의 생육은 12시간 배양 시, 7.13~7.32 log CFU/mL로 최대 생육도를 보였으며 24시간까지 유지되다가 감소하는 경향 을 나타내었고, 그 중B. amyloliquefaciens CGD3의 protease 활성이9.21 U/mL로서가장높게나타났다. B. amyloliquefaciens 이 생산하는 protease 활성은 pH 7.0~10.0, 온도는 50℃에서 최적활성을 나타내었으며, casein에서 protease활성이 가장 우수하게 나타났다. pH, NaCl, glucose 농도를 달리한 배양 조건에 따른 B. amyloliquefaciens의 생육특성으로는 pH 5.0~10.0의 넓은 범위에서 생육하였고, NaCl은 12% 농도까 지 증식하였으며 glucose 5%까지는 생육하나 10% 농도부 터는 현저하게 생육이 낮아짐을 확인하였다. 또한 혈당저 하를 유도하는 α-glucosidase의 저해활성을 측정한 결과, B. amyloliquefaciens CPD4 및B. amyloliquefaciens CGD3에 서는 각각 96.65% 및 97.85%의 저해율을 나타내었다. 이러 한 결과는 특히 protease활성이 가장 우수하고 α-glucosidase 또한 높은 저해활성을 가진 B. amyloliquefaciens CGD3 균 주의 생육특성을 고려하여 단백질 분해 분야의 프로바이오 틱 적용 및 당뇨예방용 기능성식품 소재로의 가능성이 기대 된다.