서 론
커피는 전 세계인들이 물 다음으로 많이 마시는 음료로, 전 세계 인구의 2/3가 커피를 마시고 있다(1). 세계 커피무역 에서 커피는 주로 커피를 볶은 전 상태인 생두(green been) 로 거래가 되며, 수입국에서 생두를 볶아 원두커피(roasted coffee)로 제조하게 된다. 커피의 생두는 탄수화물 (37~60%), 지방(9~18%), 단백질(11~13%), 수분(10~13%), 무기질(3.0~4.5%)로 구성되어 있으며, 그 외에 카페인 (caffeine)과 클로로겐산(chlorogenic acid)이 중요한 성분으 로 알려져 있다(2).
커피 생두는 커피 고유의 향미를 느낄 수 없으며, 배전 (roasting)과정을 거쳐 커피 고유의 향미를 갖게 되기 때문에 배전 과정은 중요한 공정이라고 할 수 있다. 배전 과정 중에 Maillard 반응, Strecker 분해, 지방 분해, 당 분해 등 여러 반응이 일어나 유리 아미노산(amino acid)과 유리당(free sugar), 클로로겐산(chlorogenic acid), 트리고넬린(trigonelline) 등이 감소되며, 동시에 약 800여 가지 이상의 화학물질이 생성된다(3). 배전 후 원두의 이화학적 성분은 생두의 종류, 배전 온도와 시간에 따라 달라진다.
지금까지 수행된 커피 생두의 배전과 관련된 논문으로는 배전이 진행되는 중 향기성분의 변화(4), 배전 온도 및 시간 에 따른 향기성분 형성(5), 배전도 및 산지에 따른 유효 향기성분에 관한 연구(6), 배전조건이 항산화 특성에 미치 는 영향(7), 배전과정 중 변화되는 주요 화학성분에 대한 연구(8) 등이 있다.
커피는 항산화력이 있는 것으로 보고되고 있다. 커피의 페놀 함량은 레드와인보다 더 높은 것으로 보고되었으며 (9), 커피가 자유 라디칼과 바이러스의 감염을 예방하는 효과가 있다는 보고도 있으며(10), 커피의 섭취가 LDL-콜 레스테롤의 산화에 대한 감수성을 줄인다는 보고도 있다 (11). 배전 과정 중에 항산화물질의 함량의 변화에 대한 여러 연구가 행해졌지만 엇갈린 결과를 보이고 있다(12). Cho 등(7)은 배전 정도가 증가함에 따라 항산화력이 감소한 다고 보고한 반면, Suh 등(13)은 165~185℃에서 배전하였을 때에 온도 차이가 그리 크지 않아서인지 약배전한 시료와 강배전한 시료에서 페놀 함량, DPPH와 ABTS 라디칼 소거 능에서 유의적인 차이를 나타내지 않았다고 보고하였다.
커피는 800종 이상의 향기성분을 가진 가장 복잡한 식품 중의 하나로 풀질평가를 위해 전문 taster에 의한 cup-test나 훈련된 panel에 의한 관능평가가 일반적으로 수행되어 왔 다. Cup-test란 커피의 품질을 분류하기 위해서 커피농장이 나 생두 무역, 산업체 현장에서 많이 이용되는 평가방법이 지만 고도로 훈련된 sensory panel이 필요하다. GC나 GC-MS가 커피의 휘발성 화합물의 분석에 이용되었으나 최근 보다 객관적이고 재현성 있는 커피의 품질평가를 위해 전자코를 이용하게 되었다(14).
본 연구에서는 3종류의 커피 생두를 배전 온도 181~21 5℃에서 약배전, 중배전, 강배전으로 볶아, 이에 따라 변화 되는 커피의 카페인, 클로로겐산, 총 페놀, 1,1-diphenyl- 2-picrylhydrazyl(DPPH)과 2,2'-anizo-bis(3-ethylbenzothiazoline- 6-sulfonic acid)(ABTS) 라디칼 소거활성을 측정하여 배전강도에 따른 커피 구성성분의 변화를 조사하고자 하였 다. 또한 전자코를 이용하여 볶음 정도에 따른 커피의 향을 객관성 있게 분석하여 커피원두의 배전 정도를 예측할 수 있는 기초자료를 제시하고자 하였다.
재료 및 방법
본 실험에 사용된 3종의 커피 생두는 브라질 미나스 제라 이스 주의 세라도 지역에서 생산된 버번 스페셜티(Brazil bourbon specialty, Cerrado, Brazil), 인도네시아 북 수마트라 지역에서 생산된 만델링 프리미엄(Indonesia mandheling premium G1, Tapanuli, Indonesia) 그리고 케냐 기암부 지역 에서 생산된 타투 스페셜티(Kenya AA tatu specialty, Kiambu, Kenya)로 모두 2013년에 수확되어 수입된 Arabica 품종이었다.
커피 생두는 반열풍식인 후지로얄 샘플 로스터(Type R-002BZB, Fuji Coffee Machine Manufacture Co., Tokyo, Japan)를 이용하여 각각 200 g의 생두를 180℃에서 투입하 였다. 생두를 투입하면 드럼의 온도는 급격히 떨어진 다음 다시 온도가 올라간다. 온도가 올라감에 따라 생두의 색이 점차 갈색으로 변하면서 1차 균열(pop)에 도달한다. 그 후 일정 시간이 지나면 1차 균열이 종료되며, 휴지기간을 거쳐 2차 균열이 시작된다. 약배전은 1차 균열이 시작하는 시점, 중배전은 1차 균열이 끝나는 시점, 강배전은 2차 균열이 시작하는 시점에서 배출하였다. 배출시간과 온도는 Table 1과 같았다. 커피 생두 및 원두를 분석 바로 전에 커피 분쇄 기(Type R-220, Fujikouki Co., Ltd., Tokyo, Japan)를 사용하 여 850 μm(표준체 No. 20) 이하의 크기가 되도록 분쇄하여 사용하였다.
생두와 원두의 수분함량은 상압가열건조법(15)에 따라 시료 1 g을 105℃에서 5회 반복하여 측정한 후 평균값으로 나타내었다.
총 중량손실은 생두를 볶기 전의 무게(WI)와 볶은 후의 무게(W)를 정확히 측량하여 다음의 식으로 계산하였다.
생두와 원두의 밀도는 100 mL 눈금 실린더에 커피콩을 넣고 10회 위아래로 흔들어 빈 공간을 최소화한 후 100 mL 부피의 무게를 측정하였으며, 각 5회 반복 측정하여 평균값을 계산하였다. pH는 볶은 커피 1 g을 100 mL 정용 플라스크에 넣고 98℃의 증류수 100 mL를 넣은 다음 20분 동안 추출하여 여과한 액을 실온으로 식힌 후 pH meter(SP-701, Suntex Instruments Co., Ltd., Taipei, Taiwan) 를 이용해서 측정하였다.
생두와 배전 조건 별 원두의 색도를 비교하기 위해 분쇄 한 시료를 색차계(CR-400, Minolta Camera Co., Ltd., Osaka, Japan)을 이용하여 5회 반복 측정하여 그 평균값으로 하였 다. 색도는 명도(L*),적색도(a*),황색도(b*)의 값으로 나타내 었다. 이 때 사용된 표준 백판의 L*값은 95.99, a*값은 -0.14, b*값은 –0.24이었다.
카페인 및 클로로겐산의 함량은 두 성분을 동시에 분석 할 수 있는 Hecimovic 등(16)의 방법에 따라 분석하였다. 커피 생두와 조건별로 배전한 커피 2 g을 정확히 평량하여 뜨거운 증류수(96℃) 20 mL를 더한 후 15분 동안 hot plate에 서 추출하였으며, 상온에서 냉각시킨 후 0.45 μm filter로 여과하여 최종 검체로 하였다. 분석기기로서는 Aglient 1200 HPLC system(Aglient Technologies, Palo Alto, CA, USA)을 사용하였고, column은 reverse-phase column Pinnacle C-18(Restek, Bellefonte, PA, USA)(250×4.6 mm, 5 μm id)을 사용하였다. 이동상은 1% formic acid(solvent A)와 HPLC grade methanol(solvent B)를 유속 1 mL/min로 흘렸으며, B용매의 비율을 2%에서 시작하여 20분 후에 32%, 30분 후에 40%, 40분 후에 95%가 되게 하였다. 카페인 은 278 nm, 클로로겐산은 330 nm에서 측정하였다. 표준용 액 제조는 카페인과 클로로겐산(Sigma Aldrich Co., St. Louis, MO, USA)을 각각 1,000 ppm으로 만든 다음 각각 5, 10, 20, 50 ppm으로 만들어 표준곡선을 작성한 다음 시료 에 대해서 농도를 측정하였다.
추출물의 총 페놀함량은 Folin-Ciocalteu시약을 사용하여 측정하였다. 커피 추출물 2 μL에 증류수 78 μL를 첨가한 후 Folin-Ciocalteu phenol reagent(Sigma Aldrich Co., St. Louis, MO, USA) 20 μL를 각각 첨가하고 실온에서 5분간 반응시켰다. 이 용액에 20% Na2CO3 100 μL를 가한 후 암소 에서 30분 동안 방치한 후 Synergy HT-Multi-microplate reader(Bio- Tek Instrument, Winooski, VT, USA)를 이용하 여 515 nm에서 흡광도를 측정하였다. 총 페놀함량은 gallic acid(GA)를 표준물질로 한 표준곡선에 의하여 산출하였다.
DPPH 라디칼 소거능은 Blois 방법(17)에 따라 측정하였 는데, 이는 자유 라디칼을 갖는 안정한 화합물인 DPPH를 기질로서 항산화 활성을 측정하는 방법이다. 각 추출물 시 료를 2배 희석하여 96 well plate에 20 μL부터 계열희석 분주하였고, 400 μL DPPH용액 180 μL를 넣고 혼합하여 암실에서 30분간 반응시킨 후 515 nm에서 흡광도를 측정하 였다. 각 시료와 ascoric acid(AA)의 DPPH 라디칼 소거능은 아래의 식에 의해 전자공여능으로 계산하였고, 50% 전자공 여능 값을 나타내는 SC50 값으로 표현하였다.
전자공여능(%)=(1-시료의 흡광도/무처리 흡광도)×100
DPPH 라디칼 소거능은 ascorbic acid equivalent(AAE)/g 건조 중량으로 표현하였다.
ABTS 라디칼 소거능은 Re 등(18)의 방법에 따라 측정하 였다. ABTS 라디칼 용액은 3.5 mM potassium persulfate를 포함하는 2 mM ABTS용액을 8배 희석시킨 후, 어두운 곳에 14시간 보관하여 만들었다. 각 추출물 시료를 2배 희석하여 96 well plate 20 μL부터 계열희석 분주하고, ABTS 라디칼 용약 180 μL씩 가하였다. 상온에서 5분간 반응 후, 730 nm에 서 흡광도를 측정하였다. 각 시료의 ABTS 라디칼 소거능은 아래의 식에 의해 전자공여능으로 계산하였고, 50% 전자공 여능 값을 나타내는 SC50 값으로 표현하였다.
전자공여능(%)=(1-시료의 흡광도/무처리 흡광도)×100
ABTS 라디칼 소거능은 ascorbic acid equivalent(AAE)/g 건조 중량으로 표현하였다.
배전 정도에 따른 차이를 GC-전자코로 분석하고자 하였 다. 커피분쇄기(Type R-220, Fujikouki Co., Ltd., Tokyo, Japan)를 사용하여 850 μm(표준체 No. 20) 이하의 크기가 되도록 분쇄한 시료 각 1 g이 들어 있는 vial을 300 rpm으로 교반하면서 60℃를 유지하였고, 주입구 온도는 130℃인 상 태에서 주입하였다. 이 때 사용한 가스는 헬륨이었으며 분 당 50mL의 유속으로 흘려보냈으며, 분석 시간은 5분이었 다. Syringe purge는 3초를 유지한 후 thermostated tray holder에 놓은 후 head space syringe를 사용하여 5 mL을 취하였다. 시료는 자동시료채취기가 연결된 전자코(GC type E Nose Heracles II, Alpha M.O.S., France)로 분석하였 다. 분석에 사용된 전자코는 두 개의 column(100 μm id # DB5,100 μm id #DB1701)과 두 개의 flame ionization detectors(FID)에 연결되어 있었다. 각 시료는 6회 반복을 실시하였다.
결과 및 고찰
생두 및 원두의 수분함량, 중량 감소, 부피 증가, 밀도, pH의 변화는 Table 2와 같다. 본 실험에 사용된 커피는 모두 아라비카종으로 생두의 수분 함량은 브라질 버번이 11.0%로 가장 높았으며 인도네시아 만델링과 케냐 타투가 각각 7.8%, 9.0%로 나타났다. 커피의 수분 함량은 배전이 진행됨에 따라 급격히 감소되어, 배전 초기 3.2~4.7%에서 배전이 완료되었을 때는 0.6~0.8%까지 감소되었다. Kim 등(19)은 아라비카와 로부스타 품종의 생두 수분 함량은 8.5~10.3%라고 보고하였으며, Tfouni 등(20)도 아라비카 품 종의 생두 수분함량이 8.5~9%에서 배전 후에는 0.8~2.2% 로 감소하였다고 보고하였다. Specialty Coffee Association of America(SCAA)에서는 스페셜티 생두의 적정 수분함량 을 내츄럴 커피의 경우 10~13%, 워시드 커피의 경우는 10~12%로 규정하고 있으며, 생두의 수입과 보관 기준을 제시하고 있는 International Coffee Organization(ICO)에서 는 8~10%의 수분함량을 허용하고 있다(21).
커피의 배전 과정에서 중량 손실은 초기에는 주로 수분 손실에 기인하였다가 배전 말기에는 탄수화물 또는 minor 화합물들의 열분해 반응과 휘발성 물질들의 손실에 의한 것으로 보고되었다(22). 본 연구에서는 약배전 시 7.5~ 10.0%, 중배전 시 14.5~15.0% 중량이 감소되었다가 배전 과정이 끝났을 때에는 브라질 버번, 인도네시아 만델링, 케냐 타투가 각각 19.0%, 18.5%, 18.0%의 중량 손실을 보였 다. 이는 Oosterveld 등(23)이 아라비카 품종을 약, 중, 강배 전했을 때 각각 11%, 15%, 22%의 중량이 손실되었다고 보고한 것이나 Franca 등(24)이 각각 7.5~10.0%, 14.5~ 15.0%, 18.0~19.0%의 중량이 손실되었다는 보고와도 유사 한 것이었다. 배전에 의한 중량 감소와는 반대로 커피 원두 의 부피는 증가하는데 이는 열가공(배전) 과정에서 다공구 조 형성으로 인한 커피원두의 팽창에 의한 것이다(25). 배전 완료 시점에서 커피 생두 대비 76~87%의 부피 증가를 보였 는데 이는 Jokanovic 등(25)의 48~50%보다 다소 높은 값이 었다.
커피의 배전 중 밀도의 감소는 부피의 증가, 내부 가스의 생성, 열분해 반응, 휘발성분의 손실에 의한 중량감소에 의한 것으로 보고되었다(26). 중배전한 시료에서 케냐 타투 는 생두에 비해 50%, 브라질 버번은 48.5%, 인도네시아 만델링은 46.4%가 감소하였다 (Table 2). 이는 생두의 상태 에 따라 40~60%의 감소를 보였다는 Franca 등(24)의 결과나 35~44%의 감소를 보였다는 Jokanovic 등(25)의 결과와 비 슷하였다. Alessandrini 등(22)은 Italian-style 배전수준에서 는 전형적으로 50~60%의 밀도 감소를 보인다고 보고하였 다. Choi(27)는 일반적으로 밀도는 생두의 등급이 높을수록 크게 나타나며 같은 등급의 경우 가공법에 의해서는 차이가 없으며, 밀도가 높은 커피가 더 풍부한 향미를 가지며 배전 에 더 많은 시간이 소요되므로 배전 조건을 결정하는데 생두의 이해가 중요하다고 하였다.
커피의 배전 중 pH의 변화는 약배전할 때 브라질 버번은 5.2, 인도네시아 만델링은 4.9, 케냐 타투가 5.0이었으며, 중배전, 강배전으로 갈수록 유의적인 차이를 보이며 증가 했다(Table 2). Illy 등(28)에 따르면 배전 강도에 따라 추출 한 커피의 pH가 4.9~5.4이며, 내츄럴(natural) 커피가 워시드 (washed) 커피보다 pH값이 더 높다고 하였는데, 이는 워시 드 커피가 점액질의 완전제거를 위해 발효과정을 거치기 때문이라고 하였다. 또한 원두커피의 pH가 일반적으로 인 스턴트커피의 pH보다 약간 높은 이유는 원두커피가 뜨거 운 상태로 공기 중에 노출되면서 다결정 구조의 산이 단결 정 구조의 산으로 변화되기 때문이라고 하였다(29). 커피원 두 추출물의 H+농도는 CGA의 함량과 밀접한 관계가 있으 며, 강배전 시 CGA의 함량감소로 pH가 증가한다는 보고가 있는데(30), 본 연구에서도 배전이 진행될수록 CQA의 함량 이 감소하면서 pH가 증가하는 경향을 나타냈다(Table 2).
CIE체계로 측정한 커피 생두와 원두의 색도의 변화는 Table 3과 같다. 커피 생두의 L*값은 브라질 버번과 인도네 시아 만델링이 각각 57.1, 56.9이었으며, 케냐 타투가 67로 가장 밝게 나타났다. a*값은 적색과 녹색, b*값은 청색과 황색을 묘사하는 것으로 생두의 전형적인 green-yellow zone에서 약배전과 중배전 시 red-orange로 이동하였다가 배전 온도와 시간이 증가함에 따라 borwn zone으로 이동함 을 보여주었다. 배전이 진행됨에 따라 L* 값과 유사하게 a*값과 b*값도 유의적으로 감소하여 커피원두는 균일한 갈 색이 되었으며, 이는 Alessandrini 등(22)의 결과와 비슷한 감소경향을 나타냈다. 배전 시 이러한 명도와 색상의 변화 는 열처리의 결과로 일어나는 Maillard 반응의 전형적인 결과로 이때 생성된 melanoidin과 같은 색소의 영향으로 보고되었다(31). 생두의 가공방식에 따라서는 워시드 (washed) 커피가 내추럴(natural) 커피보다 명도가 높게 나 타나는 것으로 보고되었는데, 이는 내추럴 커피가 커피체 리 상태로 건조되는 과정에서 체리의 당성분이 생두에 흡수 되기 때문에 명도가 낮아지는 것이라고 하였다(27). 커피원 두의 색도는 중량감소와 더불어 배전의 정도를 설계하는데 중요한 인자로 배전 중 클로로겐산의 함량 감소와도 깊은 상관관계가 있다고 보고되었다(27).
품종별 커피 생두와 원두의 배전 정도에 따른 카페인 함량은 Table 4와 같다. 브라질 버번과 인도네시아 만델링 에서 생두는 각각 7.4 mg/g, 7.3 mg/g의 카페인을 함유하였 고, 브라질 버번은 약배전의 경우 9.4 mg/g에서 강배전의 경우 11.1 mg/g으로 증가하였으며, 인도네시아 만델링은 약배전의 경우 9.0 mg/g에서 12.2 mg/g으로 증가하여 배전 시 유의적인 차이로 증가하였다. 케냐 타투의 경우 약배전 시 6.4 mg/g의 카페인이 들어있었으며, 다른 품종과 마찬가 지로 배전이 진행됨에 따라 증가하는 경향을 보여 강배전에 서 10.4 mg/g의 함량을 나타냈다. 카페인 함량은 생두에서 강배전으로 진행됨에 따라 약간 증가하거나(20) 품종에 따 라 약간 감소했다는 보고(32)도 있었다. 카페인의 함량은 배전 자체에 의한 영향보다는 다른 성분들의 손실과 생두의 유의적인 중량 감소에 의한 상대적 증가로 보는 경우도 있으며(33), 카페인의 승화점(178℃)이상에서 배전이 진행 되면 카페인의 손실이 있으나 배전공정 중 커피 내부 압력 의 상승으로 카페인의 승화점이 증가하여 매우 강한 강배전 이 아닌 경우, 비교적 카페인의 손실은 적다는 보고도 있다 (8). 또한 카페인 함량은 Rio-off-flavor(요오드와 같은 이취) 와는 음의 상관계가 있고, 높은 커피 품질(cup quality)을 갖는 커피의 카페인 함량이 높았다는 보고도 있다(34).
페놀성 화합물은 식물이 환경적인 스트레스에 적응하기 위해 필요한 항산화 물질로 식물계에 널리 분포되어있는 2차 대사산물들이다. 커피의 페놀 화합물에는 CGA(클로로 겐산)이 주된 성분이고 lignan, 토코페롤, 안토시아닌 등이 소량 존재하는 것으로 알려져 있다(35). 커피 생두와 배전 중 총 페놀함량 분석 결과는 Table 4과 같다. 총 페놀함량은 브라질 버번, 인도네시아 만델링, 케냐 타투의 생두에서 각각 21.3, 20.6, 23.1 mgGAE/g이었으며 약배전 시 브라질 과 케냐는 가장 높은 함량(36.2, 26.1 mgGAE/g)을 보였다. 이는 약배전 시 총 페놀함량이 42.4~55.0 mgGAE/g으로 가장 많았다는 Hecimovic 등(16)과 Cho 등(7)의 보고와 일 치하는 결과였다. Cho 등(7)은 배전하지 않은 생두와 비교 하여 약배전한 원두에서 약 49%의 페놀이 더 검출되었으 며, 강배전했을 때에도 73%이상이 보존되었다고 보고하였 다. 본 연구결과에서도 강배전 시 총 페놀함량이 다소 감소 하는 경향을 보였으나 약배전의 70~82%가 유지되어 비슷 한 결과를 나타냈다. Chism과 Haard(36)는 초기 배전 시 페놀 함량의 증가는 열가공에 의해 세포 구성분의 물리적 파괴가 일어나 생두 내부에 있던 항산화물질들이 방출되기 때문이며, 배전 정도가 강해짐에 따라 활성화되는 효소에 의해 페놀 함량이 감소된다고 보고하였다. 그러나 Tomaino 등(37)은 열가공 시 구조변화가 일어나는 페놀물질도 있으 나 새로운 항산화 화합물도 형성되어 총 페놀의 함량은 크게 변화하지 않으며, 커피의 전체적인 항산화능력 또한 크게 손실되지 않는 것으로 보고되었다.
커피의 페놀화합물 중 가장 많은 부분(약 83%)을 차지하 는 클로로겐산은 커피 배전 중 쉽게 분해되어 커피의 맛과 향에 영향을 미치므로 커피 품질 평가에 중요한 성분이다 (8). 클로로겐산은 quinic acid에 caffeic acid가 ester결합을 하고 있는 상태인데, caffeoylquinic acid(CQA)와 feruloylquinic acid(FQA) 그리고 dicaffeoylquinic acid(diCQA)와 같은 3개 의 이성질체가 있으며(38), 이중 5-CQA가 아라비카 품종에 서는 전체 클로로겐산의 66%, 로부스타 품종에서는 56%를 차지한다고 보고되었다(39).
클로로겐산의 한 종류인 5-CQA는 커피에서 polyphenol oxidase(PPO)의 기질이 되어 원두의 갈색화에 원인이 되는 o-quinones을 생성하는 것으로 밝혀졌으며(40), PPO의 작 용은 또한 커피콩 세포막의 구조적 변화를 유발시켜 Rio-off-flavor의 원인이 될 수 있다고 한다(41). 배전 중 CQA의 함량 분석 결과는 Table 4에 보여주는 바와 같이, 세 품종 모두 생두에서 가장 높은 함량을 나타낸 CQA는 배전이 진행됨에 따라 감소하여 강배전 시 브라질 버번 77%, 인도네시아 만델링 86%, 케냐 타투에서 86%가 손실 되었다. 이는 강배전 시 CQA가 93%의 손실되었다는 Farah 등(35)의 연구 결과와 강배전까지 진행되는 동안에 CQA의 83-93.4%가 손실되었다는 Tfouni 등(20)의 연구결과와 비 슷하였다. 또한 아라비카 생두 13.57 mg/g, 약배전 9.70 mg/g, 중배전 6.77 mg/g 강배전 4.79 mg/g의 CQA 함량을 보고한 Cho 등(7)의 연구결과와도 유사한 경향을 보였다. 클로로겐산의 일부는 배전 중 quinolactone이나 melanoidin 으로 전환되어 원두의 색상에 영향을 미치는 것으로 보고되 었다(42). Perrone 등(43)은 CQA의 감소가 배전 초기에는 isomerization 후기에는 epimerization, latonization, degradation 으로 인한 C-C 공유결합의 열분해 결과에 의한 것이라고 하였다.
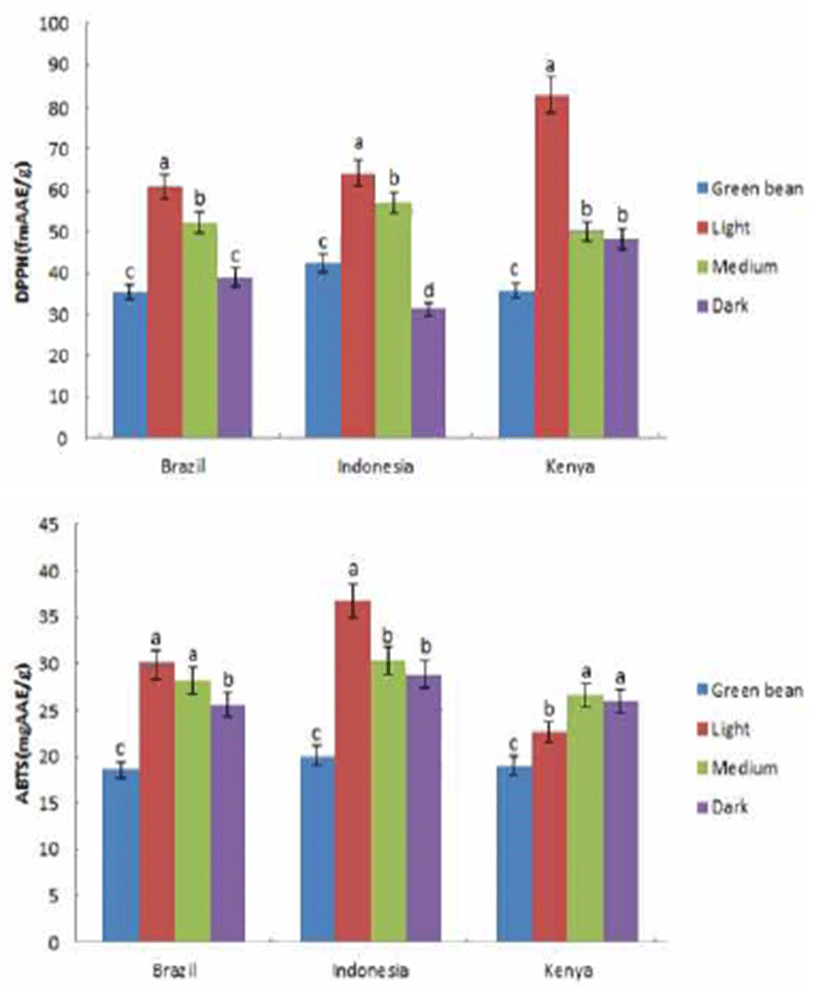
브라질, 인도네시아, 케냐 커피의 배전 정도별 항산화력 을 비교하기 위하여 DPPH와 ABTS 라디칼 소거활성을 측 정한 결과는 Fig. 1과 같다. DPPH와 ABTS 모두 라디칼의 환원력을 측정하는 실험으로 원리는 비슷하지만 ABTS는 극성, 비극성 물질에서 확인할 수 있으며, DPPH는 비극성 물질에서만 확인할 수 있다는 점에서 차이가 있다(7). 모든 시료에서 생두에 비해 배전 후 원두의 ABTS와 DPPH 라디 칼 소거활성이 높았으며, 배전 정도가 높아짐에 따라 케냐 의 ABTS 값을 제외하고는 소거활성이 감소하였다. 약배전 에서 강배전으로 진행됨에 따라 DPPH 소거능은 브라질 버번은 36%, 인도네시아 만델링은 51%, 케냐의 타투는 42%의 감소를 나타냈다. Cho 등(7)은 커피의 플라보노이드 (flavonoids)는 열처리에 의해 쉽게 파괴되어 강배전할 경우 에는 23%의 플라보노이드만 남아있게 된다고 보고하였다. 따라서 커피의 항산화력을 높이기 위해서는 약배전이 요구 되며 커피의 항산화력은 배전시간에 반비례한다고 보고하 였다. 본 연구에서도 생두보다 약배전한 원두의 항산화력 이 높았으며, 배전 정도가 증가함에 따라 항산화력이 감소 하여 Cho 등(7)의 연구 결과와 같은 경향을 나타내었다.
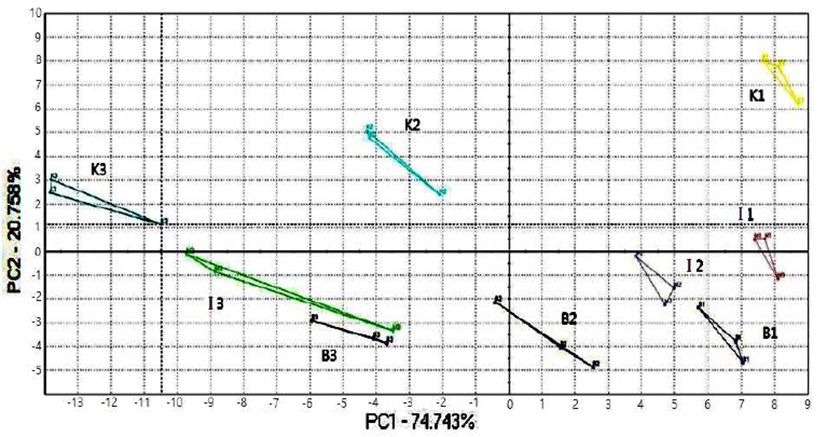
브라질, 인도네시아, 케냐 커피의 향기 패턴을 알아보기 위해 각 시료 간에 의미 있는 차이가 있는 10개의 피크를 선정하여 주성분 분석(PCA)한 결과를 Fig. 2에 나타내었다. PC1의 편차는 74.74%. PC2의 편차는 20.76%를 나타내 PC1 에서 시료간의 차별성이 뚜렷하였다. 전자코 분석 결과 향 기의 차이는 그래프 상 거리와 방향의 근접성에 따라 판단 되는데 가까운 점들은 서로 유사한 향기를 가지고 있으며 반대로 서로 다른 방향과 거리가 먼 위치의 점들은 유사성 이 없는 향기로 나타난다. 시료간의 차별성이 큰 제 1 주성 분 값을 비교할 때 배전이 진행됨에 따라 브라질 버번, 케냐 타투 및 인도네시아 만델링 시료 모두 향기패턴의 차이를 확연히 보이며 배전이 진행됨에 따라 제 1 주성분 값이 작아지는 것을 볼 수 있었다. 이러한 결과들은 커피 생두의 품종에 따른 향기패턴 분석이 가능하고, 추가적으로 배전 시간에 따라서도 향기패턴이 달라짐을 보여준다. 이는 배 전이 진행됨에 따라 커피의 향기성분이 달라지기 때문에 커피 생두의 배전과정 중에 이러한 향기성분의 변화를 전자 코 분석 방법을 통하여 구분할 수 있음을 보여준다.
요 약
아라비카 커피 생두 3종(브라질 버번, 인도네시아 만델 링, 케냐 타투)을 배전 온도 181~215℃의 범위에서 8.15~11.83분의 조건에서 약배전, 중배전, 강배전으로 배전 하여 물리적 특성, 이화학적 성질, 항산화력 등을 조사하였 다. 배전 온도가 증가함에 따라 무게와 밀도가 감소하였고, L*, a*, b*값이 감소하였다. 총 페놀함량은 생두보다는 배전 후의 원두에서 더 높았으며, 약배전과 중배전에서 가장 높 았다. 카페인 함량은 강배전한 시료에서 가장 높았다. 클로 로겐산은 생두에서 가장 높았으며, 배전의 강도가 강해짐 에 따라 감소하였다. ABTS와 DPPH 라디칼 소거능은 생두 보다는 배전 후의 원두에서 더 높았으며, 배전의 강도가 강해짐에 따라 감소하였다. 따라서 항산화력을 유지하기 위해서는 지나치게 높은 온도에서 배전하는 것보다는 낮은 온도에서 약배전하는 것이 바람직한 것으로 사료된다. GC 를 기초로 한 전자코를 활용하여 커피의 향기패턴을 분석한 결과 품종과 배전정도에 따른 향기패턴의 차이를 잘 구분할 수 있었다.