서 론
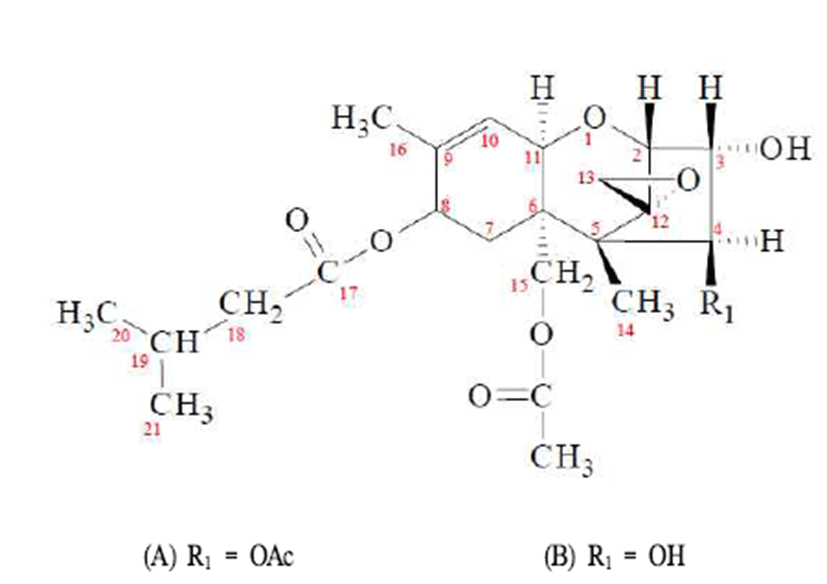
T-2 독소 및 HT-2 독소는Fusarium (F.)속에 의해 곡류에 서 생성되는 곰팡이독소이다(1). 이 독소들은 주로 쌀, 보리, 콩, 땅콩 그리고 옥수수 등의 곡물에서 빈번하게 발생하며, 곰팡이 발효식품의 섭취량이 많은 우리나라의 경우 곰팡이 독소에 노출될 위험성이 크다(1,2). T-2 독소 및 HT-2 독소 는 Fig. 1과 같이 구조적으로 9번 탄소와 10번 탄소 사이의 이중결합과 12번 탄소와 13번 탄소에 에폭시(epoxy)그룹을 가지는 세스퀴테르펜 에폭사이드(sesquiterpene epoxide)인 트리코테센류(trichothecene) 곰팡이독소로 일반적으로 매 우 안정된 화합물로 끓이기, 발효, 제빵, 튀기기와 같은 식품 의 조리 및 가공처리, 저장이나 분쇄를 하는 동안 높은 온도 에서도 화학적으로 쉽게 분해되지 않는다고 알려져 있다 (2).
T-2 독소는 다른 트리코테센류 곰팡이독소와 마찬가지 로 체중감소, 피부염, 구토, 설사, 신경장애, 면역기능 억제 등을 유발하며, 강력한 단백질 합성저해제로 트리코테센류 곰팡이독소 중에서 독성이 가장 높다. T-2 독소는 생체 내에 서 주요 대사산물인 HT-2 독소 및 다른 대사산물로 빠르게 대사되는데, T-2 독소 그 자체보다 대사산물들이 더 독성이 높거나 동등한 독성을 나타내기도 한다(2).
곡류 중 T-2 독소 및 HT-2 독소는 저장과정 중의 수분함 량, 온도를 달리한 수분활성도의 저장조건에 따라 생성곰 팡이가 생성하는 함량이 달라질 수 있고(3), 현재 T-2 독소 및 HT-2 독소에 대한 곰팡이독소 검출방법은 thin layer chromatography(TLC)법 및 효소면역분석법(enzyme-linked immunospecific assay, ELISA), 액체크로마토그래피(high performance liquid chromatography, HPLC), 기체크로마토 그래피(gas chromatography, GC) 등에 대한 분석법이 보고 되어지고 있다(4-6). 그러나, TLC법 및 ELISA법은 일반적 으로 독소의 확인시험법으로 시료의 전처리가 간편하고 적은 비용으로 분석할 수 있는 장점이 있으나, 일상적인 모니터링 체계에서 사용하기 어렵고, 동시분석이 불가능한 단점이 있다. 정량적으로 분석하는데 주로 사용되는 HPLC 법 및 GC법은 감도와 휘발성을 높이기 위해 hydroxylation, trimethylsilulation, flouoroacylation으로 유도체화 하고, flame-ionization(FID), UV diode array(DAD), fluorescence (FLD), electron capture(ECD), mass spectrometry(MS) 등의 다양한 검출기를 사용해야 하는 단점이 있다. 국내에서 연 구된 T-2 독소 및 HT-2 독소 시험법은 유도체화를 거친 후 HPLC/FLD와 GC 분석방법이 연구되어졌으나 LC-MS /MS 방법으로 동시분석에 대한 연구는 부재하다.
본 연구는 우리나라 국민들이 많이 섭취하고 있는 곡류 중 T-2 독소 및 HT-2 독소 분석을 위해서 질량분석기를 이용한 동시 분석법을 개발하고 국내 유통되고 있는 곡류에 대한 T-2 및 HT-2 독소에 대한 실태조사를 수행하였다.
재료 및 방법
분석을 위한 대상곡류는 국민건강영양조사(7)를 참고하 여 섭취량이 많은 다소비 곡류로 선정하였으며, 그 결과 백미, 보리, 찹쌀, 밀가루, 옥수수, 현미, 조, 수수, 기장 등 총 9종의 곡류를 선택하였다. 시료는 2013년도에 서울 및 6 개 광역시(부산, 인천, 대구, 대전, 광주 및 울산)과 강원 지역을 포함한 총 8개 지역의 대형마트 및 농산물 판매점에 서 포장단위별로 1 kg 이상 구매하였다. 각 품목별, 지역별 구입된 시료 전체 9품목 115건을 분석하였으며 수거현황은 Table 1과 같다. 구입한 시료는 온도와 습도에 의해 변질되 지 않도록 실험실로 즉시 운반하여 전체 시료를 취해 분쇄 기(Food processor HR7625, Philips, Guangdong, China)를 이용해 균질화 후 약 100 g 단위로 폴리에틸렌 지퍼백에 담아 영하 20°C에 보관하였다.
T-2 독소(101. 4 μg/mL in acetonitrile, 98.7%, 1 mL) 및 HT-2 독소(HT-2, 101. 4 μg/mL in acetonitrile, 98.4%, 1 mL) 표준물질은 각각 Sigma-Aldrich 제품(Sigma-Aldrich, St Louis, MO, USA)에서 구입하여 사용하였다. 표준인증물질 (reference material, RM)로는 귀리 가루(T2280QC)를 사용 하였으며, 국제시험실숙련도 평가기관인 Fera(The Food and Environment Research Agency, York, UK)에서 구입하 여 사용하였다. 아세토니트릴, 메탄올은 액체크로마토그래 피급(Merck, Darmstadt, Germany)의 용매를 사용하였고, 개 미산은 Sigma-Aldrich 제품(Sigma-Aldrich, St Louis, MO, USA)로부터 1급 시약을 구입하여 사용하였다. 기타 모든 시약은 특급 또는 액체크로마토그래피 분석용을 사용하였 고, 증류수는 증류수제조기(Barnstead International, Iowa, USA)에 의해 18.2 MΩcm 수준으로 정제된 증류수를 사용 하였다. 정제에 사용된 면역친화성칼럼은 EASI EXTRACT 칼럼(r-Biopharm Rhone Ltd., Darmstadt, Germany) 구입하 여 사용하였다.
| Compounds | Milled rice | Foxtail millet | Unpolished rice | |||
|---|---|---|---|---|---|---|
| LOD | LOQ | LOD | LOQ | LOD | LOQ | |
| T-2 toxin | 0.5 | 1.5 | 0.5 | 1.5 | 0.5 | 1.5 |
| HT-2 toxin | 0.5 | 1.5 | 0.5 | 1.5 | 0.5 | 1.5 |
T-2 독소 및 HT-2 독소 stock 표준용액은 상용화되어 판매되고 있는 표준원액을 사용하여 각각 아세토니트릴을 넣어 10 μg/mL를 조제하였다. 각각의 표준용액을 취하여 아세토니트릴로 희석하여 T-2 독소 및 HT-2 독소 혼합 표준 용액(1 μg/mL)을 조제하였다. T-2 독소 및 HT-2 독소 혼합 표준용액(1 μg/mL)은 회수율측정용(quality control), 재현 성 측정용 표준액으로 사용하고, 아세토니트릴을 가하여 2.5~100 μg/kg이 되도록 제조하여 검량선 작성용 표준용액 으로 사용하였다.
LC-MS/MS를 이용해 T-2 독소 및 HT-2 독소 분석을 위한 시험방법은 전처리방법 균질화한 곡류시료를 정밀하게 25 g을 500 mL 균질기(Ultra Turrex, IKA) 전용 용기에 취하고 2.5 g 염화나트륨과 100 mL 90% 메탄올 용액(90:10, v/v)을 넣고 균질기를 이용하여 5분 동안 추출한다. 추출한 액은 원심분리기를 이용하여 15분 동안 원심분리(1,600×g)하고 상층액을 여과지(Whatman No.4)로 여과한다. 면역친화성 칼럼을 이용하기 위해 여과액 10 mL을 40 mL의 4% 염화나 트륨 용액으로 희석시켰다. 단백질 등의 침전물을 5분 동안 방치시킨 다음 잘 혼합하여 다시 원심분리(1,600×g, 15분) 하였다. 원심분리 후, 상층액을 유리섬유여과지(GF/B, Whatman)로 여과하고 여과액 20 mL을 분당 1 방울의 속도 로 면역친화성칼럼을 통과시켰다. 시료 여과액이 모두 통 과되면, 면역친화성 칼럼을 물 15 mL로 세척하고 공기를 주입하여 물기를 없애준다. 면역친화성칼럼에 남아있는 독 소를 아세토니트릴 3 mL로 유출시킨다. 유출액은 50°C에서 질소로 건고하였다. 건조된 잔류물에 1% 개미산 함유 50% 메탄올 수용액 1 mL에 녹이고 이를 0.2 μm의 멤브레인 필터로 여과한 액 5 μL을 주입하여 액체크로마토그래피-질 량분석기/질량분석기로 분석하였다(8).
액체크로마토그래피 분석조건으로 칼럼은 phenyhexyl column(100×2.1 mm, 3.0 μm, Phenomenex)을 사용하고, 칼 럼 온도는 35°C로, 유속은 0.4 mL/min로 흘려주었다. 이동 상 용매조건은 Table 2와 같이 사용하였다. 질량분석기의 spray voltage는 양이온분석모드(positive ionization mode) 로 4.0 kV , capillary 온도는 270°C로 이온화 하였다. 곰팡이 독소별 단일 표준액을 1.0 μg/kg을 사용하여 present ion 및 product ion에 대한 분석조건 및 곰팡이독소 다중반응검 지(multiple reaction monitoring, MRM) 분석 조건은 Table 1과 같다.
액체크로마토그래피-질량분석기/질량분석기를 이용한 곡류 중 T-2 독소 및 HT-2 독소의 동시분석법의 검증은 유럽연합기준에 따라 수행하였다(9). 유럽기준은 회수율 (25~50 μg/kg) 의 경우 60~130%, 표준편차는 40% 이하이다. 오염되지 않은 곡류에 최종농도가 정량한계 2배의 농도가 되도록 T-2 독소 및 HT-2 독소 표준액을 첨가한후, 7번 반복 측정하여 표준편차(δ)를 구한다. 검량선 곡선의 기울 기(slop, S)과 표준편차를 이용하여 검출한계(limit of detection, LOD, 3δ/S), 정량한계(limit of quantification, LOQ, 10δ/S)을 산출하였다. 오염되지 않은 각 곡류의 추출 액에 표준액을 가하여 matrix mateched 검량선을 2.5~100 μg/kg에서 작성하여 직선성(linearity)을 확인하였다. 분석 법의 정밀성 및 정확성은 표준액 첨가법 및 인증물질 (reference material)을 이용한 회수율 결과로 확인하였으며, 표준액 첨가법은 2배, 5배, 10배 정량한계에 해당되는 표준 액 농도를 처리하여 그 회수율을 확인하였다. 또한, 하루에 3번 수행하여 일내(intra-day) 및 3일간 반복하여 일간 (inter-day)에 대한 정밀도를 구하였다.
결과 및 고찰
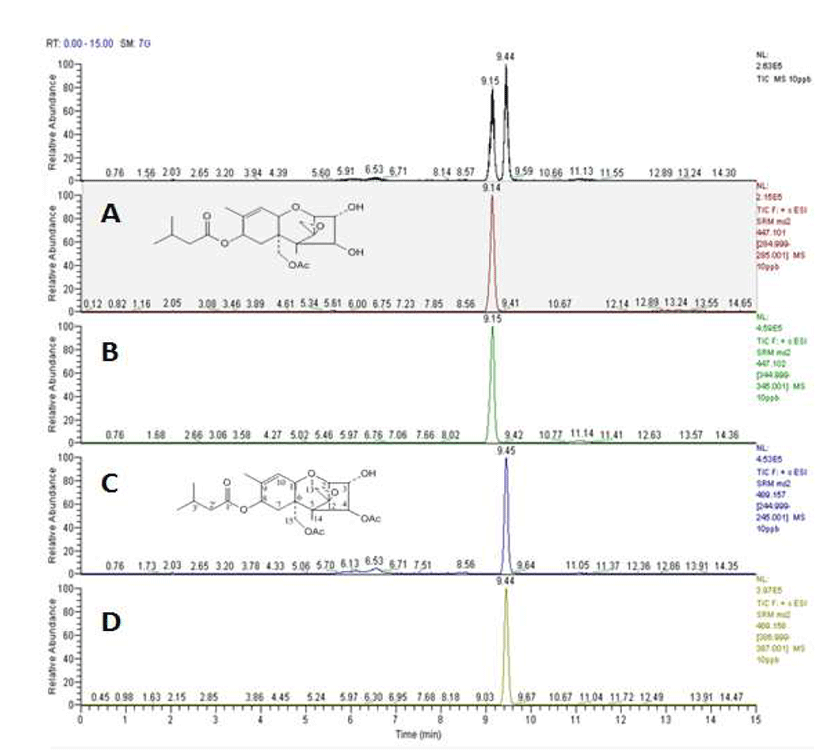
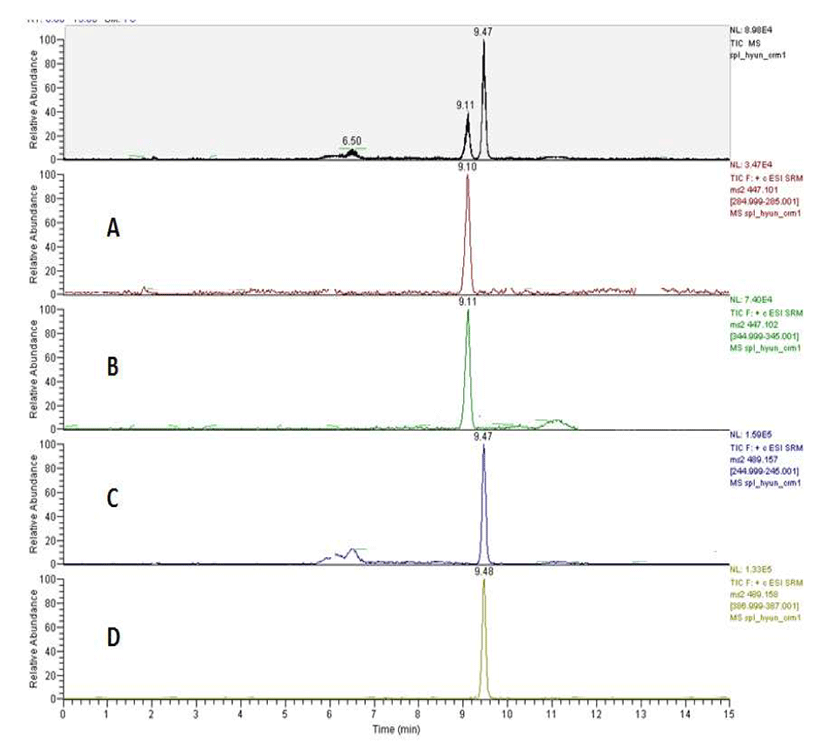
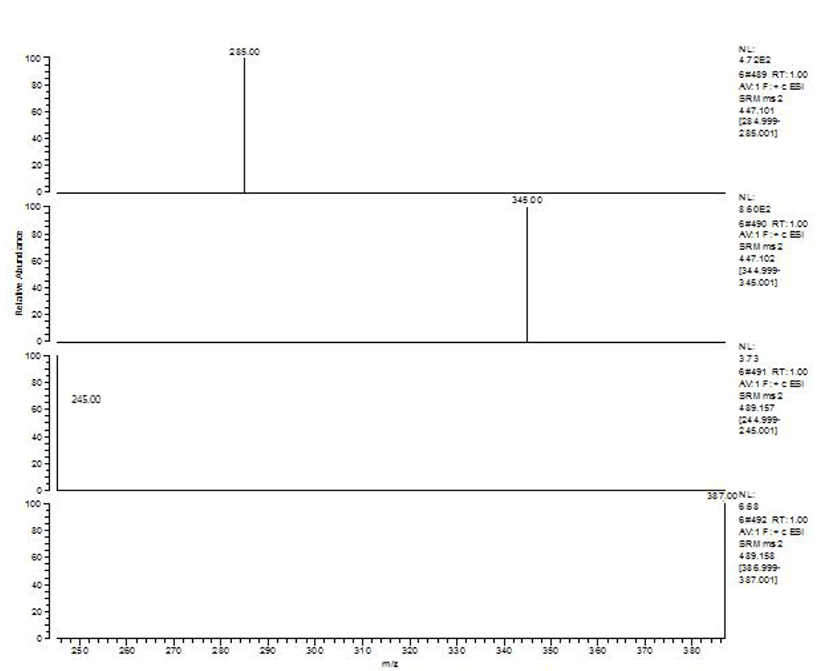
곡류 중 곰팡이독소 추출에 가장 많이 사용하는 메탄올 을 이용하여 T-2 독소 및 HT-2 독소를 추출하고자 하였으 며, T-2 독소와 HT-2 독소 두 독소 모두 메탄올에 대한 용해도가 20~30 mg/mL으로 높은 용해성을 보인다(10). 불 순물을 제거하기 위한 정제는 T-2 독소와 HT-2 독소에 특화 되어 있는 면역친화성 컬럼을 사용하여 이루어졌으며, 빠 른 시간 내에 높은 분해도와 동시분석이 가능한 질량분석기 로 정성·정량분석 하였다. 마련된 기기분석 조건으로 분석 하였을 때 머무름 시간이 T-2 독소, HT-2 독소 각각 9.15분, 9.44분으로 분리되어짐을 알 수 있었고(Fig. 2), T-2 독소 및 HT-2 독소를 첨가한 쌀, 조, 현미를 전처리하여 분석한 액체크로마토그래피-질량분석기/질량분석기 크로마토그 램 상의 각 정성/정량이온의 피크 머무름 시간이 각 표준물 질의 정성/정량이온의 피크 머무름 시간과 일치함을 확인 하였다.(Fig. 3). T-2 독소, HT-2 독소의 각 독소에 대한 질량 분석스펙트럼은 Fig. 4와 같다. 시험용액에서 T-2 독소의 특성이온 m/z 245, HT-2 독소의 특성이온 m/z 285은 정성이 온으로 선정하였고 T-2 독소는 m/z 387 특성이온, HT-2 독소는 m/z 345 특성이온을 정량이온으로 선택하여 정량하 였다. 이러한 기기조건을 토대로 하여 유럽연합 곰팡이독 소 시험법 가이드라인에 맞추어 곡류 중 T-2 독소 및 HT-2 독소 시험법에 대한 유효성을 검증하였다.
T-2 독소 및 HT-2 독소가 각각 최종농도가 3.0 ug/kg 되도록 표준물질을 첨가한 쌀, 조, 현미의 시료추출액을 7회 반복하여 분석한 후 분석 값들의 표준편차 및 기울기를 이용하여 각각 3δ/S와 10δ/S을 곱하여 검출한계와 정량한 계를 구하였다. 검출한계는 각 곡류별로 차이는 없었으며, T-2 독소는 0.5 μg/kg, HT-2 독소는 1.5 μg/kg으로 나타내었 다(Table 2).
LC-MS/MS를 이용하여 곡류중 T-2 독소 및 HT-2 독소 분석시 곡류 바탕시료의 매트릭스의 영향을 최소화하기 위해 matrix-matched 검량선을 사용하였다. T-2 독소 및 HT-2 독소는 2.5~100 ng/mL의 농도로 표준곡선을 작성한 결과, 쌀, 현미, 조 등 곡류별 T-2 독소 및 HT-2 독소 모두 검량곡선의 상관계수(R2)가 0.99이상으로서 양호한 직선 성을 나타내었다(Table 3).
T-2 독소 및 HT-2 독소가 오염되지 않은 바탕시료를 전처 리한 용액과 표준용액을 첨가하여 전처리한 용액의 크로마 토그램을 비교해 보면 T-2 독소 및 HT-2 독소의 머무름 시간이 일치하고 다른 어떤 방해 피이크가 없음을 확인하였 다. 쌀등 9품목의 모든 곡류 중 T-2 독소 및 HT-2 독소를 분석하기에 선택성 및 분리도가 좋음을 알 수 있었다.(Fig. 2-Fig. 3)
쌀, 조, 현미 바탕시료에 T-2 독소 및 HT-2 독소 혼합표준 용액을 3개의 농도(2LOQ, 5LOQ, 10LOQ)가 되도록 첨가하 고 전처리하여 분석하였다. 이 분석과정을 3일 동안 반복하 여 정밀성과 정확성을 확인하였다. 그 결과 각 농도와 식품 종류에서 회수율은 T-2 독소의 경우 72.1~108.2%, HT-2 독소의 경우 72.1~108.2%를 나타내었다. 한편 EU에서 제시 하는 회수율 적정범위 T-2 독소 60~120%, HT-2 독소 50~120%를 만족하며, 3회 반복에 의한 상대표준편차 (relative standard deviation)가 최대 18.4%(RSDr)로 나타나 EU 가이드라인의 RSDR ≤ 30%에 적합하였다.(Table. 4-5).
국내 유통 중인 백미 등 9품목 115건에 대하여 T-2 독소 및 HT-2 독소에 대한 오염도 조사하였다(Table 6). 밀가루 와 백미에서는 T-2 독소 및 HT-2 독소가 모두 검출되지 않았다. 또한 옥수수는 3건 중 2건에서 T-2 독소가 각각 5.0, 5.2 ug/kg로 검출되었고 HT-2 독소는 검출되지 않았다. 수수에서 T-2 독소가 37.1 μg/kg으로 최대 값으로 검출되었 으나 이는 제외국 기준값(100 μg/kg) 보다 낮은 수준이었다. 수수의 경우는 T-2 독소 및 HT-2 독소 모두 검출되었고, 기장의 경우는 T-2 독소가 15건에서 모두 검출되어 평균 4.3 μg/kg 오염도를 나타내고 HT-2 독소도 15건 중 12건 검출되고 평균 0.8 μg/kg 오염도를 나타내었다. 보리의 경우 는 25건 중 23건에서 T-2 독소가 검출되어 평균 1.2 μg/kg를 나타내었고, HT-2 독소는 25건 중 13건이 검출되어 평균 0.6 μg/kg으로 검출한계수준으로 조사되었다. 이는 T-2 독 소 및 HT-2독소 발생이 열대지역과 아열대 지역에 두드러 지게 나타나고, 날씨 등의 여러 가지 요인에 의해 영향을 받기 때문에 일반화하기는 어려우나, 유럽연합(EU)에서 2003년도에 실시한 SCOOP(scientific co-operation) 프로젝 트를 통하여 조사된 오염현황에서 가공되지 않은 귀리와 보리에서 발생빈도가 87%, 16% 및 오염도가 10 μg/kg 값과 비교할 때 낮은 수준이다(11),
다만, 다양한 곡류의 섭취량이 많은 우리나라 식습관 및 수입 곡류의 증대 등을 고려하여 식품 중 곰팡이독소 안전 관리를 위해, T-2 독소 및 HT-2 독소에 대한 오염도 자료는 지속적으로 축척이 이루어져야 할 것이다.
요 약
본 연구에서는 곡류 중 트리코테센류 곰팡이독소인 T-2 독소 및 HT-2 독소의 LC-MS/MS 분석방법을 검증하고 국 내 유통 곡류 중 T-2 독소 및 HT-2 독소의 오염실태를 파악 하였다. 곡류 중의 T-2 독소 및 HT-2 독소를 분석하기 위해, 염화나트륨을 포함한 90% 메탄올 용액으로 추출, 원심분 리, 여과, 4% 염화나트륨용액으로 희석하고, 원심분리한 후, 여과한 후 면역친화성칼럼에 의해 정제한 시료를 LC-MS/MS 동시정량 분석하였다. T-2 독소 및 HT-2 독소의 검출한계 및 정량한계는 각각 0.5 μg/kg 및 1.5 μg/kg 얻었다. matrix-matched 표준 검량식에서 상관계수 0.99 이상의 직 선성을 얻었으며, T-2독소와 HT-2 독소 2배에서 10배의 정량한계로 표준용액을 첨가한 시료에서 회수율은 T-2독 소와 HT-2 독소 각각 100.6±7.2 %, 96.8 ± 9.4 %로 EU 가이드라인에서 제시하는 유효성 기준을 만족하였다. LC-MS/MS 정량법을 이용하여 국내 곡류 9품목 115건에 대해 T-2 독소와 HT-2 독소의 오염도를 조사하여 본 결과, 전체 곡류 115건 중에서 T-2 독소는 83건, HT-2 독소는 93건 검출되었으며 오염도는 T-2 독소는 N.D~37.1 ug/kg, HT-2 독소는 N.D~5.4 ug/kg 으로 낮은 수준이었으며, 오염 도는 유럽기준치(100 μg/kg)이내 이었다. 본 연구에서 개발 된 곡류 중 T-2 독소 및 HT-2 독소에 대한 분석법은 향후 우리나라 곡류 중 곰팡이독소 안전관리를 위한 시험법으로 활용가능하며, 오염도 자료는 안전성 평가의 기초자료로 활용이 가능할 것으로 사료된다.