ARTICLE
돌산갓의 부위별 sinigrin 함량
오선경1, 김기웅2, 배상옥3, 최명락1,*
Sinigrin content of different parts of Dolsan leaf mustard
SunKyung Oh1, KiWoong Kim2, SangOk Bae3, Myeong Rak Choi1,*
2Department of Marine Bio Food Science, Chonnam National University, Yeosu 59626, Korea
1Department of Biomedical Electronic and Engineering, Chonnam National University, Yeosu 59626, Korea
3Department of Culinary Art, Chodang University, Muan 58530, Korea
© The Korean Society of Food Preservation . This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: May 22, 2015; Revised: Aug 12, 2015; Accepted: Aug 18, 2015
Abstract
The aims of this study was to optimize the extraction conditions of sinigrin from Dolsan leaf mustard. Dolsan leaf mustard (Dolsan-eup, Yeosu-si) harvested during at May 2014 was used for sinigrin extraction. After the extraction of sinigrin using 50% CH3CN, 10% NH4Cl, 60% CH2OH, and 70% CH3OH, the sinigrin content was measured by HPLC analysis. The results showed that sinigrin content was highest with 50% CH3CN solvent extraction and UV detector sensitivity was greater at 228 nm rather than at 242 nm. The sinigrin concentrations of leaf, stem and root with 50% CH3CN extraction were 345 ppm, 728 ppm, and 539 ppm, respectively. After extraction of the different parts of Dolsan leaf mustard, The standard retention time by HPLC analysis of sinigrin content was 2.054, 2.032, 2.059, and 2.035 min from the root, stalk, and leaf, respectively. On the other hand, HPLC analysis showed that the leaf extracts contained glucoraphanin, one of glucosinolates. The optimum time and extraction solvent for the sinigrin extraction from Dolsan leaf mustard was found to be 24 hr with 50% CH3CN solvent. In addition, opotimum UV detector k at 228 nm. These results showed that the optimum extraction conditions for Dolsan leaf mustard were 24 hr extraction with 50% CH3CN solvent. In addition, the optimum wavelength of UV detector was determined to be 228 nm for sinigrin analysis. Therefore, this study could provide a useful information for sinigrin extraction and its systematic analysis during the storage.
Keywords: leaf mustard; HPLC; sinigrin; solvent extraction
서 론
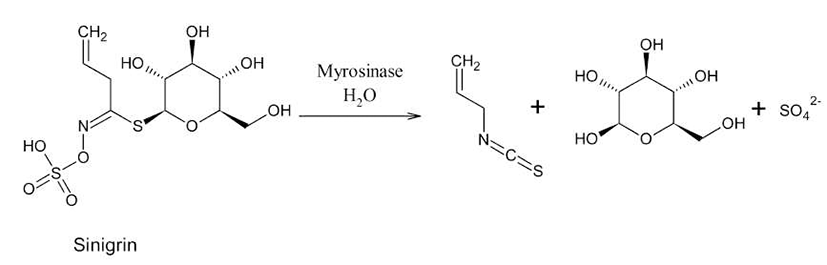
갓(leaf mustard : Brassica juncea)은 십자화과에 속하는 경엽 채소류로 중앙아시아가 원산이고, 고온 다습한 곳을 좋아하며 국내에서는 지역적인 독특한 기후, 토양조건 등 으로 전라남도 여수시 돌산지방에서 재배되어 오고 있다. 갓의 독특한 자극성 매운 맛은 겨자나 와사비의 주요 휘발 성 매운 맛 성분인 allyl isothiocyanate에 주로 기인하는 것으 로 이는 갓에 함유되어 있는 glucosinolates의 일종인 sinigrin 에 myrosinase(thioglucosinolate glucohydrolase, EC 3.2.3.1) 가 작용하여 생성된다(1). 또한 갓은 식물성 2차 대사산물인 glucosinolate, flavonoid, polyphenol류, 함황화합물 등이 풍 부하며(2), 이러한 물질들은 생리활성 물질로서 체내에서 약리작용을 나타내는데 특히 면역계를 강화시킴으로써 건 강유지에 기여하며 최근에는 암을 예방하는 대표적인 식품 으로 여겨지고 있다(3). 갓은 많은 양의 thiosulfates와 organosulfur 화합물들을 함유하고 있고 이 화합물은 화학 적으로 유도되는 종양을 저해한다고 알려져 왔다(4). 또한 돌산갓을이용한4-decanol의항돌연변이효과(5), isothiocyanate 류의 분석(6), 항산화 및 항암성, ACE 저해활성(7), 갓즙액 의 함황물질과 ACE저해활성(8)에 관한 내용이 보고되었 다.
돌산갓김치는 그 독특한 향과 맛 때문에 기호식품으로 알려져 있으며, 지역특산품으로 지역 경제에 큰 역할을 하 고 있다. 돌산갓김치의 조추출물은 항균, 항산화, ACE 저해 효과 및 각종 암세포에 대한 세포독성 등(9-13)의 기능이 있는 것으로 연구되었다. 이와 같은 기능은 유산균(12,13) 과 sinigrin(7,14)에 의한 것으로 추측된다. 이와 같이 돌산갓 김치의 기능성이 보고되어 있지만 발효과정중의 sinigrin과 그 유도체 및 기능성의 변화에 관한 연구는 미흡한 실정이 다. 또한 종자에 관한 sinigrin 함량에 대한 보고가 있었지만 주요 섭취부위인 줄기, 잎, 뿌리 등의 sinigrin 분석법에 대한 연구는 보고되지 않았다. 특히, 갓을 이용한 대표적인 식품 으로 갓김치, 갓물김치, 갓피클 등의 발효 저장 중 생리활성 물질인 sinigrin과 그 유도물질의 동향에 관한 연구가 필요 하다. 그러나 현재 돌산갓의 sinigrin과 그 유도물질에 관한 함량 및 분석법이 보고되지 않아 적절한 분석법의 확립 및 체계화가 필요한 실정이다.
본 연구에서는 sinigrin 추출법과 HPLC 분석조건을 제시 함으로써 돌산갓 뿐 만 아니라 갓을 이용한 다양한 제품 중의 sinigrin 추출과 저장기간에 따른 sinigrin 함량변화에 대한 체계적인 분석연구에 기초자료로 제시하고자 한다.
재료 및 방법
재료 및 시약
본 실험에 사용한 돌산갓(Dolsan leaf mustard, Brassica juncea)은 전남 여수시 돌산읍 소재 돌산갓 영농조합에서 2014년 3월 20일에 파종하여 5월 26일에 수확된 갓을 구입 하여 사용하였다. 돌산갓은 뿌리, 줄기, 잎 세 부분으로 나누 어 분쇄하여 사용하였다. 추출 및 분석을 위한 시약은 sinigrin(Sigma Chemical CO., St. Louis, MO, USA), acetonitrile(J.T. Baker, USA), ammonium chloride(SAMCHUN PURE CHEMICAL CO., LTD.), CH3OH(J.T. Baker, USA), CH2OH(DUKSAN PURE CHEMICAL CO., LTD.)을 사용 하였다.
Sinigrin 추출
돌산갓의 부위별 sinigrin 함량 측정을 위해 뿌리, 줄기, 잎을 원통여지에 각각 10 g씩 취하고 round flask에 50% acetonitrile(CH3CN) 200 mL를 넣어 soxhlet extractor와 연결 하여 water bath 92°C, 24시간 추출하여 실온에서 냉각 후 사용하였다(15). 10% ammonium chloride(NH4Cl), 60% CH2OH, 70% CH3OH (16)은 시료 부위별로 각각 10 g씩 취하여 용매 200 mL로 2~3분간 교반 후 Whatman No. 4(Whatman International Ltd., England)로 여과하였다. Fig 1
Sinigrin standard curve
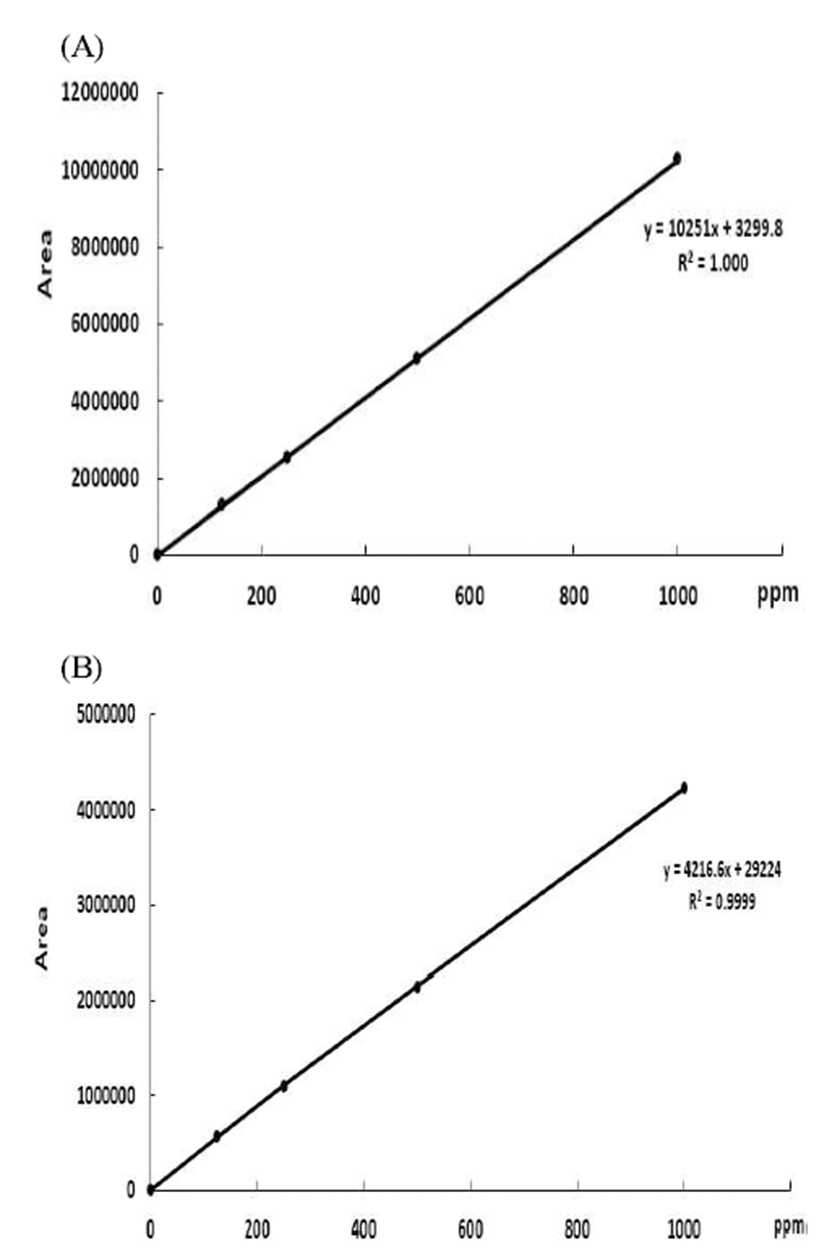
표준시약 sinigrin을 125, 250, 500, 1000 ppm의 농도로 제조하여 228 nm, 242 nm에서 3회 반복 측정하였으며 평균 값으로 standard curve을 Fig. 2에 나타냈다.
HPLC 분석조건
돌산갓 부위별 용매추출 후 syringe filter 0.45 μm(Toyo Roshi Kaisha, Ltd, Tokyo, Japan)로 여과한 여액을 vial에 담아 3회 반복 측정하여 분석하였다. Sinigrin과 그 유도물 질의 UV detector 파장은 228 nm와 242 nm에서 측정하였으 며 HPLC 분석 조건은 Table 1과 같다.
Table 1.
HPLC apparatus and operating conditions
|
Items |
Conditions |
|
HPLC |
Shimadzu JP/LC-10A System/CDD-6A detector |
|
Column |
Shim-pack VP ODS (250 4.6 mm) |
|
Mobile phase |
Acetonitrile : DDW = 40 : 60 (v/v) |
|
Flow rate |
1.0 mL/min |
|
Detector |
UV 228 nm, 242 nm |
|
Oven temp. |
40°C |
|
Injection volume |
10 μL |
Download Excel Table
결과 및 고찰
Total sinigrin 함량
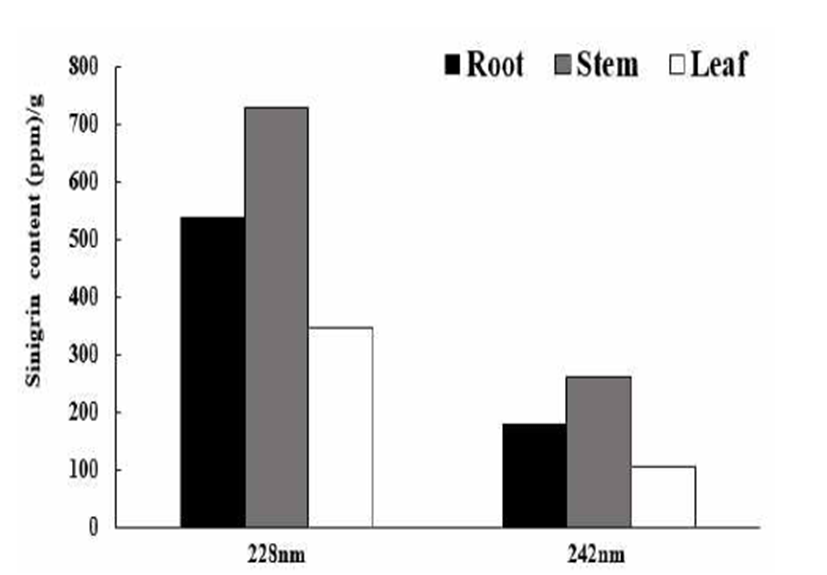
정량분석을 위한 표준시약으로 sinigrin을 이용하였으며 125, 250, 500, 1000 ppm의 농도로 제조하여 표준곡선을 작성하였다. HPLC chromatogram의 peak area와 관계는 228 nm과 242 nm에서 각각 r2=1.000, r2=0.999를 나타내었다. 각 파장별 standard curve의 regression equation을 이용하여 돌산갓의 수분함량을 제외한 실제 갓의 무게를 이용하여 정량화하였고 Fig. 3은 최적의 UV detector 파장을 선택하기 위해 228 nm 와 242 nm에서 sinigrin 함량을 측정한 결과이 다. Tsao(16)과 Rungapamestry(17)는 detector 228 nm에서 sinigrin을 측정하였고 allylisothiocyanate는 242 nm에서 측 정했을 때 감도가 높게 나타났다고 하였다. 본 연구에서도 sinigrin은 UV detector 파장을 비교하였을 때 242 nm보다 228 nm가 높게 나타났다. 또한 돌산갓 부위별 sinigrin 함량 은 줄기부위에서 728 ppm으로 가장 높게 나타났으며, 뿌리 와 잎에서는 각각 539 ppm, 345 ppm으로 나타났다. 이 결과 로부터 이후 실험에서는 UV detector 파장을 228 nm로 측정 하였다.
Fig. 3.
Sinigr in contents of Dolsan leaf mustard by the HPLC UV detector wavelengths at 228 nm and 242 nm.
Download Original Figure
용매에 따른 생갓 부위별 singrin 함량
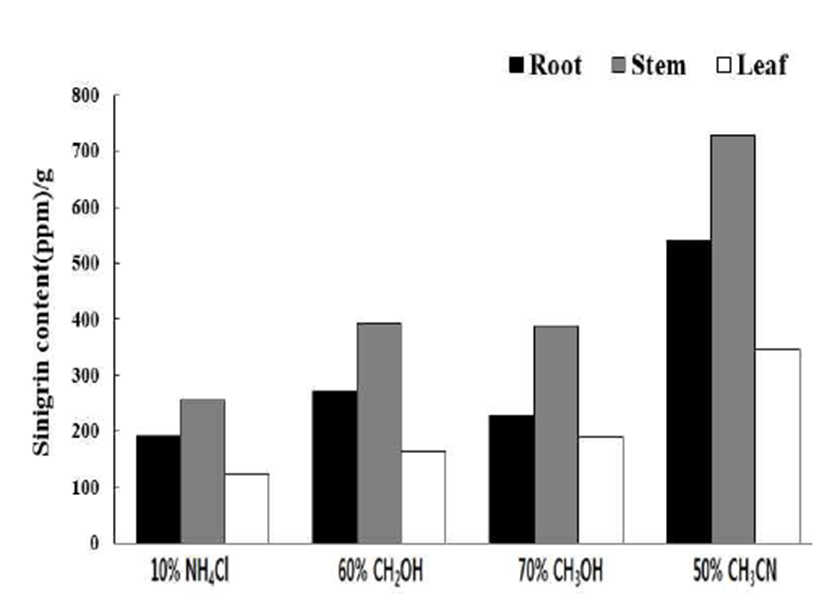
최적의 추출 용매를 선택하기 위해 돌산갓을 뿌리, 줄기, 잎으로 나누어 50% CH3CN, 10% NH4Cl, 60% CH2OH, 70% CH3OH 로 각각 추출하였고, 이때 sinigrin 함량은 Fig. 4와 같았다. 50% CH3CN에서 돌산갓의 부위별 sinigrin 함량 이 다른 용매들보다 높게 나타났으며 10% NH4Cl, 60% CH2OH, 70% CH3OH 은 큰 차이가 없음을 확인할 수 있었 다. Tao 등(15)의 보고에 의하면 갓의 종자에 함유된 glucosinolates 함량 조사에서 추출 용매로 water, 60% CH2OH, 10% NH4Cl을 사용했을 때 10% NH4Cl, 60% CH2OH, water 순으로 보고하였으나 본 연구에서는 차이가 나타나지 않았다. 또한 Tsao 등(16)의 sinigrin 추출법으로 50% CH3CN을 이용하여 24시간 환류 추출한 시료가 가장 추출율이 높았다고 보고하여 본 연구와 비슷한 결과를 나타 내었다.
생갓의 HPLC chromatogram
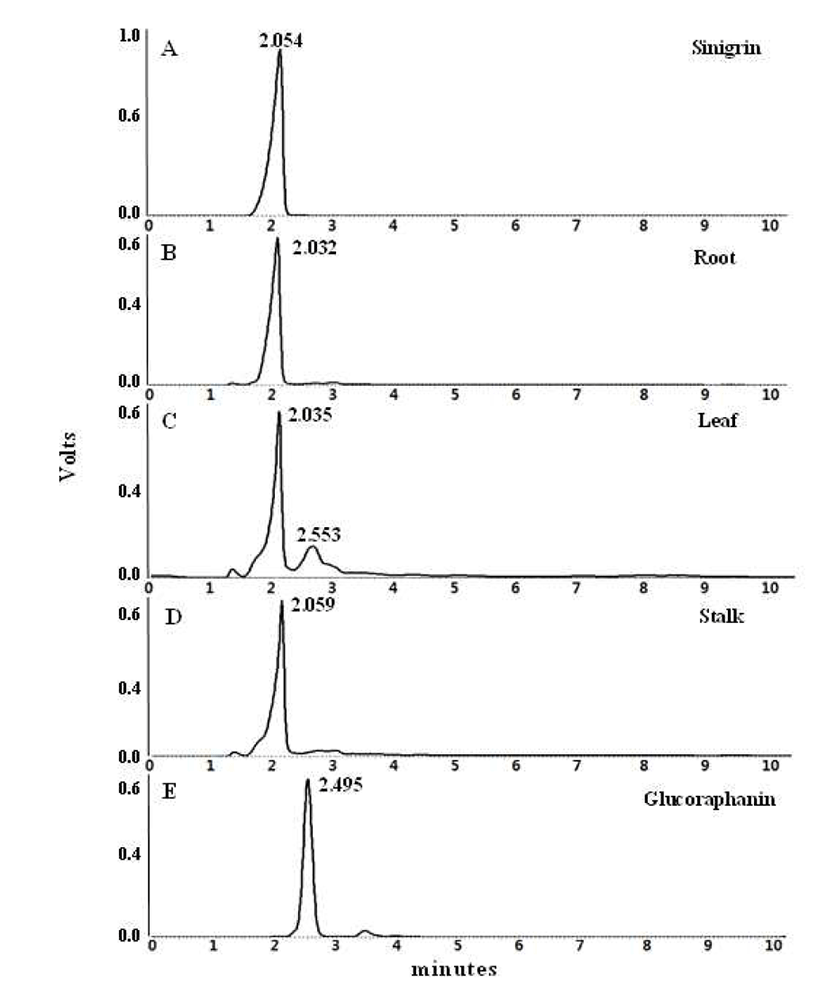
Sinigrin 표준물질과 돌산갓 부위별 HPLC 분석결과를 Fig. 4에 나타내었다. 추출 용매는 50% CH3CN를 사용하였 고, UV detector 파장은 228 nm에서 분석하여 retention time(RT)으로 비교하였다. 표준물질과 돌산갓의 부위별 추 출물의 RT는 sinigrin 2.054 min, 뿌리 2.032 min, 줄기 2.059 min, 잎 2.035 min으로 나타났다. 이 결과는 돌산갓 부위별 추출물의 RT와 표준물질의 RT가 거의 일치한다는 것을 보여주었다. 또한 돌산갓 잎의 경우 줄기와 뿌리에서 나타 나지 않은 다른 peak(RT 2.553 min)가 발견되었다. 돌산갓 줄기와 뿌리에서 나타나지 않은 이 peak는 glucoraphanin (RT 2.495 min)이라는 표준물질의 RT와 거의 일치하였다. 돌산 갓 잎에서 나타난 glucoraphanin으로 추정되는 이 물질은 주로 broccoli에 높은 농도로 함유된 항암성분으로 알려져 있다. Rangkadilok 등(18,19)은 cabbage, cauliflower, Brussels sprouts은 sinigrin의 농도가 높았고, broccoli에서 glucoraphanin의 농도가 높았다고 보고하였다. 지금까지 보 고된 결과에 의하면 Brassica species의 seed 중에서 Brassica juncea에서는 glucoraphanin이 검출되지 않았다. 그러나 본 연구의 결과로부터 seed와 식물에 함유된 생리활성 물질에 는 차이가 있음을 알 수 있었다. 특히 돌산갓에 대한 sinigrin 분석 자료가 거의 없어, 향후 십자화과 경엽채소류의 추가 적인 비교 분석 및 연구가 필요하다고 판단된다.Fig. 5
요 약
돌산갓에서의 glucosinolates인 sinigrin의 분석법을 확립 하기 위해 다양한 용매를 이용하여 추출 후 정성·정량하였 다. 돌산갓을 뿌리, 줄기, 잎으로 구분하여 50% CH3CN, 10% NH4Cl, 60% CH2OH, 70% CH3OH 을 이용해 추출 시 50% CH3CN이 가장 sinigrin 함량이 높게 나타났으며 나머지 용매들은 큰 차이가 없었다. 또한 갓 부위별에서 sinigrin함량은 큰 차이가 없었으며 줄기 부위의 50% CH3CN추출물의 sinigrin함량이 728 ppm으로 다소 높게 나 타났다. Sinigrin은 농도별로 standard curve를 작성하여 HPLC에 의한 돌산갓 부위별 sinigrin 함량을 정량화 하였고 HPLC로 분석시 UV detector 감도는 242 nm보다 228 nm에 서 높게 나타났으며 228 nm에서는 줄기, 뿌리, 잎 순서로 sinigrin함량이 나타났다. 50% CH3CN로 추출한 돌산갓의 chromatogram은 표준물질인 sinigrin의 retention time과 일 치하였으며, 잎에서 나타난 peak는 glucosinolates인 glucoraphanin으로 확인되었다. 본 연구의 결과로부터 돌산 갓에 함유된 sinigrin 분석을 위한 추출용매는 50% CH3CN, UV detector 파장은 228 nm가 가장 적합하다는 것을 알 수 있었다. 또한, sinigrin의 추출 및 분석이 체계화됨으로써 돌산갓을 이용한 다양한 식품의 저장기간에 따른 sinigrin 함량변화 및 생리기능에 관한 연구에 활용 될 수 있을 것으 로 판단된다.
감사의 글
이 연구성과는 2014년도 BK21플러스 전남대학교 미래 융합 바이오전자 메디컬 고급 창의 인력 양성사업단의 참여 학생으로서 작성한 것입니다.
REFERENCES
Popova IE, Morra MJ. Simultaneous quantification of sinigrin, sinalbin, and anionic glucosinolate hydrolysis products in Brassica juncea and Sinapis alba seed extracts using ion chromatography. J Agric Food Chem. 2014; 65 p. 10687-10693


Cho YS, Ha BS, Park SK, Chun SS. Contents of carotenoids and chlorophyll in Dolsan leaf mustard (Brassica juncea). Korean J Dietary Culture. 1993; 8 p. 153-157.

Lee SM, Rhee SH. Inhibitory effects of various cruciferous vegetables on the growth of human cancer cells. J Life Sci. 1997; 7 p. 234-240.

Kim H, Kim JY, Kim HJ, Kim DK, Jo HJ, Han BS, Kim HW, Kim JB. Anticancer activity and quantitative analysis of glucosinolates from green and red leaf mustard. J Korean Soc Food Nutr. 2011; 24 p. 362-366


Kim JO, Kim MN, Park KY, Moon SH, Ha YL. Antimutagenic effects of 4-decanol identified from mustard leaf. J Korean Agric Chem Soc. 1993; 36 p. 424-427.

Cho YS, Park SK, Chun SS, Park JS. Analysis of isothiocyanates in Dolsan leaf mustard (Brassica juncea). Korean J Dietary Culture. 1993; 8 p. 147-151.

Choi MR, Yoo EJ, Song SH, Kang DS, Park JC, Lim HS. Comparison of physiological activity in different parts of Dolsan leaf mustard. J Korean Soc Food Sci Nutr. 2001; 30 p. 721-725.

Yoo EJ, Choi MR, Lim HS. The relationship between ACE inhibitory activity and degradations of sulfur containing materials in Dolsan leaf mustard juice. Biotechnol Bioprocess Eng. 2004; 9 p. 400-404


Lim HS, Yoo EJ, Choi MR. Changes of physiological activity according to fermentation period of mustard leaf Kimchi. J Microbiol Biotechnol. 2000; 10 p. 43-47.

Choi YY, Yoo EJ, Lim HS, Kang DS, Nishizawa N, Choi MR. The relationship between physiological activity and cell number in Dolsan leaf mustard Kimchi (Brassica juncea). J Food Sci Nutr. 2001; 6 p. 117-121.

Choi MR, Yoo EJ, Lim HS. Effect of lactic acid bacterium on antioxidative and ACE inhibitory activity in Dolsan leaf mustard Kimchi. Korean J Life Sci. 2003; 13 p. 59-66.

Yoo EJ, Lim HS, Park KO, Choi MR. Cytotoxic, antioxidative, and ACE inhibiting activities of Dolsan leaf mustard juice (DLMJ) treated with lactic acid bacteria. Biotechnol Bioprocess Eng. 2005; 10 p. 60-66


Lim HS, Park KO, Nishizawa N, Bae SO, Choi MR. Cytotoxicity of extracts from Dolsan leaf mustard Kimchi treated with lactic acid bacteria on lung and gastric cancer cells. Biotechnol Bioprocess Eng. 2008; 13 p. 174-181


Lim HS. The study for contents of sinigrin in Dolsan leaf mustard Kimchi during fermentation periods. J Life Sci. 2002; 12 p. 523-527.

Tao CC, Brian BH. Isolation of intact glucosinolates from mustard seed meal to increase the sustainability of biodiesel utilization. An ASAE/CSAE Meeting Presentation 040679. 2004


Tsao R, Yu Q, Potter J, Chiba M. Direct and simultaneous analysis of sinigrin and allylIsothiocyanate in mustad samples by high-performance liquid chromatography. J Agric Food Chem. 2002; 50 p. 4749-4753


Rungapamestry V, Duncan AJ, Fuller Z, Ratcliffe B. Changes in glucosinolate concentrations, myrosinase activity, and production of metabolites of glucosinolates in cabbage (Brassica oleracea Var. capitata) cooked for different durations. J Agric Food Chem. 2006; 54 p. 7628-7634


Rangkadilok N, Nicolas ME, Bennett RN, Premier Robert RR, Eagling DR, Taylor PWJ. Developmental changes of sinigrin and glucoraphanin in three Brassica species (Brassica nigra, Brassica juncea and Brassica oleracea var. italica). J Sci Hort. 2002; 96 p. 11-26


Rangkadilok N, Nicolas ME, Bennett RN, Premier Robert RR, Eagling DR, Taylor PWJ. Determination of sinigrin and glucoraphanin in Brassica species using a simple extraction method combined with ion-pair HPLC analysis. J Sci Hort. 2002; 96 p. 27-41


Kang SK. Isolation and antimicrobial activity of antimicrobial substance obtained from leaf mustard (Brassica juncea). J Korean Soc Food Nutr. 1995; 24 p. 695-701.

Lim HS. The study for contents of sinigrin in Dolsan leaf mustard kimchi during fermentation periods. J Life Sci. 2002; 12 p. 523-527.

Shin CS, Seo KI, Kang KS, Ahn CW, Kim YG, Shim KH. Purification and enzymatic properties of myrosinase in Korean mustard seed (Brassica juncea). J Korean Soc Food Nutr. 1996; 25 p. 687-694.

Park JR, Park SK, Cho YS, Chun SS. Purification and characterization of myrosinase in Dolsan mustard (Brassica juncea) and changes in myrosinase activity during fermentation of leaf mustard Kimchi. Korean J Dietary Culture. 1994; 9 p. 137-142.