서 론
재래식 된장은 대두만을 사용하여 메주를 만들고 이것을 소금물에 담구어 발효가 끝나면 메주덩어리를 걸러내어 액체부분은 간장으로 만들고, 남은 고형물은 소금을 더 첨 가하여 재래식 된장을 만든다. 이와 같이 재래식 된장은 초기에 콩을 원료로 하여 제조된 메주를 사용한 콩된장이 주를 이루었으나, 조선 명종조(明宗朝)에 이르러 콩과 콩 이외의 전분질을 이용하여 메주 및 된장이 제조되었으며, 이때 사용된 전분질 원료에 따라 쌀된장, 보리된장 등으로 구분되었다(1). 된장의 중요 맛 성분인 아미노산은 총량에 서 큰 차이가 없으나 개량식 된장은 재래식 된장보다 aspartic acid, glutamic acid, proline, arginine, serine등의 함량 이 높은 것으로 보고되고 있다(2). 주재료가 콩으로 이루어 진 일반 된장의 연구 및 산업화가 이루어진 반면 쌀된장 관련 연구는 매우 미흡한 실정이다. 쌀된장은 국내 대기업 을 중심으로 한 3~4 업체에서 생산되며, 일본의 미소가 국 내 쌀된장 시장을 상당히 점유하고 있는 실정이다(3). 팽화 미는 쌀을 가열하여 전분을 알파화 시킨 상태로 가공한 것을 말하며, 일반적으로 고두밥을 만든 채로 가만히 두면 원활한 발효를 위해 알파(α)화한 전분이 원래의 베타전분으 로 되돌아가는데, 팽화미는 이것을 방지할 수 있는 처리법 이다. 팽화미는 최근 원료처리 공정의 간소화, 세미 폐수의 절감 등 이점이 많아서 점차 사용량이 늘고 있다. 이러한 개량식 된장을 제조하는데 있어 쌀을 기질로 이용하는 미생 물이 이용할 수 있도록 고두밥을 쪄서 가공과정을 거치는 대신 팽화미를 사용하여 누구나 손쉽게 개량식 된장을 제조 하고자 하였다. Kim 등은 전분질 대신 α화율(호화도)이 높 아 발효가 잘 진행되므로 발효기일을 단축시킬 수 있다고 하였다(4).
장류의 기능성은 콩이나 부재료 자체가 갖는 기능성뿐만 아니라 메주나 장류 발효에 관여하는 미생물이 생산하는 다양한 2차 대사산물과 효소에 의한 것으로 알려져 있다 (5,6). 된장의 품질에 영향을 끼칠 수 있는 미생물 유래 효소 로는 protease, amylase, lipase가 있으며, 이러한 효소에 의해 원료의 단백질과 탄수화물 그리고 지방 등이 가용성으로 분해되어 된장의 맛과 향이 결정된다. 즉, 된장 고유의 맛과 향은 소금에서 오는 짠맛, 탄수화물이 알코올로 발효과정 중 생성되는 다양한 향, 단백질의 가수분해 산물인 아미노 산에서 오는 구수한 맛 등이 조화를 이루면서 또한 향미와 색이 생성 된다(7). 발효 후 완성된 된장은 아미노산, 유기 산, 미네랄 및 비타민류 등을 풍부히 함유하고 있어 영양원 으로서 매우 중요하다(8). 최근에는 발효된장에서 항산화 능, 항돌연변이성, ACE저해물질, 혈전 용해성 등 여러 가지 생리활성 물질의 기능성이 확인되면서 관심이 증대되고 있다(9).
본 실험은 선행 연구에서 메밀속성장으로부터 cellulase, protease, amylase, lipase와 같은 세포외 효소 분비능이 우수 한 Bacillus subtilis HJ18-9 균주를 분리 동정하였고(10), B. subtilis HJ18-9는 우수한 효소 활성뿐만 병원성균에 대한 항균 활성이 있음을 확인하였다.
따라서 본 연구에서는 산업적으로 표준화가 용이하고 기능성이 있는 장류의 starter 표준화를 위해, 자연 발효시키 기 위해 균을 넣지 않고 제조한 control과B. subtilis KACC 15935, 그리고 다양한 효소활성을 지니는B. subtilis HJ18-9 를 starter로 사용하여 콩알 메주를 제조하여 팽화미 된장을 제조하고 품질특성을 규명하고자 하였다.
재료 및 방법
본 실험에서 사용된 콩은 대원콩은 재배농가에서 구입하 여 사용하였다. 스타터로 사용된 KACC15935는 국립 유전 자원센터에서 분양받은 균으로, 전통장에서 분리한 B. subtilis이다. B. subtilis HJ18-9는 선행연구를 통해 메밀 속 성장으로 부터 분리된 균으로 amylase, protease, cellulase등 의 세포의 효소분비능이 우수하며, S. entrerica, S. aureus, C. albicans 등에 대한 항균활성이 있는 균이다(10).
장류콩인 대원콩을 재료로 사용하였으며, 대원콩은 세척 하여 25°C에서 24시간 수침하고 autoclave를 이용하여 증자 (121°C, 30 min)하였다. 증자된 콩을 40°C 이하로 clean bench에서 냉각한다. 실험은 자연 발효시키기 위해 균을 넣지않고 제조한 control과 B. subtilis KACC 15935, B. subtilis HJ18-9를 첨가한 군으로 나누어 진행하였다. 각 균 주를 106 CFU/mL 이상의 농도가 되도록 배양하여 시료량 의 1%(w/w)가 되도록 첨가 하였다. 균을 접종한 콩을 스티 로폼 박스에 담아 37°C, 24시간 발효시킨다. 발효 시킨 콩을 50°C 송풍건조기에서 약 8시간 건조시킨(건조된 콩의 수분 : 8.5~9.5%) 후 건조하여 완성된 콩알메주로 된장제조에 사용하였다.
균별 콩알메주 : 팽화미 : 소금 : 물 = 29 : 19 : 15 : 36의 비율로 3.4 kg 된장을 밀폐용기에 담고 소금이 약간 녹을 수 있게 저어주고 30°C에서 하룻밤 수침하여 안정화시 킨다. 안정화시킨 된장을 0일차로 sampling한다. 각 시료는 28°C에서 56 days 발효하였다.
된장 시료 20 g에 80 mL의 증류수를 첨가하고(w/v) 균질 화한(POLYTRON® PT 2100 Homogenizers, Kinematica AG, Switzerland) 후 이를 원심분리(8,000 rpm, 10 min)한 후 상등액을 분석 시료로 사용하였다.
α-Amylase 활성 측정은 D.U.N(Dextrinogenic Unit of Nagase)법(11)에 의하여 측정하였다. 1% 전분 기질액(pH 7.0) 3 mL에 시료추출액 1 mL를 넣고 반응(40°C, 10 min) 시킨 후 반응액 1 mL에 0.1 M HCl 10 mL를 넣어 반응을 정지시켰다. 반응액 1 mL에 0.005% I2-0.05% KI 용액 10 mL를 넣어 발색시킨 후 660 nm에서 흡광도를 측정하였다. 위와 같은 방법으로 측정하여 다음 식에 의해 효소활성을 계산하였다.
D.U.N=[(D-D’)/D]×10/100×n
D : Absorbance of control
D’: Absorbance of sample
n : Dilution ratio of sample
Protease 활성 측정은 식품공전(12)에 따라 측정하였다. 0.2 M phosphate buffer에 0.6% casein을 용해한 후 pH를 7.0으로 보정하여 기질용액을 제조하였다. 이 기질용액 1.5 mL에 시료추출액 0.5 mL를 넣어 반응(37°C, 10 min) 시킨 후, 0.44 M trichloroacetic acid(TCA) 2 mL을 가하여 반응을 정지시켰다. 25분간 37°C water bath에서 방치시킨 후 여과 (Whatman No. 2)하였다. 여액 1 mL에 0.55 M Na2CO3 용액 5 mL를 첨가한 후, Folin 시약 1 mL를 첨가하여 발색(37°C, 20 min)시켜서 660 nm에서 흡광도를 측정하였다. 반응 후 분해물의 tyrosine 양은 tyrosine 표준곡선으로부터 계산하 였으며, 효소 활성은 시료 1 g 에 의해 1분간 tyrosine 1 μg을 생성하는 능력을 1 unit으로 하였다.
Cellulase 활성 측정은 carboxymetyl cellulose sodium salt(CMC)를 기질로 하여 효소와 반응 시킨 후, 유리된 환원 당을 3,5-dinitrosalicylic acid(DNS)방법으로 다음과 같이 측 정하였다. 1% CMC(pH 7.0) 용액 0.5 mL와 0.2 M sodium phosphate buffer(pH 7.0) 0.25 mL를 넣은 후, 효소액 0.25 mL 을 첨가하여, 50°C에서 15분간 반응시킨 후, DNS 시약 을 3 mL를 가하여 반응을 정지시킨 후, 5분간 끓는 물에 중탕시켜 발색시킨 다음, 위와 같은 방법으로 측정하였다. 대조구는 반응 정지를 먼저 시킨 다음, 위와 같은 방법으로 측정하였다. 효소활성을 시료 1 g 의해 1분간 1 μg을glucose 을 생성하는 효소의 양을 1 unit으로 정의 하였다.
시료추출액 5 mL, 중성 formalin 용액 10 mL, 증류수 10 mL를 넣은 플라스크에 0.5% phenolphthalein 용액 2~3방 울을 가한 후, 0.1 N NaOH로 미홍색이 될 때까지의 적정양 과 시료 5 mL, 증류수 20 mL을 넣은 플라스크에 0.5% phenolphthalein 용액을 2~3방울을 가한 후, 0.1 N NaOH로 미홍색이 될 때까지 적정양을 이용하여 아미노태 질소 함량 을 산출하였다(13).
Amino type nitrogen(%)=(V1-V0)×F×0.0014×D×100/S
V1 : Titration value of sample(mL)
V0 : Titration value of blank treat(mL)
F : Facter of 0.1 N NaOH
D : Dilution ratio
S : Mass of sample(g)
0.0014 : Nitrogen weight in 1 mL of 0.1 N NaOH(g)
아미노태 질소함량 측정 때와 동일한 시료액 0.1 mL 취한 후 phenol-hypochloride 반응에 의하여 시료 추출액 0.1 mL 에 A용액(phenol 10 g과 sodium nitroprusside dihydrate 0.05 g/distilled water 1 L)과 B용액(Na2HPO4·12H2O 9 g, NaOH 6 g과 NaOCl 10 mL/distilled water 1 L)을 각각 2 mL씩 넣고 37°C에서 20분간 반응시켜 630 nm에서 흡광도를 측정 하였으며, 표준곡선은 (NH4)2SO4 를 사용하여 암모니아태 질소함량을 측정하였다(14).
환원당은 dinitrosalicylic acid(DNS) 방법(15)에 의하여 측정하였다. 시료 추출액 1 mL에 DNS 3 mL를 혼합한 후 5분 동안 중탕 가열하고 냉각한 후 550 nm에서 흡광도를 측정하며glucose standard curve를통해환원당값을구하였다.
Reducing sugar(%)=A×D×1/S×100/1000
A : Reducing sugar content in sample solution(mg)
D : Dilution ratio
S : Mass of sample(g)
결과 및 고찰
발효 균주를 달리하여 제조한 팽화미 된장의 protease 활성 변화는 Fig. 1에 나타내었다. 대두 단백질을 가수분해 하여 구수한 맛 성분인 아미노산, polypeptide등을 생성하는 protease는 된장 제조 시 맛을 결정짓는 중요한 인자이다. 모든 시료에서 protease 활성이 21일에 가장 높은 효소활성 을 나타내었고, control과 KACC15935는 발효가 진행됨에 따라 다시 감소하는 경향을 보였으며, HJ18-9는 21일부터 발효 종료일 56일 까지 유사한 protease활성을 나타내었다.
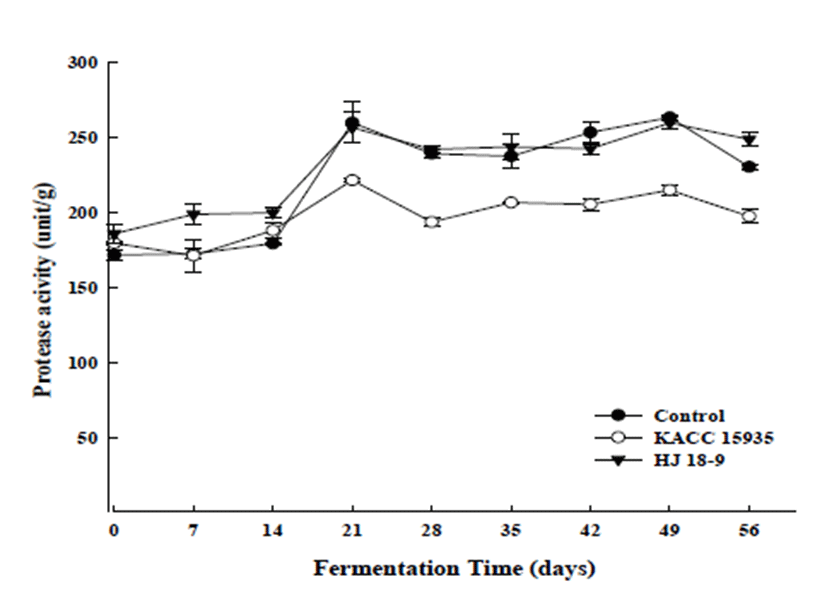
Protease는 된장 발효에 관여하는 미생물이 생산하며 아 미노태 질소 함량과도 연관성이 있어 된장 특유의 맛을 내는데 중요한 역할을 하므로 protease 활성이 높은 HJ18-9 로 제조한 된장의 품질이 우수한 것으로 판단된다. Yoon 등(16)은B. subtillis로 추정되는 균을 첨가한 된장의 발효과 정 중에 protease 활성이 발효 40일까지 증가하나 그 후 감소하는 경향을 보였다고 하였으며, Kim 등(17)은 천일염 으로 제조한 된장의 발효특성에서 protease의 활성을 측정 한 결과 발효 기간 동안 점점 증가하다가 그 이 후 감소한다 고 보고하여 본 연구 결과와 유사하였다. 또한 Mok 등(18) 은 저염된장 발효 초기에 완만한 증가를 보이다 제조 2~3주 후부터 약간 감소하는 경향을 보인 후 7~10주 발효 후에 약간 다시 증가하는 경향을 나타내었다는 보고와 유사한 결과를 나타내었다. 그 원인에 대해 계속 숙성되어 가면서 가용성 단백질이나 peptide가 아미노산으로 가수 분해되면 서 protease 활성도가 증가한 것으로 사료된다고 밝혔는데, 본 연구에서는 그런 현상이 나타나지 않았다. 이는 된장의 효소활성은 사용한 미생물에 따라 큰 차이가 날 수 있어, 사용한 균주의 차이에 기인하는 것으로 생각된다. 된장에 서 protease의 분비는 대두 단백질의 소화성과 영양성 개선 에 큰 역할을 하며, 아미노태 질소 함량과도 연관성이 있어 된장 특유의 맛을 내는데 중요한 역할을 하는 것으로 알려 져 있다. 따라서 protease 활성이 높은 균주를 사용하여 된장 을 제조할 경우, 된장의 맛과 영양성에 좋은 영향을 미칠 것으로 사료된다.
발효 균주를 달리하여 제조한 팽화미된장의 cellulase 효 소활성은 Table 1과 같다. Cellulase중 특히 CMCase (carboxymethyl cellulase, Endo β-1,4-glucanase)는 exo-β -glucanase, β-glucanase와 함께 cellulase계 구성효소로서 식 물세포벽 구성성분 중 대부분 차지하고 있는 cellulose를 분해할 수 있는 능력을 가지고 있어 장내 이용성 증진을 위해 널리 사용되는 효소이다. 발효기간에 따른 균주를 달 리하여 제조한 팽화미 된장의 cellulase 활성 변화는 Table 1에 나타내었다. 본 실험결과 control은 14까지 cellulase 활 성이 증가하다가 다시 감소하는 경향을 보여 42일에 가장 높은 활성을 나타내었으며, KACC15935는 7일까지 증가했 다가 발효종료시점까지 감소하는 결과를 보였으며 HJ18-9 는 14일에 가장 높은 활성을 나타내었으며, 21일부터 발효 종료시점인 56일까지 감소되는 경향을 나타내었다. 56일 발효 후에는 control과 KACC15935에 비해서 HJ18-9 처리 구에서 각각 2.15배, 2.63배 더 높게 나타났다.
전통 장류인 된장이나 간장은 발효과정에서 미생물의 다양한 효소(amylase, protease, cellulase 및 lipase)에 의해 콩에 함유된 단백질, 올리고다당류, isoflavone, 지질 등이 소화되기 쉬운 형태의 아미노산, 유리당, isoflavone 아글리 콘, 지방산 등으로 분해되어 항산화 및 혈전용해 기능을 갖는 2차산물이 생성된다(19,20). 아직 전통장류에서 cellulase 활성에 대한 연구는 미비한 시점이다. 따라서 본 실험의 결과가 팽화미된장 뿐 아니라, 이들 균이 전통장류의 starter 로 사용되는데있어참고자료가될수있을것으로사료된다.
발효 균주를 달리하여 제조한 팽화미 된장의 α-amylase 활성 변화를 조사한 결과는 Table 1에 나타내었다. 각 sample의 α-amylase 활성은 발효초기인 7일에 최대활성을 보였으며 control, KACC15935, HJ18-9 처리구는 각각 4.19±1.78~5.09±0.63, 0.64±0.25~4.86±1.11, 3.28±0.70~5.84 ±0.52 unit/g 범위를 나타내었으며, control은 발효가 진행됨 에 따라 α-amylase 활성이 점차 증가하였다가 감소하는 경 향을 보였으나 유의적인 차이는 나타나지 않았으며, B. subtilis KACC 15935처리구와 HJ18-9처리구는 14일 기점 으로 유의적으로 감소하는 경향을 보였다.
Kim 등(21)은 시료별로는 대조구가 숙성 15일에서 44.80 unit/g으로 가장 높은 효소활성을 나타내었으며, 시험구에 서도 15일에 가장 높은 결과를 나타내었다. 대조구와 시험 구의 효소활성은 큰 차이를 보이지는 않았지만, 숙성기간 에 따라 amylase 효소활성은 급격히 감소하는 경향을 보였 다고 하였다. 또한 된장의 숙성 기간별 amylase 활성을 측정 한 결과, 일반적으로 모든 시료의 제품에서 amylase 활성은 매우 낮게 나타났다고 하였다. No 등(22)은 α-amylase 활성 은 발효기간이 길어짐에 따 라 약간 낮아지는 경향이 있다 고 보고하였다.
일반적으로 된장의 α-amylase 활성은 담금 초기에 높았 다가 발효가 진행되면서 서서히 낮아진다고 보고되었으며, 이는 원료에 함유되어 있던 탄수화물이 α-amylase의 기질 이 되어 효소 활성이 높았다가 전분질 기질이 고갈되어감에 따라 점차 활성이 낮아지는 것으로 사료된다. 스타터의 종 류에 따라 발효와 직접적으로 관계가 있는 효소들의 활성에 차이가 있는 것으로 보아 팽화미 된장의 품질 및 관능적인 특성을 향상시키는 데에는 스타터의 선택이 매우 중요한 것으로 사료된다.
발효 균주를 달리하여 제조한 팽화미 된장의 아미노태 질소 함량 변화는 Fig. 2에 나타내었다. 발효식품의 구수한 맛의 척도인 아미노태 질소는 팽화미된장의 발효숙성 중 미생물이 생산하는 protease 활성에 의해 생성된 아미노산 에 기인한다. 아미노태 질소의 함량은 장류 발효의 품질 지표로서 중요하기 때문에 그 함량을 측정하였다. 아미노 태 질소 함량은 protease 활성과 유사한 경향을 나타내는데 본 연구에서도 유사한 경향을 확인할 수 있었다. B. subtilis HJ18-9을 접종한 팽화미 된장에서 104.37±4.27-225.39 ±3.70 mg% 로 높은 함량을 나타났고, control처리구와 KACC15935처리구는 각각 111.38±0.81-174.99±3.70, 74.19± 6.10-166.59±1.40 mg% 함량을 나타내었다. 모든 처리구에 서 발효기간 종료지점인 56일에서 아미노태 질소 함량이 가장 높게 나타났다.
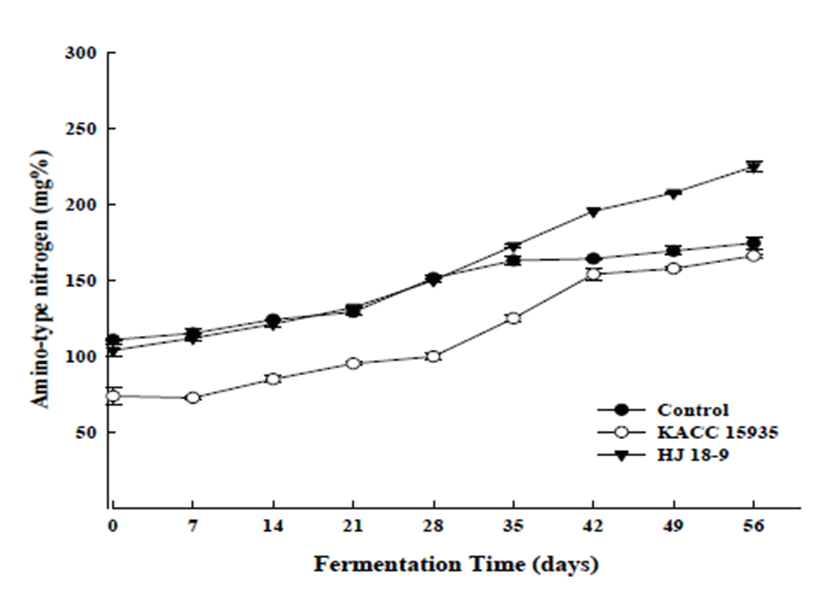
Lee 등(23)의 연구결과에 따르면 발효 초기 25.1~34.1 mg% 범위에서, 발효 42일 151.5~200.0 mg%로 모든 시험구 의 아미노태 질소 함량은 발효가 진행됨에 따라 증가하였다 라고 보고 하였으며, 이는 발효미생물에 의해 생성된 단백 질 가수분해효소작용으로 대두단백질이 분해된 것으로, 특히 발효 초기에 급격하게 분해되는 것으로 알려져 있다 (24). 식품공전의 된장규격은 아미노태 질소 함량이 160 mg% 이상으로 규정되어 있다. 본 연구결과에 의하면 모든 처리구의 발효종료일 아미노태 질소함량은 160 mg% 이상 함량을 나타내어 가식 가능한 수준으로 발효됨을 알 수 있었다. Lee 등(25)은 밀된장의 발효숙성 과정 중 아미노태 질소 함량 변화를 관찰한 결과 초기 아미노태 질소는 106.48~162.51 mg%으로 나타났으며 이와 같은 값의 차이 는 사용한 균주에 따라 그 함량이 다르다고 하였다. 또한 Kim(3)은 국내외 시판 쌀된장 14종의 아미노태 함량을 분 석하였는데 시료에 따라 1.01~2.05배 차이가 있다고 하였 다. 이는 된장 제조 시 첨가되는 콩과 쌀의 함량 차이에서 기인된 것으로 사료된다. 따라서 본 실험의 모든 시료에서 전체적으로 아미노태 질소 함량이 낮은 것은 발효시간이나 온도와 같은 환경과, 실험 시 첨가되는 재료의 함량, 그리고 사용한 균주 등의 다양한 원인에 의한 영향인 것으로 사료 된다.
발효기간에 따른 균주를 달리하여 제조한 팽화미된장의 암모니아태 질소 함량 변화는 Table 2에 나타내었다. 팽화 미된장의 암모니아태 질소의 함량은 control에서는 0일차 에 가장 높은 함량을 나타내었으며 KACC 처리구에서는 42일차에 HJ18-9 처리구에서는 49일차에 가장 높은 함량을 나타냈다. 전반적으로 B. subtilis KACC 15935처리구에서 발효되는 동안 유의적으로 높은 암모니아태 함량을 나타내 었다. Kim 등(13)은 암모니아태 질소함량은 대조구 보다는 시험구에서 높은 함량을 나타내었다. 숙성일별로 살펴보면 모든 된장에서 숙성일이 경과함에 따라 암모니아태 질소함 량도 증가하는 경향을 나타냈다고 하였으며 Kim 등(26)은 숙성과정 중 protease 작용으로 단백질성 질소가 감소하므 로 이에 따른 상대적인 증가라고 할 수 있다라고 하였다. 즉 Hwang 등(27)의 보고에서 발효 기간 중 주로 미생물이 분비하는 protease가 원료대두의 단백질에 작용하여 수용 성 질소형태로 가수분해 되고 이어서 peptide를 거쳐 아미 노태 질소형태로 가수분해 하여 된장의 구수한 맛이 생성됨 과 동시에 발효가 계속 진행되면서 암모니아태 질소를 형성 시킨다고 하였다. 암모니아태 질소는 단백질 분해과정에서 탈아미노반응에 의해 생성되며 함량이 증가할수록 이취와 함께 불쾌감을 준다. 따라서 일반적으로 장류제품의 변패 또는 이상발효의 지표로써 이용된다(28). 이처럼 암모니아 태 질소함량이 높은 시료와 숙성 기간에 따라 암모니아태 질소함량이 증가하는 것이 좋지 않은 결과로 해석할 수도 있으나, 된장 품질에 좋은 영향을 끼치는 아미노태 질소와 비교하였을 때, 그 함량이 월등히 낮을 뿐만 아니라, 식품 공전상의 규격이 400 mg% 이하인 것을 고려할 때, 본 연구 에서 사용한 균주로 제조한 된장의 품질에 나쁜 영향을 미친다고는 볼 수 없다고 생각된다.
따라서 본 실험결과 B. subtilis KACC 15935처리구에서 암모니아태 함량 값이 높은 것으로 보아 세가지 처리구에서 는 control과 HJ18-9처리구에서 더 좋은 품질의 된장이 제조 될 것으로 사료된다.
발효기간에 따른 균주를 달리하여 제조한 팽화미된장의 아미노태 질소 함량 변화는 Table 2에 나타내었다. 환원당 은 단맛을 부여하는 물질로 관능적인 품질평가에 중요시되 는 지표 중 하나이다. 환원당의 증가는 계속적인 amylase의 작용으로 전분이 dextrin으로 dextrin이 maltose와 glucose로 의 분해과정을 거쳐 생성되어 증가한다. B. subtilis는 α 또는 β-amylase를 생성하여 된장 발효 중 대두중의 전분을 당으 로 전환 시키며, 생성된 당은 된장의 단맛에 중요한 인자로 작용한다(29). 발효기간 동안 발효기간이 증가할수록 환원 당 함량이 증가하는 경향을 보였으며, B. subtilis HJ18-9 처리구에서는 3.31±0.08%~7.10±0.15% 환원당이 가장 높 게 나타났다. Control 처리구에서는 2.68±0.04~6.25±0.09% 로 나타났으며, B. subtilis KACC15935 처리구에서는 1.48±0.01~2.48±0.02%로 나타냈다. Control에서는 28일에 가장 높은 환원당 값을 나타내었으며 KACC15935처리구 와 HJ18-9 처리구에서는 발효종료시점인 56일에서 가장 높은 환원당 값을 나타내었다. 대부분 된장에서 발효 초기 에 당 함량이 최대치를 보이고, 그 이후 당이 미생물에 의한 알콜 발효 및 유기산 발효의 기질로 사용됨에 따라 감소하 는 것으로 알려져 있다(30). 그러나 본 실험에서는 control을 제외하고 발효기간이 증가할수록 높은 환원당 값을 나타내 었다. 이는 된장 발효 시, 코지 등 전분질 원료의 분해에 의해 환원당이 생성되는데 생성속도가 미생물에 의해 이 용되는 속도보다 높으면 총 함량이 증가한다고 보고하였 다(31).
Kim 등(3)은 14종의 쌀된장 환원당 함량은 0.55% 이하의 값을 나타내었으며, Seo 등(32)은 Aspergillus oryzae와 Bacillus속으로 만든 된장에서 환원당 함량은 3.5% 미만으 로 극히 적었다. 또한 본 실험의 콩과 팽화미 함량의 비율 (3:2)의 비율과 비슷한 비율로 쌀된장을 제조한 Lee 등(23) 은 발효 후 쌀된장의 환원당의 함량이 0.43~0.50%가 되었 다고 보고하였는데, 본 실험의 결과는 이와 비교하여 상당 히 높은 환원당 값을 나타내었다. 이는 전분을 a화 하여 첨가한 팽화미를 이용하여 된장을 제조함으로써, 미생물의 효소가 전분기질을 이용하는데 용이할 수 있었을 것으로 사료된다. 본 실험에서 KACC15935와 HJ18-9처리구에서 발효 종료일 까지 환원당 함량은 유의적으로 증가하는 경향 을 나타내어 발효 다른 품질특성을 감안하여 발효기간을 더 늘릴 수 있을 것으로 사료된다.
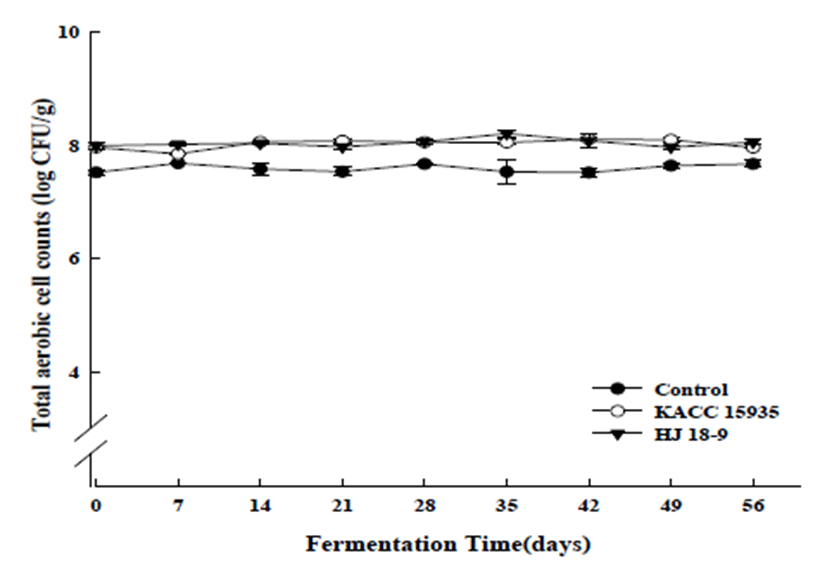
발효기간에 따른 균주를 달리하여 제조한 팽화미된장의 총균수 변화는 Fig. 3과 Fig. 4에 나타내었다. 발효 초기에 control, KACC15935, B. subtilis HJ18-9 처리구의 총균수는 7.52±0.04, 7.96±0.03, 7.99±0.05 log CFU/g로 나타났다. 발 효진행 56일 후, 총균수는 7.67±0.06, 7.96±0.01, 8.06±0.04 log CFU/g로 각각 나타났다. 전반적으로 발효기간 동안 총균수는 비슷한 값을 나타내었으며 이러한 결과는 Mok 등(18)의 연구결과와 유사하였다.
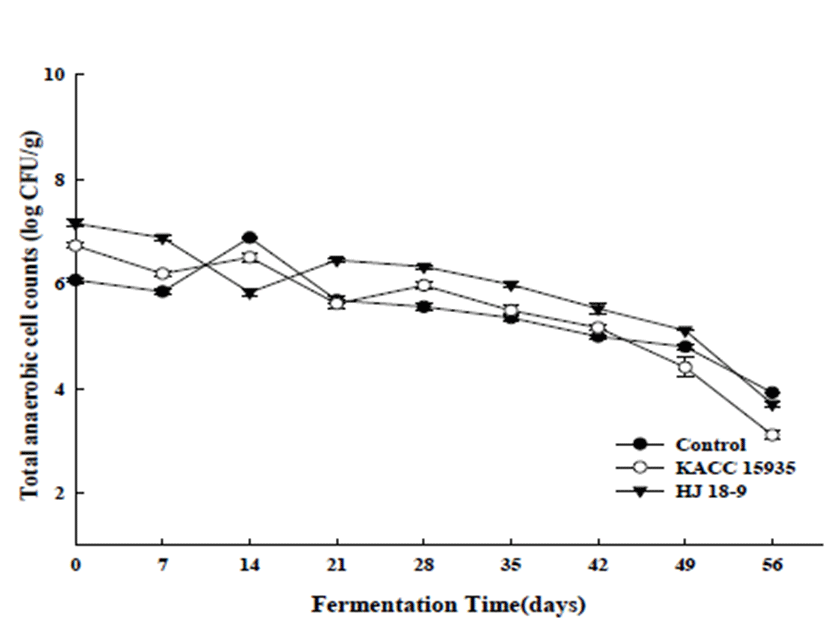
또한 콩알된장의 유산균수는 발효초기 6.07±0.03, 6.73 ±0.04, 7.15±0.07 log CFU/g로 나타났다. 발효 진행 60일 후 유산균수는 3.92±0.01, 3.11±0.09, 3.70±0.06 log CFU/g 로 나타났다. 발효기간에 따라 살펴보면, 발효기간 동안 지속적으로 감소하였다. Lee 등(22)도 연구에서도 발효 초 기균수 는 6.86~8.02 log CFU/g를 나타내었으며, 발효 42일 에는 2.00~4.69 log CFU/g으로 발효기간 동안 지속적으로 감소하였다고 하였다.
요 약
본 연구는 된장 제조 시 자연발효 시킨 control과, B. subtilis KACC15935, B. subtilis HJ18-9균주를 starter로 접종 하여 발효시킨 팽화미된장의 효소활성과 품질특성을 측정 하였다. 환원당을 유리하는데 관여하는 α-amylase 효소활 성의 경우 control과 HJ18-9를 접종한 시료에서 높게 나타났 다. 또한 된장의 단백질을 분해하여 특유의 구수한 맛 성분 을 유리하는 protease 활성의 경우도 control과 HJ18-9를 접종한 시료에서 높게 나타났으며, 이는 아미노태질소 함 량에서도 같은 경향을 나타냈다. 또한 cellulose를 분해할 수 있는 능력을 가지고 있어 유용성분의 장내 이용성 증진 을 위해 널리 사용되는 효소인 cellulase활성이 있는 HJ18-9 균주를 처리한 접종구에서 115.45±30.05 unit/g로 control과 B. subtilis KACC15935 처리구에서 53.75±15.91, 43.75± 13.51 unit/g 인 것에 비해 높게 나왔다. 이러한 결과로 본 연구를 통해 선별한 균주를 스타터로 접종하여 된장 제조에 알맞은 균주를 개발, 평가하여 가공품으로 개발의 기초연 구가 되고자 하였다.