서 론
건강에 대한 관심이 증가함에 따라 건강기능식품, 특히 미네랄 제제에 대한 소비가 증가하고 있다. 미네랄 중 칼슘 은 인체의 1.5~2.2% 정도를 차지하는 무기질로 뼈 성장, 혈액응고, 신경전달, 근육수축 등 중요한 생리적 기능을 담당하고 있다고 보고되었다(1). 따라서 칼슘의 결핍 시 골다공증을 비롯한 다양한 질병에 대한 위험도가 높아진다 고 알려졌는데(2), 식품의 섭취 시에 phytate 등의 작용에 의해 미네랄 흡수가 저해되는 경우가 있어 칼슘 보충제를 이용하는 경우가 많다(3).
현재 시판되고 있는 칼슘 보충제나 식품에 첨가되는 칼 슘 강화 물질은 대부분 무기염류 형태로써 체내 흡수율이 낮고, 식품의 성분과 반응하여 변색이나 이미, 이취 등을 발생시킨다는 단점이 있다(4). 이러한 문제점을 보완하기 위하여 펩타이드에 mineral을 chelate한 생리활성 펩타이드 에 대한 관심이 높아지고 있다. 생리활성 펩타이드는 주로 저분자 펩타이드로 체내에서 쉽게 흡수되고 생체 이용률 또한 높다고 알려져 있는데, 이를 구성하고 있는 아미노산 서열이나 조성에 의해 항산화, 항균, 항고혈압, 항비만 등 다양한 생리활성을 나타낸다(5). 최근에는 저활용 식품 단 백질의 가수분해를 통해 mineral binding peptide를 얻는 연 구가 활발히 진행되고 있다(5).
돼지 육골분은 육가공 중에 발생되는 부산물로 약 50%의 단백질을 함유하고 있으며 필수아미노산이 풍부하기 때문 에 좋은 단백질 급원이지만, 현재 대부분 버려지거나 일부 만 동물의 사료로 이용되고 있다(6). 또한 진주담치(Mytilus edulis)는 홍합과 생김새는 비슷하지만 번식력이 강하고 양 식이 쉬워 대량생산이 가능한데, 맛과 향이 좋아 국내의 중요한 수산자원 중 하나이며(7), 특히 단백질이 풍부하여 조미제품을 포함한 각종 가공품 개발에 이용이 되고 있다 (8). 따라서 본 연구에서는 기존의 칼슘 보충제의 단점을 보완하고자, 저활용되고 있는 돼지 육골분과 좋은 단백질 급원인 진주담치로부터 단백질 가수분해물을 제조하고 칼 슘 결합 물질을 분리함으로써 식품 신소재 개발과 관련한 기초자료를 확보하고자 한다.
재료 및 방법
본 실험에서 사용된 돼지 육골분은 ㈜홍창엠앤티 (Jincheon, Korea)에서 제공받아 사용하였다. 진주담치는 대전 소재의 노은농수산물시장에서 구입하여 가식부만 분 리하여 실험에 사용하였다.
돼지 육골분의 단백질은 Garcia와 Phillips(9)의 방법을 변형하여 추출하였다. 먼저, 시료와 0.1 M NaCl을 1:5(w/v) 비율로 섞고 그 혼합액을 homogenizer(IKA, Ultra-Turrax T25, Staufan, Germany)를 이용해 10,000 rpm에서 30분 동 안 균질화 시켜준 후, sonicator(GE 750, Sonics & Materials, Newtown, CT, USA)를 이용해 15분간 sonication 하였다. 단백질의 수율을 높이기 위해 60°C에서 3시간 동안 교반한 후, 10,000×g에서 1시간 원심분리 하여 얻은 상등액을 동결 건조하였다.
진주담치는 탈지과정을 거친 후 단백질을 추출하였다 (10,11). 진주담치와 isopropanol을 1:4(w/v) 비율로 섞어 균 질화 시켜준 후 37°C에서 1시간 동안 정치시켜 상등액을 제거하는 과정을 두 번 반복하고 동결 건조하였다. 탈지된 진주담치 시료에서 단백질을 추출하기 위해 deionized water를 1:6(w/v) 비율로 섞고, 1 M NaOH를 이용하여 pH 12로 맞춰준 후 1시간 동안 교반시켜주었다. 10,000×g에서 20분간 원심분리 하여 얻은 상등액을 1 M HCl을 이용하여 pH 5.2가 되도록 조절한 후 10,000×g에서 20분간 원심분리 하여 얻은 침전물을 동결건조 하였다.
돼지 육골분 및 진주담치 단백질 시료를 10 mM sodium phosphate buffer(pH 7.0)에 각각 용해하여 2% 수용액으로 제조하여 가수분해의 기질로 사용하였다. 단백질 가수분해 효소로는 Novo Nordisk Co.(Bagsvaerd, Denmark)에서 구입 한 alcalase(from Bacillus licheniformis, activity 2.4 AU/g protein)를 이용하였다. 기질 대비 효소를 500:1(w/v)로 첨가 하여 55°C, pH 7 조건에서 12시간 동안 가수분해 하면서 매 2시간마다 시료를 채취하여 가수분해도 측정 실험에 사용하였다(12).
돼지 육골분 및 진주담치 단백질 가수분해도를 측정하기 위해 trinitrobenzenesulfonic acid(TNBS) method(13) 및 O-phthaldialdehyde(OPA) method(14)를 사용하였다. TNBS method는 available amino group concentration 측정에 이용 되는 방법으로, 펩타이드 함량 측정에도 이용하였다. 시료 에 0.1 M sodium borate buffer(pH 9.2)를 첨가하고 5 mM TNBS reagent와 혼합하여 30분 동안 반응시킨 후 반응을 정지시키기 위해 18 mM Na2SO4와 2 M NaH2PO4를 넣어주 었으며, 420 nm에서 흡광도를 측정하여 펩타이드 함량을 측정하였다. 또한 Nielsen 등(14)의 OPA method에 따라, 시료 400 μL에 OPA reagent 3 mL을 첨가하여 5초 동안 섞어준 뒤 2분간 반응시켜 340 nm에서 흡광도를 측정하였 다. 가수분해도는 아래의 식에 의해 구하였고, ODtotal는 6 N HCl, 120°C에서 24시간 동안 가수분해 시킨 시료의 흡광도이다(15).
(ODsample-ODblank)/(ODtotal-ODblank)×100 %
돼지 육골분 및 진주담치 단백질 가수분해물은 Amicon 8200(Millipore Co., Billerica, MA, USA)를 이용하여 한외여 과 하였으며, Ultracel PL-3(Millipore Co.)를 통해 3 kDa이하 의 가수분해물을 얻어 동결 건조하였다. 돼지 육골분 단백 질 가수분해물은 10 mM Tris-HCl buffer(pH 8.0)에 용해하 여 1 mg/mL 용액을 제조한 후fast protein liquid chromatography (FPLC)(Amersham Pharmacia, Uppsala, Sweden)를 이용하여 anion exchange column(Mono Q, Amersham Pharmacia)를 통해 2 mL/min의 유속으로 분획하였다. 진주담치 단백질 가수분해물의 경우, Q-Sepharose(2.5 cm×10 cm, Amersham Pharmacia)를 이용하여 2 mL/min의 유속으로 분획하였으 며, loading한 시료의 농도는 2 mg/mL이었다. 두 가지 시료 모두 이동상 용매 A는 10 mM Tris-HCl buffer(pH 8.0)로 하였고, 용매 B는 10 mM Tris-HCl buffer(pH 8.0)에 0.5 M NaCl을 첨가하여 사용하였다. 분획한 시료들은 모두 214 nm에서 흡광도를 측정하였고, 분획 과정 중의 염을 제거하 기 위하여 100~500 Da size의 membrane(regenerated cellulose, Spectrum Laboratories, Inc., Rancho Domiguez, CA, USA)를 이용하여 dialysis한 후 동결건조 하여 칼슘 결합력을 측정하였다.
동결 건조된 가수분해물 분획을 10 mM phosphate buffer(pH 7.0)에 용해하여 충분히 교반시켜 준 후 2.5 mM calcium chloride를 첨가하여 1 hr 동안 실온에서 stirring 해주면서 반응시켰다. 반응이 끝난 후 3,500×g에서 20 min 동안 원심 분리하여 상등액을 얻었고, colorimetric method(16)에 의해 orthocresolphtahlein complexone reagent 를 이용하여 calcium 함량을 정량하였다.
결과 및 고찰
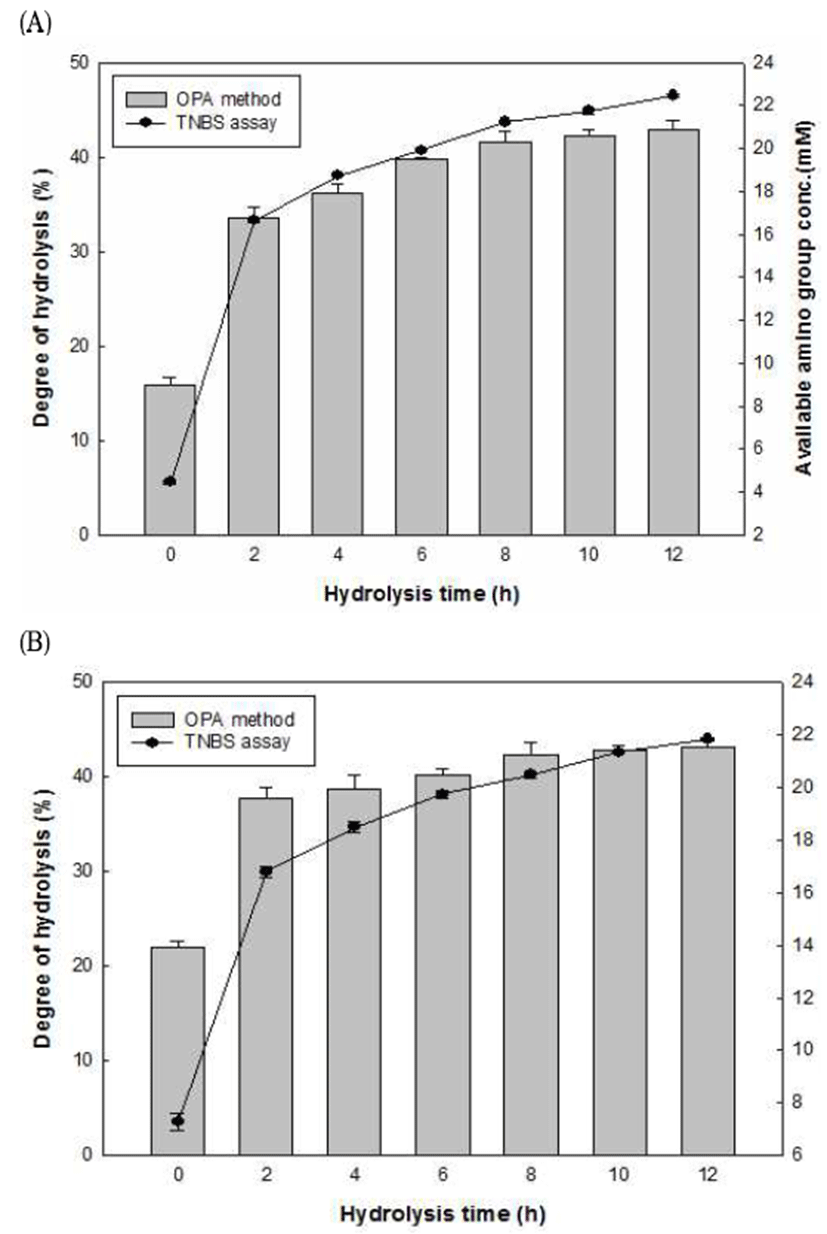
생리활성 펩타이드를 얻는 방법으로 식품 단백질의 효소 적 가수분해 방법이 많이 이용되고 있다(17). 단백질의 가수 분해가 진행됨에 따라 다양한 분자량의 펩타이드가 생성되 면서 –OH, -COOH, NH2 등의 친수기가 노출되고, 이는 칼슘을 비롯한 미네랄의 결합을 용이하게 만들어 준다고 알려져 있다(18). 따라서 본 연구에서는 돼지 육골분 단백질 을 alcalase로 가수분해하여 calcium binding peptide를 분리 하고자 하였으며, 가수분해도를 확인하기 위해 시간에 따 른 펩타이드의 양을 TNBS method로 측정한 결과를 Fig. 1에 나타내었다. 돼지 육골분의 경우, available amino group 은 가수분해가 진행됨에 따라 증가하는 경향을 보였으며, 특히 초기 2시간 동안 4.47 mM에서 16.63 mM로 가장 급격 한 증가를 나타내었고, 증가폭은 점차 감소하여 12시간 후 에는 22.44 mM의 농도를 나타내었다. 또한 진주담치 단백 질도 비슷한 경향을 보였는데, 가수분해 시간이 지남에 따 라 TNBS assay 결과 초기 7.29 mM에서 2시간 후 16.80 mM로 급격한 증가를 보였고 점차 증가폭이 감소하여 12시 간 후에는 21.83 mM로 나타났다. 또한 OPA method에 의한 가수분해도 측정값 역시 초기의 약 21%에서 43%로 증가하 여, alcalase를 이용하여 tilapia(Oreochromis niloticus) 단백 질을 가수분해 한 결과와 유사하였다(19). 또한, 가수분해 시간이 지날수록 가수분해도가 증가하지만, 일정 시간 이 후로는 크게 증가하지 않아 기존의 연구와 비슷한 경향을 나타내었다(20).
단백 분해 효소인 alcalase를 이용해 12시간 동안 가수분 해하여 얻은 돼지 육골분 및 진주담치 단백질의 가수분해물 을 Ca과 결합된 펩타이드 소재로 이용하기 위하여 3 kDa 이하로 한외여과를 하였는데, 펩타이드의 분자량과 아미노 산 조성은 칼슘 결합력과 밀접한 연관이 있다고 알려져 있다(21). Jung 등(22)은 1~5 kDa의 저분자량을 가진 펩타이 드가 체내 이용률과 흡수율이 높다고 보고한 바 있고, 기존 연구에서 얻어진 Ca binding peptide의 분자량 역시 1.4 kDa(23), 1.2 kDa(24), 1.6 kDa(25) 등으로 나타났다. 이러한 연구보고들을 참고로 하여 본 연구에서는 가수분해물의 분자량을 3 kDa 이하로 설정하였다. 펩타이드가 칼슘과 같은 2가 양이온과 효과적으로 결합하기 위해서는 음전하 를 갖는 곁사슬을 가지고 있어야 하므로(26), 한외여과 후 동결 건조된 돼지 육골분과 진주담치 단백질 가수분해물을 anion exchange chromatography에 의해 분리하였다. 돼지 육골분 가수분해물을 Mono Q column에 의해 분획한 결과, 2개의 major peak로 분리되었는데(Fig. 2A), MBM-F1과 MBM-F2의 peptide 양에 대한 Ca 결합된 정도를 측정한 결과, 각각 0.184와 0.840으로 MBM-F2의 분획이 칼슘에 대한 결합력이 더욱 높은 것으로 나타났다(Table 1).
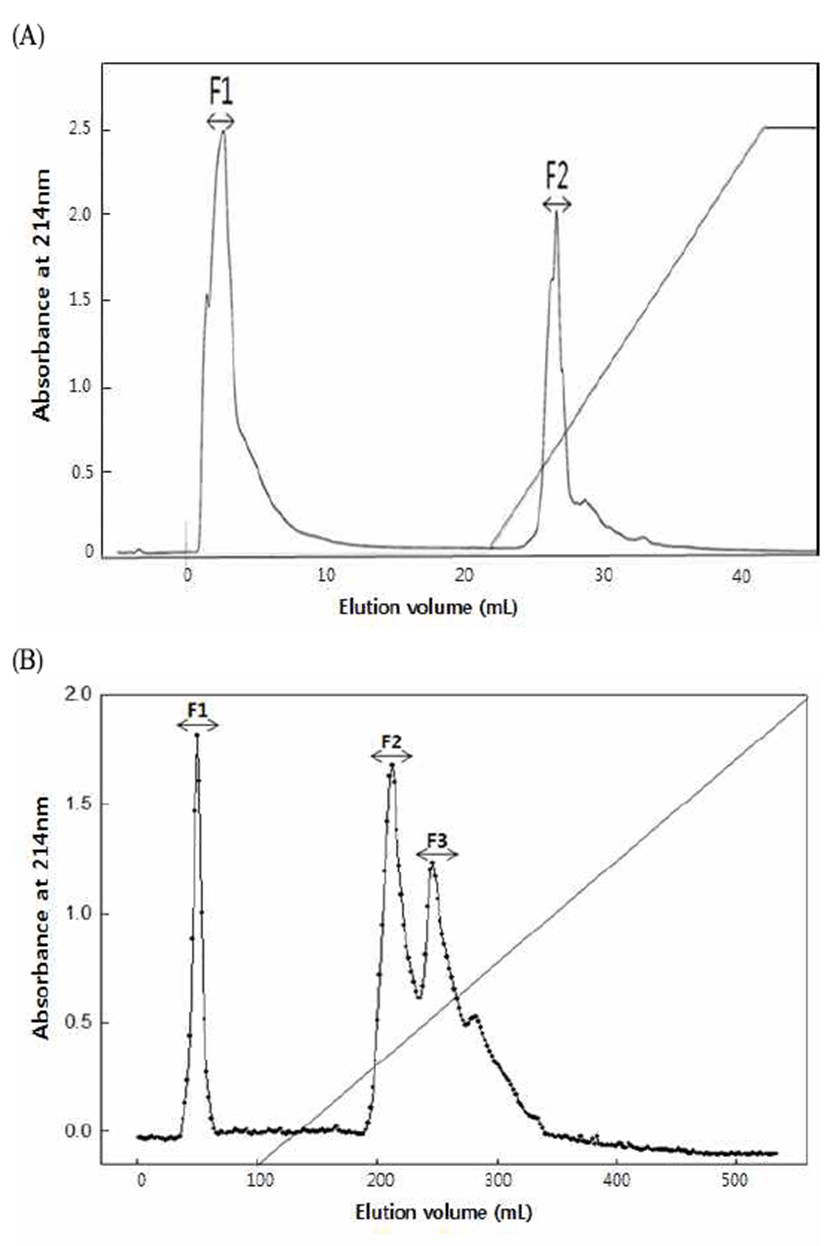
진주담치 단백질 가수분해물은 Q-Sepharose ion exchange chromatography에 의해 분리하였으며, 그 결과 Mussel-F1, F2, F3의 3가지 major peak를 얻을 수 있었다(Fig. 2B). 각 분획에서의 염을 제거하기 위해 membrane을 이용하여 dialysis 과정을 거친 후, 3가지 분획에 대한 Ca 결합력 측정 결과, 각각 0.110. 0.097, 0.875로 나타났고, Mussel-F3에 대한 Ca 결합력이 가장 높은 것을 알 수 있었다(Table 1). 각 분획의 칼슘 결합력은 가수분해물의 분자량과 펩타이드 의 아미노산 구성에 따라 달라지며, 특히 미네랄과 같은 금속이온과 결합 할 수 있는 친수기 등이 중요한 요소가 된다고 보고된 바 있다(18). 따라서 본 연구에서 칼슘 결합 력이 높게 나타난 MBM-F2와 Mussel-F3의 경우, 타 분획에 비해 칼슘과 결합하는데 있어 긍정적인 영향을 미치는 아미 노산이 포함되어 있다고 판단된다.
식품 단백질의 효소적 가수분해를 통해 분리한 Ca-binding peptide로는 명태 등뼈로부터 얻은 Val-Leu-Ser-Gly-Gly- Thr-Thr-Met-Ala-Met-Tyr-Thr-Leu-Val(23), 클로렐라의 Asn- Ser-Gly-Cys(27), 돼지혈장단백질의 Val-Ser-Gly-Val- Glu- Asp-Val-Asn(23), 새우 가공 부산물의 Thr-Cys-His(28) 등이 있다. Jeon 등(27)은 칼슘 결합에 Ser, Gly, Cys 등이 중요한 역할을 한다고 보고한 바 있고, Choi 등(29)은 Glu와 Asp가 미네랄의 결합에 관여한다고 하였다. 또한 MBM과 mussel meat의 효소적 가수분해 결과 얻어지는 가수분해물의 경우 상기 아미노산들이 풍부하게 함유되어 있다고 판단된다 (30,31). 따라서 본 연구 결과, Ca 결합력이 높게 나타난 펩타이드 분획 속에는 Ca binding에 관여하는 Ser, Gly, Cys, Glu, Asp 등이 존재할 것 이라고 생각되며, 이에 대해서는 향후 추가적인 연구가 필요할 것으로 사료된다. 또한 기존 무기염 형태의 칼슘 보충제보다 더욱 안정적이고 체내 흡수 율이 높은 생리활성 펩타이드에 대한 수요가 높아짐에 따 라, 본 연구 결과 얻어진 MBM-F2와 Mussel-F3는 칼슘 결합 소재로의 활용이 가능하다고 판단된다.
요 약
저활용 단백질로부터 칼슘 결합물질을 분리하기 위해 돼지 육골분과 진주담치 단백질을 단백질 분해 효소인 alcalase를 이용하여 가수분해물을 제조하였고, 체내 흡수 가 용이한 3 kDa 이하로 한외여과 하였다. 돼지 육골분 가수분해물은 Mono Q 컬럼을 통해 분리하였고, 진주담치 가수분해물의 경우 Q-Sepharose로 분리 하여 각각 2개, 3개 의 peptide fraction을 얻어 각 fraction의 칼슘 결합력을 측정 하였다. 그 결과 MBM F2와 Mussel F3에서 가장 높은 칼슘 결합력을 나타내었고, 따라서 본 연구 결과로 얻어진 가수 분해물들은 칼슘 보충 소재로 활용될 수 있다고 판단된다.