서 론
인체는 에너지 대사와 같은 정상적인 생체대사 반응 이 외에도 약물, 알코올, 흡연, 대기오염 등 여러 가지 요인에 의해 산화적 스트레스(oxidative stress)를 받는다. 산화적 스트레스 원인이 되는 free radicals는 항산화 방어 시스템의 활성과 균형을 이루고 있는 생체 내 정상적인 세포대사 과정에서는 조직이나 세포에 손상을 주지 않는다(1). 그러 나 혈당조절의 실패로 고혈당이 지속되는 당뇨의 경우 체내 reactice oxygen radicals, (O2-)의 증가로 산화적 스트레스가 발생하게 된다. 이렇게 형성된 활성 산소종은 전사유전자 단백질을 활성화 시키며, 활성화 된 전사유전자 단백질은 다시 reactive oxygen species(ROS) 생성 및 산화적 스트레스 를 가증시키게 된다(2).
당뇨에서 활성 산소종은 세포막의 지질과산화 이외에 포도당의 자가산화 반응을 일으키며, 이때 생성된 최종 당 산화물(advanced glycation end products, AGEs)이 조직에 축적된다. 축적된 최종 당산화물은 세포에 있는 AGEs 수용 체와 결합하여 세포외 기질과 지단백을 변형시켜 죽상동맥 경화증을 일으킬 뿐만 아니라 반응성이 강한 ROS의 생성을 증가시킴으로써 전사유전자 단백질의 활성화와 산화적 스 트레스 지표들의 발현을 촉진 시킨다. 그 결과 전사유전자 단백질은 당뇨병에서 유의적으로 그 수준이 증가하는 것으 로 나타났다(3). 선행 연구에 의하면 당뇨병 쥐 모델(4)과 당뇨 환자(5)에게서 산화적 스트레스 지표인 지질과산화물 의 증가와 효소적(superoxide dismutase, catalase, glutathione peroxidase, glutathione reductase 등) 및 비효소적 물질인 항산화 영양소의 유의적인 감소가 당뇨병 및 산화적 스트레 스로 인한 합병증의 발병을 예방 및 지연시키는데 중요한 요인으로 작용하였다.
항산화 식품은 대부분 과일과 채소, 대두 및 일부 곡류 등 식물성 식품이며, 주성분은 비타민, 무기질, 섬유질 이외 에 항산화 성분인 생리활성 물질로 알려져 있다. 대두 속에 함유되어 있는 생리활성 물질로 polyphenol과 isoflavone 함량은 항산화력과 정관계에 있으며(6), 블랙푸드에 함유 되어 있는 생리활성 물질인 anthocyanin은 우수한 항산화력 으로 생리적으로 산화-환원 반응의 항상성을 조절하는 항 산화제로 이용될 수 있는 물질로 질병의 예방과 치료 목적 으로 이에 대한 관심이 높아지고 있다(7).
특히 약콩의 종피에 다량 함유되어 있는 anthocyanin은 항암, 항산화, 항바이러스, 면역증강 등의 다양한 생리활성 효과가 있는 것으로 알려져 있으며(8,9), 약콩 추출물은 대 두에 비해 항산화 및 비만 억제 효과가 약 2배 높은 것으로 보고되고 있다(10). 또한 대두보다 많은 양의 isoflavone을 함유하고 있으며 이중 genistein은 유해한 활성 산소종의 제거를 통한 항산화력이 우수하며, 면역시스템에 대한 공 격물질인 heat shock protein(HSP)이나 glucosylated protein (GRPs)과 같은 스트레스 단백질 생성을 저해함으로써 유방 암, 직장암, 전립선암 등에 대한 항암력을 보이고 있다(11). 또한 약콩은 항산화 활성이 뛰어난 다량의 flavonoids인 diadzein과 genistein 이외에 섬유소를 함유하고 있어서 당뇨 병 환자에게 권장할 만한 식품으로 알려져 있다(12).
따라서 위의 연구배경을 토대로 본 연구에서는 polyphenol, flavonoid, isoflavone, anthocyanin과 같은 생리활성 물질이 풍부한 대두, 약콩 및 블랙푸드로 흑미, 흑임자 그리고 다시 마를 첨가하여 만든 청국장 분말이 항산화능 조절에 미치는 영향을 평가하여 당뇨병의 발병 및 합병증 예방을 위한 산화적 스트레스 조절에 대두 및 약콩과 블랙푸드가 미치는 영향에 대하여 규명하고자 한다.
재료 및 방법
본 실험에 사용한 대두청국장 분말, 약콩청국장 분말 그 리고 흑미, 흑임자, 다시마 같은 블랙푸드를 첨가한 약콩청 국장 분말은 전라북도 남원시에 위치 해 있는 (주)지리산 두류실에서 제조하여 시판하고 있는 제품을 사용하였다. 시약으로 당뇨 유도제인 streptozotocin(STZ), 분석용 시약 인 reduced glutathione(GSH), reduced nicotinamide adenine dinucleotide phosphate tetrasodium salt(NADPH), glucose- 6-phosphate terasodium salt, thiobarbituric acid(TBA), SDS(sodium dodecyl sulfate), 1,1,3,3-tetraethoxypropane, nicotinamide adenine dinucleotide(NAD), retinol, retinol acetate, tocopherol, tocopherol acetate 등은 Sigma 사 제품 (Sigma Chemical Co, USA), HPLC 용 methanol, ethanol, diethyl ether, chloroform 그리고 acetonitrile 용액은 Merck 사(Parmstadt, Germany) 제품을 사용하였다. SOD (superoxide dismutase) 활성 그리고 총 항산화력(TAC, total antioxidant capacity) 측정용 kit는 Biovision 사(U.S.A) 제품을 사용하였 다. 그 외 일반 시약은 특급 또는 일급품으로 사용하였다.
본 연구의 실험동물은 200~250 g 정도의 생후 8주령이 된 Sprague Dawley(SD)종 수컷 흰쥐(Hyochang Science, Daegu, Korea)를 본 실험에 들어가기 전 2주 동안 일반배합 고형사료(Jeilfeed Co., Korea)로 환경에 적응시킨 다음 체중 에 따라 각 처리구당 10마리씩 5군으로 완전임의 배치하여 사육하였다. 실험동물 사육실 환경온도는 22±1°C, 상대습 도는 65±5%, 명암은 12시간 주기로 조절하였다. 물과 식이 는 전 실험기간 동안 adlibitum으로 급여하였다.
본 실험에 사용한 실험 식이는 AIN-93 조성(13)에 근거하 여 정제된 원료로 배합하였다. 식이재료 및 제조된 식이는 산패방지를 위하여 4°C 냉장 보관하면서 사용 및 급여하였 다. 실험군에 대한 구체적인 식이구성은 Table 1에서 처럼 정상식이군(C), 당뇨유도 정상식이군(DC), 당뇨유도 대두 청국장 분말식이군(DS), 당뇨유도 약콩청국장 분말식이군 (DY), 그리고 당뇨유도 블랙푸드를 첨가시킨 약콩청국장 분말식이군(DYB)로 나누어 7주간 실험 식이를 공급하였 다. 성장상태는 매주 1회 12시간 동안 식이공급을 중단 시킨 다음 체중을 측정하였고, 성장효율은 실험기간 중 체중증 가량을 식이 섭취량으로 나누어 계산하였다.
당뇨 유도는 0.1 M citrate buffer(pH 4.5) 용액에 용해시켜 서 만든 STZ를 체중 당 45 mg/kg으로 실험 동물의 복강 내 1회 주사하였다. 당뇨 유발 확인은 STZ 주사 72시간 후 꼬리정맥에서 채혈하여 혈당량이 300 mg/dL 이상이면 당뇨병이 유발된 것으로 간주하였다. 정상식이군인 C 군은 STZ 대신에 0.9 % saline를 복강 내에 주사하였다.
실험동물의 시료채취는 12시간 절식시킨 후 희생시키기 직전에 체중을 측정하고, CO2 가스로 가볍게 마취시켜 개 복한 즉시 복부 대동맥에서 혈액을 채취하였다. 혈액은 3,000 rpm에서 냉장상태에서 원심분리 하여 혈청을 분리한 후 일정량씩 나누어 -70°C에서 냉동·보관하였다. 개복하여 얻은 간은 1.15% KCl 완충용액으로 perfusion 시켜 적출하 여 동일한 buffer로 여러 번 세척하고 여과지로 물기를 제거 한 다음 무게를 측정 한 후 일정 분량씩 알루미늄 호일로 포장하여 액체질소로 급속냉동시켜 -70°C에서 냉동·보관 하였다. 이 중 일부를 취해서 조직균질기(Teflon Plotte- Elvehiem Homogenizer, USA)를 사용하여 냉장상태에서 1.15% KCl 완충용액 10%(w/v) 마쇄 균질액을 만들었다. 비장은 동일한 buffer로 여러 번 세척하고 여과지로 물기를 제거한 다음 무게를 측정 한 후 알루미늄 호일로 포장하여 액체질소로 급속 냉동시켜 -70°C에서 냉동·보관하였다.
혈청과 간 조직 내의 지질과산화물 함량은 TBA와 반응 하여 생성된 TBARS(thiobarbituric acid reactive substance) 양으로 정량하였다(14). 혈청과 간 조직 균질액을 각각 0.1 mL 취해서 8.1% sodium dodecylsulfate(SDS) 용액 0.2 mL, 20% acetic acid 완충용액(pH 3.5) 1.5 mL, 0.8% TBA 용액 1.5 mL 그리고 증류수 0.6 mL를 가한 다음 95°C항온수조에 서 60분 동안 반응시켰다. 그 다음 얼음 속에서 재빨리 냉각 시키고 증류수 1.0 mL와 n-butanol과 pyridine(15:1, v/v)의 혼합액 5.0 mL를 첨가하여 잘 혼합하였다. 이 혼합액을 4,000 rpm에서 10분 동안 원심 분리하여 TBA 반응물질이 존재하는 n-butanol 층을 취하여 532 nm에서 흡광도를 측정 하였다. 이때 표준용액으로는 1,1,3,3-tetraethoxypropane을 사용해 표준 검량선을 구하여 그 양을 산출하였다.
혈청과 간 조직 내 catalase 활성은 혈청 및 50 mM phosphate 완충용액(pH 7.0)으로 희석시킨 간균질 용액을 각각 1.0 mL를 취해 30 mM의 H2O2용액 1.0 mL 첨가하여 240 nm에서 30초 간격으로 150초 동안 H2O2 분해에 따른 흡광도의 감소를 측정하였다(15). 효소의 활성은 1분 동안 분해된 1 μM의 H2O2를 1 unit로 정의하였고 단백질 1 mg을 기준으로 하여 표기하였다. SOD 활성은 SOD activity assay kit를 사용하여 microplate reader(Thermo Scientific Co., USA)를 이용하여 450 mn에서 흡광도를 측정하여 그 활성 을 구하였다.
혈청 내 retinol 함량은 Bieri 등(16)의 방법으로 정량하였 다. 혈청 200 μL에 internal standard로 일정량의 retinyl acetate에 에탄올을 가하여 잘 섞은 후 HPLC 용 hexane으로 추출 한 다음 몇 차례 반복된 원심분리를 실시하여 얻은 상층액을 취하여 최종 시료액을 얻었다. 간 조직 내 retinol 함량은 Furr 등(17) 의 방법으로 정량하였다. 간 조직 일정량 에 수분을 제거할 목적으로 2~3배의 anhydrous sodium sulfate(w/w)를 가하여 잘 마쇄한 다음 HPLC 용 dichloromethane을 가한 다음 몇 차례의 원심분리를 실시하 여 얻은 최종 시료액을 얻었다. 그런 다음 이들 시료액을 teflon level의 syringe를 사용하여 pore size 0.45 μm의 membrane filter(Hamilton, USA)로 여과시킨 다음 질소 가스 로농축시켰다. 농축된시료액에HPLC 용diethylethermethanol 로 용해시킨 최종 시료액 50 μl를 HPLC(SPD-20A, Shimadzu, Japan)에 주입시켜 분석하였다. HPLC system은 μ Bondapak C18(30 cm×3.9 mm, 10 μm, Waters) column과 Waters 991 photodiode array detector로 구성하였고, mobil phase로는 methanol:H20(95:5, v/v) 혼합액을 이용하였다. Flow rate는 1.5 mL/min 이었으며, 280 nm에 맞추어 분석하였다. 혈청과 간 조직 내 retinol과 α-tocopherol 함량은 동시에 추출 및 정량하였으며, internal standard로 retinly acetate와 α -tocopheryl acetate를 사용하였다.
혈청과 간 조직 내 총 glutathione(GSH+GSSG) 함량은 Theodorus와 Helmut(18)의 방법에 따라 glutathione reductase- DTNB recirculation assay 법을 이용하였다. 일정량의 간 조직을 1 M HClO4 용액으로 균질화시킨 다음 10,000 rpm에 서 2분간 원심분리하여 얻은 상층액을 4 M K2CO3 용액으로 pH 7.0 으로 맞추었다. 그런 다음 3,000 rpm에서 10분간 원심분리한 상층액을 시료로 사용하였다. 일정량의 시료에 NADPH, DTNB 그리고 glutathione reductase(GR)를 가하여 412 nm에서 흡광도 변화를 5분 동안 측정하였다. 총 glutathione의 표준용액으로는 산화형 glutathione(GSSG)을 이용하여 표준검량선을 구하여 그 양을 산출하였다. GSSG 함량은 NADPH와 GR에 의해서 GSSG가 환원형 glutathione (GSH)으로 변화됨에 따라서 감소되는 NADPH를 340 nm에 서 표준 검량선을 구한 후 nmol로 계산하였으며 GSH 함량 은 총 glutathione과 GSSG의 차로써 구한 다음 GSH/GSSG 를 구하였다.
혈청과 간 조직 내의 TAC는 colormetric assay kit을 사용 하여 측정하였다. 모든 well에 sample 10 μL와 H20 100 μL를 첨가한 후 Cu2+ working solution 100 μL 첨가하여 1.5시간 정도 상온에 방치한 후 micro plate reader를 이용하여 570 nm에서 흡광도를 측정하여 주어진 공식에 의거하여 그 함 량을 구하였다.
Anthocyanin 함량은 Park 등(19)의 방법에 의거하여 95% 에탄올과 1.5 N HCl 혼합용액 (85:15, v/v)으로 추출 한 후 Fuleki와 Francis(20)의 방법을 변형하여 정량하였다. 간 과 비장 조직 1 g 씩 각각 취하여 시료병에 넣은 다음 일정량 의 추출용매를 첨가하였다. 그 후 4 °C의 냉장 암 상태에서 하루 동안 분해 과정을 거친 후 시료를 여과(whatman No. 4)하여 535 nm의 파장에서 흡광도를 측정한 후 일정공식 (19)에 의거하여 anthocyanin 함량으로 환산하였다.
결과 및 고찰
실험 동물의 혈청과 간 조직내 TBARS 함량은 Table 2와 같다. 혈청 내 TBARS 함량은 C군의 2.13±0.87 nmol/dL에 비해서 DC군은 6.07±1.35 nmol/dL로 당뇨쥐의 TBARS 함 량이 p<0.05 수준에서 유의적으로 높았다. 그러나 당뇨유도 로 증가된 TBARS 함량은 DS군에서 3.84±1.77 nmol/dL 수준까지 낮출수 있었다. 간 조직 내 mg protein 당 TBARS 함량은 C군이 4.36±1.76 nmol 이였으나, DC군은 7.05±2.09 nmol로 당뇨유도로 간 조직내 TBARS 함량은 p<0.05 수준 에서 증가되었다. 그러나 세종류의 청국장을 공급시킨 DS, DY 그리고 DYB군은 mg protein 당 TBARS 함량은 각각 4.87±1.41, 5.91±1.67, 그리고 4.88±1.66 nmol로 당뇨유도로 증가된 TBARS 함량은 대두 및 블랙푸드를 첨가한 청국장 의 공급으로 p<0.05 수준에서 유의적으로 낮출수 있었다.
| Groups1) | Serum (nmol/dL) | Liver (nmol/mg protein) |
|---|---|---|
| C | 2.13±0.87c2) | 4.36±1.76b |
| DC | 6.07±1.35a | 7.05±2.09a |
| DS | 3.84±1.77b | 4.87±1.41b |
| DY | 4.98±1.74ab | 5.91±1.67ab |
| DYB | 5.21±2.33ab | 4.88±1.66b |
Streptozotocin 유도에 의한 당뇨 쥐의 혈장과 간 조직내 지질과산화물 함량의 증가와 함께 당뇨환자의 혈장에서 항산화 영양소 함량의 감소와 함께 지질과산화물 함량이 증가된다고 밝힌 Santini 등(5)의 보고는 자유래디칼에 의한 지질과산화 반응이 당뇨병 유발이나 합병증 발생에 중요한 인자로 작용할 수 있다는 것을 암시한다. 구체적인 기전은 증가된 지질과산화물에 의한 혈관 내 LDL-콜레스테롤 산 화로 당뇨병 혈관 합병증이 유발하는 것으로 나타났다(21). 위의 다른 연구자(5,18)의 연구결과와 마찬가지로 본 실험 결과에서도 STZ 유도로 당뇨쥐의 혈청과 간 조직내 지질과 산화물 함량이 증가되었으며, 당뇨로 인해 증가된 지질과 산화물 함량은 혈청에서는 대두청국장, 간 조직에서는 대 두 및 블랙푸드를 첨가한 청국장의 공급으로 낮아졌다.
혈청과 간 조직내 1분당 mg protein 당 catalase 활성은 Fig. 1과 같다. 혈청 내 catalase 활성은 C군의 9.49±1.72에 비해서 DC군은 5.62±1.05로 유의적인 차이는 없었다. 그러 나 세종류의 청국장을 공급시킨 DS, DY, 및 DYB군의 catalase 활성은 각각 13.9±3.79, 7.46±5.27 및 12.1±2.85로 p<0.05 수준에서 유의적으로 정상수준까지 활성이 유도되 었다. 간 조직내에서도 catalase 활성은 C군과 DC군 사이에 유의적인 차이는 없었다. 그러나 당뇨유도와 함께 세 종류 의 청국장을 공급시킨 DS, DY, DYB군의 활성은 각각 208.1±18.9, 111.9±25.0 그리고 218.0±44.9로 DY군에서 p<0.05 수준에서 가장 낮은 활성을 보였다.
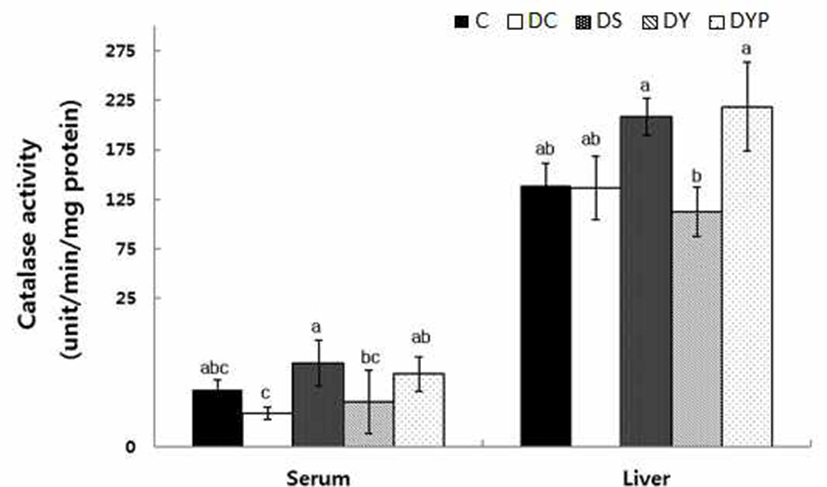
Catalse는 간과 적혈구의 peroxisome에 주로 존재하며 공격성이 강한 H2O2를 H2O로 전환시키는 기능을 가지고 있다(22). 그러나 당뇨 환자는 SOD와 catalase 효소 활성의 저하로 자유래디칼의 분해가 제대로 이루어지지 않을 경우 세포막의 변화 및 DNA 손상으로 인해 당뇨 합병증인 심혈 관계 질환을 유발하는 것으로 보고되었다(23). 본 실험에서 혈청 내 catalase 활성은 정상쥐와 당뇨쥐에서 유의적인 차 이는 없었으나, 당뇨쥐에게 이 효소 활성은 대두나 블랙푸 드를 첨가한 약콩청국장의 공급으로 유도되었다.
Superoxide dismutase 활성은 Fig. 2와 같다. 혈청 내 SOD 활성은 C군 115.3 ±7.51%에 비해서 DC군은 101.9±4.9%로 당뇨 유도에 의해 p<0.05 수준에서 11.6%의 유의적인 감소 를 보였다. 그러나 DC군에 비해서 DY군의 SOD 활성은 120.9±8.29로 19.0% 정도의 더 높은 활성을 보였다. 간 조직 내에서 SOD 활성은 모든 군 간에 비슷한 조사되었다. 고혈 당에서는 항산화 효소가 비효소적으로 당화된 결과 감소된 효소 활성으로 인하여 구조와 기능이 영향을 받게 되며, 50% 이상 당화 될 경우 항산화 효소 활성이 감소되는 것으 로 나타났다(24). 특히 산화-환원 반응을 조절하여 활성 산 소종을 해독시키는 SOD 등과 같은 효소의 활성은 췌장의 β-세포에서 감소현상이 두드러지게 나타나고, 그 결과 β- 세포에서 급격히 증가된 활성 산소종은 쉽게 세포 손상을 유발하는 것으로 보여진다(25). 본 실험에서도 당뇨유도로 혈청 내에서 SOD 활성이 낮아졌으나 약콩청국장의 공급으 로 항산화 효소 활성력을 정상수준으로 증가시킬수 있었다.
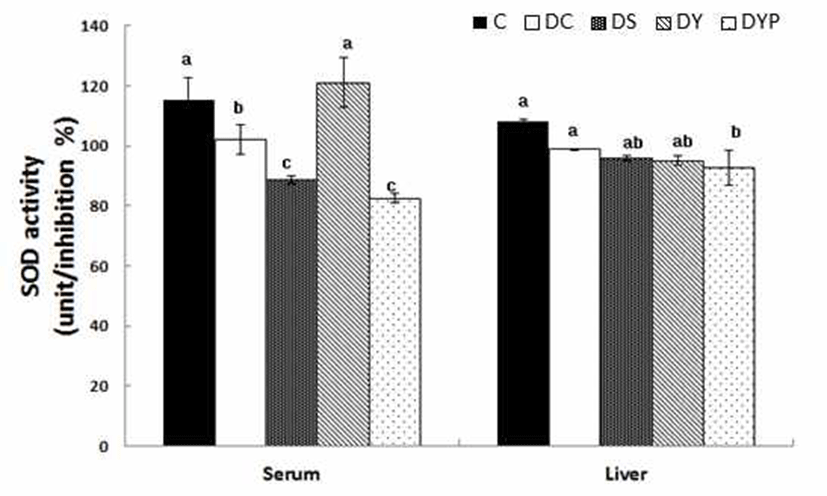
항산화 영양소로 혈청과 간 조직 내 retinol과 α-tocopherol 함량은 Table 3과 같다. 혈청 dL당 retinol 함량은 C군 2.50±1.13 μg에 비해 DC군은 0.64±0.06 μg으로 p<0.05 수준 에서 유의적으로 낮았다. 그러나 세종류의 청국장을 공급 시킨 DS, DY, DYB 군 중에서 DY군의 retinol 함량은 4.80±1.04 μg으로 DC군에 비해서 7.5배나 높은 함량을 보였 다. 당뇨유도로 낮아진 retinol 함량은 DS군과 DYB군이 각각 27.8±5.65 μg/dL와 37.9±3.70 μg/dL으로 p<0.05 수준 에서 그 함량의 증가를 보였다. 간 조직 내 retinol 함량은 C군과 DC군 간에 유의적인 차이는 없었다. 따라서 당뇨유 도로 낮아진 retinol 함량은 혈청에서는 약콩청국장, 간 조직 내에서는 대두 및 블랙푸드가 첨가돤 약콩청국장의 공급으 로 증가되는 것으로 나타났다.
혈청과 간 조직 내 α-tocopherol 함량은 Table 3에서 제시 한 바와 같이 C군과 DC군 간에 혈청 내 α-tocopherol 함량은 유의적인 차이는 없었으며, 세종류의 청국장 공급도 혈청 내 α-tocopherol 함량에 긍정적인 영향을 미치지는 못했다. 그러나 간 조직내에서는 C군 18.1±6.40 μg/g에 비해서 4.45±0.59 μg/g으로 낮은 함량을 보인 DC군의 α-tocopherol 함량은 세종류의 청국장의 공급으로 p<0.05 수준에서 유의 적으로 높은 증가를 보였다.
당뇨로 인한 고혈당은 정상적인 항산화 방어 능력에 손 상을 일으키는데, Sundaram 등(26)의 연구 결과를 보면 당 뇨병 환자의 전혈에서 비타민 A, E, C 등의 항산화 영양소 함량이 감소하였다. 제 2형 당뇨병 환자 체내의 항산화 영양 소는 고혈당으로 인해 증가된 활성 산소, 포도당의 자동산 화 및 지질과산화 반응 등에 의하여 유발된 산화 스트레스 에 대한 방어물질로 당뇨병의 합병증 발생이나 심혈관계 질환의 이환률을 감소시키는 것으로 알려졌다(27). 그러나 본 연구에서는 당뇨로 인하여 감소된 혈청과 간 조직내 항산화 영양소인 retinol과 α-tocopherol 함량은 세종류의 청국장 공급으로 부분적으로 증가되었으며, 이는 당뇨 환 자에게 청국장 및 블랙푸드를 꾸준히 섭취시켰을 때 체내 비타민 A와 E 조절을 통한 합병증을 예방할 수 있는 가능성 을 보여주고 있다.
항산화 영양소로 간 조직 내 총 glutathione 함량과 GSH/GSSG를 분석한 결과는 Table 4와 같다. 간 조직 내 총 glutathione 함량은 모든 군에서 유의적인 차이가 없었으 며, GSH/GSSG는 C군과 DC군 사이에는 유의적인 차이는 없었다. 그러나 당뇨 유도군인 DC, DS, DY, 그리고 DYB군 의 GSH/GSSG는 각각 2.07±0.23, 2.78±0.52, 5.17±0.91, 그 리고 3.10±0.53으로 p<0.05 수준에서 DY군의 GSH 함량이 가장 높은 것으로 나타났다.
| Groups1) |
Total glutathione |
GSH/GSSH2) |
|---|---|---|
| (nmol/mg protein) | ||
| C | 2.49±0.243)NS4) | 3.27±0.58b |
| DC | 2.94±0.88 | 2.07±0.23b |
| DS | 2.70±0.29 | 2.78±0.52b |
| DY | 2.14±0.28 | 5.17±0.91a |
| DYB | 4.08±0.82 | 3.10±0.53b |
C, Normal diet; DC, Supplementation of normal diet in STZ-induced diabetic rat; DS, Supplementation of 50.0% SC in STZ-induced diabetic rat; DY, Supplementation of 44.5% YC in STZ-induced diabetic rat; DYB, Supplementation of 50% YCB in STZ-induced diabetic rat.
외부의 산화적 손상에 대한 세포 방어에 중요한 역할을 하는 tripeptide 형태의 GSH는 세포 내 지질과산화물이나 각종 이물질의 제거와 아미노산 수송 등 다양한 세포기능을 수행하며 독립적인 이물질 제거와 아미노산 수송 등 다양한 세포기능을 수행하며 독립적인 2개의 대사 저장창고를 가 지고 있다(28). 그러나 당뇨 등에 의한 산화적 스트레스가 수반이 될 경우 GSH의 고갈을 유도하며, GSH의 고갈은 세포 전체 생존 능력을 감소시키므로 GSH는 산화적 손상 에 중요한 방어체계이다(29). Videla 등(30)과 그리고 Burk 등(31)은 생체가 노화와 더불어 외부의 산화적 스트레스가 존재 할 경우 비타민 E와 C, 그리고 cysteine이나 glutathione 등의 sulfhydryl(SH)기가 감소되었다고 밝혔다. 이는 –SH 기를 함유하고 있는 glutathione과 cysteine이 생체 내에서 지질과산화 반응에 관여하고 있다는 것을 시사 해 주고 있다. 본 연구 결과에서는 정상쥐와 당뇨쥐 사이에 총 glutathione과 GSH/GSSG에 있어서 유의적인 차이는 없었 다. 그러나 당뇨 유도군 중 약콩청국장을 공급시켰을 때 GSH/GSSG가 높아진 것으로 보아 산화적 손상을 받았을 때 약콩청국장이 glutathione의 공급원으로 작용하여 산화 적 스트레스에 도움을 줄것으로 생각된다.
혈청과 간 조직 내 TAC 수준은 Fig. 3과 같다. 혈청 내 TAC는 C군과 DC군 간에 유의적인 차이는 없었다. 그러나 당뇨 유도군인 DC, DS, DY, 그리고 DYB군의 TAC 수준은 각각 2.36±0.02, 2.42±0.03, 2.79±0.02, 그리고 3.15±0.07으 로 p<0.05 수준에서 약콩청국장 및 블랙푸드가 첨가된 약콩 청국장을 공급으로 당뇨 유도로 인하여 낮아진 TAC수준을 향상시킬수 있었다. 간 조직 내의 TAC 수준은 Fig. 3과 같이 모든 군 간에 유의적인 차이는 없었다. 항산화 효소 활성이나 전자전달계의 환원력을 전체적으로 반영하는 혈 청 내 TAC 수준은 정상군에 비해서 제2형 당뇨병 환자의 혈장에서 감소되었다고 보고되었다(32). 그 반면에 Kim과 Kim(33)의 보고에서 당뇨 노인의 TAC 수준이 정상군에 비해서 유의적으로 높았음을 보고하였다. 그러나 본 실험 에서는 혈청과 간 조직내 TAC 수준은 정상쥐와 당뇨쥐 간에 유의적인 차이는 없었으나, 당뇨쥐의 혈청 내 TAC는 블랙푸드가 첨가된 약콩청국장의 공급으로 높아진 것으로 나타났다.
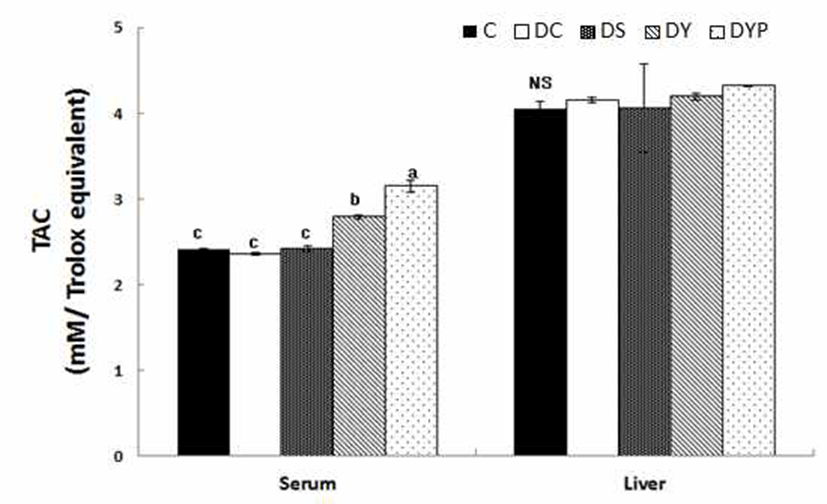
항산화 생리활성 물질로 간과 비장 조직의 anthocyanin 함량은 Fig. 4와 같다. 간 조직 1 g 내의 anthocyanin 함량은 C군의 13.4±5.34 mg에 비해 DC군은 2.81±0.24 mg으로 당 뇨로 인하여 p<0.05 수준에서 유의적인 감소를 보였다. 그 러나 이때 세종류의 청국장을 각각 공급시켰을 때 anthocyanin 함량은 DS군은 5.11±0.38 mg, DY군은 5.41± 0.14 mg, 그리고 DYB 군은 6.70±0.24 mg으로 DC군에 비해 서 세종류의 청국장을 공급시킨 군들에서 p<0.05 수준에서 유의적인 증가를 보였으나 C군 수준에는 미치지 못하였다. 비장조직 1 g 내의 anthocyanin 함량은 C군의 27.1±5.13 mg, 그리고 DC군은 17.9±2.11 mg으로 두군 간에 유의적인 차이는 없었다. 그러나 이때 세종류의 청국장을 각각 공급 시켰을 때 DS군은 5.05±0.80 mg, DY군은 41.1±9.26 mg, 그리고 DYB군은 22.2±6.87 mg으로 DC군에 비해서 DS군 은 p<0.05 수준에서 유의적으로 감소된 반면에, DY군은 p<0.05 수준에서 유의적으로 증가되었다.
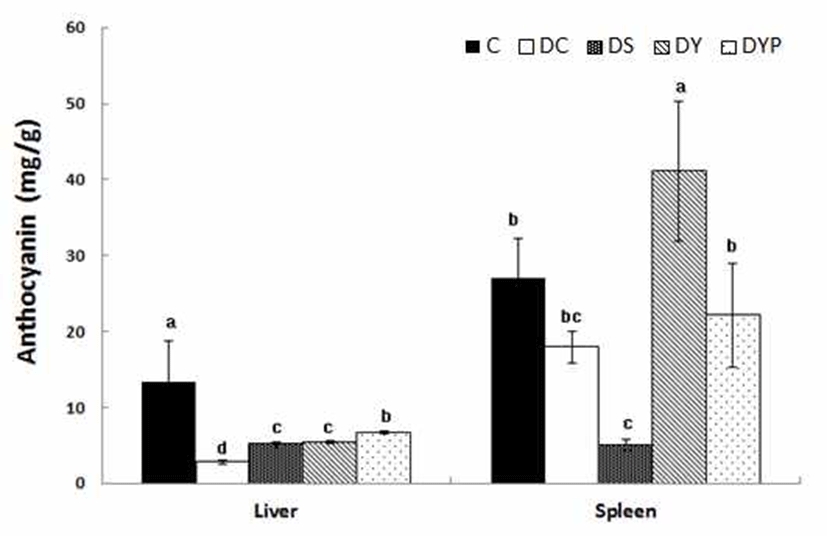
약콩의 항산화력은 종피에 함유되어 있는 anthocyanin 함량과 상관성이 높다는 관련 보고가 있다(34). anthocyanin 색소는 인체의 만성적 질병과 연관된 항산화, 항염증, 항암, 동맥경화나 지질과산화 억제, DNA cleavage 보호 작용 등 다양한 생리활성 효과가 인정되고 있다(8,9). Ryu(35)의 연 구에서는 콩과 청국장 식이의 항산화 효과 및 활성 산소종 생성억제 효과가 흰쥐에서 나타났고, 또한 노화의 지표인 리포퓨신(lipofucin) 생성도 유의적으로 억제되었다. 이때 콩 자체 보다 발효시킨 청국장 내의 isoflavonoids가 배당체 형태가 되면서 더욱 더 강한 우수한 항산화 효과를 나타내 는 것으로 알려져 있다. 본 실험에서도 정상쥐에 비해서 당뇨쥐의 anthocyanin 함량은 간 조직에서 낮았으나, 당뇨 쥐에게 청국장 중에서도 특히 anthocyanin 함량이 높은 약 콩청국장과 블랙푸드가 첨가된 약콩청국장의 공급으로 anthocyanin 함량이 증가되었다. 이러한 결과는 약콩이나 블랙푸드로 흑미 및 흑임자로부터 공급된 anthocyanin 함량 에 기인된 결과로 사려된다.
요 약
본 연구는 산화적 스트레스에 대한 당뇨병의 예방과 관 리에 대한 청국장과 블랙푸드의 효과를 평가하고자 대두청 국장, 약콩청국장 그리고 블랙푸드를 첨가한 약콩청국장 분말을 식이에 첨가하여 STZ로 유도된 당뇨쥐에게 7주간 급여한 후 지질과산화물 함량, 항산화 효소 및 항산화 영양 소 상태를 측정하였다. 그 결과 당뇨로 인하여 혈청과 간 조직 내 증가된 지질과산화물 함량은 대두 및 블랙푸드가 첨가된 약콩청국장 공급군에서 p<0.05 수준에서 유의적으 로 낮았다. 항산화 효소 중에서 당뇨 유도로 혈청 내 catalase 활성은 변화 없었으나 SOD 활성은 감소되었으며, 이때 약 콩청국장의 공급으로 SOD 활성이 유도되었다. 항산화 영 양소 중에서 혈청 내 retinol 함량은 당뇨 유도로 낮아졌지만 약콩청국장의 공급으로 7.5배 가량의 증가 현상을 보였고, 간 조직 내 retinol과 α-tocopherol 함량은 세종류의 청국장의 공급으로 높일수 있었다. 당뇨 유도로 낮아진 간 조직 내의 GSH/GSSG와 비장 조직의 anthocyanin 함량은 약콩청국장, 그리고 혈청 내 총 항산화능은 블랙푸드 청국장의 공급으로 높아진 것으로 나타났다. 이상의 결과 당뇨병이 유발되었 을 때 산화적 스트레스 지표인 지질과산화물 함량은 증가된 반면에, 항산화 효소인 catalase 및 SOD 활성과 항산화 영양 소인 retinol, α-tocopherol, GSH/GSSG, TAC 및 anthocyanin 함량이 낮아졌다. 그러나 세종류의 청국장이 당뇨쥐의 산 화적 스트레스 반응과 항산화 영양소 상태에 긍정적인 반응 효과를 보였다. 이를 기반으로 향후 당뇨병의 예방과 관리 를 위한 건강 기능성 식품으로서 청국장 및 블랙푸드의 활용 방안에 대한 좀 더 많은 연구가 이루어져야 하겠다.