서 론
최근 가공 산업의 발달로 각종 농산물들의 상당량이 가 공처리 되고 있으나 제조 과정 중에 대량의 부산물이 발생 하고 있으며, 이를 자원화 하려는 연구가 다각적으로 이루 어지고 있다(1). 특히 부산물 중에는 천연 항산화 물질인 폴리페놀을 다량 함유하고 있어 이를 활용한 고부가가치의 기능성 소재 관련 연구가 주목을 받고 있다.
양파(Allium cepa L.)는 백합과에 속하는 다년초로써 quercetin, quercitrin, rutin 등의 flavonoid 물질이 풍부한 대 표적인 식품으로 알려져있다. 특히 양파의 주된 성분인 quercetin은 flavonoid 성분으로써 벤젠환의 탄소에 -OH기 와 2번 탄소와 3번 탄소 사이의 이중결합, 4번 탄소위치에 carbonyl기, 그리고 A-ring와 B-ring에 결합되어 있는 -OH기 에 의해서 항산화 활성을 갖는 구조를 가지고 있어, 활성산 소의 산화활동을 억제하거나 제거하는 능력이 매우 강하여 (2,3) 식품의 산화 방지제로 사용되고 있다. 또한 뇌세포의 보호기능(4)과 혈당상승억제(5)에도 효능이 있다고 알려져 있다. 특히 Kang 등(6)의 연구결과에 따르면 quercetin 함량 이 양파껍질을 포함한 비가식 부위가 208.82 mg%로 가식부 위의 2.26 mg%보다 약 90배 이상 많이 함유되어있다고 보고되었다. 많은 양의 유용성분들이 양파껍질에 함유되어 있으나 양파 육질에 대한 연구가 대부분으로 양파껍질에 대한 연구는 미비한 실정이다. 또한 양파껍질에 대한 연구 는 주로 양파껍질 자체의 품질특성이나 생리특성에 관한 것으로 추출방법에 따른 품질특성 및 생리활성에 관한 연구 는 진행되지 못하고 있다.
식물의 기능성물질을 추출하기 위한 대표적인 방법으로 는 환류냉각추출법이 많이 사용되고 있으나 환류냉각추출 은 열에 의한 유용성분 파괴, 단백질 변이, 가용성분 위주의 추출, 장시간의 추출 및 낮은 추출효율로 인한 에너지 소비 등과 같은 단점이 있으므로 천연물의 추출효율을 증가시키 기 위하여 고온고압추출, 저온고압추출, 초음파추출, 에탄 올추출 등 여러 가지 추출방법들이 이용되고 있다(7,8).
따라서 본 연구에서는 양파껍질의 이용가치를 향상시키 기 위한 가압가열추출, 저온고압추출, 환류냉각추출, 상온 교반추출을 조건으로 하여 양파껍질 추출물을 제조한 후 각 추출물의 품질특성 및 항산화 활성을 비교하여 가장 효과적인 추출방법을 제시하고, 산업화에 적용할 방법을 모색 및 기능성 식품 소재를 개발하는 기초자료로 활용하고 자 한다.
재료 및 방법
본 실험에서 사용된 양파껍질은 이강산 닷컴 (http://egangsan.com)에서 2013년 10월 일괄 구매하여 사용 하였으며, 흙과 먼지 등의 이물질을 제거하여 균질기(IKA A11 basic, IKA Werke GmbH & Co., KG, Staufen, Germany) 를 사용하여 분쇄한 후 40 mesh의 분말을 –50°C에 보관하 면서 실험에 사용하였다.
양파껍질 추출방법은 분쇄시료 50 g에 15배의 70% ethanol을 가한 후 가압가열추출, 저온고압추출, 환류냉각 추출, 상온교반추출 방법으로 추출물을 제조하였다. 가압 가열추출은 autoclave(DF-100A, DOORI Scientific Co., Gyeonggi, Korea)를 이용하여 121°C에서 15분 동안 추출하 였으며, 저온고압추출은 rapid extractor(FT110, Benchtop rapid extractor, ARMFIELD, England)를 이용하여 실온에서 2시간 동안 8.0 bar의 압력 하에서 2회 반복 추출하였다. 환류냉각추출은 분쇄시료와 용매를 넣은 용기에 냉각관을 부착하여 60°C의 맨틀 상에서 3시간씩 3회 반복 추출하였고 상온교반추출은 25±2°C의 실온에서 교반기(Wise Stir SMHS-3, DAIHAN Scientific Co., Seoul, Korea)를 이용하여 250 rpm으로 24시간 추출하였다. 각각의 추출물은 rotary vacuum evaporator(rotary vacuum evaporator N-N series, Eyela, Tokyo, Japan)로 감압농축한 후에 동결건조(FD SFDSM12, Samwon, Korea)하여 분말 시료를 제조하였으 며, -50°C에 보관하면서 실험에 사용하였다.
색도는 색차계(Chromameter CR-200, Minolta, Tokyo, Japan)로 측정하였으며, 밝기를 나타내는 L(lightness), 적색 도를 나타내는 a(redness), 황색도를 나타내는 b(yellowness) 및 H°(hue angle value)를 측정하였다.
Dewanto 등(9)의 방법에 따라 시료 100 μL에 2% sodium carbonate 2 mL과 50% Folin-Ciocalteu reagent 100 μL을 가한 후 720 nm에서 흡광도를 측정하였으며, gallic acid(Sigma-Aldrich Co., St. Louis, MO, USA)의 검량선에 의하여 함량을 산출하였다.
Abdel-Hameed(10)의 방법에 따라 시료 100 mL에 5% sodium nitrite 0.15 mL을 가한 후 25°C에서 6분간 방치한 다음 10% aluminium chloride 0.3 mL를 가하여 25°C에서 5분간 방치하였다. 다음 1 N NaOH 1 mL를 가하고 vortex상 에서 가한 후 510 nm에서 흡광도를 측정하였으며 rutin hydrate(Sigma-Aldrich Co., USA)의 검량선에 의하여 함량 을 산출하였다.
DPPH radical 소거활성은 Blois(11)의 방법에 의하여 실 험하였다. 시료 0.2 mL에 0.4 mM DPPH(1,1-diphenyl- 2-picryl-hydrazyl) 용액 0.8 mL를 가하여 10분간 방치한 다 음 525 nm에서 분광광도계(UV-1650PC, Shimadzu, Kyoto, Japan)를 이용하여 흡광도의 변화를 측정하였으며, electron donating ability(%)=100-[(OD of sample/OD of control) ×100]에 의하여 활성도를 산출하였다.
Re 등(12)의 방법에 따라 7.4 mM ABTS[2,2’-azinobis( 3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt] 와 2.6 mM potassium persulfate를 혼합하여 실온∙암소에서 24시간 동안 방치하여 radical을 형성시킨 다음 실험 직전에 ABTS 용액을 732 nm에서 흡광도가 0.700±0.030이 되도록 phosphate buffer saline(PBS, pH 7.4)로 희석하여 사용하였 다. 희석된 용액 950 μL에 추출물 50 μL를 가하여 암소에서 10분간 반응시킨 후 732 nm에서 흡광도를 측정하였으며 계산식, ABTS radical scavenging ability(%)=100- [(OD of sample/OD of control)×100]에 의하여 활성을 산출하였다.
Kim 등(13)의 방법에 따라 추출물 0.05 mL, 1 uint/mL α-glucosidase 0.05 mL과 200 mM potassium phosphate buffer(pH 7.0) 0.05 mL을 잘 혼합하여 37°C에서 10분간 전처리 하였다. 그 다음 3 mM ρNPG(ρ-nitrophenyl α -D-glucopyranoside) 0.1 mL을 첨가하여 37°C에서 10분간 반응시킨 후 0.1 M Na2CO3 0.75 mL로 반응을 정지시켜 405 nm에서 흡광도를 측정하였으며, 효과는 α-glucosidase inhibition(%)=[1-(CAbs-SAbs)/(CAbs-BAbs)]×100: “CAbs; 대조구 흡광도, SAbs; 시료 흡광도, BAbs; 시료 무첨가구의 흡광도”에 의하여 산출하였다.
ACE 저해 효과는 Cushman과 Chung의 방법(14)을 변형 하여 측정하였으며, 조효소액은 rabbit lung acetone powder(Sigma-Aldrich Co.)를 0.2 g/10 mL(w/v)의 농도로 4°C에서 24시간 추출한 후, 원심분리(4°C, 4,000 rpm, 40 min)하여 상등액을 조효소액으로 사용하였다. 기질은 0.3 M NaCl이 함유된 0.1 M sodium borate buffer(pH 8.3)에 HLL(hippuryl-histidyl-leucine, Sigma-Aldrich Co.)을 5 mg/mL(w/v)의 농도로 녹인 후 기질로 사용하였다. ACE 저해 활성은 시료 50 μL를 가한 다음 37°C에서 5분간 예비 반응을 시킨 후, 기질 50 μL를 가하고 다시 37°C에서 1시간 반응시켰다. 다음 1 N HCl 150 μL를 가하여 반응을 정지시 키고 750 μL의 ethyl acetate를 가한 후, 1분간 교반하고 원심분리(4°C, 5,000 rpm, 10 min)한 다음 500 μL의 상등액 을 얻었다. 이 상등액을 120°C에서 30분간 완전히 건조시켜 2 mL의 methanol을 넣은 후 228 nm에서 흡광도를 측정하였 다. 대조구로서는 추출물 대신 추출용매 50 μL을 가하여 측정하였으며, 저해 효과는 계산식 ACE inhibition(%)= [1-(CAbs-SAbs)/(CAbs-BAbs)]×100: “CAbs, 대조구 흡광 도; SAbs, 시료 흡광도; BAbs, 시료 무 첨가구의 흡광도”에 의하여 산출하였다.
Kato 등(15)의 방법에 따라 1 mM NaNO2 용액 1 mL에 추출물 l mL를 가하고 0.1 N HCl과 0.2 M citrate buffer(pH 2.5)를 가하여 총 부피를 10 mL를 취하여 2% 초산용액 3 mL와 30% 초산용액으로 용해한 Griess reagent(1% sulfanilic acid : 1% naphthylamine = 1:1) 0.4 mL를 순차적으 로 가한 후 실온에서 15분간 방치, 520 nm에서 흡광도를 측정하였다. 대조구는 Griess reagent 대신 증류수를 사용하 였으며, 계산식 nitrite scavenging activity(%)=100-[OD of acnple/OD of control]×100]에 의하여 산출하였다.
Yen 등(16)의 방법에 따라 시액 1 mL, 80% ethanol 0.08 mL, 2 mM FeCl2∙4H2O [iron(II) chlotide tetrahydrate] 용 액 0.1 mL, 5 mM ferrozine[3-(2-pyridyl)- 5,6-diphenyl- 1,2,4-rtiazine –4’,4”=disulronic acid]용액 0.1 mL를 첨가한 다음 혼합하여 실온에서 10분간 반응시킨 후 562 nm에서 흡광도를 측정하였다. 대조구는 대표적 chelating agent인 EDTA를 사용하였으며 계산식, ferrous ion chelating effect(%)=100=[(OD of sample/OD of control)×100]에 의하 여 산출하였다.
결과 및 고찰
추출방법에 따른 양파껍질 70% 에탄올 추출물의 추출 수율 및 색도는 Table 1과 같다. 추출수율은 AE(autoclave extraction)가 13.21%로 가장 높았으며, SE(stirrer extraction), RE(reflux extraction) 및 LTPE(low temperature high pressure extraction)가 각각 12.41%, 9.00%, 5.39%로 높은 수율을 나타내었다. 특히 SE와 RE의 경우 LTPE의 수율과 2배 이상 의 차이를 보였다. 이는 Kwon 등(17)의 추출방법에 따른 쇠비름의 추출 수율이 환류냉각추출 및 가압가열추출이 저온고압추출에 비해 약 3배 정도의 수율을 나타낸 것과 일치하였다. 환류냉각추출과 가압가열추출에서 높은 수율 을 나타내는 것은 열처리 공정에 의하여 불용성 세포벽의 수용화에 의해 수용성 식이섬유가 증가되는 현상과 더불 어, 수용화 과정 중에 식물조직의 구조적인 변화에 따라 불용성 식물의 세포벽으로부터 식이섬유 성분의 용해가 용이해짐에 따른 결과로 사료된다(18). 또한 Kang 등(19)의 연구에서 양파껍질의 착즙 전 가열온도에 따른 추출수율을 비교한 결과 100°C가열 했을 때 보다 낮은 온도인 80°C에서 가열했을 때의 수율이 더 높았던 것으로 미루어 볼 때 121°C 에서 추출을 하는 가압가열 추출물의 경우 고온에서 양파껍 질의 유용성분이 파괴가 되어 비교적 낮은 온도에서 추출하 는 환류냉각추출과 상온교반추출에 비해 낮은 수율을 나타 낸 것으로 사료된다. 색도의 경우 밝기를 나타내는 L값과 채도를 나타내는 chroma value의 경우 추출방법에 따른 차 이가 나타나지 않았다. 반면 적색도를 나타내는 a값은 상온 교반추출과 환류냉각추출은 비슷한 값을 보였으나 압을 가한 저온고압추출의 경우 증가하였으며 열과 압을 모두 가한 가압가열추출의 경우 상온교반추출과 환류냉각추출 의 2배 높은 값을 나타내었으며, 황색도를 나타내는 b값은 가압가열추출이 다른 추출방법에 비하여 감소하는 경향을 나타내었다.
페놀화합물(polyphenolics)은 자연계에 널리 존재하는 천 연색소로서 주로 액포 및 세포막에서 유리형, 에스테르형 또는 결합형으로 존재하며(20), 항암을 비롯하여 항고혈압, 항염증, 항당뇨, 항산화 및 항노화 등 여러 생리적 및 약리적 효능이 있는 것으로 밝혀져 왔다(21). 특히 유리라디컬(free radical)을 소거하는 항산화 활성이 높은 것으로 알려져 있 다(22).
추출방법에 따른 양파껍질 추출물의 폴리페놀 및 플라보 노이드의 함량을 측정한 결과는 Table 2와 같다. 각 추출물 의 폴리페놀 함량은 가압가열추출(209.99 mg/g)이 가장 높 은 함량을 나타내었으며, 환류냉각추출(178.24 mg/g), 저온 고압추출(176.01 mg/g), 상온교반(140.14 mg/g) 순으로 높 은 함량을 나타냈다. 플라보노이드 함량 또한 가압가열추 출(25.00 mg/g), 환류냉각추출(23.30 mg/g), 저온고압추출 (20.32 mg/g), 상온교반(20.09 mg/g)순으로 높은 함량을 나 타내었다. 폴리페놀의 경우 고온과 고압 하에서 불용성 성 분들이 가용화 됨에 따라 막 투과성이 증가하고, 물질 이동 이 용이하게 되어 용매가 세포 안으로 들어가 보다 많은 성분이 세포 밖으로 용출되면서 폴리페놀 함량이 높아진 것으로 보이며 이는 Han 등(23)의 고압 추출공정이 길어짐 에 따라 수율 또한 증가한다는 보고와 일치하였다. 플라보 노이드 또한 고온고압추출에서 가장 높은 함량을 나타냈으 며 환류냉각추출, 저온고압추출, 상온교반추출 순으로 높 은 함량을 나타내어 폴리페놀과 비슷한 경향을 보였지만 저온고압의추출의 경우에는 상온교반추출과 큰 차이가 나 지 않아 고압의 환경보다는 고온에서 추출하는 방법이 효율 적인 것으로 사료된다.
| Measurement | AE1) | LTPE2) | RE3) | SE4) |
|---|---|---|---|---|
| Polyphenols (mg GAE5)/g) | 209.99±7.087)a8) | 176.01±3.18b | 178.24±3.89b | 140.14±5.88 |
| Flavonoids (mg RHE6)/g) | 25.00±0.57a | 20.32±0.80c | 23.30±0.36b | 20.09±0.10c |
추출방법에 따른 양파껍질의 DDPH 라디칼 소거활성을 측정한 결과는 Fig. 1과 같다. 1 mg/mL의 농도에서 AE 값이 28.39%로 DPPH 라디칼 소거활성이 가장 높게 측정 되었으 며, RE(26.07%), LTPE(24.35%), SE(19.53%)순으로 높은 활 성을 나타 내었다. 이와 같은 결과는 약용식물류의 총 페놀 함량과 항산화 활성의 상관관계에서 폴리페놀의 함량이 높을수록 항산화 활성이 높다는 보고(24)로 미루어 볼 때, 양파껍질 추출물의 전자공여능이 페놀류에 기인하여 항산 화 활성을 나타내며, 총 폴리페놀 함량이 높을수록 DPPH 라디칼 소거활성도 높다는 Choi 등(25)의 보고와 일치하는 결과를 나타내었다.
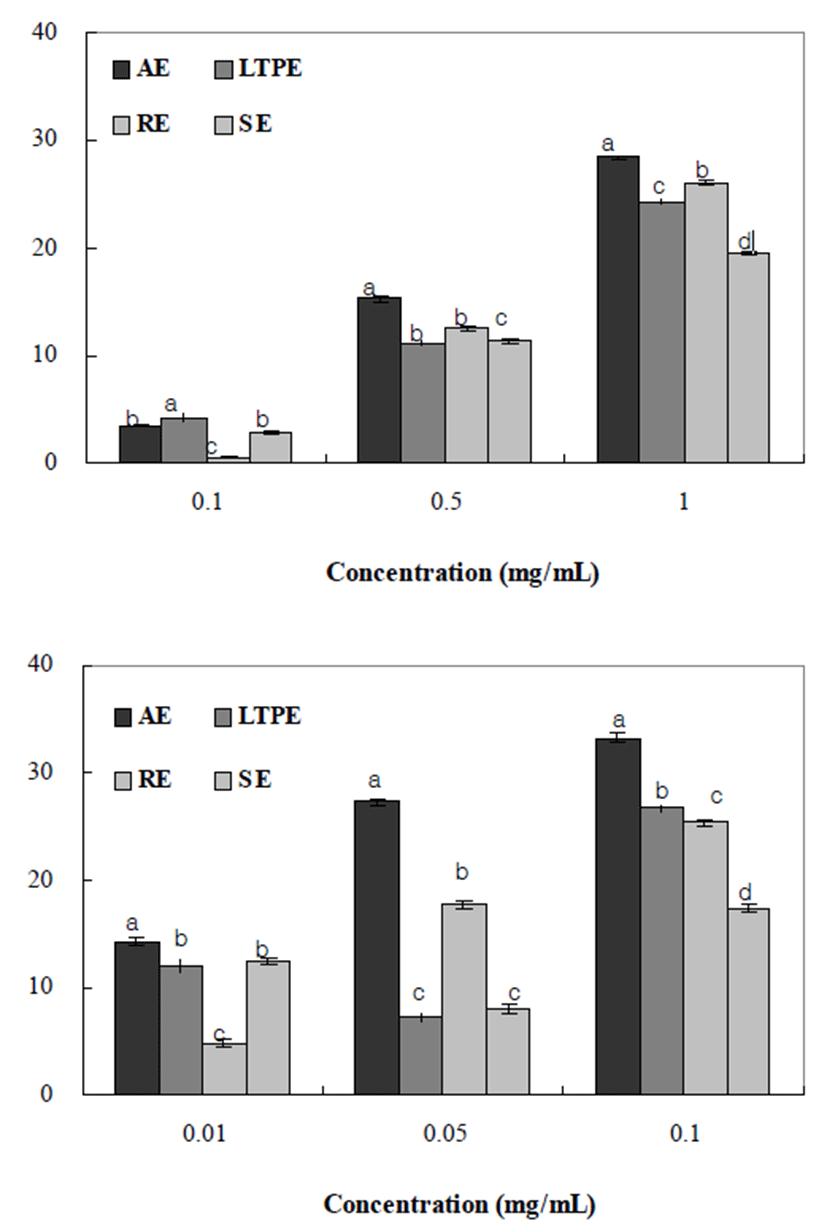
ABTS와 potassium persulfate와의 반응에 의해 생성된 ABTS radical(ABTS+∙)은 시료에 함유된 항산화성 물질의 항산화력에 의해 전자를 받아 무색의 물질로 환원시키며, 소수성과 친수성 시료 모두에 적용 가능하다(10). 양파껍질 의 추출방법에 따른 ABTS radical 소거활성을 살펴보면 AE는 33.29%, LTPE는 25.35%, RE는 26.72%, SE는 17.45% 로 나타났다. ABTS 라디칼 소거활성은 DPPH radical 소거 활성과 원리는 동일하지만 ABTS는 양이온 라디칼을, DPPH는 음이온 라디칼을 소거활성을 측정하는 방법으로 두 방법에 대한 기질과 반응물질과의 결합정도가 달라 추출 물을 이용한 라디칼 소거활성 측정값에서 차이가 나타난다 는 보고(26)로 미루어 볼 때 DPPH radical 소거활성 결과와 비교 시 폴리페놀 함량에 따른 LTPE와 RE의 값이 차이를 나타내었다.
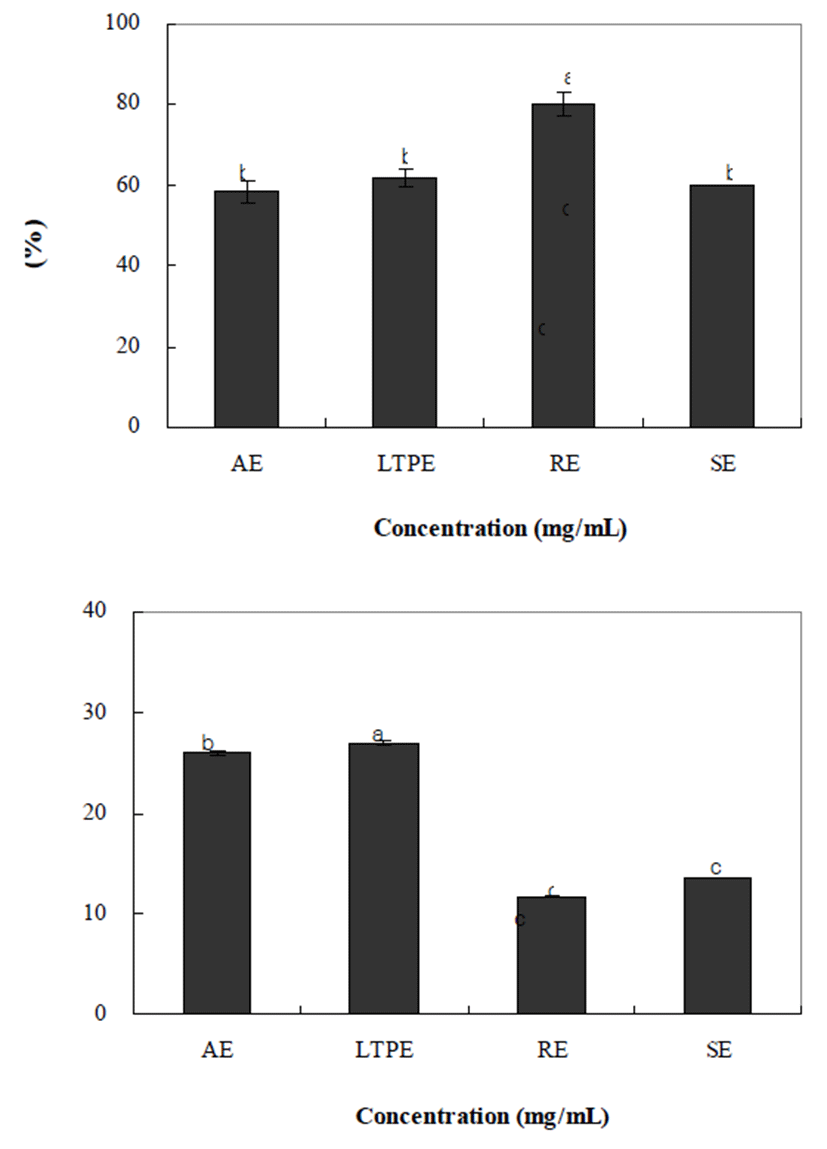
추출방법에 따른 양파껍질의 α-Glucosidase 저해 효과를 측정한 결과는 Fig. 2와 같다. α-Glucosidase 저해 효과에서 는 가압가열추출, 저온고압추출, 환류냉각추출, 상온교반 추출이 각각 58.18%, 61.72%, 80.24%, 59.71%의 저해 효과 를 나타냈다. 일반적으로 α-glucosidase는 소장 상피세포의 brush-border membrane에 존재하는 효소로서 다당류의 탄 소화물을 단당류로 분해하는 탄수화물의 소화와 흡수에 필수적인 효소로서 경구혈당강하제로 사용되고 있다(27). Kim(5)의 연구에 따르면 양파 추출물은 α-glucosidase에 높 은 저해 효과를 보이며, 양파껍질의 주요 활성성분인 quercetin외에도 양파껍질에 함유되어 있는 여러 성분들이 혈당상승억제에 기여하고 있는 것을 알 수 있다. 따라서 양파껍질 추출물 중 특히 환류냉각추출은 혈중 포도당 농도 의 증가를 억제할 수 있는 효과가 높아 제2형 당뇨와 같은 당질 관련 질병을 위한 치료제 개발을 위한 가장 적합한 추출방법이라 판단된다.
ACE는 혈압을 감소시키는 bradykinin을 불활성화시키 는 효소로서 결국 본태성고혈압의 원인이 되고 있으며(28), ACE 저해제는 ACE 활성을 저해하여 심혈관실환 및 내혈 관질환 및 고혈압과 관련이 깊은 질환을 치료하는데 사용될 수 있다(29).
추출 방법별 양파껍질추출물의 ACE 저해활성 조사결과 전체적으로 낮은 저해 효과를 보였지만 추출방법에 따라서 는 저온고압추출(27.05%)에서 가장 높았고, 다음으로 가압 가열추출(26.04%), 상온교반추출(13.61%), 환류냉각추출 (11.66%)순으로 저해 효과를 나타내었다. 이는 추출방법을 달리한 참취 추출물에 관한 Kim 등(30)의 연구에서 저온고 압을 실시한 참취 추출물에서 가장 높은 활성을 보는 결과 와 일치하였다. 이러한 효소 활성 저해 효과를 통해 다른 문제점을 유발시키는 저해제들에 대한 양파껍질을 이용한 추가적인 연구와 검증을 통하여 좀 더 다양한 제품들을 개발할 수 있도록 해야 할 것으로 사료된다.
아질산염은 수산물이나 식육제품에 첨가하여 독소 생성 억제와 발색, 산패방지제로 널리 이용되지만 그자체가 독 성을 나타내어 과량 섭취 시 혈액중의 hemoglobin이 산화되 어 met hemoglobin을 형성하여 각종 중독을 일으키는 것으 로 알려져 있으며, 아민류와 아질산염이 반응하면 발암물 질인 nitrosamine을 생성하므로 아질산염 소거활성은 항암 작용을 간접적으로 알 수 있는 지표로 활용된다(31). 추출방 법을 달리한 양파껍질의 아질산염 소거능을 분석한 결과는 Fig. 3과 같다. 아질산염 소거능은 가압가열추출(33.97%), 환류냉각추출(32.47%), 저온고압추출(21.86%), 상온교반 추출(21.71%)의 순으로 가압가열추출, 환류추출에서 높은 활성을 나타내었다. Choi 등(32)의 보고에 따르면 polyphenol 과 flavonoid 화합물은 종류에 따라 차이는 있으나 phenol계 유도체들이 nitroso 화합물의 생성을 억제한다고 하여 본 연구에서 추출방법에 따른 소거활성의 차이는 페놀화합물 의 함량 차이에 의한 결과라 판단되며, 유용성분의 함량이 높을수록 라디칼 소거능이 높아지는 것으로 확인 되었다.
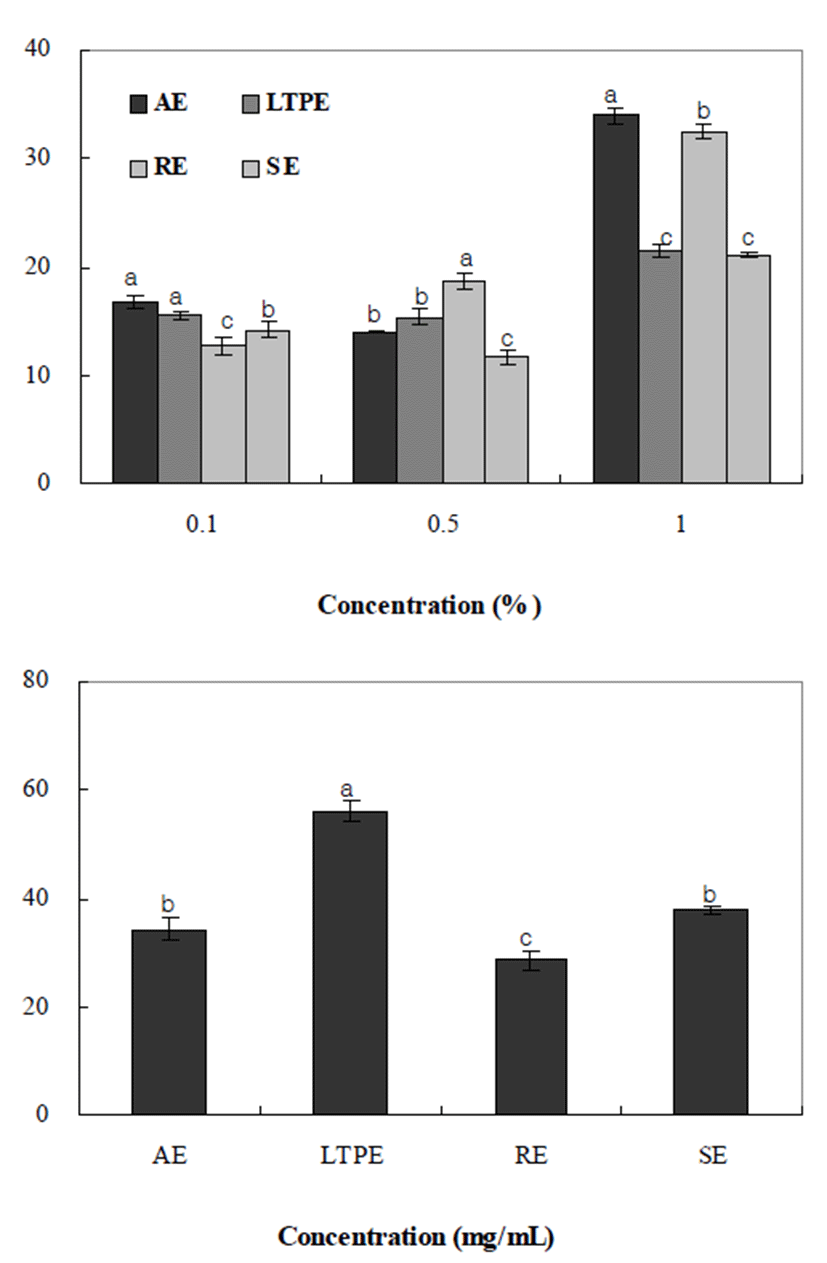
한편, 금속 킬레이트 활성 측정은 ferrozine이 Fe2+와 반응 하여 복합체를 형성하면 붉은색을 띠게 되는데 이 때 시료 추출물 중에 킬레이트 활성을 가진 성분이 존재하면 Fe2+-ferrozine 복합체 형성을 방해하여 발색이 저해되는 원 리를 이용하였다(31). 추출방법을 달리한 양파껍질의 철 이온(Fe2+) Chelating을 분석한 결과는 Fig. 3과 같다. 50 mg%의 농도에서 ferrous ion chelating 활성에서는 가압가열 추출(35.88%), 저온고압추출(54.73%), 환류냉각추출(28.43%), 상온교반추출(37.29%)로 저온고압추출에서 가장 높은 활 성을 나타내었는데 이는 항산화 활성의 경향과는 상반되는 결과로 금속이온을 제거할 수 있는 물질과 radical을 제거할 수 있는 물질의 작용기작의 차이에 따른 결과(33)라 사료되 며, Kwon 등(17)의 추출방법에 따른 쇠비름 추출물의 철 이온(Fe2+)에 대한 Chelating 활성을 측정하였을 때 저온고 압추출 및 가압가열추출에서 높게 나타난 결과와 일치한다.
요 약
추출방법에 따른 양파껍질 추출물의 품질 특성 및 생리 활성 특성을 비교하였다. 환류냉각추출의 수율이 13.21% 로 가장 높았고, 폴리페놀과 플라보노이드 함량은 가압가 열추출이 가장 높게 나타났다. DPPH 라디칼 소거능 및 ABTS 라디칼 소거능 또한 가압가열추출이 가장 높게 측정 되었다. α-Glucosidase 저해 효과는 80.24%로 환류냉각추출 이 가장 높은 저해 효과를 나타내었고, ACE 저해 효과는 27.05%로 저온고압추출이 가장 높았다. 아질산염 소거활 성은 가압가열추출이 33.97%로 가장 높았고 다음으로 환류 냉각추출이 32.47%로 높은 활성을 나타내었다. Ferrous ion chelating 효과에서는 저온고압추출이 54.73%로 가장 높은 활성을 나타내었다. 이러한 결과를 종합해 볼 때 가압가열 추출이 소재 활용가치가 높을 것으로 사료되며 천연 항산화 제 및 기능성 증진을 위한 소재로 이용 가능할 것으로 판단 된다.