ARTICLE
재래 식초에서 초산균의 분리와 발효특성 신속 비교
백성열1, 박혜영1, 이충환2, 여수환1,*
Comparison of the fermented property and isolation of acetic-acid bacteria from traditional Korean vinegar
Seong Yeol Baek1, Hye Young Park1, Choong Hwan Lee2, Soo-Hwan Yeo1,*
1농촌진흥청 국립농업과학원 농식품자원부 발효식품과
1Fermented Food Science Division, Department of Agrofood Resources, NAAS, RDA, Wanju 565-851, Korea,
2Division of Bioscience and Biotechnology, Konkuk University, Seoul 143-701, Korea
*Corresponding Author :
yeobio@korea.kr Phone:82-63-238-3610, Fax:82-63-238-3843
© The Korean Society of Food Preservation. . This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Sep 17, 2014; Revised: Oct 31, 2014; Accepted: Nov 3, 2014
Abstract
For the selection of a starter for vinegar, six strains of acetic-acid bacteria were isolated from traditional Korean vinegar fermented through the static method. These strains were investigated for their acetic-acid fermentation and identification characteristics. The 16S rRNA sequences of six strains were identified as Acetobacter pasteurianus, A. malorum, Gluconacetobacter entanii, Ga. intermedius, and Ga. xylinus respectively. The overoxidation of acetic acid, acetic-acid and pH tolerances, and acetic-acid production of these strains were investigated. None seemed to have been overoxidized. The Gluconacetobacter genus showed acetic-acid tolerance. Among the acetic-acid bacteria, A. malorum V5-7 exhibited the highest pH tolerance. The Ga. intermedius V11-5 and Ga. xylinus V8-1 strains produced colloids that exopolysaccharides of fiber. The acetic-acid production by isolated acetic-acid bacteria and type strain was a achieved at a shaking culture at 30°C for 5 days. A. malorum V5-7, A. pasteurianus Gam2, and Ga. intermedius V11-5 exhibited the highest acetic acid production. The study results indicate that appropriate strains of acetic-acid bacteria improved the thraditional Korean vinegar fermented through the static method.
Keywords: vinegar; starter; acetic acid bacteria; 16S rRNA gene; static fermentation
서 론
발효식품은 미생물이 생산한 다양한 유기물들과 2차 대 사산물을 가지고 있어 원래의 식품에는 없는 독특한 풍미를 만들어 저장식품보다 음료, 조미 등의 기호성 식품으로서 역할이 커지게 되었다. 식초는 오랜 역사를 가진 조미료로 우리 일상생활과 밀접한 관련을 맺고 있으며, 세계인들이 좋아하는 발효식품이다. 최근, 소비자들의 지적수준 향상 으로 발효식품의 기능성에 큰 주목을 받고 있다. 식초는 소량의 휘발성 및 비휘발성의 유기산, 당류, 아미노산, 에스 테르 등이 함유된 독특한 방향과 신맛을 가지며, 특유의 강한 산성으로 식품 내 유해 미생물의 생육을 억제하는 대표적인 발효식품이다(1). 식초는 크게 곡류, 과실류, 주류 등을 주원료로 제조한 곡물식초, 과실식초 및 주정식초 등 의 발효식초와 빙초산 또는 초산을 음용수로 희석한 후, 조미 제조하는 희석 초산으로 구분되며, 국내에서는 총 산(w/v%)이 초산으로서 4.0~20.0% 미만으로 규정하고 있다(2).
초산균은 그 종류에 따라 생성하는 acetic acid 함량이 다르며 총산 함량을 좌우하는 품질판정의 지표로 이용되므 로 우수한 초산균을 개량하는 것은 산업적으로 매우 중요하 다. 초산균은 당과 알코올을 초산으로 산화시킬 수 있는 능력에 따라 초산과 젖산을 재산화시킬 수 있는Acetobacter 속 및Gluconacetobacter 속과 알코올보다 당을 더 선호하며 초산을 재산화시킬 수 있는 능력이 없는Gluconobacter 속 으로 분류되어 있다. Acetobacter 속 계열의 초산균 대부분 은 식초 제조에 이용되고 있다(3).
최근, 국내 식초 연구는 원료의 기능성을 이용한 식초 개발로써 야콘, 오이, 복분자, 홍삼 등을 사용한 웰빙형 천연 발효식초 연구가 대부분을 이루고 있다(4-7). 하지만 식초 의 품질에 영향을 미치는 우수 초산균에 관한 연구는 특정 원료에 적합한 균주 선발로 제한적인 연구가 이루어 졌다 (8-10). 고품질의 발효식초 제조시 필요한 초산균의 특징은 알코올 산화력, 초산 생성능, 초산의 비과산화, 낮은 pH 저항성, 세포외 다당 비생성 및 이취 미생성 등이 있다(11). 따라서 재래식초의 품질을 향상 시킬 수 있는 산업용 우수 초산균에 대한 연구가 필요하다.
농촌진흥청에서는 발효식품 제조의 품질 차별화 및 현대 화를 위해, 유용 발효미생물을 농업기술센터에 보급함으로 써 농산업가공업체의 부가가치 향상에 매진하고 있다. 특 히, Acetobacter pasteurianus은 정치발효를 하는 발효식초 에서 자주 발견되는 대표적인 초산균이다. 국내 재래 발효 식초의 다양화와 부가가치 향상을 위해서는 산 생성능이 우수한 초산균과 종초의 개발이 요구된다.
따라서 본 연구에서는 기존에 종초로 사용하던 A. pasteurianus 균주 외에 다른 종의 초산균을 분리하여 이들 의 초산발효 특성을 신속 비교하여, 종초로써의 특성 결과 를 보고하고자 한다.
재료 및 방법
초산균 분리 및 동정
본 연구에서는 한국미생물자원센터(KCTC) 및 한국농업 미생물자원센터(KACC)에서 분양받은 초산균을 대조구로, 국립농업과학원 발효식품과에서 분리한 균주를 공시균으 로 사용하였다. 분리균은 전국의 4개 지역(경기 성남, 경북 청도, 전북 무주, 충남 서천)에서 복분자 식초 및 감식초 시료를 수집하여 GYCEA 배지에 도말하고 30°C에서 배양 한 후, 초산균을 순수분리 하였다(12). 분리균의 동정은 16S rRNA 유전자 염기서열 분석을 하였다. 프라이머는 Universal PCR primer인 27F (5’-AGAGTTTGATCCTGG CTCAG-3’)와 1492R (5’-GGTTACCTTGTTACGACTT-3’) 을 사용하였고, PCR은 initial denaturation 5분, 그리고 94°C 에서 45초간 denaturation, 55°C에서 60초간 annealing 및 72°C에서 60초간 extension cycle을 35회 수행하였다. PCR 산물의 염기서열은 ㈜제노셀에 의뢰하여 염기서열을 분석 하였다(12). Phylogenetic tree 작성은Lasergene사의DNASTAR pro software (Seqman Pro, Ver 8.1.5)와 The National Center for Biotechnology Information (NCBI, http://www.ncbi.nlm.nih.gov/)에서 제공하는 Advanced Blast Search 프로그 램을 통하여 GenBank에 보고 된 유사 균주와의 염기서열을 비교하여 계통분류학적 유연관계를 분석한 후, MEGA V4.0을 이용하여 Tamura-Nei distance model과 neighborjoining method에 의해 계통도를 작성하였다(14,15).
분리 초산균의 발효 특성
초산균의 발효 특성을 분석하기 위해, 초산 과산화, 초산 및 pH 내성, 정치배양시 콜로이드 생성 유무, 초산 발효능을 조사하였다. 초산 과산화는 시험배지(D-glucose 5 g/L, glycerol 5 mL/L, polypeptone 5 g/L, yeast extract 5 g/L, bromocresol purple 30 mg/L, acetic acid 10 mL/L, ethanol 10 mL/L, agar 15 g/L)에 초산균을 접종하여 푸른색의 콜로 니가 생성되면 과산화 특성이 있는 것으로 판정하였다(16). 초산 및 pH 내성 시험배지(D-glucose 5 g/L, glycerol 5 mL/L, polypeptone 5 g/L, yeast extract 5 g/L, acetic acid 30 mL/L, ethanol 20 mL/L, agar 15 g/L), (D-glucose 5 g/L, glycerol 5 mL/L, polypeptone 5 g/L, yeast extract 5 g/L, pH 3.0~3.4, ethanol 20 mL/L, agar 15g/L)에 초산균을 접종하여 30°C 및 37°C에 3일간 배양하여 콜로니 생성 유무로써 초산 내성 을 판정하였다(16). 정치배양시 콜로이드 생성은 시험배지 (D-glucose 5 g/L, glycerol 20 mL/L, polypeptone 10 g/L, yeast extract 10 g/L, potato extract 200 mg/L)에 초산균을 30°C에 3일간 정치배양 후, 콜로이드 형성 유무를 판정하였 다(16). 초산 생성능은 시험배지(D-glucose 10 g/L, glycerol 10 mL/L, polypeptone 2 g/L, yeast extract 2 g/L, potato extract 100 mg/L, acetic acid 10 mL/L, ethanol 40 mL/L)에 초산균을 30°C에 5일간 진탕 배양하여 2일마다 적정산도를 측정하였 다(17).
결과 및 고찰
분리균의 동정
종초용 우수 초산균 선발은 전국 4개 지역에서 수집한 재래 식초에서 GYCEA 배지에 도말하여 30°C에서 배양하 여 clear zone을 형성하는 집락을 초산균으로 추정하고 순수 분리하였다. 일반적으로 GYCEA 배지에서 초산균이 생육 하면 배지내 CaCO3를 분해하여 투명환(clear zone)이 형성 된다. 따라서 투명환의 크기가 클수록 초산 생성력이 뛰어 난 것으로 판단할 수 있다(12).
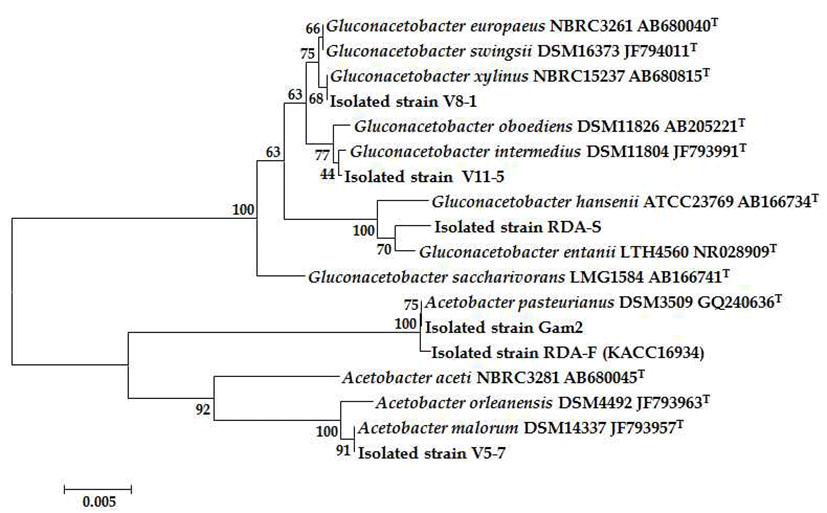
분리 초산균의 16S rRNA 염기서열을 비교분석한 결과는 Fig. 1과 같다. KACC16934(RDA-F) 및 Gam2 균주는 A. pasterianus DSM3509(GQ240636)와 염기서열이 99.9%, 100% 일치하여 유연관계가 가장 가까움을 확인할 수 있었 다. 따라서 KACC16934, Gam2 균주는A. pasterianus 또는 그 근연종으로 판단되어A. pasterianus로 동정하였다. V5-7 균주는 A. malorum DSM14337(JF793957)과 V8-1 균주는 Gluconacetobacter xylinus NRBC15237(AB680815)와 염기 서열이 각각 100% 일치하여 A. malorum V5-7 Ga. xylinus V8-1로 동정하였다. 또한, V11-5 균주는 Ga. intermedius DSM11804(JF793991)와 RDA-S 균주는Ga. entanii LTH4560(NR028909)와 염기서열이 99.8%, 99.7% 일치하 여Ga. intermedius V11-5, Ga. entanii RDA-S로 동정하였다. Table 1.
Fig. 1.
Phylogenetic tree based on 16S rRNA sequences showing the positions of the acetic acid bacter ia isolated from different kind of vinegar .
Download Original Figure
Table 1.
Acetic acid bacter ia species isolated from different kind of vinegar
|
Species |
Strain |
Number |
Source |
|
Acetobacter acetii
|
- |
KCTC1010 |
Quick vinegar, Zwolle, Netherlands |
|
Acetobacter malorum
|
- |
KACC12222 |
Rotting apple, Belgium |
|
Acetobacter pasterianus
|
- |
KACC13994 |
Beer, Netherlands |
|
Acetobacter pasterianus
|
RDA-F |
KACC16934 |
Vinegar (Rubus coreanus), Seongnam-si, Gyeonggi-do |
|
Acetobacter pasterianus
|
Gam2 |
- |
Vinegar (persimmon), Yeongju-si, Gyeongsangbuk-do |
|
Acetobacter malorum
|
V5-7 |
- |
Vinegar (Rubus coreanus), Seocheon-gun, Chungcheongnam-do |
|
Gluconacetobacter entanii
|
RDA-S |
- |
Vinegar (Rubus coreanus), Seongnam-si, Gyeonggi-do |
|
Gluconacetobacter intermedius
|
V11-5 |
- |
Vinegar (persimmon), Cheongdo-gun, Gyeongsangbuk-do |
|
Gluconacetobacter xylinus
|
V8-1 |
- |
Vinegar (persimmon), Muju-gun, Jeollabuk-do |
Download Excel Table
초산균의 발효특성
초산을 한 번 더 산화시켜 pH를 높이고, 산도를 떨어뜨리 는 초산의 과산화 조사에서는 분리 균주 모두 음성으로 나타났으며, 식초 발효시 과산화로 인한 식초 제조의 실패 는 적은 것으로 판단된다. 초산균은 당과 알코올을 초산으 로 산화시킬 수 있는 능력에 따라 초산과 젖산을 과산화시 킬 수 있는Acetobacter 속 및Gluconacetobacter 속이 있으 며 알코올보다 당을 더 선호하며 초산을 과산화시킬 수 없는 Gluconobacter 속으로 구분된다(3). 본 실험에서는 Acetobacter 속과 Gluconacetobacter 속 모두 과산화하지 않는 것으로 나타났다. Saeki 등(16)이 보고한 바에 따르면 A. rancens, A. lovanienis, A. xylium, A. aceti, A. pasteurianus, G. sphaericus 중에서 A. rancens, A. aceti 등 몇몇 균주가 초산을 과산화한다고 보고되었다. 초산균이 초산을 과산화 하는 것은 초산균이 존재하는 곳의 알코올 농도, 초산 농도, 온도 등 환경 요인에 따라 달라질 수 있으므로 이에 대한 세부적인 연구가 필요하다.
초산에 대한 내성은 Gluconacetobacter 속 균주에서만 나타나는 것으로 확인되었다. pH에 대한 내성은 A. malorum V5-7, A. acetii KCTC1010에서 가장 높은 활성을 보였고, Gluconacetobacter 속 균주와A. pasteurianus Gam2 에서도 pH 3.3 까지 내성을 보이는 것으로 나타났다. A. malorum KACC12222, A. pasteurianus KACC13994는 pH 3.5까지 내성을 있는 것으로 관찰되었다. A. pasteurianus KACC16934, Ga. entanii RDA-S에서는 pH 3.5 이하에서는 콜로니가 발견되지 않았다. 초산균의 최적 생장 pH는 5.0~6.5이며 보다 낮은 pH에서도 생육하는 균주도 발견되 어 균주의 특성이 다양한 것으로 생각된다(11).
발효 중 콜로이드 생성 조사에서 Gluconacetobacter 속 중 Ga. intermedius V11-5, Ga. xylinus V8-1 균주만 다량의 콜로이드를 생성하였으며, 이는 식초 발효균으로 적합하지 않은 성질이다(16). Acetobacter 속 균주중 A. malorum KACC1222, V5-7, A. pasteurianus KACC16934, Gam2는 상층부에 얇은 균막이 발견되었으나, 이는 균주의 성장이 활발한 것을 의미함으로 식초 발효균으로 적합한 것으로 생각된다. 초산균이 생성하는 콜로이드는 초산균의 glucose 대사에 의해 생산되는 dextrans, levans, cellulose이며 세포 외 다당체이다. 이러한 세포외 다당체는 최종 식초 제품의 품질에 해로운 것으로 알려져 있다(18).
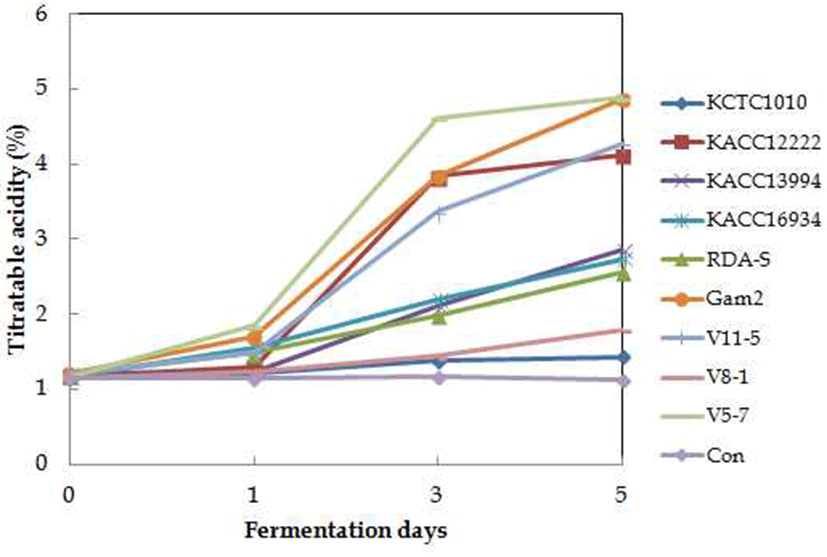
초산 생성능 결과는 Fig. 2에 나타내었다. 상위 4종의 균주가 발효 3일 이후부터 식초 발효에 필요한 총산 4% 이상 생성하는 것으로 나타냈다. A. malorum V5-7, A. pasteurianus Gam2, Ga. intermedius V11-5, A. malorum KACC12222에서 가장 높은 산 생성능을 보였다. 상위 4종 외 A. pasteurianus KACC13994, A. pasteurianus KACC16934, Ga. entanii RDA-S 균주도 발효 5일 이후에는 총산이 3% 이상 될 것으로 예상되며, 초산균 7균주가 종초 로써 가능성을 나타내었다.
Fig. 2.
Acetic acid production by isolated acetic acid bacteria and type strains.
Acetic acid bacteria were grown shaking on 100 mL of medium containing 1.0% D-glucose, 1.0% glycerol, 0.2% polypeptone, 0.2% yeast extract, 10.0% potato extract, 1.0% acetic acid, 4.0% ethanol in 250 mL flask at 30°C for 5 days. Acetic acid contents were determined by titration with 0.1 N NaOH against phenolphthalein. The data are averages based on three trials.
Download Original Figure
식초 제조를 위해, 요구되는 초산균의 특징은 알코올을 보다 산화시킬 수 있는 능력, 빠른 초산 생성능, 초산 내성, 초산의 비과산화, 낮은 pH 내성, 박테리오파지 저항성, 세 포외 다당 비생성, 불쾌한 냄새를 내지 않는 것이 필요하다 (11). 본 연구에서 국내 재래식초에서 분리된 초산균을 대상 으로 웰빙형 발효식초 제조를 위한 초산균의 특성 일부를 규명하였다. 하지만 제조 현장에 적용하기 위해서는 현장 기술과 환경에 적합한 맞춤형 종초 제조 기술에 대한 연구 가 필요하다. 본 연구를 통해 종초용 초산균의 선발과 계량 으로 국내 발효 식초의 품질 향상에 도움이 되길 바란다. Table 2.
Table 2.
Fermentation proper ties of Acetobacter spp. and Gluconacetobacter spp. isolated from different kind of Korean traditional vinegar.
|
|
Acetobacter spp. |
Gluconacetobacter spp. |
|
KCTC 1010 |
KACC 12222 |
KACC 13994 |
KACC 16934 |
Gam2 |
V5-7 |
RDA-S |
V11-5 |
V8-1 |
|
Colloid |
- |
WS |
- |
WS |
WS |
WS |
- |
C |
C |
|
Acetic acid tolerance |
- |
- |
- |
- |
- |
- |
+- |
+ |
|
|
pH tolerance |
3.5 |
++ |
+ |
+ |
- |
+ |
++ |
- |
+ |
++ |
|
3.3 |
++ |
- |
- |
- |
+ |
++ |
- |
+ |
+ |
|
3.1 |
+ |
- |
- |
- |
- |
+ |
- |
- |
- |
|
Overoxidation |
- |
- |
- |
- |
- |
- |
- |
- |
- |
Download Excel Table
요 약
식초 제조용 종초 선발을 위해 다양한 초산균을 분리한 후, 그들의 발효특성 분석하여 종초 가능성을 검토하였다. 수집된 식초 시료에서 분리된 균주의 16S rRNA 염기서열 을 분석한 결과, A. pasteurianus, A. malorum, Ga. entanii, Ga. intermedius, Ga. xylinus로 동정되었다. 식초 제조용 초 산균의 발효특성을 분석한 결과, 초산의 과산화능은 모든 시험 균주에서 음성으로 나타나 과산화를 보이지 않았으 며, 초산 내성은 Gluconacetobacter 속 균주만 관찰되었다. pH 내성은A. malorum V5-7 균주가 가장 높았다. 식초 품질 에 해로운 영향을 주는 섬유질상의 세포외 다당체인 콜로이 드 생성 균주는 Ga. intermedius V11-5, Ga. xylinus V8-1 균주로 나타났다. 초산 생성능은 A. malorum V5-7, A. pasteurianus Gam2, Ga. intermedius V11-5에서 가장 높은 산 생성능을 나타내었다. 본 연구에서는 종초용 초산균의 발효 특성 연구를 통해 국내 발효 식초의 품질 향상을 기대 한다.
감사의 글
This work was carried out with the support of ‘Cooperative Research Program for Agriculture Science & Technology Development (Project No. PJ00982601)’ Rural Development Administration, Republic of Korea.
References
Jeoung YJ, Lee MH. A view and prospect of vinegar industry. Food Industry Nutr. 2000; 5 p. 7-12.

Anon Notification some revision of standards and specifications of food. 2014Notification No. 2014-106 of Ministry of Food and Drug Safety.

Sokollek SJ, Hertel C, Hammes WP. Cultivation and preservation of vinegar bacteria. J Biotechnol. 1998; 60 p. 195-206


Lee MK, Choi SR, Lee J, Choi YH, Lee JH, Park KU, Kwon SH, Seo KI. Quality characteristics and anti-diabetic effect of yacon vinegar. J Korean Soc Food Sci Nutr. 2012; 41 p. 79-86


Hong SM, Moon HS, Lee JH, Lee HI, Jeong JH, Lee MK, Seo Kl. Development of functional vinegar by using cucumbers. J Korean Soc Food Sci Nutr. 2012; 41 p. 927-935


Hong SM, Kang MJ, Lee JH, Jeong JH, Kwon SH, Seo KI. Production of vinegar using Rubus coreanus and its antioxidant activities. Korean J Food Preserv. 2012; 19 p. 594-603


Kim DK, Baik MY, Kim HK, Hahm YT, Kim BY. Manufacture of the red ginseng vinegar fermented with red ginseng concentrate and rice wine, and its quality evaluation. Korean J Food Sci Technol. 2012; 44 p. 179-184


Cho KM, Shin JH, Seo WT. Production of Korean domestic wheat (keumkangmil) vinegar with Acetobacter pasteurianus A8. Korean J Food Sci Technol. 2013; 45 p. 252-256


Kang SK, Jang MJ, Kim YD. Isolation and culture conditions of Acetobacter sp. for the production of citron (Citrus junos) vinegar. Korean J Food Preserv. 2006; 13 p. 357-362.

Park MH, Lee JO, Lee JY, Yu SJ, Ko YJ, Kim YH, Ryu CH. Isolation and characteristics of acetic acid bacteria for persimmon vinegar fermentation. J Korean Soc Food Sci Nutr. 2005; 34 p. 1251-1257.

Drysdale GS, Fleet GH. Acetic acid bacteria in winemaking: a review. American J Enology Viticulture. 1988; 39 p. 143-154.

Kim SW, Park JH, Jun HK. Analysis of optimum condition for production of and onionic vinegar by two-step fermentations. J Life Sci. 2008; 18 p. 1410-1414


Felske A, Akkermans ADL. Spatial homogeneity of abundant bacterial 16S rRNA molecules in grassland soils. Microb Ecol. 1998; 36 p. 31-36


Tamura K, Dudley J, Nei M, Kumar S. MEGA4: Molecular evolutionary genetics analysis (MEGA). Mol Biol Evol. 2007; software version 4.024 p. 1596-1599.

Saitou N, Nei M. The neighbor joining-methods: a new method for reconstructig phylogenetic trees. Mol Biol Evol. 1987; 4 p. 406-425.

Saeki A, Theeragool G, Matsushita K, Toyama H, Lotong N, Adachi O. Development of thermotolerent acetic acid bacteria useful for vinegar fermentation at higher temperatures. Biosci Biotech Biochem. 1997; 61 p. 138-145


Nanda K, Taniguchi M, Ujike S, Ishihara N, Mori H, Ono H, Murooka Y. Characterization of acetic acid bacteria in traditional acetic acid fermentation of rice vinegar (Komesu) and unpolished rice vinegar (Kurosu) produced in Japan. Appl Environ Microbiol. 2001; 67 p. 986-990


Gullo M, Giudici P. Acetic acid bacteria in traditional balsamic vinegar: phenotypic traits relevant for starter cultures selection. Int J Food Microbiol. 2008; 125 p. 46-53