서 론
최근 우리나라에서는 소득수준의 향상 및 산업의 발달로 인하여 식생활, 식습관 등 라이프 스타일이 서구화됨에 따 라 만성질환이나 성인병 환자가 급격히 증가하고 있다. 이 에 따라 건강에 관한 관심이 높아져 건강 기능성 식품에 대한 수요가 크게 증가하고 있는 추세이다. 식품 관련 산업 및 학계에서는 자연계에 존재하는 다양한 동식물로부터 얻어지는 각종 유용성분을 식품소재로 활용 및 생리활성 작용에 관한 연구가 활발히 진행되고 있으며, 특히 인체의 생리기능 조절이나 항상성 유지에 관여하여 질병예방과 노화억제 등 건강을 유지하는데 중요한 역할을 하는 것으로 밝혀진 각종 식품소재를 찾는 것이 식품산업의 새로운 연구 목표로 부각되고 있다(1,2).
일반적으로 천연물에 존재하는 생리활성 물질은 대부분 페놀성 화합물로 항산화 및 항균효과를 가지고 있다. 즉, 식물체는 다양한 형태의 항산화 물질을 함유하고 있으며 그 중에서 페놀성 물질은 항산화성을 가진 대표적인 물질로 알려져 있다. 이들로부터 분리된 천연 항산화 물질들은 각 종 노화관련 질환 예방에 대하여 유익한 작용을 할 것으로 알려져 있다(3). 현재 항산화 물질로서 아스코르빈산, 토코 페롤, 카로티노이드, 플라보노이드, 탄닌 등의 천연 항산화 제와 함께 butylated hydroxyanisole(BHA) 및 butylated hydroxy-toluene(BHT) 등의 합성 항산화제가 개발 되어 식 품, 화장품 등에 산화방지제로 많이 사용되고 있다. 천연 항산화제들은 항산화력이 비교적 낮고 합성항산화제의 경 우는 생체 효소 및 지방의 변이원성 및 독성으로 인체에 암을 유발할 수 있다는 보고(4)가 있어 안전하고 활성이 높은 천연 항산화제의 개발이 요구되고 있는 실정이다.
또한 식물체 내에 존재하는 많은 화합물들은 부위별, 품 종, 처리방법, 추출용매 종류 및 용매 비, 추출온도 등의 다양한 조건으로 추출하며 이러한 조건은 식물 화합물의 함량 뿐만 아니라 항산화 및 생리활성 특성에 변화를 준다. 따라서 추출용매의 선별은 기능성 물질의 추출에 매우 중요 하게 작용할 수 있으며 methanol, ethanol, water 등 다양한 추출용매를 이용하여 항산화성 물질을 효율적으로 찾고자 하는 노력이 많이 시도되고 있다(5).
모링가(Moring oleifera Lam)는 모링가과(moringaceae) 에 속하며 높이가 5~10 m에 이르는 나무로 아시아, 아프리 카, 아라비아 등에서 재배된다. 단백질과 비타민이 풍부해 영양가가 높고, 의약적으로 과혈당증과 항염증, 항암 등 다양한 약리작용을 가지고 있으며(6,7), 모링가의 꽃, 뿌리, 씨, 잎, 열매에는 다른 식물들에 비해 비타민, 플라보노이드, 아미노산 등과 같은 phytochemical이 풍부한 것으로 알려져 있다. 모링가의 다양한 부위들 중 잎은 β-카로틴, 단백질, 비타민 C, 칼슘 등이 풍부해 항산화제로 이용되며(8), 피부 염증이나 피부 상처 치유에 효과가 있다는 보고가 있다(9). 또한 모링가 씨 추출물은 flavonoid와 isothiocyanates, glucosinolates, thiocarbamates와 같은 생리활성물질을 포함 하고 있으며(7), 간 기능 보호 효과(9)나 암세포의 세포자살 과 증식억제 효과(10) 등이 보고되면서 모링가 잎의 우수성 이 밝혀진바 있다. 그러나 국내에는 모링가 잎에 관한 연구 가 미비한 실정이며 이를 유용하게 사용하기 위한 다양한 조건 및 그에 따른 과학적인 근거의 제시가 절실히 요구되 고 있다.
따라서, 본 연구에서는 모링가 잎의 활용성 증진을 위하 여 추출용매에 따른 항산화 활성 및 생리활성을 평가하였으 며 이를 통해 기능성 식품으로서의 적용을 위한 가능성을 검토하고자 하였다.
재료 및 방법
본 실험에 사용된 모링가 잎은 (주)셀렉스 팜(Kimpo, Korea)에서 제공받아 사용하였다. 실험에 사용된 모든 시약 은 Sigma-Aldrich사(St. Louis, MO, USA)의 제품을 사용하 였다.
모링가 잎 100 g에 각각 추출용매인 물, ethanol, methanol 을 10배씩 가하여 60°C의 수욕 상에서 환류냉각관을 부착한 추출장치로 3시간씩 3회 반복하여 추출하였다. 추출액은 Whatman No. 1로 여과한 다음, rotary vacuum evaporator (Eyela Co., Tokyo, Japan)로 감압농축 한 후에 동결건조(FD SFDSM12, Samwon, Korea)하여 분말로 제조하였다. 각 추 출물들의 수율은 추출액을 동결 건조시켜 건물 중량을 구한 다음 추출액 조제에 사용한 원료 건물량에 대한 백분율로 계산하였다.
총 폴리페놀 함량은 Dewanto 등의 방법(11)에 따라 시액 100 μL에 2% sodium carbonate 2 mL과 50% Folin-Ciocalteu reagent 100 μL을 가한 후 720 nm에서 흡광도를 측정하였으 며 gallic acid(Sigma-Aldrich Co.)의 검량선에 의하여 함량 을 산출하였다.
총 플라보노이드 함량은 Saleh와 Hameed의 방법(12)에 따라 시액 100 mL에 5% sodium nitrite 0.15 mL을 가한 후 25°C에서 6분간 방치한 다음 10% aluminium choloride 0.3 mL를 가하여 25°C에서 5분간 방치하였다. 다음 1N NaOH 1 mL를 가하고 vortex상에서 가한 후 510 nm에서 흡광도를 측정하였으며 rutin hydrate(Sigma-Aldrich Co.)의 검량선에 의하여 함량을 산출하였다.
DPPH 라디칼 소거활성은 Blois의 방법(13)에 따라 시액 0.2 mL에 0.4 mM DPPH(1,1-diphenyl-2-picryl-hydrazyl)용 액 0.8 mL를 가하여 10분간 방치 한 다음 525 nm에서 흡광 도를 측정하였으며 계산식, electron donating ability (%)=100-[(OD of sample/OD of control)×100]에 의하여 활 성도를 산출하였다. ABTS 라디칼 소거활성은 Re 등(14)의 방법에따라7.4 mMABTS[2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt]와 2.6 mM potassium persulfate를 혼합하여 실온암소에서 24시간 동안 방치하여 radical을 형성시킨 다음 실험 직전에 ABTS 용액을 732 nm에서 흡광도가 0.700±0.030이 되도록 phosphate buffer saline(PBS, pH 7.4)로 희석하여 사용하였다. 희석된 용액 950 μL에 추출물 50 μL를 가하여 암소에서 10분간 반응시 킨 후 732 nm에서 흡광도를 측정하였으며 계산식, ABTS radical scavenging ability(%)=100-[(OD of sample/OD of control)×100]에 의하여 활성을 산출하였다.
Kato 등(15)의 방법에 따라 1 mM NaNO2 용액 1 mL에 추출물 1 mL를 가하고 0.1 N HCl과 0.2 M citrate buffer(pH 2.5)를 가하여 총 부피를 10 mL로 조정하였다. 다음에 37°C 에서 1시간 반응시킨 후 1 mL를 취하여 2% 초산용액 3 mL와 30% 초산용액으로 용해한 Griess reagent(1% sulfanilic acid:1% naphthylamine=1:1) 0.4 mL을 순차적으로 가한 후 실온에서 15분간 방치, 520 nm에서 흡광도를 측정 하였다. 대조구는 Griess reagent 대신 증류수를 사용하였으 며 계산식, nitrite scavenging activity(%)=100-[(OD of sample/OD of control)×100]에 의하여 산출하였다.
Yen 등(16)의 방법에 따라 추출물 1 mL, 80% ethanol 0.8 mL, 2 mM FeCl2·4H2O[iron(II) chloride tetrahydrate] 용 액 0.1 mL, 5 mM ferrozine[3-(2-pyridyl)-5,6-diphenyl-1,2,4-triazine -4’,4’’-disulfonic acid]용액 0.1 mL를 첨가한 다음 혼합하여 실온에서 10분간 반응시킨 후 562 nm에서 흡광도를 측정하였으며 계산식, ferrous ion chelating effect(%)=100-[(OD of sample/OD of control)×100]에 의하 여 산출하였다.
Kim 등의 방법(17)에 따라 추출물 0.05 mL, 1 unit/mLα-glucosidase 0.05 mL와200 mM potassium phosphate buffer (pH 7.0) 0.05 mL를 잘 혼합하여 37°C에서 10분간 전처리하 였다. 다음에 3 mM ρNPG(ρ-nitrophenyl α-D-glucopyranoside) 0.1 mL를 첨가하여37°C에서 10분간 반응시킨 후 0.1 M Na2CO3 0.75 mL로 반응을 정지시켜 405 nm에서 흡광도를 측정하였다. 이때, 활성 비교를 위하여 acarbose를 사용하였 다. 저해활성은 α-Glucosidase inhibition(%)=[1-(CAbs-SAbs)/(CAbs-BAbs)]×100: “CAbs,대조구흡광도 SAbs, 시료흡광도 BAbs, 시료 무첨가구의 흡광도”에 의하여 산출하였다.
ACE 저해활성은 Cushman과 Cheung의 방법(18)을 변형 하여 측정하였으며, 조효소액은 rabbit lung acetone powder(Sigma-Aldrich Co.)를 0.3 M NaCl을 함유한 0.1 M sodium borate buffer(pH 8.3)에 0.2 g/10 mL (w/v)의 농도로 4°C에서 24시간 추출한 후, 원심분리(4°C. 4,000 rpm, 40min)하여 상등액을 조효소액으로 사용하였다. 기질은 0.3 M NaCl이 함유된 0.1 M sodium borate buffer(pH 8.3)에 HLL(Hippuryl- histidyl-leucine, Sigma)을 5 mg/mL(w/v)의 농도로 녹인 후 기질로 사용하였다. ACE 저해활성은 시료 50 μL에 ACE 조효소액 50 μL을 가한 다음 37°C에서 5분간 예비 반응을 시킨 후, 기질 50 μL을 가하고 다시 37°C에서 1시간 반응시켰다. 다음 1 N HCl 150 μL을 가하여 반응을 정지시키고 750 μL의 ethyl acetate를 가한 후, 1분간 교반하 고 원심분리(4°C. 5,000 rpm, 10 min)한 다음 500 μL의 상등 액을 얻었다. 이 상등액을 120°C에서 30분간 완전히 건조시 켜 2 mL의 methanol을 넣은 후 228 nm에서 흡광도를 측정하 였다. 대조구로서는 추출물 대신 추출용매 50 μL을 가하여 측정하였으며, 저해활성은 계산식, ACE inhibition(%)=[1-(CAbs-SAbs)/(CAbs-BAbs)]×100: “CAbs; 대조구 흡광도, SAbs; 시료 흡광도, BAbs; 시료 무첨가구의 흡광도”에 의하여 산출 하였다.
3-hydroxy-3-methylglutaryl-CoA(HMG CoA) reductase 저해활성은 Kleinsek 등의 방법(19)을 변형하여 측정하였 다. 추출물 40 μL, dimethyl sulfoxide 40 μL와 0.5 μM phosphate buffer(pH 7.0) 200 μL에 20 mM dithiothreitol 200 μL, 0.3 mM β-NADPH 200 μL를 넣고 혼합하였다. 다음 37°C에서 3분간 preincubation을 한 다음 0.3 mM HMG CoA 200 μL를 첨가하여 37°C에서 5분간 반응시킨 후 340 nm에 서 흡광도 변화를 측정하였으며, 저해활성은 계산식, HMG CoA reductase inhibitory activity(%)=[1-(CAbs-SAbs)/(CAbs-BAbs)]×100: “CAbs; 대조구 흡광도, SAbs; 시료 흡광도, BAbs; 시료 무첨가구의 흡광도”에 의하여 산출하였다.
결과 및 고찰
추출 용매에 따른 모링가 잎의 추출 수율과 총 폴리페놀 및 플라보노이드 함량을 측정한 결과는 Table 1과 같다. 추출 수율은 물 추출물이 13.17%로 가장 높았으며 메탄올 (9.54%), 에탄올(7.48%) 추출물의 순으로 나타났다. 특히, 에탄올 추출물의 경우 물 추출물의 수율과 약 2배 정도의 차이를 보였다. Yang과 Park(20)의 연구에서는 흑양파 물 추출물의 수율이 28.56%로 에탄올과 메탄올 추출물에 비하 여 월등히 높은 결과를 나타내었으며, Kwon 등(21)의 용매 별 마카 추출 수율이 물 > 메탄올 > 에탄올의 순으로 나타났 다는 결과와 일치하였다. 이는 식물체에 존재하는 수용성 폴리페놀 화합물과 방향족 아민 등의 용출이 증가하여 결과 적으로 극성용매에서의 추출수율이 높게 나타난 것으로 판단된다. 각 용매별 추출액의 총 폴리페놀 함량은 물 추출물이 58.04 mg/mL로 가장 높은 함량을 나타내었으며 메탄올 추출물이 47.15 mg/mL, 에탄올 추출물이 40.72 mg/mL로 나타났다. 이러한 결과는 Kwon(21)의 마카 물 추출물에서 총 폴리페 놀 함량이 가장 높게 나타났다고 보고한 연구결과와 일치하 였다. 총 플라보노이드 함량 또한 물 추출물이 12.36 mg/mL 로 다른 용매에 비해 높은 함량을 나타내었다. 폴리페놀 화합물은 식물체에 널리 존재하는 다기능성 물질로 분자 내에 하나 이상의 hydroxyl기를 가지고 있어서 수소 공여체 로 작용하고 페놀 구조의 공명안정화에 기여함으로써 항산 화 활성을 나타낸다(22). 또한 당이나 수용성 단백질이 폴리 페놀의 hydroxyl기에 ether 결합으로 존재하는 경우가 많은 데(23), 이를 통해 극성용매에 대한 용해성이 증가하여 물 추출물에서 높은 함량을 보인 것으로 사료된다.
추출 용매별 모링가 잎 추출물의 DPPH 및 ABTS 라디칼 소거활성을 측정하였고 그 결과는 Table 2와 같다. DPPH 라디칼 소거활성의 경우 500 mg%의 농도에서 물 추출물이 79.18%, 에탄올 추출물이 72.88%, 메탄올 추출물이 68.41% 로 나타났으며, 합성 산화방지제인 BHT(butylated hydroxytoluene)와 물 추출물을 비교한 결과 각각 77.18%, 79.18%로 물 추출물에서 높은 라디칼 소거활성을 보였다. ABTS 라디칼 소거활성의 경우 50 mg%의 농도에서 양성 대조구인 BHT(98.65%)보다 낮은 값이었지만 물 추출물이 92.11%의 활성을 보여, 전체적으로 물 추출물의 라디칼 소거능 효과가 다른 추출물에 비해 매우 높은 것으로 나타 났다. Choi 등(24)의 산수유, 복분자, 음양곽, 우슬, 현삼, 지황 등 14종의 생약 추출물이 50 mg/mL 농도에서 90% 이상의 ABTS 라디칼 소거활성을 나타내었다고 보고한 결 과와 비교하였을 때, 본 실험에서 사용된 모링가 물 추출물 의 활성이 우수함을 확인할 수 있었다. 또한, 모든 처리구에 서 ABTS 라디칼 소거활성이 DPPH 라디칼 소거활성에 비 하여 높은 활성을 나타내는 것은 라디칼을 제거하는 기작이 다르고, 기질이 결합하는 정도가 다르다는 점에서 낮은 농 도에서도 높은 활성을 나타내는 것으로 판단된다(14). 또한 추출 용매에 따라 활성의 정도가 다른 것은 식물자원에 존재하는 다양한 항산화 물질이 추출에 사용된 용매의 극성 에 의해서 용해되는 정도가 다르기 때문으로 판단된다(25).
모링가 잎 추출물의 총 폴리페놀 및 플라보노이드 함량 과 항산화 활성의 관련성을 비교한 결과, 유용성분의 함량 이 높을수록 라디칼 소거능이 높아지는 양적 상관관계를 나타내었으며, 각 추출물이 함유하고 있는 총 페놀 화합물 의 함량이 증가하면 항산화 활성도 증가한다는 Seo 등(26) 의 보고와 유사하여 높은 페놀 함량을 나타낸 물 추출물에 서 높은 항산화 활성을 보인 것으로 판단된다.
추출 용매를 달리한 모링가 잎의 아질산염 소거활성 및 체내에서 세포의 지질 및 단백질의 산화를 촉진하는 Fe2+의 chelating 효과를 조사한 결과는 Table 3과 같다. 500 mg%의 농도에서 아질산염 소거활성은 물 추출물(78.64%), 메탄올 추출물(76.59%), 에탄올 추출물(72.86%)의 순으로 물 추출 물에서 높은 활성을 보였으며 Kim 등(5)의 보고와 일치하 는 경향을 나타내었다. 이는 폴리페놀과 플라보노이드 화 합물은 종류에 따라 차이는 있으나 phenol계 유도체들이 nitroso화합물의 생성을 억제하므로(27) 용매에 따른 모링 가 잎의 소거활성의 차이는 페놀 화합물의 함량 차이에 의한 결과라 판단된다.
한편, 금속 킬레이트 효과 측정은 ferrozine이 Fe2+와 반응 하여 복합체를 형성하면 붉은색을 띠게 되는데 이 때 시료 추출물 중에 킬레이트 효과를 가진 성분이 존재하면 Fe2+-ferrozine 복합체 형성을 방해하여 발색이 저해되는 원 리를 이용하였다(28). ferrous ion chelating 효과에서는 물 추출물이 다른 용매 추출물에 비해 매우 높은 활성을 확인 하였고 그 활성은 최대 63% 이상 차이가 나타났으며, 대조 군 BHA(butylated hydroxyanisole)와 비교하였을 때 용매간 의 활성 차이가 크며 전체적으로 낮은 활성을 나타내었으나 물 추출물의 경우 단일 성분이 아닌 추출물임을 고려해 볼 때 추후 분리 및 구조 동정을 통해 체내에 생성된 ferrous ion을 효과적으로 제거시킬 수 있는 천연물로 활용이 가능 할 것으로 판단된다. 또한 Chung(29)의 보고에 따르면, 총 폴리페놀 함량과 총 플라보노이드 함량이 물 추출물에서 가장 높게 나타난 결과와 일치한다고 할 수 있다.
추출용매를 달리한 모링가 잎 추출물의 α-glucosidase, angiotensin converting enzyme(ACE) 및 HMG-CoA reductase 저해활성을 측정한 결과는 Fig. 1과 같다. 일반적으로 α-glucosidase는 소장 상피세포의 미세융모막(brush border membrane)에 존재하는 효소로서, 소장에서 음식물 중의 전분을 포도당과 같은 당으로 분해하여 흡수시킨다. α-glucosidase 저해제는 이당류의 분해효소를 가역적으로 억 제하여 탄수화물의 흡수를 지연시키는 역할을 하며, 소장 전체에 포도당이 흡수되어 식후 혈당 상승을 완만하게 한다 (30). 500 mg%의 농도에서 α-glucosidase 저해 활성을 측정 하였으며, 이때 제2형 당뇨치료제로 쓰이는 acarbose를 양 성대조군으로 하여 비교하였다. 그 결과 물 추출물이 12.49%, 에탄올 추출물이 91.27%, 메탄올 추출물이 47.43% 으로 나타났으며, 가장 높은 저해활성을 보인 에탄올 추출 물은 양성대조군인 acarbose(500 mg%)와 비슷한 저해활성 을 보였다. Xu 등(31)은 토후박 추출물에서 총 페놀 함량과 DPPH 라디칼 소거능이 높을수록 α-glucosidase의 활성이 높다고 보고하였으나 본 연구와는 상반된 경향을 나타내었 다. 따라서 본 연구에서는 모링가 잎의 에탄올 추출물이 우수한 α-glucosidase 활성 억제효과를 보였으며 향후 항당 뇨 효과를 갖는 후보물질 탐색에 활용될 수 있을 것으로 판단된다.
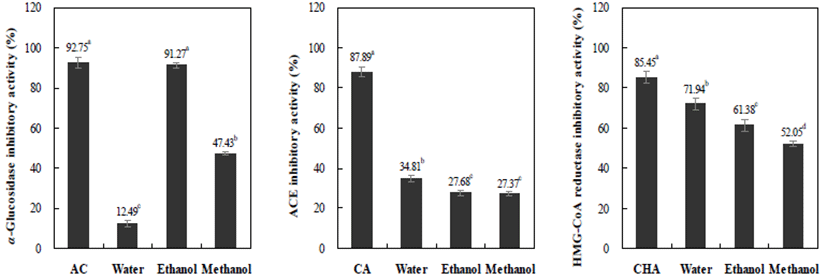
ACE(angiotensin converting enzyme)는 혈압 상승 및 유지 에중요한역할을하는효소로써, 혈관이완작용의noanpeptide 인 bradykinin을 불활성화시킴으로서 혈압을 상승시키는 작용을 한다. 따라서 ACE 활성의 억제는 혈관수축을 막고 체내 수분저류를 막아 혈압을 낮추는 효과를 나타내는 것이 다(32). ACE 저해활성은 물 추출물이 34.81%, 에탄올 추출 물 및 메탄올 추출물이 각각 27.68% 및 27.37%로 물 추출물 에서 높은 저해활성을 나타내었으며 에탄올과 메탄올 추출 물은 유의적인 차이는 없었다. ACE 저해활성은 Ahn(33)과 Kim 등(34)의 연구 보고에 따르면 식물자원의 풍부한 폴리 페놀 화합물의 작용에 의한 가능성이 높다는 보고처럼 본 연구 결과에서도 폴리페놀 함량의 결과와 유사한 결과로 나타나 ACE 저해 효과에 폴리페놀의 영향이 클 것으로 판단되며, 향후 체계적인 분석이 필요할 것으로 사료된다. 한편, 모링가 잎 추출물의 경우 대표 저해인자로 알려진 활성물질인 catechin(87.89%)만큼 저해활성을 나타내지 못 하였으나 천연 항고혈압 소재로서의 가능성을 보였으며, 특히 물 추출물이 산업적 활용에 적합할 것으로 판단된다.
HMG-CoA reductase는 콜레스테롤 생합성 단계에서 작 용하는 rate-limiting enzyme으로써 스테롤이나 이소프레노 이드계 화합물의 생합성 경로의 중간단계인 mevalonic acid 의 합성을 매개하는 역할을 한다. 따라서 HMG-CoA reductase 활성이 저하되면, LDL-receptor의 활성이 증가되 어 혈중 콜레스테롤 농도를 감소시킨다고 보고되고 있다 (35). 추출용매에 따른 모링가 잎의 HMG-CoA reductase 저해활성을 측정한 결과, 물 추출물에서 71.94%, 에탄올 추출물에서 61.38%, 메탄올 추출물에서 52.05%로 나타나 추출 용매간의 유의적 차이를 보였다. 또한, 양성 대조구인 chlorogenic acid(85.45%)의 수준에는 미치지 못하였으나, 전체적으로 높은 저해 활성을 보여 천연 저해제 후보 물질 로써의 가능성을 시사하였다. 모링가 잎에 다량 함유되어 있는 식물세포막의 구성성분인 스테롤(phytosterol) β-sitosterol의 영향으로 판단된다. β-sitosterol은 화학적 구조 는 콜레스테롤의 구조와 매우 유사하나 고지단백질 형성 억제 등에 효과가 있어 콜레스테롤 및 고지방의 의한 성인 병의 치료 및 예방효과가 있으며, 면역조절, 류마티스 관절 염 치료 등에 효과적인 물질로도 알려져 있다. Ghasi 등(36) 의 연구에 따르면 모링가 잎 추출물이 고지방식이를 한 쥐의 콜레스테롤 저하에 영향을 미쳤으며 이는 β-sitosterol 의 영향으로 보고하였다.
요 약
모링가 잎의 이용성 증대를 할 수 있는 적정 추출조건을 알아보고자 추출용매를 달리하여 추출한 후 항산화 및 생리 활성 특성을 비교하였다. 추출수율은 물(13.17%), 메탄올 (9.54%), 에탄올(7.48%)의 순으로 나타났으며, 총 폴리페놀 및 플라보노이드 함량은 물 추출물에서 각각 58.04 mg/g, 12.36 mg/g으로 다른 용매에 비해 높은 값을 보였다. 항산화 활성은 물 추출물이 에탄올, 메탄올 추출물에 비해 유의적 으로 높은 활성을 나타내었으며 특히 DPPH 및 ABTS 라디 칼 소거활성은 양성대조구인 BHT와 비교하였을 때 비슷한 경향을 보여 높은 항산화 활성을 확인하였다. α-glucosidase 저해활성은 다른 추출물에 비해 에탄올 추출물에서 가장 높은 활성을 나타내었다. 한편 ACE 및 HMG-CoA reductase 저해활성은 물 추출물에서 높은 활성을 보였으며 특히 HMG-CoA reductase 저해활성의 경우, 전체적으로 높은 저 해활성을 나타내어 콜레스테롤 개선 효과에 대한 가능성을 확인하였다. 이러한 결과를 종합해 볼 때 물 추출물이 에탄 올이나 메탄올 추출물보다는 우수한 항산화 및 생리활성 효과를 나타내어 소재 활용가치가 높고 향후 천연 항산화제 및 기능성 소재로서의 개발이 가능할 것으로 판단된다.