서 론
우리나라의 와인 시장 규모는 국산와인이 약 870억원, 수입와인이 약 1억6천6백만 달러로서 국내에서 소비되는 와인의 대부분이 수입와인에 의존하고 있다(1). 이러한 현 상은 프랑스, 스페인, 이태리를 중심으로 한 유럽의 구세계 와인과 칠레, 미국, 호주 등 신세계 와인의 치열한 각축 속에서 국산와인의 품질이나 가치가 떨어진다는 인식에 기인한 것으로 생각되고 있다(2). 따라서 국산와인은 지리 적, 기후적 특성상 양조용 포도 재배에 있어서의 불리함을 극복하고 글로벌 시장에서도 경쟁력을 갖추기 위하여 품질 향상과 이미지 개선을 위해 많은 노력과 다양한 방안을 모색해야하는 시점에 와 있다(3).
와인의 품질은 포도 품종에 많은 영향을 받는데 일반적 으로 포도는 계통에 따라 유럽종(Vitis vinifera)과 미국종 (Vitis labrusca), 아시아종(Vitis amurensis) 등으로 나눌 수 있다. 외국의 경우 양조용 포도 품종은 레드 와인의 제조를 위한 까베르네소비뇽, 메를로, 피노누아 등과 화이트 와인 의 제조를 위한 샤르도네 등 거의 모두가V. vinifera에 속하 는 품종들로 이루어져 있다(4). 국내 포도의 대부분을 차지 하는 캠벨얼리는 미국에서 개량한V. labrusca 종에 속하는 교잡종으로 내한성이 강하여 한국의 토질과 기후에 적합하 며 완숙되면 단맛과 신맛이 적당하고 미국종 특유의 풍미가 있어 생과용으로서 환영받는 품종이다(5). 그러나 캠벨얼 리는 유럽종에 비해 당도가 낮고 산도가 강하며 와인의 색과 향이 약하고 와인에서 바람직하지 못한 특유의 호취향 (fox aroma)을 가지고 있어 양조 적합성이 떨어진다. 그럼에 도 우리나라 포도 재배 면적의 70% 이상을 차지하여 국산 와인 제조 시 가장 많이 사용되는 품종이기도 하다(6,7).
와인의 품질에 영향을 미치는 다른 중요한 요소는 양조 용 효모로서Saccharomyces cerevisiae에 속하는 우수한 배 양 효모를 스타터로 사용하여 와인 제조를 하는 것이 일반 적이다. 그러나 포도재배와 와인의 양조에 오랜 전통을 지 닌 유럽의 프랑스나 스페인 등에서는 배양 효모에 의한 발효는 품질 단순화로 이어진다고 생각하여 현재도 자연발 효에 의한 양조가 행해지고 있는 곳이 많다(8). 자연발효에 의해 제조된 와인은 야생 효모에서 유래된 고급 알코올 함량이 많아 순수배양 효모를 첨가하여 발효시킨 와인보다 도 강렬하다고 알려져 있다(8). 우리나라의 야생효모 또는 자연발효에 의한 와인의 발효 연구로서 Hong 등(9)은 자연 발효 중인 캠벨얼리로부터 분리한 Hanseniaspora uvarum 과 S. cerevisiae에 의한 발효특성을 비교 분석하였고 Kim 등(10)은 안성지역 거봉 포도로부터 분리한 야생효모를 이 용하여 국내산 캠벨얼리와 거봉포도를 발효하여 레드와인 를 제조한 후 그 특성을 보고한 바 있다. 그러나 아직까지도 우리나라 야생효모 또는 자연발효를 이용한 와인 품질 향상 에 관한 연구는 많이 부족한 실정이다.
따라서 캠벨얼리 포도를 자연 발효시킨 와인의 품질 특 성을 조사하고 아황산 처리가 자연발효 캠벨얼리 와인의 발효에 미치는 영향을 알아보고자 캠벨얼리 포도를 아황산 처리구와 무처리구로 나누어 자연 발효를 진행하면서 효모 의 천이상태를 알아보고 발효가 끝난 와인의 이화학적 성질 을 조사하였다.
재료 및 방법
원료 포도인 캠벨얼리를 제경 파쇄하여 최종 농도 200 mg/L가 되도록 potassium metabisulfite(K2S2O5)를 첨가한 아황산 처리구와 첨가하지 않은 무처리구로 나누어 20 L 발효 용기에 5 kg씩을 담은 후 당도를 24°Brix로 조정하였 다. 여기에 배양효모를 첨가하지 않고 20℃로 온도가 조절 되는 발효실에서 발효를 진행하였고 가용성 고형분이 거의 소비되어 일정하게 유지되는 시점에서 발효를 종료하였다.
알코올 발효가 진행 중인 술덧에 멸균수를 가하여 단계 희석액을 만들고 각 희석 시험용액 100 μL를 취하여 YPD(1% yeast extract, 2% peptone, 2% glucose, 2% agar) 배지에 도말한 후 30℃에서 48시간 배양하였다. 형성된 단 일 colony의 형태를 관찰하여 효모로 판단되는 균주를 무작 위로 12개씩을 분리하여 30% glycerol 용액과 1:1로 혼합하 여–70℃에 보존하면서 실험에 사용하였다.
효모 genomic DNA의 분리는 Walsh 등(11)의 방법에 따 라 5% Chelex 100(C7901-25G, Sigma-Aldrich, St. Louis, MO, USA)를 사용하여 행하였다. YPD 액체배지에 효모를 접종한 후 30℃에서 48시간 진탕 배양한 배양액 1 mL를 취하여 소형 원심 분리기에서 13,000×g로 5분간 원심분리 하여 균체를 집균하였다. 여기에 0.1 M Tris-Cl(pH8.0)-0.05 M EDTA-5% Chelex 200 μL를 첨가한 후 잘 혼합하였다. 이 혼합액을 heating block에서 10분간 반응 후 10분간 식히 기를 2회 반복한 다음 10분간 13,000×g로 원심분리하여 얻은 상징액을 효모 genomic DNA로 사용하였다.
효모 genomic DNA의 PCR 반응을 위한 primer(12)는 효 모 internal transcribed spacer(ITS)영역의 universal primer인 ITS1(5` -CATTTAGAGGAACTAAAAGTCG-3`)과 ITS4(5`-CCTCCGCTTATTGAT- ATGC-3`)를 SolGent 사 (Daejeon, Korea)에 의뢰하여 합성하였다. PCR 반응의 조건 은 94℃에서 3분간 1회 반응 후, 94℃에서 45초, 55℃에서 1분, 72℃에서 1분간 반응을 1 cycle로 35회 반복하고 72℃ 에서 10분간 1회 반응 후 종결하였다. PCR machine은 Tpersnal 48(Biometra, Göttingen, Germany)을 사용하였다. PCR-RFLP를 통한 균주의 동정을 위하여 PCR 산물을 Hae Ⅲ와 HinfⅠ제한효소로 처리한 다음 전기영동하여 생성되 는 band 패턴의 차이를 확인하였다(12,13).
DNA 단편의 확인은 1.5% agarose gel과 0.5×Trisborate- EDTA(TBE) 완충액을 사용하여 100 V의 전압으로 전기영동한 후 0.5 mg/mL 농도의 Ethidium bromide(EtBr) 용액에 10분간 발색시키고 UV transilluminator(TFX-20M, Viber Lourmat, Paris, France)로 전기영동상을 관찰하였다 (14). DNA 단편의 크기 측정을 위한 size marker로는 100 bp+ DNA ladder(SDL41-B500, Solgent, Daejeon, Korea)를 사용하였다.
발효 특성은 와인을 13,000×g에서 10분간 원심분리 (Supra22K, Hanil Science Industrial Co., Incheon, Korea)하 여 얻은 상징액을 사용하여 분석하였다. 가용성 고형분의 함량은 상징액을 당도계(RA250, ATAGO, Tokyo, Japan)로 측정하였다. 알코올의 함량은 상징액 100 mL를 메스플라 스크에 취하여 증류 플라스크로 옮긴 후 메스플라스크를 15 mL의 증류수로 2회 세척하여 세척액과 합친 뒤 증류하 여 70 mL의 증류액을 받아 100 mL로 정용한 다음 주정계로 측정한 값을 Gay Lussac 표를 이용해 보정하여 환산하였다 (15). pH는 pH meter(DL22 F&B, Mettler Toledo, Schwerzenbach, Switzerland)로 측정하였으며 총산 함량은 상징액 10 mL를 0.1 N NaOH 표준용액으로 pH 6.8이 될 때까지 적정한 다음 malic acid로 환산하였다(15). 총 페놀성 화합물 함량은 Folin-Denis법(16)에 따라 측정하였다. 상징 액 2 mL에 50% phenol reagent(Folin-Ciocalteu's reagent) 2 mL를 첨가하여 실온에서 3분간 방치한 뒤, 10% Na2CO3 용액 2 mL를 첨가하였다. 그런 다음 실온에서 1시간 방치한 후 UV-visible Spectrometer로 700 nm에서 흡광도를 측정하 여 tannic acid 표준곡선으로부터 총 페놀성 화합물 함량을 환산하였다. 효모 생균수의 측정은 시료를 적당하게 희석 한 후 plate 당 50~200개의 콜로니가 형성될 수 있도록 YPD 고체배지에 도말한 다음 30℃에서 배양한 후 형성된 콜로니 수를 직접 계수하여 log CFU/mL로 환산하였다.
유기산의 함량은 시료를 메탄올과 증류수로 활성화시킨 Sep-pack(Sep-pack plus C18 cartridge, Waters, Milford, MA, USA)과 0.45 μm membrane filter로 여과한 후 UV Detector 가 부착된 HPLC(1260 Infinity, Agilent Technologies, Santa Clara, CA, USA)를 사용하여 정량하였다(17). Column은 PL Hi-Plex H(Φ;7.7×300 mm, Agilent Technologies)을 사용 하였고 column 온도는 65℃, mobile phase는 0.005 M sulfuric acid를 사용하여 0.6 mL/min의 flow rate로 분석하였 다. 각 peak의 동정은 표준품의 retention time과 비교하였으 며 peak의 면적으로 함량을 계산하였다.
알데히드, 에스테르 및 메탄올, 퓨젤유의 함량은 시료를 증류한 다음 증류액을 0.45 μm membrane filter로 여과한 뒤 FID detector가 부착된 GC(6890N, Agilent Technologies) 를 사용하여 정량하였다. Column으로는 HP-FFAP(Φ0.25 mm×30 m, Agilent Technologies) column을 사용하였으며 column 온도는 60℃(4 min) → 210℃(6℃/min) → 210℃(2 min), injector 온도는 250℃으로 설정하였다. Carrier gas는 H2를 사용하였으며 split ratio는 100:1, detector 온도는 28 0℃로 분석하였다. 각 peak의 동정은 표준품의 retention time과 비교하였고 peak의 면적으로부터 함량을 계산하였 다(8).
와인의 관능검사는 경북대학교 식품공학과 학생 중 관심 이 있는 관능요원 10명을 선정하여 본 연구에 관한 설명과 관능검사의 평가기준을 숙지시킨 후 색, 향, 맛 및 전반적인 기호도의 항목에 관하여 5점 척도법으로 실행하였다(18). 이때 관능 평점은 5, 매우 좋다(very good); 4, 좋다(good); 3, 보통이다(fair); 2, 나쁘다(bad); 1, 매우 나쁘다(very bad) 로 정하여 평가하였다.
모든 데이터는 독립적으로 3회 이상 반복 실시하여 실험 결과를 평균±표준편차로 나타내었다. 실험군간의 유의성 을 검정하기 위하여 SPSS Ver. 22.0(SPSS Inc., Chicago, IL, USA)으로 t-test를 실시하고 유의성이 있는 경우 최소유 의차 검정을 실시하였다(19).
결과 및 고찰
아황산 무처리구와 처리구의 캠벨얼리 자연발효 중 알코 올 함량과 가용성 고형분의 변화를 조사한 결과는 Fig. 1과 같다. 가용성 고형분의 함량은 발효가 진행됨에 따라 아황 산 무처리구가 처리구에 비해 더욱 빠르게 감소되었다. 알 코올의 함량은 가용성 고형분의 감소와 반비례하여 아황산 무처리구에서는 발효 3일 후, 아황산 처리구에서는 5일후 부터 증가하여 아황산 무처리구에서 알코올의 생성시기가 빨랐다. 그러나 알코올의 농도가 급격하게 증가되는 시기 의 증가량의 정도는 아황산 처리와 관계없이 발효 후 5~7일 에 거의 유사하게 나타났다. 또한 발효 종료 후 알코올의 함량 역시 아황산 무처리구의 경우 11.9%(v/v), 아황산 처리 구의 경우 12.0%(v/v)로 두 구에서 거의 유사하였다. 발효 종료시점인 12일 후 굴절당도계로 측정한 가용성 고형분의 양 역시 아황산 무처리구의 경우 6.7, 아황산 처리구의 경우 6.6으로서 거의 유사하였다.
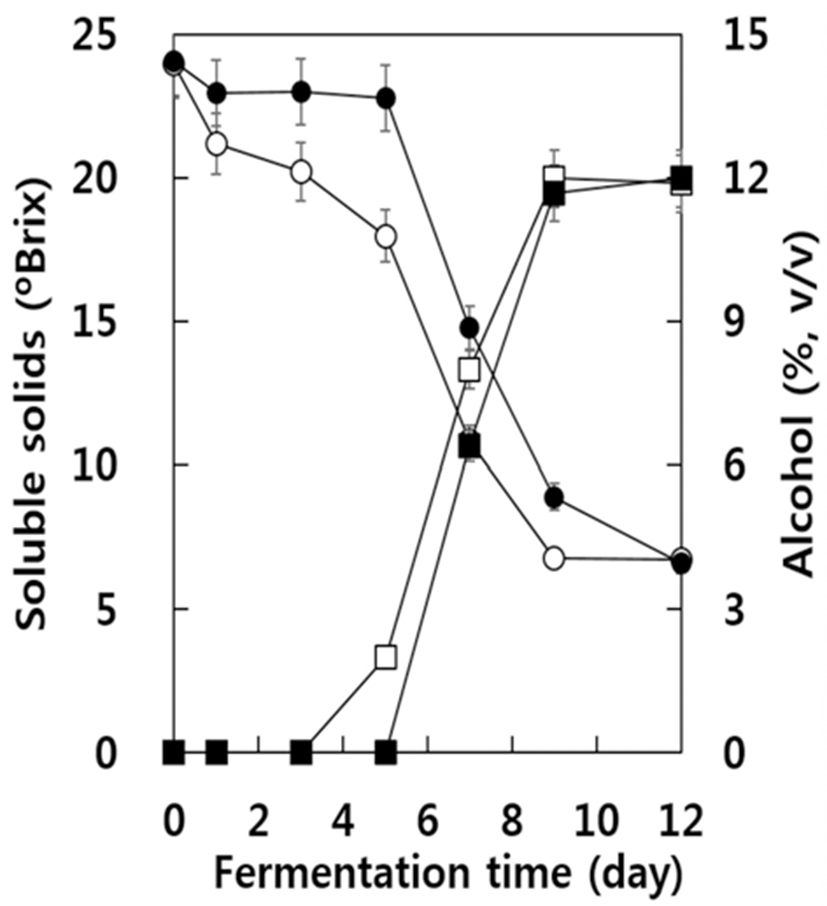
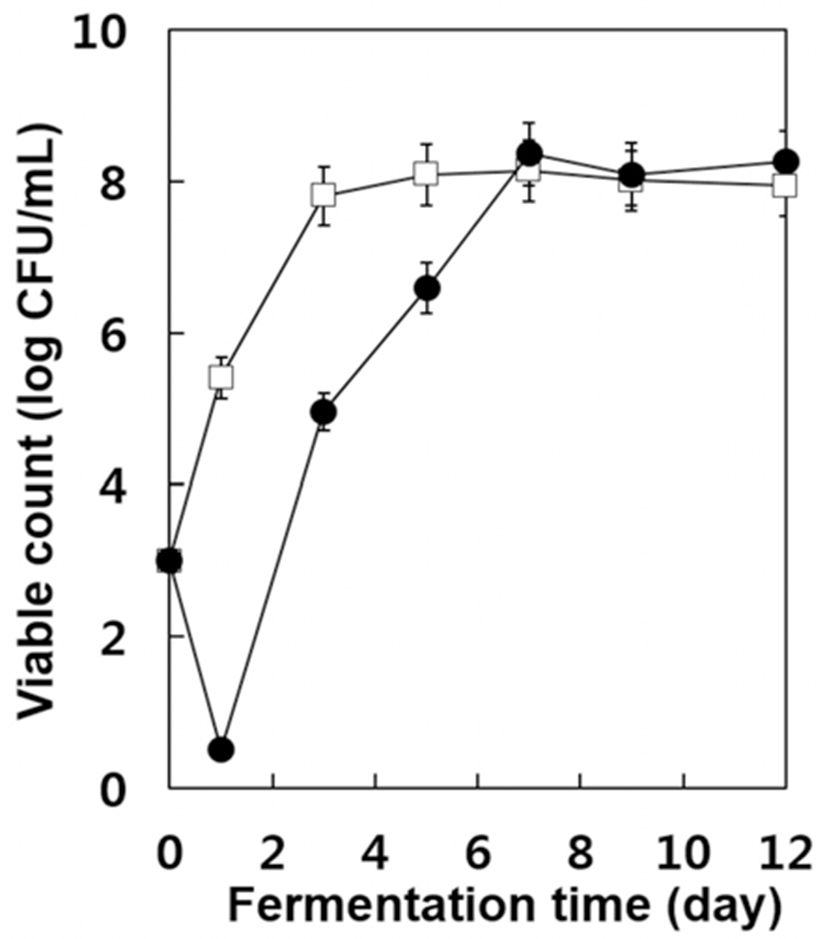
발효 초기 아황산 무처리구의 경우 아황산 처리구에서 보다 가용성 고형분의 함량이 빨리 감소하는 한편 알코올이 빨리 증가되는 현상을 알아보기 위하여 효모 생균수를 조사 한 결과는 Fig. 2와 같다. 아황산 무처리구의 경우 초기의 효모 농도 약 103 CFU/mL에서 급격히 효모 생균수가 증가 하여 발효 3일 후에는 약 108 CFU/mL에 도달하였으며 이후 거의 유사한 수준을 나타내었다. 그러나 아황산 처리구에 서는 발효 1일 후에는 효모 생균수가 0.5 log 단위까지 감소 하였다가 이후부터 급격히 증가하였으며 발효 7일 후에는 아황산 무처리구의 경우보다 약간 높은 수준의 108 CFU/mL에 도달하여 발효 종료 시까지 약간 높은 수준을 유지하였다. 이러한 현상은 자연발효 중 포도 머스트에 존 재하는 효모들 중 아황산에 내성이 약한 효모들의 수가 감소하였으며 그 이후 아황산 내성 효모들이 증식하였기 때문으로 추정된다. 따라서 아황산 처리구에서 알코올 생 성이 늦어지는 현상은 발효초기 효모수가 감소하여(Fig. 2) 가용성 고형분의 소비 및 알코올 발효가 지연되었기 때문으로 추정된다.
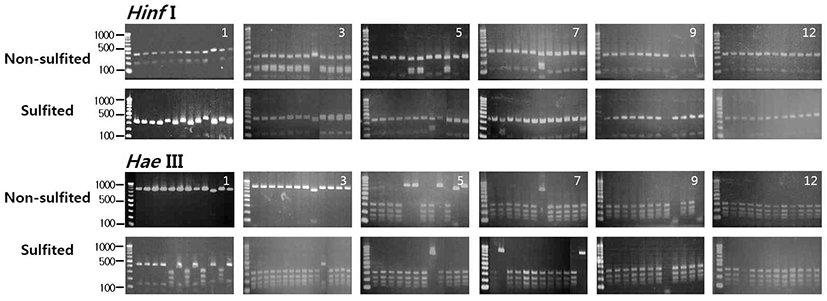
캠벨얼리 포도를 아황산 처리구와 무처리구로 나누어 발효 과정 중에 분리한 효모의 PCR-RFLP 패턴을 조사한 결과는 Fig. 3과 같다. 아황산 무처리구의 경우 발효 초기에 분리된 효모는 대부분이 745 bp의 HaeIII 단편과 330, 180, 150 bp의HinfI 단편을 가진H. uvarum으로 나타났다. 발효 가 진행되면서 5일 후부터H. uvarum이 점차 사라지고 320, 225, 180, 145 bp의HaeIII 단편과 360, 350, 120 bp의 HinfI 단편을 가진 S. cerevisiae가 급격히 증가하여 발효 종료 시점까지 우점종으로 나타났다. 일반적으로 포도의 껍질에 는 곰팡이, 박테리아, 그리고 효모 등 여러 가지 미생물이 존재하는데 주된 알코올 발효를 담당하는 S. cerevisiae를 제외한 여러 가지 다른 효모들은 포도 머스트의 발효과정에 서 복잡한 작용을 하며 발효 초기에는 발효력이 약한 H. uvarum과Candida sp.가 흔히 발견된다. 하지만 이러한 효 모들은 알코올에 대한 저항성이 떨어지기 때문에 발효가 시작되고 2~3일이 지나 알코올 5~6%이상이 되면 빠르게 사라지는 것으로 알려져 있다(8,21,22). 이에 비해 아황산 처리구는 발효 1일 후부터 비록 효모 생균수는 적었지만 (Fig. 2) H. uvarum과 S. cerevisiae가 함께 발견되었으며 3일 후부터는 S. cerevisiae가 우점종이 되었으며 아황산 무처리구에 비해 아황산 처리구에서S. cerevisiae가 빠르게 증가하는 것을 알 수 있었다.
캠벨얼리 와인의 일반성분 함량은 Table 1과 같다. 아황 산 무처리구의 경우 pH는 3.61, 총산 함량은 0.66%, 총 페놀 화합물의 함량은 0.68 mg/mL로 나타났으며 아황산 처리구 의 경우 pH는 3.53, 총산 함량은 0.74%, 총 페놀화합물의 함량은 0.92 mg/mL로 나타나 pH는 다소 낮았으나 총산과 총 페놀화합물의 함량이 다소 높았다. 일반적으로 레드 와 인은 흡광도 520 nm와 420 nm에서 극대 흡수치와 극소 흡수치를 나타낸다(23). 흡광도 420/520 nm로 표시되는 hue 값은 와인의 갈변정도나 와인의 광택, 윤기와 관계가 있는 것으로 알려져 있는데(24) 아황산 무처리구의 경우 1.39, 아황산 처리구의 경우 1.43으로 아황산 처리구에서 다소 높은 값을 나타내었다. 레드 와인의 intensity 값은 갈변이 진행될수록 증가하는 경향을 보이는 것으로 알려져 있는데 (25) 본 연구에서 제조한 와인은 아황산 무처리의 경우 1.56, 아황산 처리구의 경우 1.96으로서 다소 높게 나타났다. 포 도주 제조에 있어서 아황산의 효과는 매우 잘 알려져 있다. 아황산은 항균성을 가지고 있어 바람직하지 못한 미생물을 억제하는 한편 항산화 활성을 가지고 있어 산화취의 생성을 방지하고 색소를 안정화한다(26). 또한 아황산은 발효 중 포도 머스트에 존재하는 물질들의 추출에도 효과가 있는 것으로 알려져 있다(26). 아황산의 처리구에서 총산 및 총 페놀화합물의 함량 과 hue 및 intensity 값들이 아황산 무처 리구보다 높게 나타난 것은 아황산의 이러한 작용들에 의한 것으로 추정된다.
| Item | Non-sulfited | Sulfited |
|---|---|---|
| pH | 3.61±0.02 | 3.53±0.02 |
| Total acid (%, malic acid) | 0.66±0.04 | 0.74±0.05 |
| Total phenol (mg/mL) | 0.68±0.05 | 0.92±0.07 |
| Hue | 1.39±0.12 | 1.43±0.14 |
| Intensity | 1.56±0.17 | 1.96±0.18 |
발효 종료 후 여과하여 얻은 와인의 유기산 함량을 조사 한 결과는 Table 2와 같다. 일반적으로 캠벨얼리 와인에는 약 2.4 mg/mL의 사과산과 약 3.0 mg/mL의 주석산이 함유되 어 있다(8,9). 자연발효에 의해 제조한 와인에서는 사과산, 주석산 및 호박산들이 검출되었으며 구연산과 젖산 등은 검출되지 않았다. 사과산의 함량은 아황산 처리구의 경우 2.98 mg/mL 아황산 무처리구의 경우 2.61 mg/mL의 함량을 나타내었으며 주석산의 함량은 아황산 처리구의 경우 1.41 mg/mL 아황산 무처리구의 경우 1.09 mg/mL로 낮게 검출되 었다. 와인 유기산의 대부분을 차지하는 이 두 유기산의 함량은 아황산 무처리구에 비하여 아황산 처리구에서 다소 높게 나타났다. 호박산은 효모가 생성하는 산으로 아황산 처리구의 경우 1.34 mg/mL, 무처리구의 경우 1.38 mg/mL로 거의 유사한 함량을 나타내었다. Kim 등(27)에 의하면 캠벨 얼리 포도 과즙의 유기산 조성으로서 사과산이 약 3.87 mg/mL, 주석산이 2.56 mg/mL, 구연산이 0.32 mg/mL의 순 으로 함유되어 있다. 또한 이를 원료로 발효한 와인의 경우 스타터로 사용한 와인 효모 균주에 따라 사과산이 0.11~0.17 mg/mL, 주석산이 0.04~0.05 mg/mL, 구연산이 0.07~0.13 mg/mL 등으로 유기산의 조성 및 함량이 크게 달라진다고 보고한 바 있다. 따라서 본 연구의 결과 유기산 의 조성이 Kim 등(27)의 연구결과와 매우 상이하게 나타난 것은 자연발효 시 아황산 첨가 유무에 따라 미생물의 분포 가 크게 달라진 것 때문으로 추정된다. 와인에서의 유기산 함량은 원료 포도의 숙성 정도에 따라 달라지기도 하고 와인효모의 종류 및 발효 조건에 따라 달라진다(26). 유기산 은 와인의 신맛에 영향을 주는 산으로서 주로 사과산, 주석 산, 젖산 및 초산이 관여하는 것으로 알려져 있다. 호박산과 구연산 등의 다른 유기산들 또한 와인에서 검출되기도 하지 만 와인의 신맛에 영향을 줄 만큼 충분한 양이 검출되는 경우는 드물다고 알려져 있다(28).
| Organic acid (mg/mL) | Non-sulfited | Sulfited |
|---|---|---|
| Malic acid | 2.61±0.51 | 2.98±0.49 |
| Tartaric acid | 1.09±0.20 | 1.41±0.23 |
| Succinic acid | 1.38±0.19 | 1.34±0.18 |
| Citric acid | ND | ND |
| Lactic acid | Tr | ND |
발효 후 와인의 메탄올 및 고급알코올의 함량을 조사한 결과는 Table 3과 같다. 과실 주스 및 와인의 경우 메탄올은 펙틴의 분해에 의해 주로 생성되며 에탄올과 맛과 향, 색깔 이 비슷하지만 인체에 흡수되면 포름알데히드 및 포름산으 로 변하여 치명적인 독성을 나타내는 성분으로서(26) 과실 주에서의 허용 기준치는 1,000 mg/L로 식품 공전에 명시되 어있다(29). 캠벨얼리 와인의 메탄올 함량은 식품공전에 명시된 허용 기준치보다 모두 낮았으며 아황산 처리구의 경우 187.3 mg/L로서 아황산 무처리구(203.6 mg/L)보다 다 소 낮게 나타났다. 국제적으로 소비자 건강에 문제가 없다 고 생각되는 와인의 메탄올 허용치는 화이트 와인의 경우 150 mg/L, 레드 와인의 경우 300 mg/L 이하로 보고된 바 있다(30). 일반적으로 와인의 메탄올 함량은 이보다 낮게 나타나지만 특정 경우에는 이보다 높은 농도를 가진 와인이 보고되기도 한다(31,32).
| Alcohol (mg/L) | Non-sulfited | Sulfited |
|---|---|---|
| Methanol | 203.6±39.7 | 187.3±35.2 |
| n-Propanol | 60.3±11.3 | 53.9±10.3 |
| iso-Butanol | 91.9±13.2 | 89.3±12.1 |
| iso-Amyl alcohol | 291.5±40.2 | 359.8±43.2 |
고급 알코올은 효모에 의한 알코올 발효의 부산물로서 주로 효모가 생성하거나 아미노산의 분해로 생성되는데 와인에 함유된 고급 알코올의 함량은 와인 품질에 큰 영향 을 미치는 것으로 알려져 있다(26,33). 주요 고급 알코올로 는 이소아밀알코올, 이소부탄올 및 프로판올 등으로 이들 각각의 성분은 매우 독특한 냄새와 휘발성을 가지고 있다. 와인과 같이 알코올 농도가 낮은 알코올성 음료에는 flavor 나 body에 결정적인 영향을 미치는 중요한 구성성분으로 유기산과 다양한 에스테르를 형성하여 와인의 숙성된 향에 기여하지만 숙취의 원인이 되는 물질로 알려져 있다(26). 고급 알코올을 이루는 대표적인 성분의 하나인 이소아밀알 코올의 함량은 아황산 처리구에서 359.8 mg/L로서 높게 나타났으며 이소부탄올 함량은 아황산 무처리구(91.9 mg/L)와 처리구(89.3 mg/L) 모두 유사하였으나 프로판올 함량은 아황산 무처리구에서 60.3 mg/L로 다소 높게 나타 났다. 와인의 고급 알코올 함량은 원료 포도의 품종 및 재배 지역뿐만 아니라 와인 발효에 관여하는 효모의 종류에 따라 서도 달라질 수도 있다(34). 이러한 결과는 원료 포도의 품종, 재배지역, 야생효모의 종류 및 스타터로 사용하는 와인효모의 균주 차이에 따라서 매우 다양한 와인이 제조될 수 있음을 뒷받침하고 있다. 시판 와인효모 S. cerevisiae W-3와 우리나라 토착형 와인효모를 스타터로 첨가하여 제 조한 캠벨얼리 와인의 고급알코올의 함량은 이소아밀알코 올이 580~623 mg/mL, 이소부탄올이 93~124 mg/L, 프로판 올이 50~59 mg/L 범위에 있다고 보고된 바 있다(35). 이에 비하여 본 연구에서 제조한 캠벨얼리 와인의 경우 이소부탄 올과 프로판올의 함량은 거의 유사하였으나 이소아밀알코 올의 함량은 약 60% 수준으로 낮게 나타났다.
자연발효 캠벨얼리 와인의 아세트알데히드 함량(Fig. 4) 은 식품공전상의 기준치(29)인 700 mg/L보다는 매우 낮은 수준이었으나 아황산 무처리구 경우 129.8 mg/L, 아황산 처리구의 경우 161.5 mg/L으로 아황산 처리구에서 다소 높게 나타났다. 아세트알데히드는 와인에 존재하는 알데히 드 중 90%를 차지하며 간 독성, 발암성 등 사람의 건강에 나쁜 영향을 미치는 것으로서 우리나라 식품공전에서 그 기준치를 정하여 관리하고 있다(29). 아세트알데히드는 와 인의 종류에 따라서 다른 화합물과 결합하여 향을 좋게 하는 경우도 있으나 대부분의 와인에 있어서 자극적인 나쁜 냄새를 내고 와인의 향에 나쁜 영향을 미친다(26). 일반적으 로 와인의 아세트알데히드는 발효 중 미생물에 의해 생성되 며 레드와인의 경우 종류에 따라 4~212 mg/L를 함유하고 있다(36). 스타터를 첨가하여 제조한 우리나라 캠벨얼리 와인의 경우 그 함량이 약 24~30 mg/L로 보고된 바 있다 (35). 자연발효로 제조한 캠벨얼리 와인의 아세트알데히드 함량은 이보다 약 5배 이상으로 나타났는데 이는 자연발효 시 다양한 미생물들이 발효에 관여하게 되어 이들이 아세트 알데히드의 생성에 관련이 있을 것으로 생각된다.
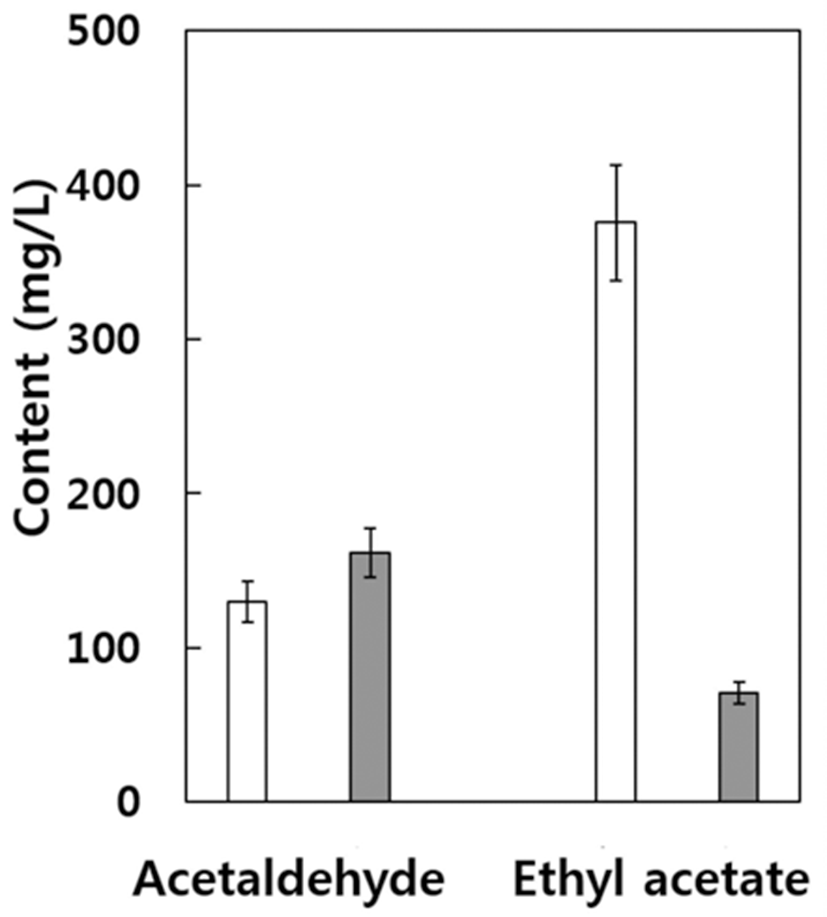
일반적으로 와인에 존재하는 에스테르 종류는 160종 이 상이 동정된 바 있으며 과일향의 대표적인 성분으로서 대부 분 원료 포도 자체에서 유래하거나 알코올 발효 중 생성되 는 것으로 알려져 있다(26). 에틸아세테이트의 함량은 아황 산 무처리구의 경우 375.5 mg/L로서 아황산 처리구의 70.5 mg/L보다 약 5.3배의 높은 함량을 나타내었다. 와인에 함유 되어있는 대부분의 에스테르는 극미량으로 존재하거나 휘 발성이 낮거나 또는 향의 정도가 낮아 와인의 향에 있어서 무시되기도 하지만 어떤 에스테르의 경우에는 와인의 향에 영향을 미칠 수 있는 농도 이상으로 자주 검출되기도 한다 (26). 아황산 무처리 캠벨얼리 와인에서 많은 양의 에틸아세 테이트가 검출되었는데 이는 Fig. 3에서 본 바와 같이 아황 산 무처리의 경우 발효초기에 다양한 야생효모가 관여하여 에스테르의 생성이 증가한 때문으로 추정된다(34).
캠벨얼리 와인의 아황산 처리구와 무처리구에 따른 관능 검사 결과는 Table 4와 같다. 색에서는 아황산 처리구가 3.86로 더 높은 점수를 얻었으며 이는 아황산의 항산화 효과 로서 와인의 색이 안정화되었기 때문으로 추정된다. 그러 나 향에서는 발효초기 H. uvarum이 우점종이 되어 발효를 주도한 아황산 무처리구가 3.82로서 아황산 처리구 3.27보 다 더 높은 점수를 얻었다. 맛에서는 아황산 무처리구와 처리구의 차이가 크지 않았으나 전반적인 기호도는 아황산 무처리구가 아황산 처리구보다 높은 점수를 얻었다. 국산 와인에 대한 소비자의 선호분석 결과에 따르면 전체 응답자 의 오직 21.7%가 국산 와인을 선호하였으며 응답자의 40.3%가 맛, 그 다음으로 20.4%가 향을 국산 와인의 보완점 으로 지적한 바 있다(37). 따라서 아황산 무처리가 와인의 맛에는 큰 차이가 없었으나 향과 전반적인 기호도에서 높은 점수를 얻어 발효 초기 야생효모의 증식이 국산 와인의 품질에 긍정적인 영향을 미칠 수 있을 것으로 생각된다. 캠벨얼리 와인의 초기발효에 관여하는H. uvarum을 스타터 로 사용하여 제조한 캠벨얼리 와인의 특성에 관한 연구로는 Hong 등(9)의 보고가 있다. 포도로부터 분리한H. uvarum을 배양한 후 그 균체를 첨가하여 캠벨얼리 와인을 발효한 경우 S. cerevisiae W-3를 스타터로 첨가한 경우에 비하여 발효가 다소 지연되기는 했으나 8일 후에는 최종 알코올 농도가 거의 유사한 수준에 도달하였다. 그러나 와인의 유 기산 조성, 아세트알데히드와 메탄올 및 고급알코올의 함 량 등이 서로 상이하게 나타났으며 관능평가 결과 맛과 향 등에서 더욱 우수한 결과를 얻은 바 있다(9). 그러나 아황산을 첨가하지 않고 자연발효한 경우 다양한 미생물들 이 초기발효에 관여하게 되고 어떤 종들은 와인의 품질에 긍정적인 영향을 미치기도 하지만 어떤 종들은 부정적인 영향을 미칠 수 있으므로 이들을 제어할 수 있는 방법들이 강구되어야 하겠다.
| Sulfiting | Sensory quality | |||
|---|---|---|---|---|
| Color | Flavor | Taste | Overall preference | |
| Non-sulfited | 3.86±0.56 | 3.27±0.36 | 2.55±0.25 | 3.18±0.45 |
| Sulfited | 3.73±0.45 | 3.82±0.45 | 2.55±0.32 | 3.55±0.28 |
요 약
국산 캠벨얼리 포도의 자연발효 특성을 알아보는 한편 아황산 처리가 캠벨얼리 와인의 자연발효에 미치는 영향을 조사하였다. 발효 중 가용성 고형분의 함량은 아황산 처리 구보다 아황산 무처리구에서 더욱 빠르게 감소하면서 알코 올의 함량이 빨리 증가하였다. 그러나 발효 종료 후 알코올 의 함량은 모두 유사한 수준으로 나타났다. 효모 생균수는 아황산 무처리구에서 빨리 증가하였으며 아황산 처리구에 서는 발효 1일 후 오히려 생균수가 감소하다가 그 이후 급격히 증가하여 발효 7일 후부터는 더욱 높은 수준을 나타 내었다. 임의로 분리한 효모의 PCR-RFLP 분석 결과 아황산 무처리구는 4일 후부터 S. cerevisiae가 나타나 5일 후부터 S. cerevisiae가 우점종으로 작용하였으나 아황산 처리구는 발효 1일 후부터H. uvarum과S. cerevisiae가 함께 발견되었 으며 발효 3일 후부터S. cerevisiae가 우점종으로 나타났다. 발효 후 여과한 와인의 유기산으로는 사과산, 주석산, 호박 산들이 검출되었는데 아황산 처리구에서 사과산과 주석산 함량이 다소 높게 나타났다. 메탄올, 아세트알데히드, 프로 판올의 함량은 아황산 처리구에서 다소 높았으나 이소아밀 알코올 함량은 낮았다. 아황산 무처리구의 경우 에틸아세 테이트 함량은 375.5 mg/L로서 아황산 처리구보다 약 5.3배 로 높았으며 와인의 향과 전반적인 기호도 면에서 높은 점수를 얻었다.