서 론
염증은 생명체의 생로병사의 과정에서 중요한 병리적 요소로 작용하며, 급성 염증은 화학적 혹은 물리적 자극 등에 대항하는 인체의 방어 기전이며, 조직이나 장기의 손 상을 회복시키는 기전으로서 중요한 역할을 담당하고 있 다. 염증이 유발되는 과정은 그 자체로는 질병으로 취급받 지 않지만, 장기간 지속 할 경우 다른 질환을 유발하는 원인으로 작용하기도 한다(1). 또한, 세포 및 자극의 종류에 따라 PG(prostaglandin), LT(lekotrine) 등이 생성됨으로써 시작된다(2). 대식세포는 대표적인 면역세포로써(3), 동물 체내 모든 조직에서 분포하며, 세균이나 이물질을 탐식 제 거하는 과정에서 IL-1β(Interleukin 1-β), IL-6(interleukin-6), TNF- α(tumor necrosis factor- α)등의 염증 매개 물질들을 분비하여 초기 염증 반응에 주요 역할을 담당한다(4,5). 또 한, iNOS(inducible nitric oxide synthase)와COX-2(cyclooxygenase 2)의 발현을 유도하여 NO(nitric oxide) 및 PGE2(prostaglandin E2) 와 같은 염증성 인자가 생성됨으로써 염증반응이 매개 된다(6,7). 구체적으로 살펴보면, NO는 체내 방어기능, 신 호전달기능, 신경독성, 혈관 확장 등의 다양한 생리기능을 가지고 있으며, 3종류의 NOS(nitric oxide synthase), nNOS(neuronal nitric oxide synthase), eNOS(endoterial nitric oxide synthase), iNOS(inducible nitric oxide synthase) 에 의 해 합성된다. 이들 NOS 중 iNOS에 의한 NO생성이 절대적 으로 많으며 이는 병리적으로 중요한 작용을 한다(8). 과도 한 NO생성은 염증반응을 촉진시킬 뿐만 아니라 염증매개 체의 생합성을 촉진하고 염증을 심화시켜 조직의 손상, 유 전자 변이 및 신경손상 등을 일으킨다(9,10).
최근 사회가 발전함에 따라 사람들의 건강에 대한 관심 도가 급증하면서 피부 트러블을 보완 할 수 있는 천연 항염 증 소재에 대한 관심이 증대되고 있으나 아직 다양한 천연 소재들이 개발되어 있지 않다(11). 이에 본 논문에서는 마디 풀과의 여러해살이풀(Polygonum multiflorum)의 덩이뿌리 로 간을 보하고 신의 기능을 더하여 혈을 보하여 풍사를 제거하는 효능이 있고 간양이 성하여 생긴 풍증, 머리가 희어지는 현상, 어지러운 혈이 허하여 어지러운 증상, 허리 와 무릎에 힘이 없음 등을 치료하는 데에 활용 되고 있는 (12-14) 적하수오(Polygonum multiflorum)의 추출방법에 따 른 염증 억제 효과를 실험을 통하여 증명하고, 피부 트러블 을 완화하는 천연 항염증 소재 개발을 위해 본 논문을 활용하고자 한다.
재료 및 방법
본 실험에 사용한 적하수오(Polygonum multiflorum)는 한 약재 시장에서 구매하여 사용하였다. 적하수오 열수 추출 물(PMW)의 경우 85 ℃에서 9시간 환류 냉각 추출을 3회 반복 하였고, 적하수오 70% ethanol 추출물(PME)의 경우 12시간 동안 침지 추출한 후 여과지(Whatman No. 1)로 3회 반복 여과하였다. 농축 후 동결 건조한 결과 PMW의 경우 35%의 수율을 나타내었으며, PME는 25%의 수율을 확인할 수 있었으며 냉장실에 보관하면서 본 실험의 시료로 사용하 였다.
세포 배양액인 dulbeco's modified eagle medium (DMEM), fetal bovine serum(FBS), streptomycin penicillin 등의 세포배양용 시약들은 invitrogen사(Carlsbad, CA, USA)에서 구입하였다. 실험에 사용된 시약 중 sodium dodesyl sul-fate(SDS), acrylamide, bisacrylamide는 Bio-rad 사(Hercules, CA, USA)에서 구입하였고, protease inhibitor, RIPA buffer, griess reagent 등은 Sigma Chemical CO.(St. Louis, MO, USA)에서 구입하였다. 실험에 사용된 1차 항체 에는 iNOS BD bioscience(Sanjose, CA, USA)와 COX-2 cayman(Ann arbor, MI USA), Glyceraldehyde 3-phosphate dehydrogenase(GAPDH)와 2차 항체인 anti-rabbit Ig-G horseradish peroxidase(HRP), bovine anti-goat IgG horseradish peroxidas(HRP) Santa Cruz사(CA, USA)에서 구입하였다. PGE2, TNF-α,IL-6,IL-1β측정을 위한 ELISA kit는 R&D systems Inc.(Minneapolis, MN, USA)에서 구입하였다.
RAW 264.7 macrophages cell 배양은 DMEM 배지에 불 활성화시킨 FBS를 10% 첨가하고 penicillin-streptomycin 100 units/mL 첨가 한 것을 사용하였다. 세포는 10∼12번의 계대 배양을 통해 세포가 안정된 상태에서 진행하였고 배양 기의 온도는 37℃이였으며 CO2는 5% 조건에서 사용되었다
RAW 264.7 세포의 생존율을 측정하기 위해 MTT 분석법 으로 세포독성을 측정하였다. RAW 264.7 세포 5×104 cell/mL을 96well plate에 분주하고 PMW, PME를 농도 별 (μg/mL)로 24시간 동안 처리 하였다. Well당 20 μL의 MTT 용액을 첨가하여 37℃, 5% CO2 incubator에서 4시간 동안 반응시켰다. 배양 후 상등액을 제거하고 MTT 환원에 의해 형성된 formazan에 DMSO를 첨가하여 세포를 용해시킨 후 ELISA reader를 이용하여 540 nm에서 측정하였다.
대식세포주인 RAW 264.7 세포를 DMEM 배지를 이용하 여 suspension을 100 mm cell culture dish에 각 5×105 cell/mL 로 조절한 후, 37℃, 5% CO2 incubator에서 24시간 동안 배양하여 cell을 안정화 시킨 후, RAW 264.7 세포에 1 μ g/mL의 LPS를 처리하여 1시간 배양한 후 PMW, PME를 처리하여 24시간 배양 한 후 세포 배양액을 수거하여 실험 에 사용하였다. 배양액 100 μL와 같은 양의 griess reagent를 넣어 10분간 상온에서 반응 시킨 후 ELISA reader로 540 nm에서 흡광도를 측정하였다. Sodium nitrite(NaNO2)의 농 도 별 표준곡선을 이용하여 배양액 내의 NO 농도를 결정하 였다
iNOS, COX-2 protein 활성 측정을 확인하기 위하여 대식 세포주인 RAW 264.7 세포를 DMEM 배지를 이용하여 suspension을 100 mm cell culture dish에 각 5×105 cell/mL로 조절한 후, 37℃, 5% CO2 incubator에서 24시간 동안 배양하 여 cell을 안정화 시켰다. 세포의 1 μg/mL의 LPS를 처리하고 1시간 뒤에 10, 25, 50, 100 μg/mL의 적하수오를 처리하여 24시간 배양 한 후 배지를 제거하고 배양한 세포들을 cold PBS로 세척 후 40 μL의 lysis buffer(50 mM HEPES, pH 7.0, 250 mM NaCl, 5 mM EDTA, 0.1% Nonidet P-40, 1 mM phenylmethylsulfonyl fluoride, 0.5 mM dithiothreitol, 5 mM NaF, 0.5 mM Naorthovanadate)를 이용하여 단백질을 추출한 후 원심 분리하여 상등액을 취하였다. 상등액을 모 아 새 튜브로 옮긴 후 단백질 정량을 하거나 또는 차후 사용하기 위해 -20℃에 보관한다. 상등액을 bradford assay 로 단백질 농도를 정량 한 후 8% SDS-PAGE(50 μg/lane of protein)를 시행하고, 전개된 단백질을 nitrocellulose membrane으로 transfer 시켰다. 1시간 동안 blocking buffer (5% skim milk in Tris-Buffered Saline Tween-20(TBST))를 이용하여 blocking 시켰고, 1차 항체(1:1,000)를 희석하여 4℃에서 overnight한 다음, Tris buffered saline(10 mM tris-HCl, pH 7.4, 150 mM NaCl, 0.1% Tween 20)으로 10분 간격으로 3회 세척하고, 각각의 2차 항체(1:1,000)를 희석하 여 실온에서 1시간 동안 상온에서 반응시켰다. 다시 TBST 로 10분 간격으로 3회 세척 후, 암실에서 ECL(Millipore, Bedford, MA) 용액으로 반응 시켜 Gel DocTM XR+ System (Bio Rad, CA, USA)을 이용하여 현상 및 정량을 하였다.
결과 및 고찰
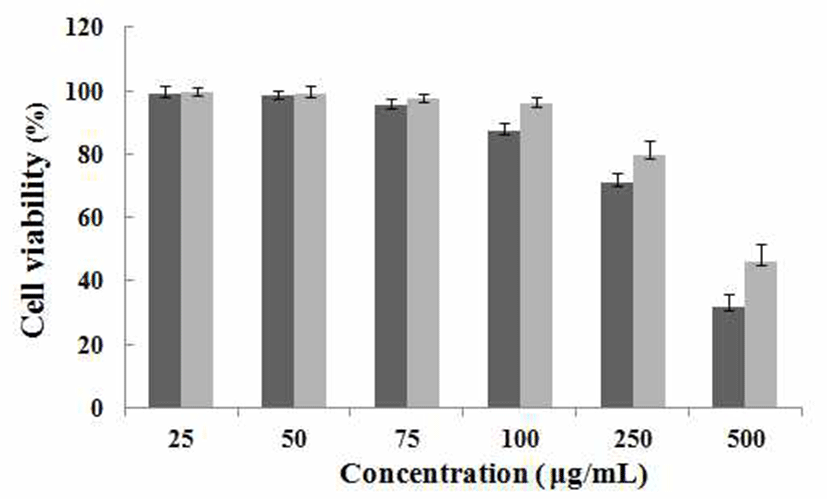
마우스 대식세포인 RAW 264.7 cell에 대한의 세포독성 을 확인하기 위하여 MTT assay를 수행하였다. PMW, PME 를 25, 50, 75, 100, 250, 500 μg/mL농도로 24시간 동안 처리 한 결과(Fig. 1) 100 μg/mL의 농도까지는 세포 독성이 나타 나지 않았음을 확인하였고 250 μg/mL 이상의 농도에서는 세포독성을 나타내었기 때문에 100 μg/mL의 농도까지를 이용해 다음에 실험들을 진행하였다.
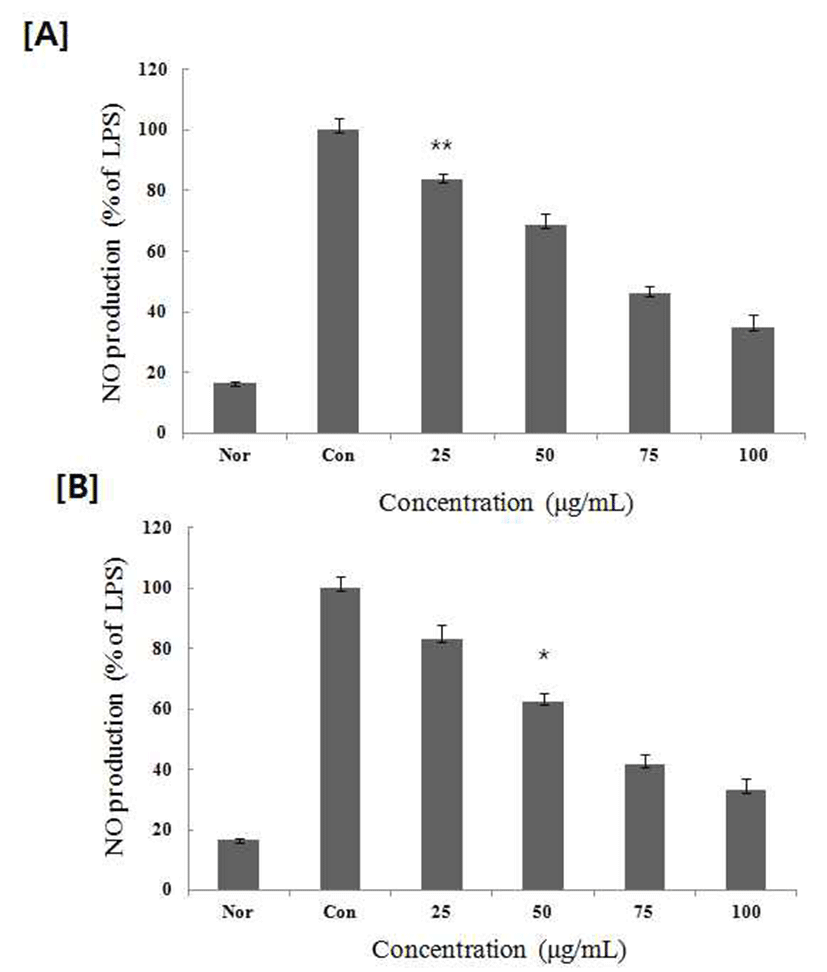
염증상태에서 iNOS에 의해 생성된 NO는 혈관 투과성, 부종 등의 염증 반응을 촉진시킬 뿐만 아니라 염증매개체의 생합성을 촉진하며(15), 혈관을 확장시키거나 암 조직의 성장을 억제하고, 바이러스나 세균들의 증식을 저해하거나 직접 사멸시키는 등 인체 면역염증반응에 있어서 중요한 역할을 하지만 과잉 배출 시에 만성염증질환 등의 문제점이 발생되기도 한다(16,17) 항염증 활성을 가지는 물질이나 소재에 대한 연구에서 NO의 생성 억제에 대한 검토는 필수 적으로 수행 되어 지고 있다(18,19). 따라서, NO생성에 대한 PMW, PME 는 배양액 내의 nitrite 농도를 Griess reagent system을 이용하여 측정하였다. PMW, PME를 농도 별로 세포에 처리하여 생성되는 NO량을 측정한 결과를(Fig. 2) 에 나타내었다. 두 추출물 모두 75 μg/mL에서 50% 이상의 NO 생성 억제율을 나타내었다.
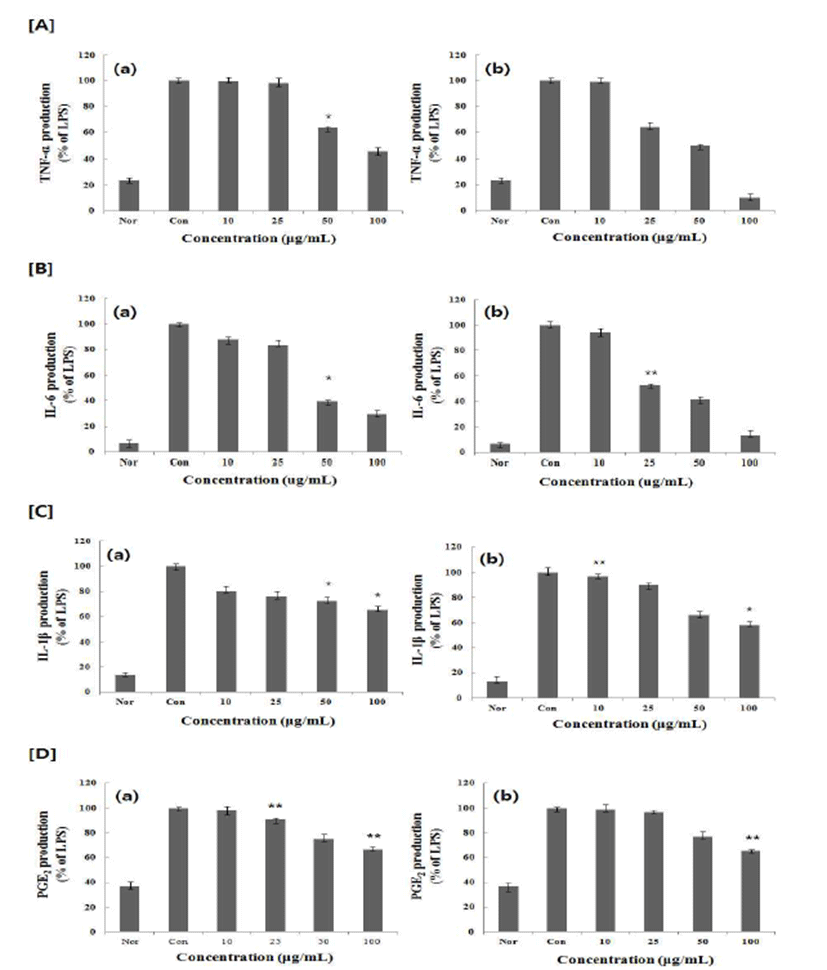
활성화된 대식 세포에서는 IL-1β, IL-6, IL-10, TNF-α와 같은 전염증성 및 염증성 사이토카인과 PGE2를 생산하게 되는데(20,21), 대식세포는 사이토카인을 분비함으로써 염 증성 반응을 유도하여 이중 TNF-α, IL-6는 면역 반응, 급성 기 반응, 조혈 작용을 조절하는 다면발현성 효과를 보인다 (22). TNF-α 는 다른 백혈구가 염증성 사이토카인을 분비하 도록 자극할 뿐만 아니라 혈관내피세포의 표면에 세포접착 의 발현을 유도하므로 순환중의 백혈구가 유출 되도록 한 다. 특히 TNF-α의 영향이 전신으로 나타나면 열, 식욕, 감퇴, C반응성 단밸질의 상승, 빈혈증을 나타낸다(23). PMW, PME가 염증성 cytokine인, TNF-α, IL-1β, IL-6, PGE2의 분 비에 미치는 영향을 알아보기 위해 RAW 264.7 세포에 LPS 처리 한 후 PMW, PME를 농도 별로 처리 한 후 분비된 TNF-α, IL-1β, IL-6, PGE2분비량을 ELISA 방법으로 측정한 결과 PMW, PME는 LPS에 증가된 RAW 264.7 cell의 TNF-α, IL-1β, IL-6, PGE2의 생성을 농도 의존적으로 감소시키는 것을 확인 할 수 있었다(Fig. 3).
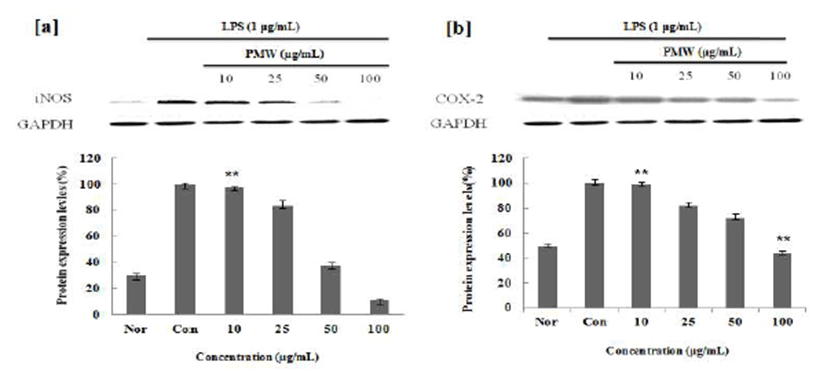
염증인자인 NO와 PGE2의 합성요소인 iNOS와 COX-2의 발현량에 미치는 영향을 조사한 결과, LPS 처리에 의해 증가된 iNOS와 COX-2의 발현이 PMW, PME에 의해 농도 의존적으로 감소함을 확인할 수 있었으며(Fig. 4,5), Gel Doc™ XR+ System(Bio Rad)를 사용하여 감소효과를 정량 적으로 확인해본 결과, 100 μg/mL의 농도에서 PMW는 iNOS는 89%, COX-2는 54%의 효과를 나타내었으며, PME 의 iNOS는 91%, COX-2는 57%까지 단백질 발현 저해효과 가 있음을 확인 할 수 있었다. 또, PME의 경우 저 농도에서 부터 효과를 나타내어 우수한 항염증 소재임을 확인 할 수 있었다.
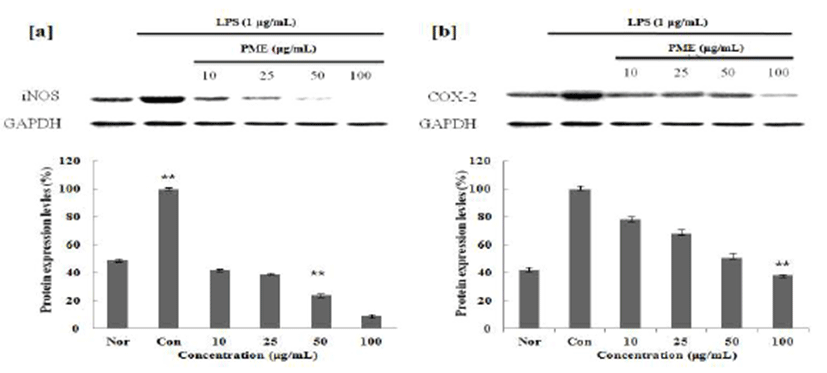
요 약
적하수오 추출물의 추출용매별 항염증 작용을 알아보기 위해 LPS로 자극된 RAW 264.7 세포를 이용하여 실험을 진행 한 결과 열수 추출물 및 70% 에탄올 추출물 모두 100 μg/mL에서 60%이상의 NO 생성 억제 율을 보이는 것을 확인 하였다. 또한 사이토 카인들에 대하여 적하수오 추출 물은 TNF-α, IL-1β, IL-6, PGE2 생성량은 농도 의존적으로 감소하였고, 이는 적하수오 추출물이 염증성 사이토 카인 의 발현을 억제 하여 염증 발생을 억제 할 수 있다고 할 수 있다. PMW는 100 μg/mL의 농도에서 iNOS 단백질 발현 량이 89%, COX-2는 54%의 효과를 나타내었으며, PME는 100 μg/mL의 농도에서 iNOS 91%, COX-2는 57%의 단백질 발현 저해효과가 있음을 확인 할 결과로 보아 적하수오는 대식세포에서 NO, TNF-α, IL-1β, IL-6, PGE2 iNOS, COX-2 발현을 억제 하며, 특히 적하수오 70% 에탄올 추출물의 경우 저 농도에서부터 효과를 나타내어 우수한 항염증 소재 임을 확인 할 수 있었다.