서 론
마황(Ephedra sinica Stapf)은 마황과(Ephedraceae)에 속 하는 다년생 초본 혹은 초본섬목으로서 중국의 동북부 및 몽고가 원산으로 30∼70cm 가량 자라며, 뿌리줄기는 황적 색으로 두꺼운 목질이다. 줄기는 가늘고 길며 마디가 많은 데 마디에는 퇴화한 비늘 같은 잎이 한 쌍씩 마주 달린 특성을 나타내며, 원줄기를 마황이라 하며, 한방에서는 중 풍, 상한, 두통, 발한, 해열, 진해 및 항염증 등에 응용되고 있다(1). 마황의 주요성분으로는 ephedrine, pseudoephedrine, N-methylephedrine, N-methylpseudoephedrine, norephedrine, norpseudoephedrine 등이 알려져 있으며(2), 이들 성분들에 대한 약리적인 면에서는 중추흥분작용, 항균, 항바이러스, 항암, 항염, 항알레르기에 대한 효과를 나타낸다고 보고되 고 있으나 정확한 작용기작에 대한 연구는 전무하다(3-7).
한편, 당뇨, 암, 바이러스 감염 등과 같은 많은 질병에 관여하는 것으로 알려진 glucosidases는 세포내 glucose trimming을 통하여 당단백질 혹은 당지질의 수식에 관여한 다. 그리고 α-glucosidase 저해제는 당단백질 혹은 당지질의 수식을 통하여 항당뇨, 항암, 및 항바이러스 활성을 나타낸 다(8-12). 특히, 댕기바이러스, HIV, 간염바이러스 등을 포 함한 해로운 바이러스들은 glucosidase 저해에 매우 민감한 것으로 알려졌다(12). 이러한 이유로 인하여, α-glucosidase 저해제는 관련된 많은 질병의 치료제 개발 타켓으로써 뿐만 아니라 작용기작 연구에 이용된다(13).
Nojirimycin, N-butyldeoxynojirimycin, nectricine, castanospermine 와 같은 α-glucosidase 저해제는 당단백질 수식의 초기단계 를 저해함으로써 인간면역결핍 바이러스(HIV, human immunodeficiency virus)의 복제, 세포융합을 통한 syncytium (합포체) 형성의 저해활성을 나타낸다(14-19). 그리고 바이 러스 감염성에 기인하는 envelope glycoprotein은 세포내에 서 합성되어 세포표면으로 분비되는 과정에서 α-glucosidase 수식을 받아 활성형으로 전환된다(14). 특히, HIV-1 envelope glycoprotein(Env)으로 알려진 outer membrane gp120와 transmembrane gp41 subunits은 precursor gp160의 절단으로부터 유래된다(20). T helper cell 표면에 위치한 HIV 수용체인 gp41와 gp120은 lymphocytes 표면의 CD4 수용체에 결합하며, 이러한 상호작용을 통하여 거대하고 비기능적인 막융합을 야기시켜 syncytium(합포체)을 형성 한다(18,21). α-glucosidase inhibitor로써 deoxynojirimycin와 그 유사체들은(18), gp160으로부터 gp41와 gp120으로의 절 단 활성을 감소시켜 정상적인 glycan processing을 저해함으 로써 감염세포내에서 HIV 수용체의 형성을 방해한다. HIV 감염된 세포에서의 합포체 형성은 Newcastle disease virus(NDV) 감염된 baby hamster kidney(BHK) 세포에서도 유사하게 관찰되며, 또한 HIV 바이러스 감염성에 중요한 envelope glycoprotein은 세포내에서 α-glucosidase 수식과정 으로BHK 세포내에서NDV 바이러스의envelope glycoprotein 수식과정과 유사하다(22). 그러므로 HIV 활성물질 스크리 닝을 위한 훌륭한 전략으로 합포체 형성을 저해하는 저해제 탐색방법과 α-glucosidase 활성 저해제 탐색방법의 사용이 기대된다.
마황 추출물이 항바이러스 효능에 대한 것으로는 RNA 바이러스인 코로나바이러스(coronavirus)과에 속하는 돼지 유행성 설사 바이러스(PEDV, Porcine epidemic diarrhea virus)에 대한 항바이러스 효능(23), 마황 수침엑스 처리시 간염 B형 바이러스(hepatitis B virus) 증식 억제 활성(24) 등이 간략하게 보고가 되어있다. 본 연구에서는, 우리는 마황 추출물의 α-glucosidase 저해활성과 항바이러스 활성 과의 상광관계를 규명하고자 연구를 수행하였다.
재료 및 방법
Baby hamster kidney(BHK) 세포주는 37℃, humidified CO2 incubator(5% CO2-95% air)내에서 10% calf serum (BD)이 포함된 Eagle’s minimum essential medium(BD, Carlsbad, CA, USA)에서 배양하였다. Newcastle disease virus(NDV; Miyadera strain)는 국립보건연구원(National Institute of Health, Seoul, Korea)에서 분양받은 BHK 세포에 서 증식하였다. 증식된 바이러스 stock 들은 monolayer BHK 세포주상 plaque forming units(PFU)의 assay를 통하여 적정 하였다. 모든 시험에 사용된 시약들은 Sigma-Aldrich(St. Louis, MO, USA) 사로부터 구입하여 사용하였다.
마황 시료는 대구시내에 위치한 한약방으로부터 구입하 여 사용하였다. 마황 시료 10 g을 각각 메탄올(100 mL)로 상온에서 24시간동안 추출하여 Whatman filter paper No.1(GE Healthcare, CA, USA)을 사용하여 여과하였다. 그 리고 메탄올을 제거하기 위하여 여과액을 감압농축(40℃) 하여 동결건조 한 후 4℃에 보관하여 활성 시험의 재료로 사용하였다(22).
마황 추추물은 시판하는 다양한 glucosidase에 대하여 효소 활성 억제를 보였다. glycosidase의 assay 는 Lee 등(25) 과 Lee 등(26)의 방법에 따라 수행하였다. α-glucosidase와 다른 glucosidase의 활성 분석을 위하여 기질로 p-nitrophenol (PNP) glycosides(1 mM)를 포함하는 50 mM phosphate 완충 용액(pH 6.7)을 조제하여 사용하였다. 시료를 완충용액에 첨가하고 37℃, 5 분 효소 반응 개시 후 기질을 첨가하여 37℃, 10분 간 효소 반응을 수행하였다. 효소반응 종료는 3배 vol.의 1 M Na2CO3를 첨가하여 반응을 종한 후 OD405를 측정하여 흡광도 변화로부터 효소저해활성을 계산하였다. 활성단위인 1 unit는 활성측정 조건에서, 1분 동안 PNP 1.0 μmol을 생성하는데 사용된 효소 양으로 정하였다. 억제율 계산은 아래와 같이 하였다.
BHK cell의 표적 세포 단일층(monolayer)은 96 well microtiter plate에 5 multiplicity of infection(MOI) 농도의 NDV를 감염시킨 후 표시된 농도의 시료를 첨가하여 배양 하였다. 그런 후 NDV 감염 세포주에서 syncytium 형성여부 와 cytopathic 효능(CPE), cytopathic units(CPU) 정량을 광학 현미경으로 관찰하였다(26,27).
96 well microtiter plate에 배양된 BHK 세포주에 2배 희석 농도가 되게 하여 VSV를 감여시킨 후 CPU 정량을 하였다. CPU는 세포병변효과가 일어나는 추출물 농도 이전의 최대 희석 배율로 정하며, 세포병변효과에 내성을 갖는 물질의 최대 희석농도를 의미한다.
96 well plates에 BHK 세포를 분주한 후 2배 농도로 희석 된 마황 추출물을 처리하여 37℃, CO2 incubator에서 배양하 였다. BHK 세포 성장은 2-(4-iodophenyl)-3-(4-nitrophenyl)- 5-(2,4-disulfophenyl)-2H-tetrazolium monosodium salt(Sigma- Aldrich)를 이용한 colorimetric 방법에 준하여 결정하였다.
바이러스 당단백질 NDV-hemagglutinin-neuramidase (NDV-HN) 생합성은 NDV 감염 세포주의 용해물에 혈구응 집단위(hemagglutination units, HAU)를 결정하여 정량하였 다. 세포 표면에서 NDV-HN 발현유무는 혈구흡착 (hemadsorption, HAD)의 정량으로 결정하였다(27,28).
6-well plates(Falcon; BD, Detroits, MI, USA)에 1 HAU/mL 농도의 NDV를 2 mL 처리 하여 감염시킨 후 14 시간, 37℃, humidified 5% CO2-95% air incubator에서 BHK 세포의 confluent 배양을 수행하였다. 배양한 배지를 제거한 후 냉각된 식염수(chilled saline)에 있는 1%(v/v) 닭 적혈구 (chicken red blood) 세포 2 mL를 각각의 well에 분주 한 후 4℃, 30 분간 정치하였으며, 가끔씩 가겹게 흔들어 주었 다. 흡착되지 않은 혈구세포를 제거 한 후, cell layer를 냉각 한 식염수 2 mL로 3회 씻어주었다. 적혈구 세포는 1% 암모 니아가 포함된 멸균수로 swollen 후 OD550를 측정하여 정량 하였다.
모든 실험은 3회 이상 반복하여 실시하였으며, 실험 결과 는 SAS(Statistical Analysis System, SAS Inc., Cary, NC, USA)를 이용하여 one-way ANOVA 분석을 실시하였으며, Duncan의 다범위 검정(Ducan’s multiple range test)을 통하 여 5% 수준에서 시료간의 유의적인 차이를 검증하였다 (29).
결과 및 고찰
Glucosidase 저해제 스크리닝 시스템을 이용하여 α -glucosidase에 대하여 활성저해능을 갖는 마황 추출물을 선별하여 조사하였다. 추출물에 의한 저해활성을 조사하기 위하여 50% inhibition(IC50)values을 결정하였으며, 효소활 성 저해능 결정은 샘플 추출액 농도의 로그 값에 대한 효소 활성 저해 %을 정하여 나타내었다. Fig. 1에서와 같이, α -glucosidase에 대한 추출물의 IC50값은 18 μg/mL이었으며 추출물에 대한 α-Glucosidase 활성 억제를 3개의 다른 효소 와의 IC50의 비교 변화를 보았을 경우도 유사한 양상을 나타 내었다. 이러한 결과는 마황 추출물이 농도 의존적으로 α -glucosidase에 대한 억제활성이 증가하였다고 사료된다. Fig. 1에서 나타난 바와 같이, β-glucosidase, α-mannosidase, β-mannosidase에 대한 마황 추출물의 IC50은 각각 60, 40, 150 μg/mL으로 나타났다. 즉, 마황 추출물은 β-type glycosidases 보다 α-type glycosidase에 대한 효소활성 저해 능이 우수하였다. 이러한 결과들은 마황 추출물이 세포내 당단백질의 당쇄화 수식에 강한 저해 활성을 나타내는 것으 로 추론된다.
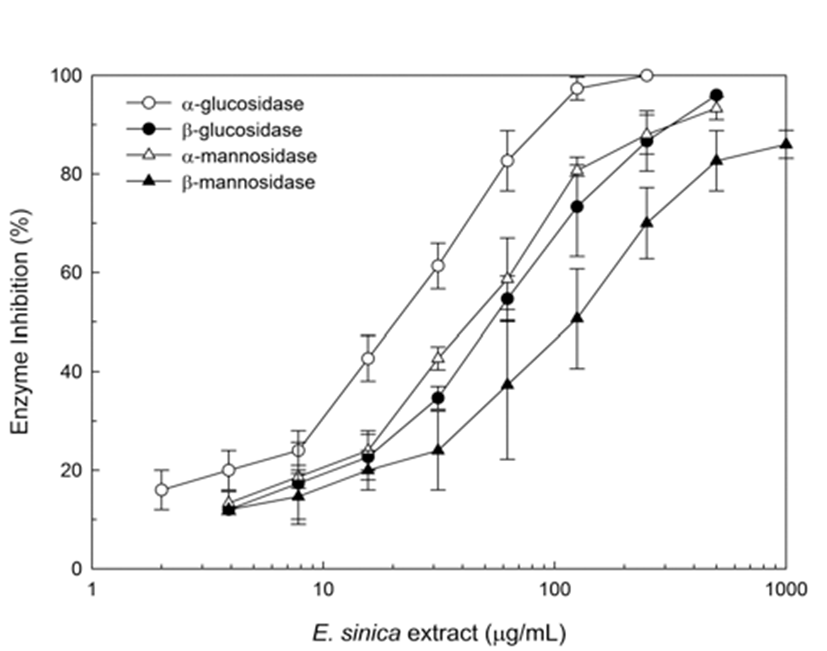
많은 α-glucosidase inhibitor들은 항바이러스 활성 물질로 알려져 있다(9-13). 즉, α-glucosidase에 대한 억제활성을 나 타내는 것은 세포내에서 바이러스 단백질들의 glycosylation 와 같은 당단백질 수식과정을 억제하는 것으로 보고되었 다. 그러므로, Fig. 1과 같이 α-glucosidase 억제 활성을 나타 내는 마황 추출물이 세포내에서 바이러스 당단백질의 합성 과정 및 세포표면으로의 분비과정 등을 이해하는데 유용한 재료로 이용될 수 있을 것이라 기대된다.
본 실험은 세포수준에서 마황 추출물의 항바이러스 억제 활성을 조사하기 위하여, NDV 감염된 BHK 세포 내에서 발현되는 바이러스 당단백질(NDV-HN)의 생합성 및 세포 표면으로의 분비 효능을 검토하였다.
마황 추추물이 합포체 형성을 억제시키는 MIC(minimum inhibitory concentration) 값은 25 μg/mL로 나타났다(Table 1). 그러나, 부분적으로 합포체 형성이 지연되는 MIC 값은 12.5 μg/mL로 나타났다. 또한 NDV 감염된 BHK 세포에서 의 합포체 형성은 HIV 감염시와 유사하기 때문에 (16,19,21), 마황 추출물에 의한 α-glucosidase 활성억제는 virus 감염 세포주에서의 glycan 형성 과정을 억제하므로 합포체 형성을 저해한다고 할 수 있다.
| Concentration (μg/mL) | 3.2 | 6.3 | 12.5 | 25 | 50 | 100 |
|---|---|---|---|---|---|---|
| Syncytium formation | ++ | ++ | + | - | - | - |
| %HAU | 100 | 97 | 92 | 83 | 74 | 55 |
Confluent monolayer cultures of BHK cells in 96-well titer plates were infected with NDV. Methanol extract was added at 1 h after infection and the cells were incubated for a further 18 h. The syncytium formation in NDV-infected cells was determined under an optical microscope The degrees of syncytium formation was expressed as follows; -, none; +, moderate; ++, severe.
마황 추추물에 의한 바이러스 당단백질의 세포표면으로 의 발현 억제는 세포내에서 바이러스 당단백질의 세포내 생합성 저해에 의해 일어날 가능성이 있으므로, 추출물에 의한 당단백질 생합성 저해능을 검토하였다. NDV-감염 BHK 세포에서 바이러스 당단백질 NDV-NH의 총 생합성 양은 세포 용해물(cell lysate)에서 전체 HAU 측정으로 정량 화한다는 연구가 보고되었다(25,26). NDV 감염된 세포배 양액을 초음파 파쇄하여 닭 적혈구(chicken red blood cells) 을 첨가한 후, 용해물에서 hemagglutination 활성을 측정하 였다. HAU는 마황 추출물의 농도가 25 과 3.2 ug/ml 사이에 서는 현저하게 감소하는 경향을 나타내지는 않았지만(Fig. 2, white bar □), NDV 감염된 세포에 닭 적혈구 세포를 첨가하여 혈구 흡착(HAD %) 정도를 측정한 결과, 25 ug/mL 농도(Fig. 2, black bar ■)에서 광범위한 흡착능의 감소를 나타내었다. 즉, NDV 감염된 세포에 대하여 마황 추출물 처리한 결과, 추출물 25 ug/mL 농도로 처리한 샘플 구에서 바이러스 당단백질의 세포내 생합성은 저해되지 않으나 (Fig. 2, white bar □), 당단백질이 세포표면으로의 분비가 저해되어 혈구흡착이 되지는 않았다(Fig 2, black bar ■).
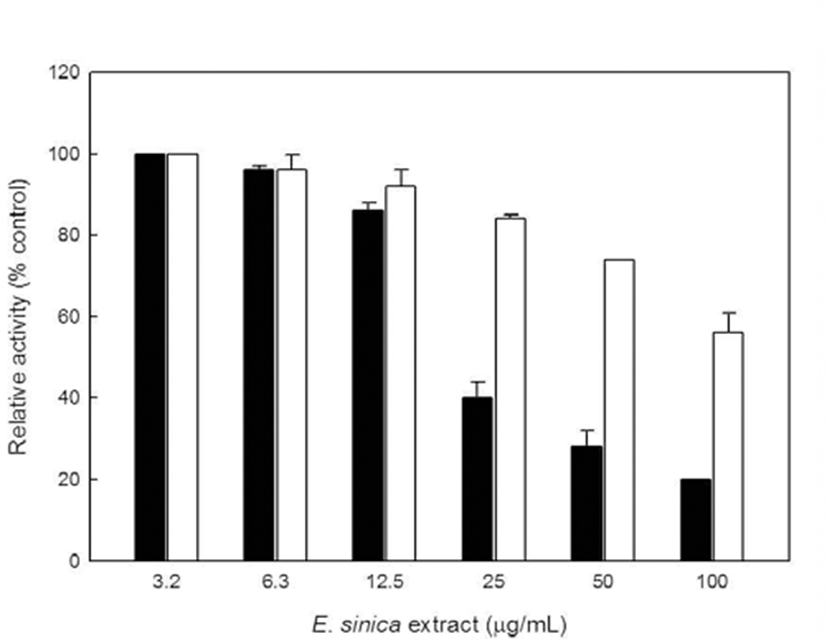
이상의 결과들을 종합해 볼 경우, 마황 추출물은 NDV 감염된 BHK 세포에서 바이러스의 당단백질 분비과정을 저해함으로써 세포표면으로 당단백질 발현을 방해되므로 성숙한 감염성 바이러스 입자의 완성이 어려우므로 결국 항바이러스 작용을 하는 것으로 추론된다. 향후 마황 추출 물로부터 항바이러스 물질의 분리 및 작용기작에 대한 연구 가 필요하다.
요 약
Newcastle disease virus(NDV) 감염된 baby hamster kidney(BHK) 세포에서 syncytium(합포체) 형성은 세포막 표면으로의 수송된 바이러스 당단백질 hemagglutininneuramidase( HN)에 의해 일어난다. HAU 값은 추출물의 농도가 25 과 3.2 ug/mL 사이에서는 현저하게 감소하였으 나, NDV 감염된 HAD(%)는 25 ug/mL 농도에서 광범위한 흡착능의 감소를 나타내 바이러스 당단백질의 세포내 생합 성은 저해되지 않았다. 그러므로, 약용식물인 마황 메탄올 추출물이 바이러스 당단백질의 세포막으로의 수송과 함께 합포체 형성을 저해하여 항바이러스 작용을 하였다. 또한 마황 추출물의 저해활성을 조사한 결과 α-glucosidase에 대 한 추출물의 IC50은 18 μg/mL이었으며, β-glucosidase, α -mannosidase, β-mannosidase에 대한 마황 추출물의 IC50은 각각 60, 40, 150 μg/mL로 나타나 β-type glycosidases 보다 α-type glycosidase에 대한 효소활성 저해능이 우수하였다. 따라서 IC50농도에서는 세포내에서 당단백질 생합성은 저 해되지 않으며 당단백질의 수송을 저해하는 것으로 판단되 었으며 향후 항바이러스 관련 작용기작의 연구가 필요하다 고 판단된다.