서 론
아로니아(Aronia melanocarpa)는 장미과에 속하는 베리 류로 북부 아메리카 지역에서 자생한다(1). 학명에 따라 black chokeberry(Aronia melanocarpa), red chokeberry (Aronia arbutifolia) 및 purple chokeberry(Aronia prunifolia) 로 나누어지나, 일반적으로 아로니아(Aronia melanocarpa) 에 모두 포함시킨다(2). 폴란드, 덴마크, 네덜란드 등 유럽에 서 주로 재배, 생산되는 아로니아는 2007년 국내에 처음 도입되어 충북 옥천, 강원 원주 등지에서 소규모로 재배하 기 시작하여 현재 의령, 단양 등으로 확산되어 농촌 소득 경쟁력 향상에 많은 영향을 끼치고 있다.
아로니아의주요유용성분으로는polymeric proanthocyanidins, chlorogenic acid, neochlorogenic acid, cyanidin-3-Ogalactoside, cyanidin-3-O-arabinoside등으로 다양한 생리적 기능을 가지고 있어 식품 및 기능성소재로 널리 사용되고 있다(3). 대표적으로 아로니아에 풍부하게 함유되어 있는 폴리페놀 성분에 대한 라디칼 소거활성, 항산화 효과에 대 한 연구가 활발히 이루어져 있으며(4-6), 인간대장암 세포 주, 자궁암 세포주와 같은 암세포주에 대한 종양억제활성 에 대한 연구도 이루어지고 있다(7,8). 당뇨 유발 쥐 및 고지 혈증 유발 쥐에게 아로니아 주스를 투여하여 혈당 및 지질 저해 효과(9) 및 심혈관질환 저해 효과(10-12)를 확인하여 건강에 유익하다고 보고되고 있으며, 가벼운 콜레스테롤 혈증을 가진 사람이 아로니아 주스 섭취를 하였을 경우 동맥 혈압에 좋은 영향을 주는 것으로 알려져 있다. 또한 위 보호효과(13), 면역조절 기능활성(14) 등 각종 만성질환 의 예방효과가 있는 것으로 보고되고 있다. 아로니아에 함 유되어 있는 주요 안토시아닌은 cyanidin-3-O-galactoside, cyanidin-3-O-arabinoside 및 cyanidin-3-O-xyloside이며(6), 일반적으로 phenyl group 중의 OH기가 증가하면 청색이 진해지고, methoxyl group이 증가하면 OH기보다 전자 공여 능이 크기 때문에 bathochromic shift 현상이 더 크게 일어나 빨간색이 진해지는 경향이 있다고 알려져 있다(15). 안토시 아닌은 안토시아니딘의 배당체로써 가수분해 시키면 aglycone인 안토시아니딘과 당으로 분해된다. 안토시아니 딘과 결합할 수 있는 대부분의 당류는 glucose, galactose, xylose, arabinose, rhamnose 등이며, 결합하여 monoside, bioside, trioside 등으로 구성되고 있으며 경우에 따라서 당 고리에 방향족 혹은 비방향족 유기산이 결합되기도 하고 그 결합방법 및 위치에 따라 자연계에 수백종이 존재하고 있다(16,17). 그 중에서도 아로니아는 현존하는 베리류 중 안토시아닌을 얻을 수 있는 가장 유용한 소재로 알려져 있어(18), 안토시아닌의 다양한 기능성을 쉽게 식품소재에 활용할 수 있을 것으로 사료된다.
따라서 본 연구에서는 다양한 생리활성을 가지는 아로니 아를 기능성식품 소재로 활용하고자 추출용매별로 추출하 였으며 추출물의 항산화 활성 및 자궁암 세포주에 대한 항암 활성을 조사하였다.
재료 및 방법
본 실험에 사용된 아로니아(Aronia melanocarpa)는 국내 산으로 경상북도 칠곡군 소재의 (주)웰추럴로부터 제공받 아 이용하였다. 씨를 제거한 아로니아를 동결건조하여 분 쇄기(FM-909W, Hanil Co., Sejong, Korea)로 분쇄하여 –7 0℃이하의 암소에 보관하면서 추출용 시료로 사용하였다.
10 g의 아로니아 동결건조 분말에 증류수, 50% 에탄올 및 50% 메탄올을 고형분 대비 20배 첨가하여 증류수 첨가 구는 100℃에서, 50% 에탄올 및 50% 메탄올 첨가구는 80℃ 에서 4시간 동안 환류냉각추출기(CA-1112, Eyela Co., Tokyo, Japan)를 이용하여 추출하였다. 추출물은 불순물을 제거하기 위하여 여과지(No.1, Whatman International Ltd., Leicestershire, England)를 이용하여 여과시켰다. 여과된 용 액은 감압농축기(N-1N, Eyela Co., Tokyo, Japan)를 사용하 여 감압농축한 뒤, 동결건조(FreeZone 2.5, Labconco Co., Kansas, MO, USA)하여 –70℃ 이하의 암소에 보관하면서 분석용 시료로 사용하였다.
추출수율은 각각의 추출물을 동결건조 시켜서 건물 중량 을 구한 다음 추출물 제조에 사용한 원료 건물량에 대한 백분율로 나타내었다.
총 당 함량 측정은 phenol-sulfuric acid법(19)에 따라 시료 1 mL에 5% phenol 1 mL를 첨가하고 충분히 혼합하여 반응 시킨 후 94% H2SO4 5 mL를 첨가하고 실온에서 20분간 반응시킨 다음 분광광도계(Ultraspec 2100pro, Amersham Co., Uppsala, Sweden)를 이용하여 470 nm에서 흡광도를 측정하였다. 총 당 함량은 glucose(Sigma-Aldrich Co., St. Louis, MO, USA)를 정량하여 작성한 표준곡선으로부터 계산하였다.
총 안토시아닌 함량 측정은 Lee 등(20)의 방법에 따라 시료 0.1 g에 pH 1.0 buffer(0.2 M KCl+ 0.2 M HCl) 또는 pH 4.5(0.2 M potassium phosphate+0.1 M citric acid) 2 mL를 각각 혼합한 다음 분광광도계(Ultraspec 2100pro, Amersham Co.)를 이용하여 520 nm와 700 nm에서 흡광도를 측정하였 다. 총 안토시아닌 함량은 아래와 같이 cyanidin-3-Oglucoside를 기준으로 계산하였다.
Total anthocyanin content(mg/100 g) = × Mw × DF × 1,000 × 1
A = (Aλ520 - Aλ700)pH 1.0 - (Aλ520 - Aλ700)pH 4.5
Mw = molecular weight of cyanidin-3-glucoside = 449.2 g/mol
DF = dilution factor
ε = the molar absorptivity = 26,900 L/cm·mol
아로니아 추출물 동결건조 분말의 안토시아닌 조성은 HPLC(Waters 2695, Waters Co., Miliford, MA, USA)를 이용 하여 분석하였다. Column은 XBridgeTM C18 Column(5μm, 4.6×150 mm)(Waters Co., Miliford, MA, USA)을 사용하였 고 column 온도는 30℃였으며, 검출기는 photodiode array detector(Waters 2996, Waters Co.)로 535 nm에서 검출하였 다. 이동상 용매로는 Water:HCOOH (90:10, v/v)와Acetonitrile: Methanol:Water:HCOOH(22.5:22.5: 40:10, v/v)를 사용하여 유속은 1.0 mL/min, 시료주입량은 10 μL였다. 안토시아닌의 표준물질은cyanidin-3-O-galactoside, cyanidin-3-O- glucoside 및 cyanidin-3-O-arabinoside 3종을 Sigma-Aldrich Co.로부 터 구입하였고 HPLC chromatogram에서 retention time의 비교로 동정하였으며, peak area의 실측치와 표준물질의 농도간 계산에 의해 안토시아닌 조성을 산출하였다.
총 페놀 함량 측정은 Folin-Denis법(21)에 따라 시료 1 mL에 1 N Folin Ciocalteu reagent 1 mL를 첨가하고 충분히 혼합하여 반응 시킨 후 20% Na2CO3 1 mL를 첨가하고 실온 의 암소에서 30분간 반응시킨 다음 분광광도계(Ultraspec 2100pro, Amersham Co.)를 이용하여 725 nm에서 흡광도를 측정하였다. 총 페놀 함량은 tannic acid(Sigma-Aldrich Co.) 를 정량하여 작성한 표준곡선으로부터 계산하였다.
총 플라보노이드 함량 측정은 Jia 등(22)의 방법에 따라 시료 1 mL에 5% NaNO2 150 μL를 혼합하여 실온에서 6분간 반응 시킨 다음 10% AlCl3 300 μL와 혼합하여 다시 실온에 서 5분간 반응 시킨 후 1 N NaOH 1 mL와 혼합한 다음 분광광도계(Ultraspec 2100pro, Amersham Co.)를 이용하여 510 nm 에서 흡광도를 측정하였다. 총 플라보노이드 함량 은 rutin(Sigma-Aldrich Co.)을 정량하여 작성한 표준곡선으 로부터 계산하였다.
ORAC 측정은 Talcott와 Lee(23)가 항산화 활성 측정에 사용한 분석법을 이용하였다. 본 시험에서 아로니아 추출 물 동결건조 분말 및 Trolox의 농도별 희석과 실험용 시료의 제조에는 중성 phosphate buffer(61.6:38.9, v/v, 0.75 M K2HPO4와 0.75 M NaH2PO4)를 사용하였다. 검량 곡선을 작성하기 위하여 항산화 활성 비교 표준액으로 Trolox (Water soluble analogue of vitamin E, 6-hydroxy- 2,5,7,8-tetramethylchroman-2-carboxylic acid, Sigma-Aldrich Co.) 10 μL를 phosphate buffer 50 mL에 용해하여 제조하였 고, 측정기기는multilabel plate readers(VICTOR3, PerkinElmer, Inc., Waltham, MA, USA)를 사용하여 485 nm에서 전자가 여기되고 538 nm에서 방출되게 조절하여 본 실험에 적용되 었다.
DPPH radical 소거활성 측정(24)은 1,1-diphenyl-2- picrylhydrazyl(DPPH)의 환원력을 이용하여 측정하였다. 즉, 시료 0.5 mL에 4×10-4 M DPPH용액(99.9% ethyl alcohol 에 용해) 5 mL를 혼합하여 실온에서 15분간 반응 시킨 다음 분광광도계(Ultraspec 2100pro, Amersham Co.)를 이용하여 517 nm에서 흡광도를 측정하였다. DPPH radical 소거활성 은 추출물의 첨가 전과 후의 차이를 아래와 같이 백분율로 나타내었다.
DPPH radical scavenging activity(%)=
Superoxide radical 소거활성 측정은 Nishikimi(25)의 방법 에 따라 다음과 같이 측정하였다. 시료 500 μL에 0.1 M Tris-HCl 완충용액(pH 8.5) 100 μL, 100 μM phenazine methosulfate(PMS) 200 μL를 혼합하여 반응 시킨 후 500 μM nitro blue tetrazolium(NBT) 200 μL 및 500 μM β -nicotinamise adenine dinucleotide(NADH) 400 μL를 첨가하 여 실온에서 10분간 반응시킨 다음 분광광도계(Ultraspec 2100pro, Amersham Co.)를 이용하여 560 nm에서 흡광도를 측정하였다. Superoxide radical 소거활성은 추출물의 첨가 전과 후의 차이를 아래와 같이 백분율로 나타내었다.
Superoxide radical scavenging activity(%) =
FRAP 측정은 Benzie와 Strain(26)의 방법에 따라 다음과 같이 측정하였다. FRAP 용액은 25 mL acetate buffer(300 mM, pH 3.6)를 37℃에서 가온한 후, 40 mM HCl에 용해한 10 mM 2,4,6-tris(2-pyridyl)-s-triazine(TPTZ, Sigma-Aldrich Co.) 2.5 mL와 20 mM ferric chloride(FeCl3) 2.5 mL를 첨가하 여 제조하였다. 시료 30 μL에 제조된 FRAP 용액 900 μL와 증류수 90 μL를 넣은 후 37℃에서 10분간 반응시킨 다음 분광광도계(Ultraspec 2100pro, Amersham Co.)를 이용하여 510 nm에서 흡광도를 측정하였다. FRAP는 FeSO4· 7H2O(Sigma-Aldrich Co.)을 정량하여 작성한 표준곡선으 로부터 계산하였다.
Tyrosinase 저해활성은 Kameyama 등(27)의 방법을 응용 하여 96 well plate에 시료 100 μL, 0.175 M phosphate buffer(pH 6.8) 40 μL, 5 mM L-DOPA 40 μL를 순서대로 넣고 mushroom tyrosinase(2,000 U/mL, Sigma-Aldrich Co.) 20 μL를 첨가하여 37℃ 배양기에서 10분간 반응시킨 다음 생성된 DOPA chrome을 microplate reader(UVM-340, ASYS Co., Eugendorf, Austria)를 이용하여 490 nm에서 흡광도를 측정하였다. Tyrosinase 저해활성은 추출물의 첨가 전과 후 의 차이를 아래와 같이 백분율로 나타내었다.
Tyrosinase inhibition activity(%) =
인간 자궁경부암 세포주인 HeLa는 한국세포주은행으로 부터 분양받아 실험에 사용하였다. RPMI 1640배지에 10% fetal bovine serum, 2% penicillin-streptomycin을 첨가하여 37℃, 5% CO2 incubator(MCO-18AIC, SANYO Eletric Biomedical Co., Ltd., Osaka, Japan)에서 배양하였다. 배양된 세포주를 2×104 cell/well로 96 well plate에 첨가하여 24시간 배양하고 시료를 처리한 후 48시간 동안 배양하였다. 배양 후 PBS 완충용액에 녹인 MTT 용액(5 mg/mL)을 각 well에 10 μL씩 첨가하고 다시 4시간 동안 배양하여 MTT가 환원 되도록 하였다. 배양종료 후 생성된 formazan결정이 흐트러 지지 않게 배양액을 완전히 제거한 후 각각의 well에 100 μL씩 DMSO를 첨가하고 실온에서 10분간 반응시켜 formazan결정을 완전히 용해한 다음 microplate reader (UVM-340, ASYS Co.)를 이용하여 540 nm에서 흡광도를 측정하였다. 시료를 처리하지 않은 세포를 대조군으로 하 여 상대적인 세포생존율로 나타내었다.
결과 및 고찰
추출용매에 따른 아로니아의 추출수율, 총 당 및 총 안토 시아닌 함량은 Table 1과 같다. 추출수율은 50% 에탄올 추출물에서 84.50%로 가장 높은 수율을 나타내었으며, 열 수추출물 및 50% 메탄올 추출물에서 각각 84.05%와 76.20%순이었는데, 열수추출물에서 높은 수율을 나타낸 것으로 보아 수용성 성분이 많을 것으로 판단된다. Wangensteen 등(28)은 품종이 다른 4종의 아로니아 80% 에탄올 추출물의 추출 수율이 9.4~19.7%라고 보고하였으 며, Kang(29)은 안토시아닌을 함유하고 있는 국내산 베리 류인 블루베리, 라즈베리, 오디, 딸기에 대한 80% 에탄올 추출물의 추출 수율이 16.74~23.21%라고 보고하였다. 본 연구에서 사용한 아로니아 추출물은 상대적으로 높은 수율 을 나타내었는데, 이는 아로니아의 씨를 제거한 후 동결건 조한 분말을 사용하여 추출물을 제조하였기 때문이라고 사료된다.
총 당을 분석한 결과, 35.56~37.68 g/100 g으로 추출용매 별로 유사하였고, 유의적인 차이를 나타내지 않았다. 총 안토시아닌 함량은 50% 메탄올, 50% 에탄올 및 열수 추출 순으로 유의적인 차이를 나타내었는데, 50% 메탄올 추출물 에서 395.10 mg/100 g으로 가장 높은 함량을 나타내었으며, 50% 에탄올 및 열수추출물에서 각각 318.61 mg/100 g 및 252.82 mg/100 g이었다. Rugina 등(8)은 품종에 따른 아로니 아 열매의 총 안토시아닌 함량이 176.18~366.16 mg/100 g이라고 보고하였으며, 그 중에서도 Aronia melanocarpa cultivar Viking은 277.13 mg/100 g, Aronia melanocarpa cultivar Aron은 176.18 mg/100 g을 함유하고 있어 본 연구에 서 사용된Aronia melanocarpa의 총 안토시아닌 함량이 높 음을 확인하였다.
추출용매별 아로니아 추출물의 안토시아닌 조성은 Table 2와 같다. 50% 메탄올 추출물에서 cyanidin-3-O-galactoside, cyanidin-3-O-arabinoside 및 cyanidin-3-O-glucoside가 각각 364.65 mg/100 g, 163.06 mg/100 g 및 35.69 mg/100 g으로 가장 많이 함유되어 있었으며, 열수, 50% 에탄올 및 50% 메탄올 추출물 모두 cyanidin-3-O-galactoside가 64.72∼ 79.84%로 가장 높은 조성을 보여주었다. Hwang 등(4)은 국내산 아로니아를 70% 에탄올로 10배 첨가하여 추출한 추출물의 안토시아닌 함량을 분석한 결과 cyanidin-3- galactoside가 93.3 mg/g 및 cyanidin-3-arabinoside의 함량은 37.1 mg/g 함유되어 있다고 보고하였다. 본 연구에서 사용 한 추출물의 HPLC분석에 따른 안토시아닌 함량은 열수추 출물, 50% 에탄올 및 50% 메탄올 추출물에서 각각 170.97 mg/100 g, 341.38 mg/100 g 및 563.4 mg/100 g으로 Table 1의 총 안토시아닌 함량과 유사한 경향을 나타내었다. Wangensteen 등(28)은 품종이 다른 4종의 아로니아 80% 에탄올 추출물의 안토시아닌 조성을 비교한 결과 Aronia melanocarpa cultivar Moskva가 252 mg/100 g, Aronia melanocarpa cultivar Hugin이 249 mg/100 g이었으며, Aronia melanocarpa cultivar Nero가 447 mg/100 g 및 Aronia prunifolia에서 737 mg/100 g으로 나타나 본 연구에서 사용 된 아로니아 품종이 상대적으로 높은 안토시아닌 함량을 나타냄을 확인하였다. 안토시아닌 조성은 추출물 모두 cyanidin-3-O-galactoside, cyanidin-3-O-arabinoside 및 cyanidin- 3-O-glucoside순이었다. Bijak 등(30)은 아로니아 50% DMSO 추출물의 안토시아닌 조성 분석에서 cyanidin-3-Ogalactoside, cyanidin-3-O-arabinoside, cyanidin-3-O-xyloside 및 cyanidin-3-O-glucoside순이었으며, g당 함량은 각각 64.04 mg, 23.38 mg, 3.19 mg 및 3.14 mg 함유하고 있다고 보고하였다.
추출용매에 따른 아로니아 추출물의 총 페놀, 총 플라보 노이드 함량 및 ORAC은 Table 3과 같다. 총 페놀 함량은 열수추출물에서 80.14 mg/g으로 가장 낮은 함량을 나타내 었으며, 50% 에탄올 및 50% 메탄올 추출물이 각각 121.38 mg/g 및 122.43 mg/g으로 상대적으로 함량이 높았다. 이는 품종이 다른 4종의 아로니아 80% 에탄올 추출물의 총 페놀 함량이 98~175 mg/g 함유하고 있다는 Wangensteen 등(28) 의 보고와 유사함을 알 수 있었다. 선행 연구에 따르면 아로 니아에 함유되어 있는 페놀성 물질은 항산화 활성(31), 대장 암 억제(32), 간 보호 효과(33), 심장 보호 효과(34) 등 다양 한 건강증진 기능(35-37)을 나타낸다고 보고되어 있다. 총 플라보노이드 함량은 열수 추출, 50% 에탄올 및 50% 메탄 올 추출물에서 각각 56.98 mg/g, 104.58 mg/g 및 104.19 mg/g으로 총 페놀 함량과 유사한 경향을 나타내었다. ORAC은 열수추출물, 50% 에탄올 및 50% 메탄올 추출물에 서 g당 각각 715.66 μM, 768.15 μM 및 780.77 μM로 나타나 50% 에탄올 및 50% 메탄올 추출조건의 항산화 활성이 높았 다. Rugina 등(8)은 품종에 따른 아로니아의 ORAC을 조사 한 결과 g당 35.3~42.3 μM로 보고하였으며, 평균적으로 39.8 μM을 나타낸다고 보고하였다. Hong(38)은 Acai 추출 물의 ORAC값이 137.73~562.94 μM/g로 보고하여 다른 베 리류에 비해 Acai의 항산화 활성이 높다고 보고하였는데, 본 연구에서 사용한 아로니아 추출물의 항산화 활성이 보다 우수함을 확인하였다.
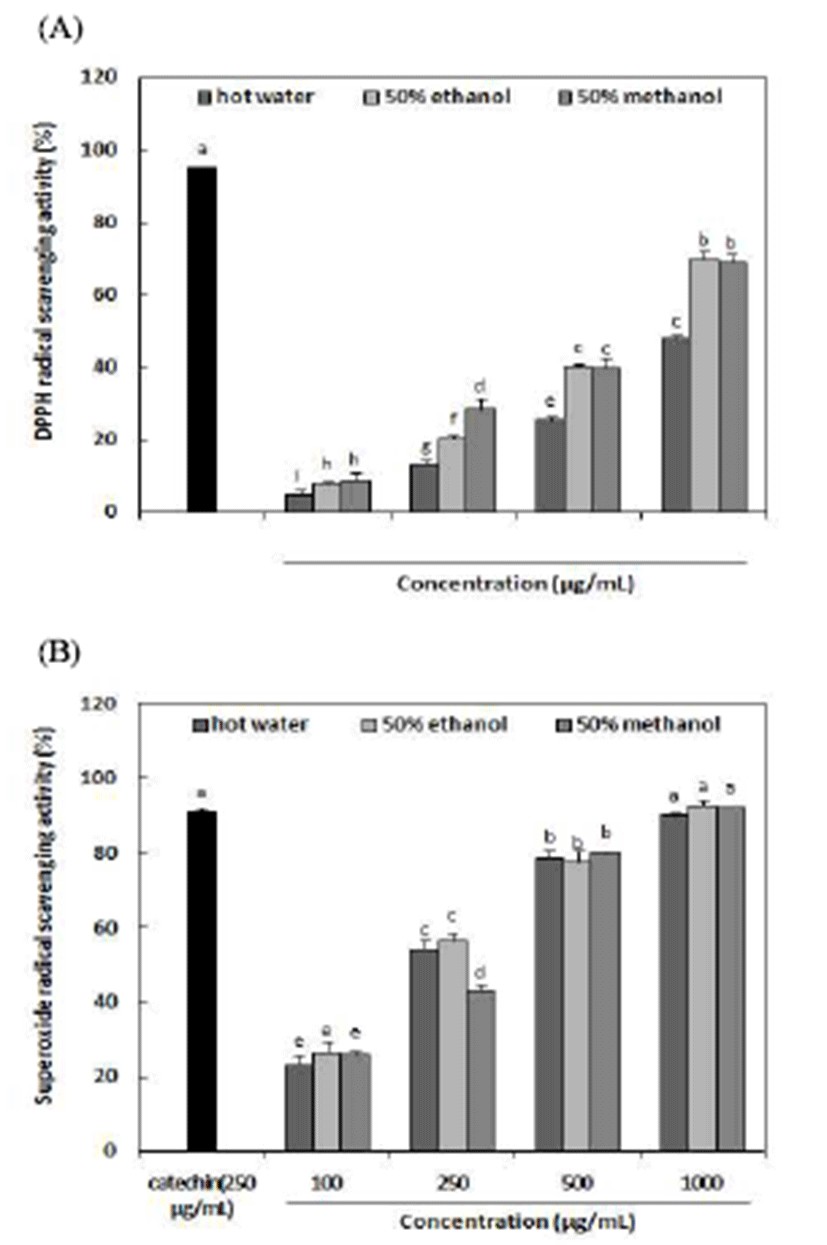
추출용매에 따른 아로니아 추출물의 DPPH 및 superoxide radical 소거활성은 Fig. 1과 같다. DPPH radical 소거활성을 분석한 결과 100 μg/mL에서 1,000 μg/mL으로 농도가 증가 함에 따라 열수추출물의 경우 4.99~47.78%로 가장 낮은 활성을 나타내었으며, 50% 에탄올 및 50% 메탄올 추출물 이 각각 7.96~70.01% 및 8.90~69.21%로 유의적으로 높은 활성을 나타내었다. 모든 구간에서 시료 처리 농도가 증가 함에 따라 DPPH 소거활성이 증가하였으며 열수 추출물보 다 50% 에탄올 및 50% 메탄올 추출물의 활성이 우수함을 확인하였다. Hwang 등(4)은 70% 에탄올로 추출한 아로니 아 추출물의 DPPH radical 소거활성을 조사한 결과 500 μg/mL에서 약 80%로 같은 조건에서 추출한 블루베리보다 2배정도 높은 활성을 나타내었다고 보고하였다. Superoxide radical 소거활성을 분석한 결과 추출용매에 따른 활성의 차이가 유의적으로 나타나지 않았으나, 모든 시료에서 농 도 의존적으로 증가하였다. 100~1,000 μg/mL의 농도에서 열수 추출물이 23.14∼90.13%, 50% 에탄올 추출물에서 26.38∼92.72% 및 50% 메탄올 추출물이 25.73∼92.23%의 높은 활성을 나타내었다. 특히 모든 추출방법에서 1,000 μg/mL 농도의 항산화 활성이 90.13∼92.72%로 나타나 양성 대조군으로 사용한 catechin(91.10%)과 유사한 활성을 나타 내어 아로니아의 superoxide radical 소거활성이 우수함을 확인하였다. Jeong(39)은 아로니아를 주정으로 추출한 분말 의 superoxide radical 소거활성을 조사한 결과 양성대조군 으로 사용한 녹차 카테킨 EGCG와 비타민C의 SC50값은 각각 3.01 ppm, 8.84 ppm으로 나타나 아로니아 추출물의 활성이 EGCG(epigallocatechin gallate)보다 약 2.2배 낮은 활성을 보여주었으나 비타민C보다는 약 1.22배 우수한 활 성을 나타내었다고 보고하였다.
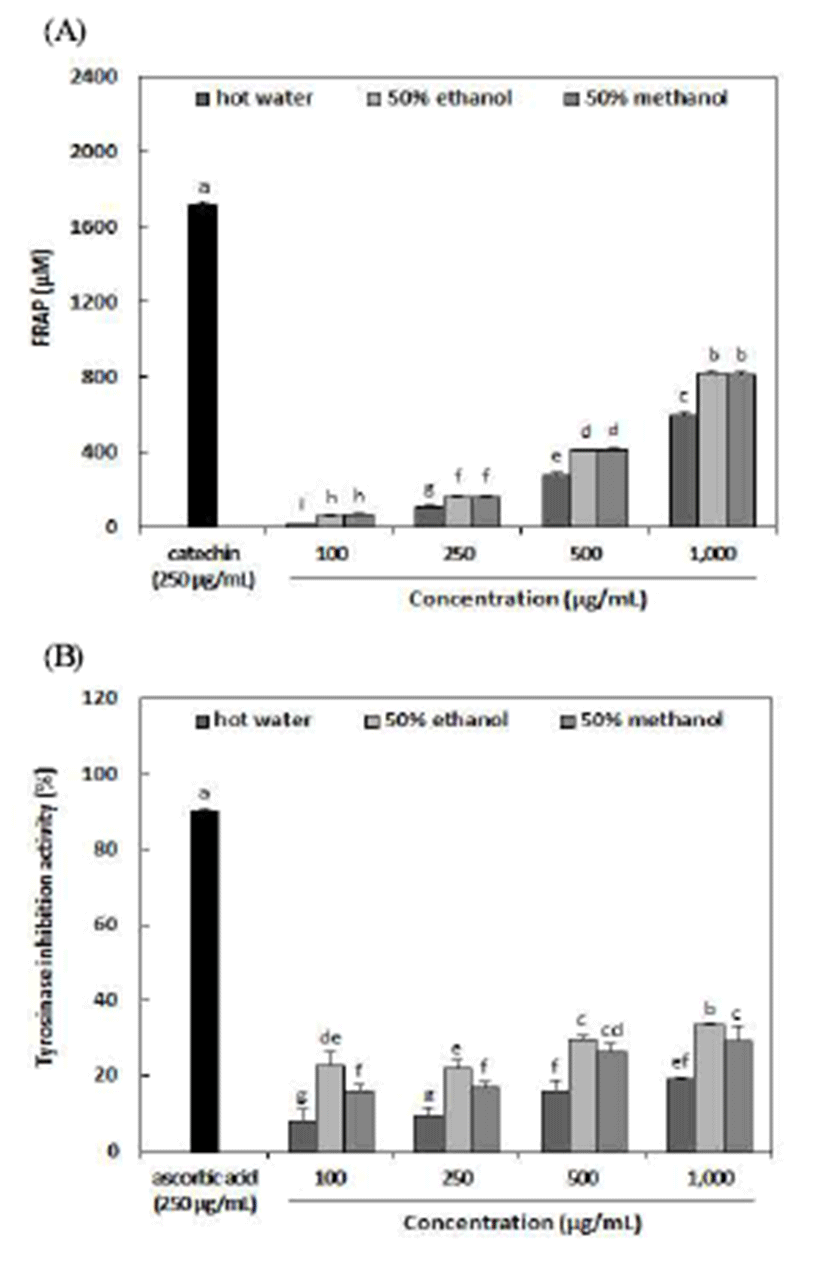
추출용매에 따른 아로니아 추출물의 FRAP 및 tyrosinase 저해활성은 Fig. 2와 같다. FRAP를 분석한 결과, 100~1,000 μg/mL 농도에서 열수추출물이 20.49~595.17 μM로 가장 낮았으며 50% 에탄올 추출물(57.14~817.87 μM) 및 50% 메탄올 추출물(67.32~812.78 μM)이 상대적으로 우수하였 다. 50% 에탄올 및 50% 메탄올 추출물은 1,000 μg/mL농도 에서 각각 817.87 μM 및 812.78 μM로 나타나 양성대조군으 로 사용된 catechin(1710.44 μM)과 비교하여 0.5배 정도였으 며 모든 시료에서 농도의존적으로 증가하였다. Rugina 등 (8)의 보고에 따르면 품종에 따라 아로니아의 FRAP 함량은 185.0~300.2 μM Fe2+/g FW로 보고하였으며, 평균적으로 230.5 μM/g의 함량을 나타냄을 확인하였다. Tyrosinase 저 해활성을 분석한 결과 100~1,000 μg/mL농도에서 50% 에탄 올 추출물이 23.03~33.82%로 가장 우수한 저해활성을 나타 내었으며, 50% 메탄올 추출물(16.07~29.35%) 및 열수 추출 물(8.26~19.12%) 순이었다. 특히 50% 에탄올 추출물 1,000 μg/mL 농도에서의 저해활성은 33.82%로 가장 높은 활성을 나타내었으며, 양성대조군으로 사용된 catechin(90.03%)의 약 0.34배였다. 따라서 모든 아로니아 추출물에서 농도 의 존적으로 tyrosinase 저해활성이 나타남에 따라 향후 피부미 백 기능성 소재로의 활용 가능성이 기대된다 하겠다.
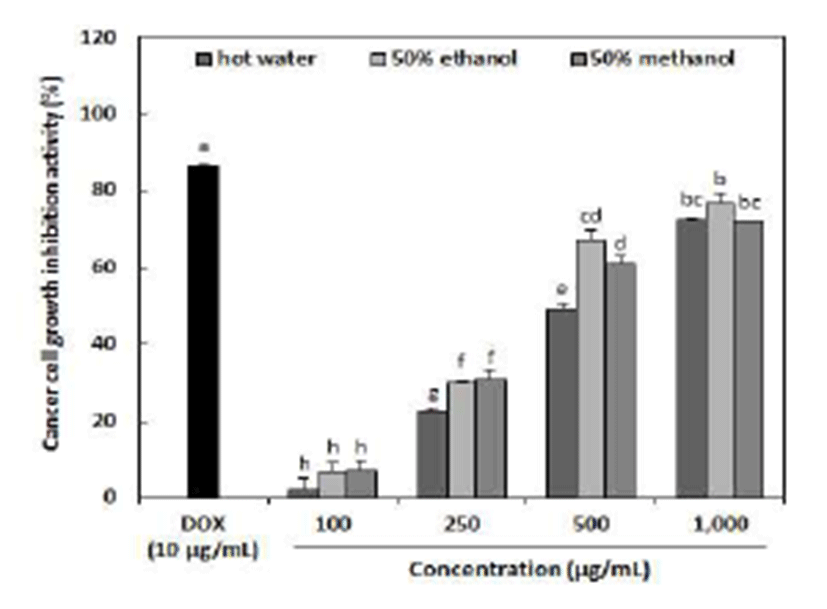
인간 자궁경부암세포주인 HeLa에 추출용매별 아로니아 추출물을 농도별로 처리하여 48시간 배양한 후 MTT assay 로 분석한 암세포생육 저해활성은 Fig. 3과 같다. 자궁경부 암세포의 생육 저해활성은 50% 에탄올 추출물이 100~ 1,000 μg/mL 농도에서 6.58~76.86%로 유의적으로 높은 저 해활성을 나타내었다. 열수추출물 및 50% 메탄올 추출물은 각각 2.12~72.59% 및 7.24~71.97%로 50% 에탄올 추출물과 유사하게 높은 암세포생육 저해활성을 나타내었다. 모든 추출물에서 농도의존적으로 저해활성을 나타내었으며 1,000 μg/mL 농도에서의 저해활성은 71.97~76.86%로 양성 대조군으로 사용된 doxorubicin 10 μg/mL의 86.48%과 비교 시 0.9배로 나타나 높은 저해활성을 보여주어 향후 여성을 대상으로 한 기능성식품 소재로 활용가능하다 사료된다. Rugina 등(8)은 아로니아에서 분리한 cyanidin glycosides의 자궁경부암 세포주에 대한 생존율을 확인한 결과 200 μ g/mL에서 40%의 저해활성을 나타내었으며, 시료의 농도가 증가할수록 암세포생육 저해활성이 증가되었다고 보고하 여 본 연구결과와 유사하였다. 따라서 추출용매에 따른 아 로니아 추출물의 항산화 활성 및 자궁경부암 세포 생육 저해활성을 조사한 결과, 50% 에탄올 추출조건이 유용성분 의 추출, 기능적 특성 및 가공비용 등을 고려하였을 때 산업 적으로 적용가능하다 판단된다.
요 약
본 연구에서는 페놀성물질 및 안토시아닌을 함유하고 있어 다양한 생리활성을 가지는 아로니아의 산업적 이용 증대 및 기능성식품 소재 개발을 목적으로 열수추출, 50% 에탄올 추출 및 50% 메탄올을 사용하여 추출물을 제조하였 으며 추출용매에 따른 생리 활성을 조사하였다. 추출수율 은 50% 에탄올, 열수 및 50% 메탄올 추출물 순으로 나타났 으며, 총 당 함량은 35.56~37.68 g/100 g으로 유의적인 차이 는 나타나지 않았다. 총 안토시아닌 함량은 50% 메탄올 추출물이 395.10 mg/100 g으로 가장 높은 함량을 나타내었 으며, 50% 에탄올 및 열수추출물이 각각 318.61 mg/100 g과 252.82 mg/100 g이었다. 50% 메탄올 추출물의 안토시 아닌조성은cyanidin-3-O-galactoside, cyanidin-3-O-arabinoside 및 cyanidin-3-O-glucoside순이었으며, 100 g당 각각 364.65 mg, 163.06 mg 및 35.69 mg으로 가장 높은 함량을 나타내었 다. 총 페놀 함량은 50% 에탄올 및 50% 메탄올 추출물에서 각각 121.38 mg/g 및 122.43 mg/g으로 열수추출물 80.14 mg/g보다 유의적으로 높은 함량을 나타내었으며, 총 플라 보노이드 함량은 총 페놀 함량과 유사한 경향을 나타내었 다. ORAC은 열수 추출물, 50% 에탄올 및 50% 메탄올 추출 물에서 각각 715.66 μM/g, 768.15 μM/g 및 780.77 μM/g로 나타나 50% 에탄올 및 50% 메탄올 추출조건의 항산화 활성 이 높게 나타났다. DPPH radical 소거활성은 50% 에탄올 및 50% 메탄올 추출물이 100~1,000 μg/mL 농도에서 각각 7.96~70.01% 및 8.90~69.21%로 높은 활성을 나타내었으며, superoxide radical 소거활성은 모든 추출물에서 농도가 증 가함에 따라 소거활성이 증가하였다. FRAP는 100~1,000 μg/mL 농도에서 50% 에탄올 추출물이 57.14~817.87 μM이 었고 50% 메탄올 추출물이 67.32~812.78 μM로 나타나 높 은 함량을 보여주었다. Tyrosinase 저해활성은 50% 에탄올 추출물이 100~1,000 μg/mL의 농도에서 23.03~33.82%로 가 장 우수한 활성을 나타내었다. 인간 자궁경부암세포주인 HeLa에 암세포생육 저해활성을 분석한 결과 50% 에탄올 추출물이 100~1,000 μg/mL 농도에서 6.58~76.86%로 유의 적으로 높은 저해활성을 나타내었다. 따라서, 50% 에탄올 추출방법이 아로니아의 생리 활성이 우수한 추출물 제조방 법으로 적합하였으며 기능성 식품 소재 개발에 있어 산업적 으로 적용 가능할 것으로 사료된다.