서 론
새싹채소는 짧은 기간 동안 종자에서 발생하는 싹을 키 워 생육 초기의 어린 배축과 떡잎을 식용으로 하거나, 숙근 초 등의 뿌리나 줄기를 묻어 움을 트게 하여 그 싹을 식용으 로 하는 채소(1)로 우리나라에서 예로부터 즐겨 먹었던 콩 나물이나 무순, 숙주나물과 같은 싹기름 채소도 넓은 의미 로 새싹채소로 포함할 수 있다(2). 최근 well-being이라는 추세로 인해 콜라비(Brassica oleracea var. gongyloides), 적 무(Raphanus sativus L. var. sativus), 브로콜리(B. oleraceavar. italica), 배추(B. rapa var. glabra Regel), 유채(B. napus), 무순(R. sativus) 및 다채(B. campestris var. narinosa) 등의 다양한 십자화과 새싹채소들이 주목 받고 있으며, 소비량 도 점차 증가하고 있다(1,2).
십자화과 채소는 꽃이 십자 모양으로 피는 식물들로, 이 들은 β-carotene, rutin과 같은 phenolic compounds와 섬유소, 각종 비타민류를 풍부하게 함유하고 있다(3). 또한 새싹채 소는 그 생육기간이 짧아 농약을 사용하지 않아 다른 채소 에 비해 농약오염에 대한 걱정을 줄일 수 있고, 깨끗한 물로 만 키우는 환경 친화적인 기능성 청정채소로서, 연중 신선 한 채소를 필요한 시기에 먹을 수 있으며, 채소 자체 내 다량의 효소를 함유하고 있어 소화가 잘 되는 특징이 있다 (4,5). 특히, 새싹이 돋아나는 시기에는 두꺼운 껍질과 배아 속에서 안전하던 씨앗이 수분과 온도가 주어지면서 싹이 트는데, 이때 식물은 성장과 생명유지에 필요한 영양소를 다량 합성하게 되며, 곰팡이, 박테리아 등 외부의 적으로부 터 자신을 보호하는 목적으로 이차대사산물을 생산한다(6).
Fahey 등(7)의 연구에서, 브로콜리에 함유된 항암물질인 sulforaphane의 함유량은 다 자란 브로콜리 보다 새싹에서 40배 이상 많이 함유되어 있다는 사실이 보고되면서 새싹 채소에 대한 관심이 높아졌다. 하지만 다양한 종류의 십자 화과 새싹채소에 대한 항산화활성 및 지방세포 내 reactive oxygen species(ROS) 소거활성에 대한 연구는 아직 초기단 계에 머물러 있다.
따라서 본 연구에서는 국내에서 다소비 되는 십자화과 새싹채소 7종(콜라비, 무순, 배추, 적무, 브로콜리, 다채 및 유채)의in vitro 항산화활성과 3T3-L1 전지방세포에서 ROS 생성 저감 활성을 평가하였다.
재료 및 방법
본 연구에서 사용한 십자화과 새싹채소인 콜라비, 적무, 브로콜리, 배추, 유채, 무순 및 다채는 한국식품연구원으로 부터 제공받아 사용하였다. 이들 새싹채소의 항산화활성 평가를 위하여 다음의 방법에 따라 추출물을 제조하였다. 동결건조 후 분쇄된 새싹채소의 100배에 해당하는 80% 에탄올을 가한 후, 실온에서 18시간 이상 일정 속도로 교반 하여 추출하였다. 그 후 추출액은 여과지(Whatman filter paper No. 4)를 이용하여 2회 여과한 후 하루 동안 정치시킨 뒤 다시 한 번 여과하였다. 그 후 회전식 감압농축기 (EYELA N-000, Tokyo, Japan)를 이용하여 농축시킨 뒤, 동결건조기(FD5510 SPT, Ilshin, Seoul, Korea)를 이용하여 동결건조 하여 추출물을 제조하였다.
마우스 유래 지방세포 3T3-L1 세포주는 American type culture collection(ATCC, CL-173, Manassas, VA, USA)로부 터 분양받아 사용하였다. 실험에 사용된 시약인 folin & ciocalteu's phenol reagent, sodium nitrite, aluminium chloride, sodium hydroxide, catechin, 2,2-diphenyl-1- picrylhydrazyl(DPPH), potassium persulfate, 6-hydroxy- 2,5,7,8-tetramethlychroman-2-carboxylic acid(Trolox), 2,2'- azobis (2-methylpropionamidine) dihychloride(AAPH), 3- isobutyl-1-methylxanthine(IBMX), nitrotetrazolium blue chloride(NBT), dexamethasone(DEX), quercetion, ascorbic acid, gallic acid, N-acetyl-L-cysteine(NAC), trichloroacetic acid(TCA), 2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt(ABTS), potassium ferricyanide, sodium carbonate, 2,4,6-tris(2-pyridyl)-s-triazine(TPTZ), potassium persulfate, insulin, acetic acid 등은 Sigma(sigma-aldrich Co., St. Louis, MO, USA)로부터 구입하였고, Dulbecco’s modified Eagle’s medium(DMEM), bovine serum(BS), fetal bovine serum(FBS), phosphate-buffered saline(PBS), penicillinstreptomycin( P/S) 및 trypsin-EDTA는 Gibco(Gaithersburg, MD, USA)로부터 구입하였으며, XTT{2,3-bis(2-methoxy- 4-nitro-5-sulfophenyl)-2H- tetrazolium-5-carboxanilide innersalt)} assay kit는 WelGene(Seoul, Korea)로부터 구입하였고, fluorescein sodium salt는 Junsei(Junsei Chemical Co., Tokyo, Japan)로부터 사용하였다.
총 페놀 함량은 Folin-Ciocaluteau의 방법(8)을 변형하여 측정하였다. 1 mg/mL의 농도로 제조한 시료 1 mL, 10% Folin-Ciocaltueu's reagent 1 mL과 2% sodium carbonate 용 액 1 mL을 혼합하여 1시간 반응 시킨 후 microplate reader(Molecular Devices, Sunnyvale, CA, USA)를 이용하 여 750 nm에서 흡광도를 측정하였다. Tannic acid를 이용하 여 표준검량선을 작성하였고, 이로부터 시료의 총 페놀 함 량(mg tannic acid equivalent/g)을 산출하였다.
총 플라보노이드 함량 측정은 Moreno 등(9)의 방법을 변형하여 측정하였다. 1 mg/mL의 농도로 제조 한 시료 1 mL에 4 mL의 double distilled water(DDW)와 0.3 mL의 5% sodium nitrite를 첨가하여 5분간 반응 하였다. 0.3 mL의 aluminum chloride를 첨가하고 6분간 반응시킨 후 1 M의 sodium hydroxide 2 mL을 넣었다. DDW로 총 부피를 10 mL로 맞춘 후 microplate reader를 이용하여 510 nm에서 흡광도를 측정하였다. 표준물질로는 catechin을 사용하였 으며, 시료의 총 플라보노이드 함량은 작성된 표준곡선을 이용하여 catechin에 상응하는 양(mg catechin equivalent/g) 으로 환산하였다.
DPPH free radical 소거능은 Abdille 등(10)의 방법을 변형 하여 시료의 항산화활성을 비교하였다. 시료 0.2 mL과 etanol에 녹인 0.4 mM DPPH 시약 0.8 mL을 혼합 후 25℃ 암소에서 10분간 반응시킨 후 517 nm에서 흡광도를 측정하 였다. 다음 식에 의하여 DPPH free radical 소거능을 나타내 었다.
DPPH radical scavenging activity (%) =
동결건조 된 7종의 새싹채소 추출물을 75 mM phosphate buffer(pH 7.4)에 녹여 peroxy radical의 생성과 소멸에 의한 fluorescent의 감소율을 측정하였다. Peroxy radical의 생성 을 위해 AAPH를 사용하였고, 표준물질로 trolox를 사용하 여 Ou 등(11)의 방법을 응용하여 ORAC value를 평가하였 다. Black well plate에 시료 25 μL와 40 nM fluorescein 150 μL을 첨가하고 측정 직전에 37℃에서 15분간 정치하고 150 mM AAPH 25 μL를 첨가한 후 fluorescence microplate reader(Spectramax GEMINI EM, Molecular Devices)를 이용 하여 485 nm에서 전자여기 후 535 nm에서 방출되는 조건으 로 37℃에서 90분간 3분마다 fluorescence의 감소율을 측정 하였다. 표준물질인 trolox를 이용하여 the area under the curve(AUC)를 구하고 이로 표준검량선(y=1.1713x+0.266) 을 작성하여 시료의 peroxy radical 저해능을 정량하였다.
3T3-L1 지방세포에 대한 십자화과 새싹채소 추출물의 세포독성 평가는 Hanks와 Brent(12)의 방법을 변형하여 XTT assay kit를 이용하여 측정하였다. 3T3-L1 지방세포는 실험 전날 1×106 cell 농도로 96-well plate에 seeding 하고 시료를 100 μg/mL 농도로 처리하여 24시간 동안 37℃ CO2 incubator에서 배양하였다. 그 후 XTT 및 PMS(NMethylphenazonium methyl sulfate) reagent를 37℃에서 완 전히 해동 시켜 1 mL의 XTT와 20 μL의 PMS reagent를 혼합하여 working solution을 조제하였다. 이를 96-well medium 부피의 20%가 되는 양 만큼을 각각의 well에 첨가 하여 혼합하였다. CO2 incubator에서 4시간 동안 배양 후, microplate reader를 이용하여 690 nm 흡광도 값에서 450 nm의 흡광도 값을 뺀 결과 값으로 세포독성을 계산하였다.
3T3-L1 전지방세포는 24-well plate에 각각 1×106 seeding 한 후, BS(10%) 및 P/S(1%)를 함유한 High glucose DMEM (89%)에서 100% confluence 될 때까지 CO2 incubator에서 배양하였다. 2일 후 지방세포 분화유도 물질(10 μg/mL insulin, 1 μM DEX, 0.5 mM IBMX)과 FBS(10%) 및 P/S(1%) 를 함유한 DMEM으로 전지방세포를 지방세포로 분화유도 하였다. 지방세포 분화(day 0)시 DMEM에 새싹채소 7종 추출물을 각각 100 μg/mL의 농도로 처리하였고, 이때 시료 의 효과를 관찰하기 위하여 음성 대조군(negative control)에 는 아무것도 처리하지 않았으며, 양성 대조군(positive control)에는 항산화제인 NAC(5 mM)를 처리하여 비교하였 다. 지방세포의 분화는 분화유도 물질을 처리한 후, 2일마 다 지속적으로 10 μg/mL insulin, 1% P/S, 10% FBS가 함유된 배지에 각각의 시료를 처리하여 배양하였다.
분화 과정에 따른 지방세포의 ROS 생성량을 측정하기 위하여 먼저 24-well plate에 배양 및 분화 된 3T3-L1 세포의 배양액을 제거한 후 멸균된 PBS를 이용하여 2회 세척, 0.2% NBT reagent 0.2 mL를 첨가하여 CO2 incubator 안에서 90분 간 반응시킨 뒤 하루 정도 충분히 말린 plate에 DMSO와 1 N KOH를 7:3의 비율로 처리하고, 동량의 증류수를 추가 하여 dark blue formazan을 모두 용출시켰다. 그 후 microplate reader를 이용하여 550 nm에서 흡광도를 측정하 였다.
결과 및 고찰
페놀 화합물은 벤젠고리의 탄소에 phenolic hydroxyl (-OH)기가 결합되어 있는 물질이다. 페놀성 화합물은 식물 계에 널리 분포되어 있는 2차 대사산물의 하나로서 다양한 구조와 분자량을 가진다. 페놀 화합물은 -OH기를 통한 수 소 공여와 페놀 고리 구조의 공명 안정화에 의해 항산화활 성을 가지며 항암 및 항균 효과 등의 생리활성을 가지는 것으로 알려져 있다(14-16). 페놀계 화학물질 중 플라보노 이드는 C6-C3-C6의 기본골격을 가지고 있다. 과채류에는 anthocyanines, catechin, eicatechin, kaempferol, luteolin, myricetin, naringenin, phloridzin 및 quercetin 등 다양한 종류 의 플라보노이드들이 존재한다.
본 연구에서 십자화과 새싹채소 7종 추출물의 총 페놀과 총 플라보노이드 함량을 분석 한 결과는 Table 1과 같다. 무순 추출물의 총 페놀 함량이 24.40±1.24 mg TAE/g으로 가장 낮은 브로콜리 새싹 추출물(18.30±0.80 mg TAE/g)에 비해 약 1.3배 높은 것으로 나타났다. 콜라비 새싹 추출물의 총 페놀 함량이 23.97±0.46 mg TAE/g으로 높게 나타났으며 유채 새싹 추출물(22.17±0.18 mg TAE/g), 적무 새싹 추출물 (21.83±0.34 mg TAE/g), 다채 새싹 추출물(20.68±0.11 mg TAE/g), 배추 새싹 추출물(19.02±0.51 mg TAE/g) 및 브로콜 리 새싹 추출물 순으로 총 페놀 함량을 나타냈다. 총 플라보 노이드 함량의 분석 결과, 무순 추출물이 15.30±1.35 mg CE/g으로 가장 높은 결과를 나타냈고, 유채와 콜라비 새싹 추출물이 각각 13.34±0.58 및 13.08±0.37 mg CE/g으로 높은 값을 나타내었다. 총 페놀의 경우 무순과 콜라비 새싹 추출 물이 유의적 차이가 없었지만 총 플라보노이드의 경우 무순 추출물이 유채와 콜라비 새싹 추출물 보다 유의적으로 높게 나타났다. 플라보노이드는 페놀성 화합물로, 시료간의 유 의성 차이가 비슷한 경향을 나타내는 경우가 많으며, 서양 민들레의 부위별 추출물의 총 페놀 함량과 총 플라보노이드 함량을 분석한 Chon 등(17)의 연구와 같이 두 함량 사이의 상관계수(R2)가 0.9770(p<0.05)으로 매우 높아, 본 연구 결 과와 유사한 경향을 보였다.
식품 내 구성성분의 항산화활성은 식품 내에 들어있는 항산화물질의 함량을 측정하여 산화에 대항하는 능력을 측정하거나, 식품의 섭취 후 생체 내부에서 얼마나 항산화 활성을 갖는지에 대한 능력을 측정하여 알 수 있다(18,19). 이는 전자전달에 의한 항산화활성 측정법과 수소전자의 전달에 의한 항산화활성 측정법으로 나뉜다. 전자 전달에 의한 항산화활성을 측정하는 방법에는 대표적으로 DPPH radical 소거능 측정법이 있으며, ascorbic acid 및 tocopherol, polyhydroxy 방향족 화합물, 방향족 아민류에 의해 전자나 수소를 받아 환원되어 안정한 분자를 형성하게 될 때, 보라 색이 탈색되어지는 원리를 이용하여 다양한 천연소재로부 터 항산화물질을 탐색하기 위해 많이 이용되고 있다. 비교 적 짧은 시간 내에 간단하게 항산화능을 측정할 수 있어 널리 사용되고 있는 방법이다(20). 수소전자의 전달에 의한 항산화활성 측정법은 항산화물질의 free radical 소거능을 측정하는 방법으로, ORAC assay가 대표적인 예이다.
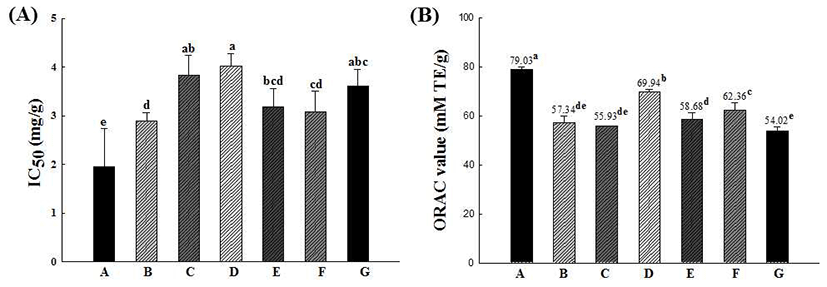
본 연구에서는 십자화과 새싹채소 7종 추출물을 이용하 여 전자전달을 이용한 항산화활성 측정과 수소전자의 전달 을 이용한 항산화활성 측정 두 가지를 함께 진행하여 새싹 7종 사이의 항산화활성을 비교·분석 하였다(Fig. 1). DPPH radical 소거능의 경우 각 시료의 소거능을 측정한 후 대조군 의 흡광도를 50% 감소시키는데 필요한 시료의 농도 (inhibition concentration 50, IC50)로 나타내었다. 그 결과 콜라비 새싹 추출물(IC50=1.95 mg/mL)이 가장 높은 DPPH 라디칼 소거능을 보였고 적무(IC50=2.90 mg/mL)와 무순 (IC50=3.09 mg/mL) 새싹 추출물 순으로 나타났다. ORAC value의 경우 콜라비 새싹 추출물이 79.03 mM TE/g으로 가장 높은 항산화활성을 나타내었고, 그 뒤로 배추 새싹 (69.94 mM TE/g), 무순(62.36 mM TE/g) 추출물의 순서로 나타났다. 이상의 결과를 볼 때, 콜라비 새싹 추출물의 경우 DPPH radical 소거능과 ORAC 효능 평가에서 모두 높은 항산화활성을 나타내었고, DPPH는 적무 새싹 추출물이, ORAC은 배추 새싹 추출물이 각각 두 번째로 항산화활성이 높게 나타났다. 무순 추출물 또한 DPPH radical 소거능과 ORAC 효능이 우수한 것으로 나타났다.
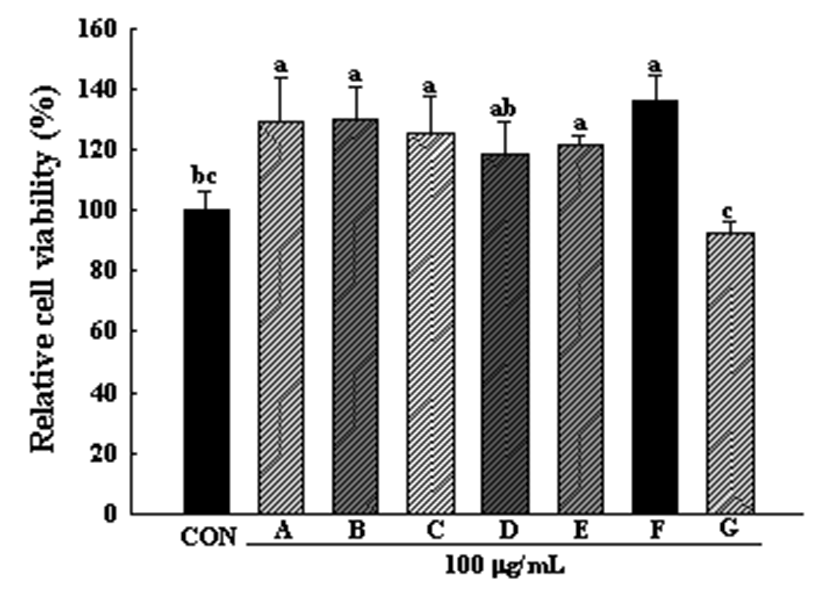
3T3-L1 지방세포에 대한 새싹 7종의 세포독성은 Fig. 2와 같다. 100 μg/mL의 농도로 십자화과 새싹채소 7종 추출 물을 처리한 후 실험을 진행한 결과, 다채를 제외한 6종에서 는 독성이 나타나지 않았다. 다채의 경우 아무것도 처리하 지 않은 control cell 대비 92.56%의 생존율을 보였다.
NBT assay는 NBT 용액이 지방세포 내에 축적된 reactive oxygen species(ROS)와 반응하여 dark blue formazan을 생성 하게 되며, 이를 용출하여 세포 내 ROS의 생성량을 알 수 있다. 이러한 산화적 스트레스는 지방세포의 분화 및 지방 의 축적과 밀접한 관계를 갖는 것으로 알려져 있다(13,21). 3T3-L1 전지방세포에 분화 유도 물질을 처리하여 지방세포 로 분화 시킨 뒤 생성된 ROS 생성량을 측정하기 위하여 NBT assay를 이용하여 측정한 결과는 Fig. 3과 같다. 양성대 조군으로 사용된 NAC는 thiol기를 포함하는 화합물로서 glutathione(GSH)의 전구체이며 천연 항산화제 중 하나로 잘 알려져 있다(22). 시료를 처리하지 않은 대조군과 십자화 과 새싹채소 7종 추출물의 흡광도를 비교한 결과 다채 새싹 추출물을 제외한 콜라비 새싹, 적무 새싹, 브로콜리 새싹, 배추 새싹, 유채 새싹 및 무순 추출물 6종에서 모두 ROS 생성을 저감하는 것으로 나타났다. 다채 새싹 추출물의 경 우는 control과 유의적 차이가 없었다.
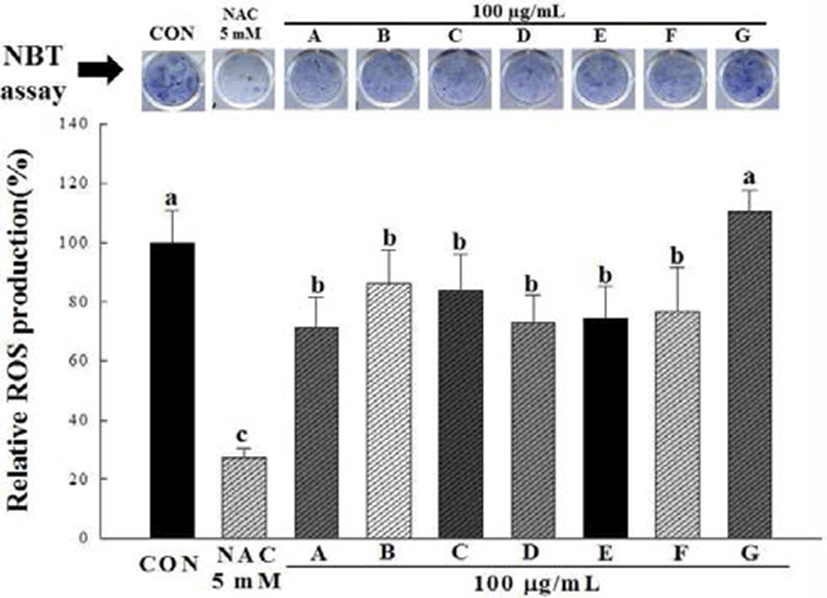
이상의 결과를 통해 지방세포의 분화과정에서 콜라비, 적무, 브로콜리, 배추, 유채 및 무순 추출물의 처리는 지방세 포 내 ROS의 생성을 억제하는 것으로 나타났다. 세포 내 산화적 스트레스는 지방세포의 분화 및 지방의 축적과 밀접 한 관계를 갖는 것으로 알려져 있는데, 에너지대사 경로에 의해 생성된 NADPH는 NADPH Oxidase 4(NOX4)에 의하 여 세포 내 superoxide를 생성한다. 이와 같이 지방세포 내에 서 생성된 ROS와 세포가 분비하는 cytokine들은 새롭게 생성되는 전지방세포의 분화를 촉진시키고, 또한 체내에서 지방세포 주변에 위치한 macrophage에 영향을 미쳐 또 다 른 ROS를 생성한다. 따라서 지방세포의 분화를 억제하는 물질은 ROS의 생성저감을 통한 지방의 축적량 감소에도 영향을 미칠 것으로 생각된다(13,21,23).
요 약
본 연구에서는 국내에서 다소비 되는 십자화과 새싹채소 7종(콜라비, 적무, 브로콜리, 배추, 유채, 무순 및 다채)의 항산화 및 지방세포 내 ROS 생성 억제 활성을 측정하였다. 총 페놀 및 총 플라보노이드 함량을 측정한 결과, 총 페놀 함량은 콜라비 새싹과 무순 추출물이 23.97±0.46 mg TAE/g 및 24.40±1.24 mg TAE/g으로 유의적으로 가장 높은 값을 나타내었고, 총 플라보노이드 함량은 무순 추출물이 15.30±1.35 mg CE/g으로 다른 새싹채소 추출물에 비해 높 은 값을 나타내었다. DPPH radical 소거능과 ORAC value를 측정한 결과, 콜라비가 DPPH radical 소거능(IC50=1.95 mg/mL)과 ORAC value(79,032.5 μM TE/g)에서 모두 항산 화능이 뛰어난 것으로 나타났다. 한편, 다채를 제외한 새싹 채소 추출물 6종 모두에서 세포 내 ROS 생성량을 감소시킴 을 확인하였다. 이상의 결과로부터, 십자화과 새싹채소 중 콜라비 새싹과 무순 추출물의 경우 항산화활성 및 지방세포 내 ROS 생성 억제 활성을 가지며, 천연물 유래 항산화 소재 로써 활용 가능성이 높은 것으로 기대된다.