서 론
우리가 살고 있는 자연계에는 일반적으로 생물의 생육이 어려운 고온, 고압, 강산 및 강알칼리 등의 극한 환경에서 생육 가능한 생물들이 다수 존재하는 것으로 알려지고 있 다. 이러한 특수 환경에 서식하는 생물은 주변 환경조건에 적응할 수 있는 특별한 효소나 각종 대사산물을 생성하며 이들을 산업적으로 유용하게 활용할 수 있다. 그 중 알칼리 내성 미생물은 pH 9.0~11.0의 강알칼리 환경에서 생육하 지만 중성 이하에서는 생육이 느린 미생물이다(1). 알칼리 성 유래 미생물은Bacillus 속 세균이 많이 분리되었고 이들 이 생산하는 효소는 잡균 오염방지와 더불어 발효공업, 식 품공업 및 세제공업 등 생물화학공업에 안정성을 부여하여 산업적으로 이용하려는 연구가 진행되고 있다(2).
섬유소(cellulose)는 식물 세포막의 주요성분이며, 자연 계에 널리 분포되어 있는 고분자 유기물질로 활용가치가 매우 높은 자원임에도 불구하고 이용은 제한적이다. 또한 영양소 섭취라는 관점에서는 부분적으로 반추동물이나 일 부 미생물에 의해 분해․이용될 뿐 대부분이 그대로 폐기되 고 있는 실정이다(3).
섬유소는 지구상에 풍부하게 존재하는 biomass 자원이 며 산업적으로 유용한 물질전환을 위한 연구가 지속적으로 수행되어 왔다(4). 최근에는 cellulose로부터 올리고당과 같 은 기능성 물질 생산뿐만 아니라 차세대 대체 에너지로써 각광을 받고 있는 바이오 에탄올 생산용 원료로 활용하기 위한 연구가 수행되고 있다(5,6). 이러한 관점에서 cellulose 활용을 위해서는 이들 biomass 자원의 구성당인 glucose 분해가 선행되어야 하고, 지구 환경오염의 문제가 현대 사 회에 심각하게 대두되면서 화학적 분해법을 대신하여 미생 물 유래의 효소를 이용한 cellulose 분해의 생화학적 방법이 많은 주목을 받고 있다(7,8).
섬유소를 활용하기 위해, 이들 중합체를 분해하는 미생 물 유래의 효소 발굴이 무엇보다도 중요한 연구 중의 하나 라고 할 수 있으며, 향후 산업적으로 효소 자원을 활용하기 위해, 대량생산 및 유전자 확보 또한 효소 자원 발굴과 함께 반드시 병행되어야 할 중요한 연구 분야라고 할 수 있다(9).
오늘날 다양한 종류의 미생물들이 cellulase를 생산하는 것으로 보고되고 있으며, cellulase는 cellulose를 분해하는 효소로 cellulose에 무작위로 작용하여 비환원성 말단기를 만드는 1,4-β-D-glucan glucanohydrolase(E.C. 3.2.1.4, endoglucanase, CMCase)와 섬유소 사슬이 비환원성 말단기 에 작용하여 cellobiose를 생성하는 1,4-β-D-glucan cellobiohydrolase(E.C. 3.2.1.91, exoglucanase, Avicelase), 그 리고 cellobiose를 glucose로 분해하는 β-D-glucoside glucohydrolase(E.C. 3.2.1.21, β-Glucosidase)의 복합효소이 다(10).
많은 연구자들로부터 cellulose를 효과적으로 분해할 수 있는 미생물의 탐색 및 cellulase에 대한 연구가 진행되고 있는데, 동물이나 곤충의 소화기관과 토양 및 식물 등의 다양한 환경조건에서 cellulase 생산 미생물들이 연구되었 다(11). 특히, Bacillus 속은 호기성 또는 통성혐기성 세균으 로 배양이 간편한 미생물로, amylase, protease, cellulase 등 의 효소를 세포 외부로 분비하는 exoenzyme으로 산업적 연구가 많이 수행되고 있다.
본 연구에서는 한국의 대표 발효식품인 장류에서 cellulase 분비능이 뛰어난 균주를 분리·동정하였으며, 이들 미생물의 배양조건과 효소적 특성을 조사·분석함으로써 산업적으로 활용하는데 있어 기초자료를 제공하고자 한다.
재료 및 방법
본 실험에 수집한 전통 장류에서 시료를 채취하여 멸균 된 생리식염수 (0.85% NaCl)에 현탁시켰으며, 각 단계별 희석액을 0.4% Na-carboxymethyl cellulose(Sigma, St. Louis, MO, USA)과 1.2% plant agar가 첨가된 R2A (LAB M, Lancashire, UK)배지에 도말하고 30°C에서 배양하였다. 각 배지에서 얻은 단일 균주의 replica plate를 만들고 24시 간 배양한 후, 0.1% Congo red(Sigma) 용액으로 염색하였으 며, 1 M NaCl로 세척한 후, 나타나는 투명환이 큰 균주들을 선발하였다.
선발된 균주는 16S rRNA 염기서열을 분석하여 균주를 최종 동정하였다. 선발된 균주의 16S rRNA 염기서열을 분석하기 위해, genomic DNA extraction kit(Qiagen, Germany)로 분리 균주의 genomic DNA를 추출하였으며, 유전자를 증폭하기 위해 primer로는 27F primer (AGAGTTTGATCMTGGCTCAG) 와 1492R primer(TACGGYTACCTTGTTACGACTT) 를사용하였고, PCR은initial denaturation 5분, 그리고 94°C에서 45초간 denaturation, 55°C에서 60초 간 annealing 및 72°C에서 60초간 extension cycle을 35회 수행하였다. 16S rRNA 염기서열 확인은 (주)제노셀사에 의뢰하여 확인하였다(12). Lasergene사의 DNASTAR pro software(SeqMan Pro V8.0)와 The National Center for Biotechnology Information(NCBI, http://www. ncbi.nlm.nih.gov/) 에서 제공하는 advanced blast search 프로그램을 통하여 GenBank에 보고된 유사 균주와의 염기서열을 비교하여 계통분류학적 유연관계를 분석한 후, MEGA v4.0을 이용하 여 Tamura-Nei distance model과 neighbor-joining method에 의해 계통수를 작성하였다(13,14).
분리균의 생육 및 효소 생산능을 조사하기 위해, CMC 액체배지(CMC 1%, Yeast extract 0.1%, (NH4)2SO4 0.1%, NaCl 0.6%, K2HPO4 0.05%, KH2PO4 0.05%, MgSO4·7H2O 0.01%, CaCl2 0.01%, pH 7.0)에 접종하고, 30°C, 120 rpm에 서 진탕 배양하면서 일정시간 별로 시료를 채취하였다. 배 양온도는 20°C, 30°C, 37°C 및 45°C, 초발 pH는 5.0~10.0로 각각 조절하였다. 영양원인 탄소원의 경우, CMC 대신 glucose, xylose, soluble starch, dextrin, cellulose를 각각 1.0% 씩 첨가하였으며, 질소원은 yeast extract, peptone, tryptone, skim milk, ammonium chloride, ammonium sulfate을 각각 1.0%씩 첨가하였다. 균주의 생육은 microplate reader (SYNERGY MX, BioTek, Winooski, VT, USA)로 600 nm에 서 배양액의 흡광도를 측정하였으며, 균주를 배양하면서 채취한 상등액을 사용하면서 효소활성을 측정하였다. 효소 활성은 DNS 환원당 정량법으로 측정하였다(15).
균주를 CMC 액체배지에 접종하고 30°C에서 120 rpm으 로 24시간 전배양 후, 새로운 CMC배지에 5%(v/v) 접종하여 온도조건과 배양시간에 따라 배양한 후, 배양액을 10,000× g, 4°C에서 20분간 원심분리한 상등액을 효소액으로 사용 하였다.
Cellulase 활성도는 DNS 환원당 정량법으로 측정하였다 (15). 즉, 1.0% CMC 500 μL, 200 mM sodium phosphaste buffer(pH 7.0) 250 μL를 2.0 mL tube에 넣은 후, 효소액 250 μL를 첨가하여 50°C에서 15분간 반응시킨 후, CMC로 부터 유리된 glucose 함량을 DNS 환원당 정량법으로 측정 하였다(15). 효소활성도 1 U(unit)는 위 조건하에서 1분간에 1 μM의 glucose에 상응하는 환원당을 생산하는 효소의 양 으로 정의하였다.
Cellulase 활성과 반응에 미치는 pH 및 온도 영향을 조사 하기 위해, 선발 균주가 생산하는 조효소액을 사용하였다. 효소의 최적 pH를 조사하기 위해서, 조효소액을 아래의 각 pH별 완충용액에 넣고 50°C에서 반응시킨 후, 활성을 비교하였다. 사용한 완충액은 0.2 M sodium citrate buffer (pH 4.0, 5.0), 0.2 M sodium phosphate buffer(pH 6.0, 7.0), 0.2 M Tris-HCl buffer(pH 8.0, 9.0, 10.0)이다. 효소의 pH 안정성은 pH 4.0에서 pH 10.0까지 각 pH별 완충용액에 조효소액을 첨가하여 4°C에서 24시간 방치한 후, 각각 0.2 M sodium phosphate buffer(pH 7.0)에 1.0% CMC 용액을 기질로 사용하여 cellulase 활성측정 방법(15)에 따라 측정 하였다. 효소 반응의 최적온도를 조사하기 위해, 조효소액 을 0.2 M sodium phosphate buffer(pH 7.0)에서 1.0% CMC 용액을 기질로 사용하여 20°C에서 70°C까지 구간별로 반응 시킨 후, 효소활성법(15)으로 측정하였다. 온도 안정성은 0.2 M sodium phosphate buffer(pH 7.0)에 1.0% CMC 용액을 기질로 사용하여 조효소액을 20°C에서 90°C까지 15~60분 동안 15분 간격으로 열처리한 후, 효소 활성을 분석(15)하였 다.
효소활성에미치는각종저해제의영향을조사하기위하여, phenylmethylsulfonyl fluoride(PMSF)(Sigma), ethylenediaminetetra acetic acid(EDTA)(Sigma), Iodoacetate, 1,10-phenanthroline (Sigma)과 p-chloro mercuribenzoate (p-CMB)(Sigma) 등 5종 류의 저해제를 조효소액에 최종농도가 각각 1 mM, 5 mM, 10 mM, 20 mM과 40 mM이 되도록 첨가하여 50°C에서 30분간 처리한 후 효소활성을 측정하였다(15-17). 조효소의 기질 특이성은 Avicel, filter paper (Whatman NO.1), CMC, p-nitrophenyl-β-D-glucoside (p-NPG) (Sigma,)를 각각 1% 기 질용액을 제조하여 상기 서술한 효소 활성 측정법으로 효소 활성을 비교하여 기질 특이성을 확인하였다(16,17).
결과 및 고찰
장류 시료에서 미생물을 1차 선별한 후, CMC를 함유한 배지에 접종하여 섬유소 분해 활성을 보유한 균주 중 가장 넓은 투명 환을 보여주는 4-1 균주를 선발하였다. 그리고 표준 균주(Bacillus subtilis KACC10114)와 분리균 4-1의 섬 유소분해 효소활성 결과를 Fig. 1에 나타내었다.

4-1 균주의 16S rRNA 염기서열을 분석한 결과, Bacillus sp.와 높은 상동성을 가지고 있었다. 그리고 4-1 균주의 계통 학적 유연관계를 16S rRNA 유전자의 염기서열을 기초로 Bacillus 속의 표준 종과의 유사도를 분석한 결과, B. subtilis 로 동정되어 B. subtilis 4-1로 명명하였다(Fig. 2).
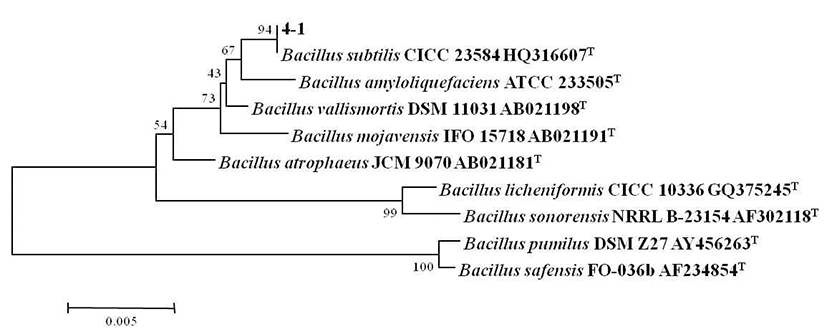
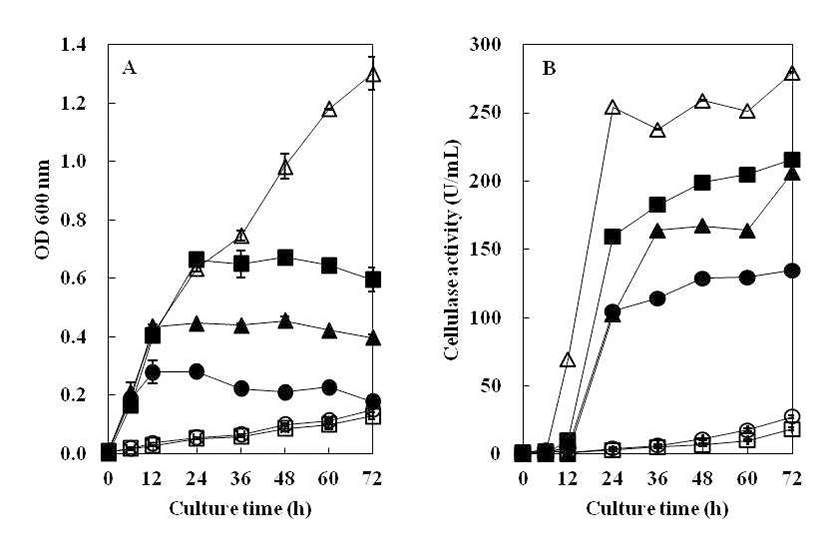
B. subtilis 4-1 균주를 CMC 액체배지에 접종하여 온도별 (20°C, 30°C, 37°C, 45°C)로 조정하여 진탕 배양하면서 온도 에 따른 생육도와 효소활성 결과를 Fig. 3에 나타내었다. 분리 균주의 생육은 30~37°C 중온 조건에서 높은 생육활성 을 보였으며, 특히 37°C 배양조건에서 48시간 때 최대 생육 활성을 나타내었다. 그러나 낮은 온도인 20°C에서는 초기 생육활성이 중온배양 조건에 비해 느리게 나타났으며, cellulase 활성 또한 완만히 증가하는 것으로 나타났다. 45°C 배양조건에서는 배양 초기에 급격한 생육을 보였으며 배양 12시간째에 최대 생육을 보인 정지기에 도달한 후, 급격한 생육 저하로 완만한 곡선을 나타내었다. Cellulase 활성은 45°C에서 24시간 배양하였을 때 활성이 가장 높게 관찰되었 는데 초기 생육속도로 인해 효소의 최대 생산량을 보인 이후 급격히 생육이 저하되면서 활성이 낮아져 다시 완만한 생육 곡선으로 인해 효소활성이 높아진 것으로 추측된다. 일반적으로 Bacillus 속 유래의 탄수화물 분해효소는 세포 의 생장과 더불어 지속적으로 증가하고 정지기에 이르러 최대 활성을 나타내는 것으로 보고되고 있는데(18), 20°C~ 37°C 배양에서B. subtilis 4-1가 분비하는 cellulase는 이러한 경향과 일치하였으나, 고온의 배양조건에서는 급격히 증가 했다가 감소하는 것으로 관찰되었다. 이것은 Ham(19)이 분리한 균주가 30°C에서 72시간 배양하였을 때, cellulase의 활성이 가장 높게 나타났다는 결과와는 차이를 보여 균주마 다 독특한 배양 특성을 가지는 것으로 생각된다.
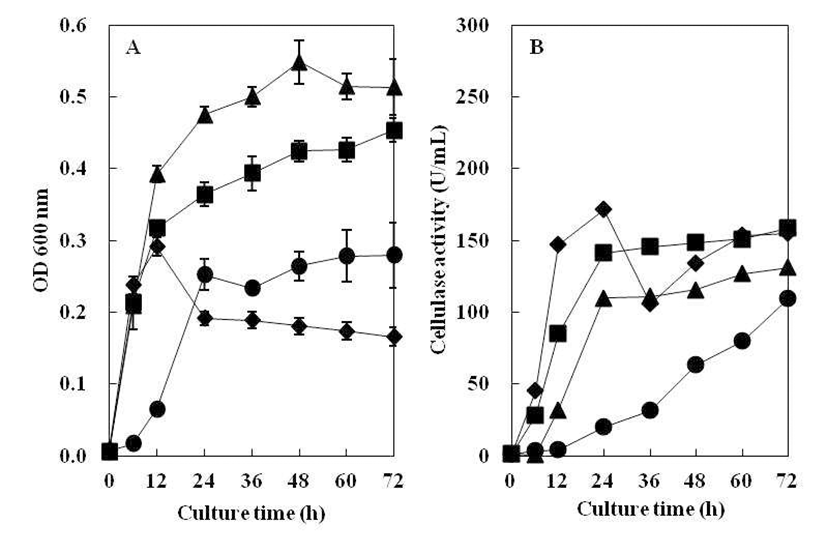
CMC 액체배지의 pH를 5.0~10.0으로 조절하여 B. subtilis 4-1균주를 접종한 후, 72시간 동안 배양하면서 초기 pH에 따른 생육도와 효소활성 결과를 Fig. 4에 나타내었다. B. subtilis 4-1 균주는 pH 5.0~9.0까지 상당히 넓은 범위에 서 생육하였으나 고알칼리성인 pH 10.0에서는 생육하지 못하였다. 분리균 B. subtilis 4-1은 pH 5.0~9.0에서 균의 성장과 cellulase 활성이 높게 나타났으나, pH 10.0에서는 cellulase 활성이 나타나지 않았다. 최적의 pH는 cellulase 활성과 균의 성장이 높은 pH 6.0~7.0으로 관찰되었다. 이 는 Ham(19)의 분리 균주가 pH 5.0 에서 최대 효소활성을 나타난 것과 pH 10.0 이상에서는 효소 생산이 거의 일어나 지 않는 결과와 유사하였고, Kim 등(20)이 분리한B. subtilis CH-10이 pH 4.5~5.5 범위에서 효소활성이 낮게 나타났고, pH 7.5에서 효소활성이 가장 높게 나타났다는 결과와는 차이가 있었는데 이는 같은 종이라도 균주마다 특성의 차이 를 나타내는 것으로 보인다.
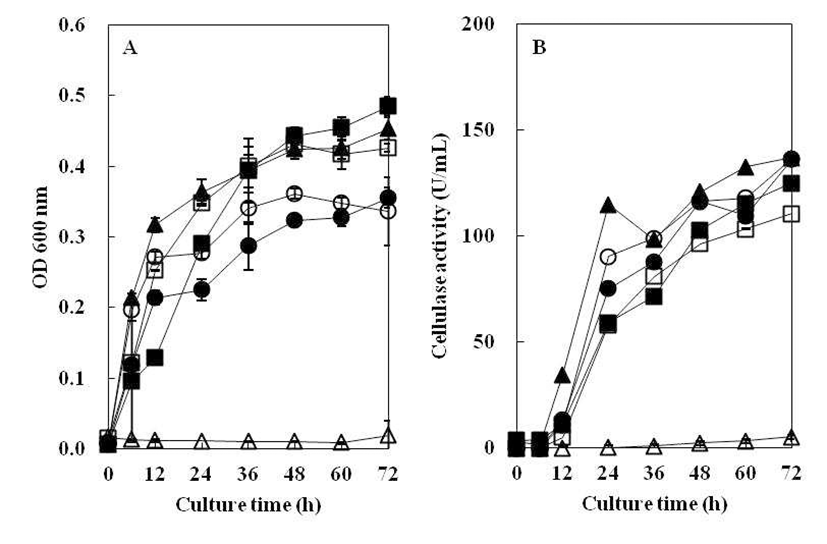
탄소원에 따른 균주의 생육도와 효소생성에 미치는 영향 을 Fig. 5에 나타내었다. 탄소원으로 1.0% soluble starch를 첨가하였을 때, 균의 생육과 효소활성이 가장 높게 나타났 지만 glucose, xylose, dextrin, cellulose 첨가시 균의 생육이 매우 낮았다. Hahm 등(21)은 Bacillus sp.가 CMC를 탄소원 으로 사용하였을 때, 가장 높은 효소활성이 있다고 보고하 였으나, 분리균 B. subtilis 4-1의 cellulase 활성을 분석한 결과(Fig. 5), soluble starch를 탄소원으로 사용하였을 때 가장 높은 효소활성이 나타났고 dextrin 첨가시에도 비교적 효소활성이 높게 나타났다. 그러나 soluble starch, dextrin과 CMC를 제외한 다른 탄소원을 사용하였을 때는 cellulase 활성이 나타나지 않았다. CMC에서는 효소활성이 나타났 지만 cellulose에서는 효소활성이 나타나지 않았는데, 이는 cellulase 대부분이 유도효소로 존재하고, CMC는 저분자 수용성인 반면, cellulose는 거대분자이고 물에 대한 친화력 이 낮아서 효소 유도체로써의 역할을 하지 못한 결과(22)로 보인다. 또한 glucose와 같이 쉽게 대사를 일으키는 탄소원 의 경우, cellulase 생성을 억제시키는 것으로 알려져 있는데 (23), 본 연구의 저분자 탄소원에 나타난 결과도 여기에 기인 한 것으로 추측된다.
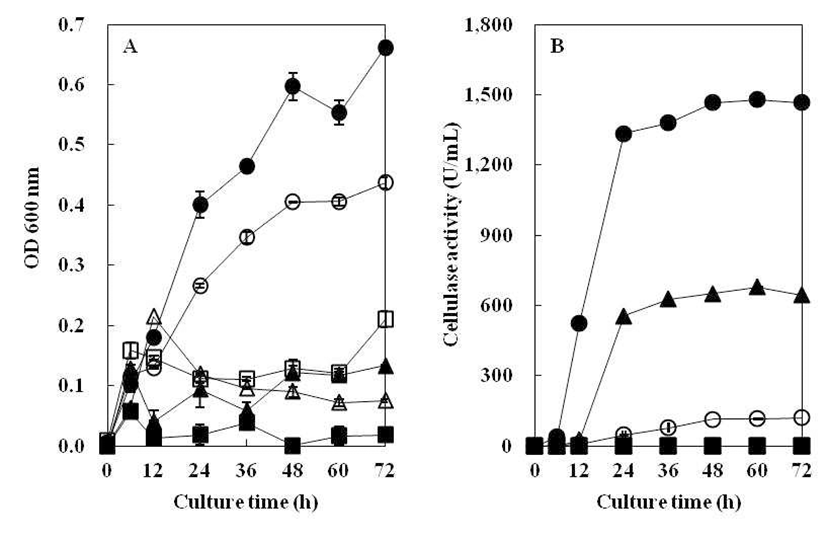
질소원에 따른 균주의 생육도와 효소생성에 미치는 영향 을 Fig. 6에 나타내었다. 균의 성장은 yeast extract를 질소원 으로 첨가하였을 때 가장 높게 관찰되었으며, tryptone, skim milk, peptone, ammonium sulfate, ammonium chloride 순으 로 균주의 생육이 저조한 것으로 나타났다. 특히, 균의 생육 도와 같이 yeast extract를 질소원으로 첨가하였을 때 효소활 성이 가장 높았는데 이는 Hahm 등(21)과 Jeong 등(24)이 질소원으로 1% yeast extract를 첨가하였을 때, 효소 활성이 가장 높았다는 결과와 일치하였다. Yeast extract의 경우, 타 질소원에 비해 고활성의 cellulase 생산을 위한B. subtilis 4-1 배양에 질소원으로 효율적일 것으로 관찰되었다. 그리 고 ammonium chloride, ammonium sulfate를 각각 첨가하였 을 때는 현저하게 낮은 효소활성을 나타내어B. subtilis 4-1 조효소 생산에 이용할 수 없을 것으로 생각된다.
B. subtilis 4-1 균주가 생산하는 cellulase 최적 pH를 조사 하기 위하여 조효소액의 pH를 달리하여 효소활성 측정 결 과를 Fig. 7(A)에 나타내었다. B. subtilis 4-1 균주가 생산하 는 cellulase 활성은 pH 4.0에서 가장 낮았고, pH 5.0~10.0에 서 모두 높게 나타났다. Kim 등(18)의 실험에서 B. licheniformis DK42가 pH 6.0에서 최대 활성을 나타낸 결과 와 달리B. subtilis 4-1 균주는 pH 9.0에서 효소활성이 가장 높았다. 따라서 B. subtilis 4-1에 의해 생성되는 cellulase는 알칼리성 효소로 추측된다.
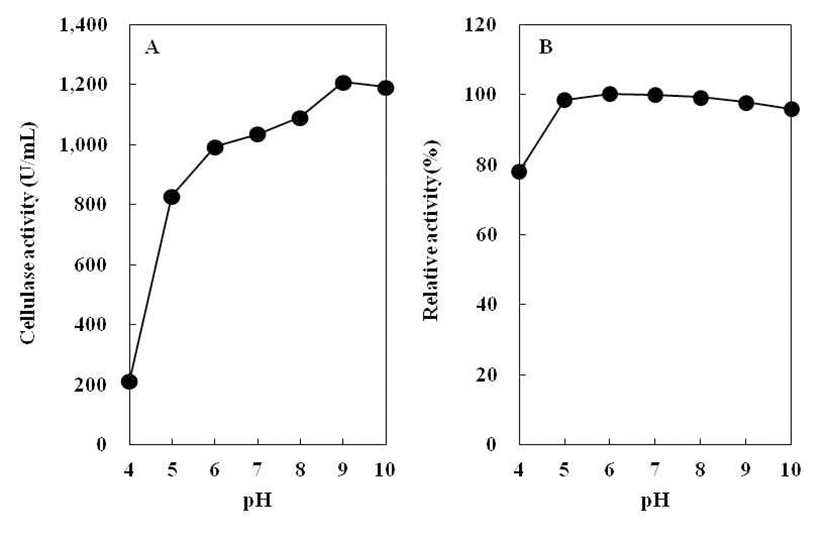
조효소의 pH 안정성을 측정하여 상대 활성으로 나타내 었다(Fig. 7B). Jeong(25)이 분리한 Bacillus sp. 1-5의 pH 안정성을 조사한 결과, pH 2.0~12.0에서 cellulase 활성이 60% 이상 유지되었다고 보고하였다. 그러나B. subtilis 4-1 이 생산하는 cellulase는 pH 4.0에서 효소활성이 약 70~80% 정도 유지되어 상대적으로 낮게 나타났지만, pH 5.0~10.0 에서는 효소활성이 비교적 안정하여 거의 100%로 유지되 었다. 따라서 B. subtilis 4-1 균주가 생산한 조효소의 pH 안정성은 매우 높은 것으로 나타났다.
조효소의 최적 반응온도를 조사하기 위하여 20~70°C의 각 온도에서 효소활성 측정 결과는 Fig. 8(A)와 같다. B. subtilis 4-1 균주가 생산하는 cellulase는 반응온도가 높아질 수록 효소활성은 비례적으로 상승하였다. 그리고 반응온도 60°C에서 효소활성이 가장 높게 나타났으며, 70°C에서는 효소활성이 더 이상 증가하지는 않지만 60°C와 유사한 값으 로 효소활성이 높게 유지되었다. 따라서B. subtilis 4-1 균주 의 효소반응 최적온도는 60~70°C인 것으로 나타났다. 이는 Jeong(25)이 분리한 Bacillus sp. 1-5 균주의 cellulase 효소 반응 최적온도가 20°C로 나타난 결과보다 매우 높은 온도이 다. 따라서 본 실험에서 분리한B. subtilis 4-1 균주가 생산하 는 cellulase의 최적반응 온도는 매우 높은 것으로 생각된다.
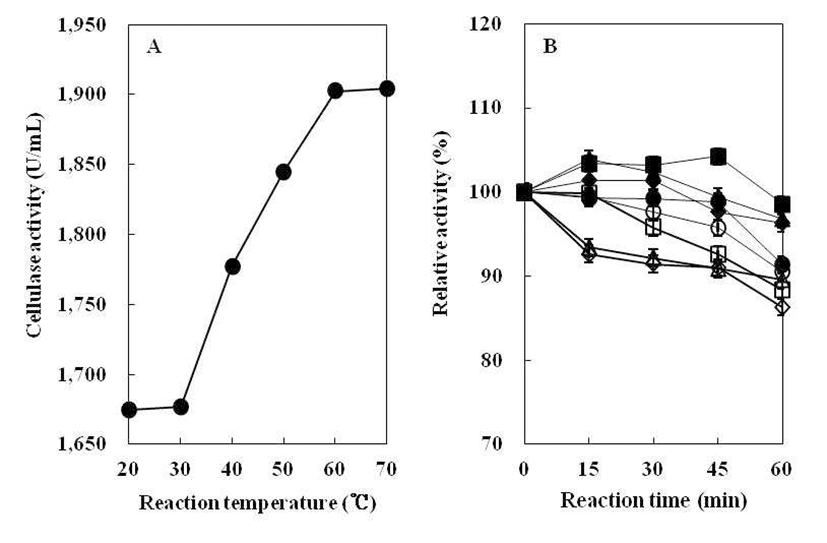
조효소의 온도 안정성을 조사하기 위하여, B. subtilis 4-1 균주의 조효소액을 열처리한 후, 효소 잔여활성을 측정하 여 상대 활성으로 표시한 결과는 Fig. 8(B)와 같다. Kim 등(18)의 실험에서 B. licheniformis DK42가 생산하는 cellulase는 45°C에서 효소활성이 매우 안정하게 유지되었 으나 55°C 이상의 온도에서는 거의 소실된다고 보고하였다. 그러나B. subtilis 4-1 균주가 생산한 cellulase는 20~90°C에 서 60분간 열처리를 하여도 효소활성이 80% 이상 유지되는 것으로 보아 분리균인B. subtilis 4-1이 생성하는 cellulase는 높은 열에도 비교적 안정한 것으로 나타났다.
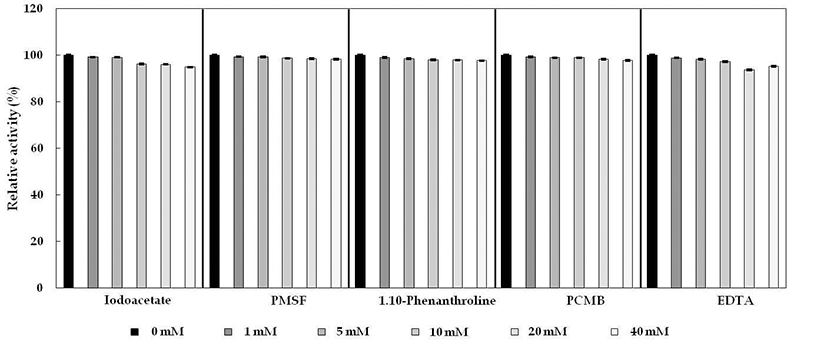
Cellulase 저해제인 PMSF, EDTA, Iodoacetate, 1,10- phenanthroline, p-CMB를 각 농도별(1 mM, 5 mM, 10 mM, 20 mM, 40 mM)로 조정하여 50°C에서 30분간 처리한 후, 효소의 잔여활성 결과를 Fig. 9에 나타내었다. B. subtilis 4-1 균주는 화학 저해제 첨가시, 90% 이상 활성을 유지하였 고 cellulase는 cystein inhibitor인 iodoacetate와 -SH기를 특 이적으로 저해하는 p-CMB에 의해 효소 활성이 크게 영향 을 받지 않았다. 그리고 금속이온의 chelating agent인 1,10-phenanthroline과 EDTA, serine inhibitor인 PMSF의 저 해를 거의 받지 않는 것으로 보아 아미노산인 serine 잔기와 금속이온의 결합이 존재하지 않는 것으로 추정된다.
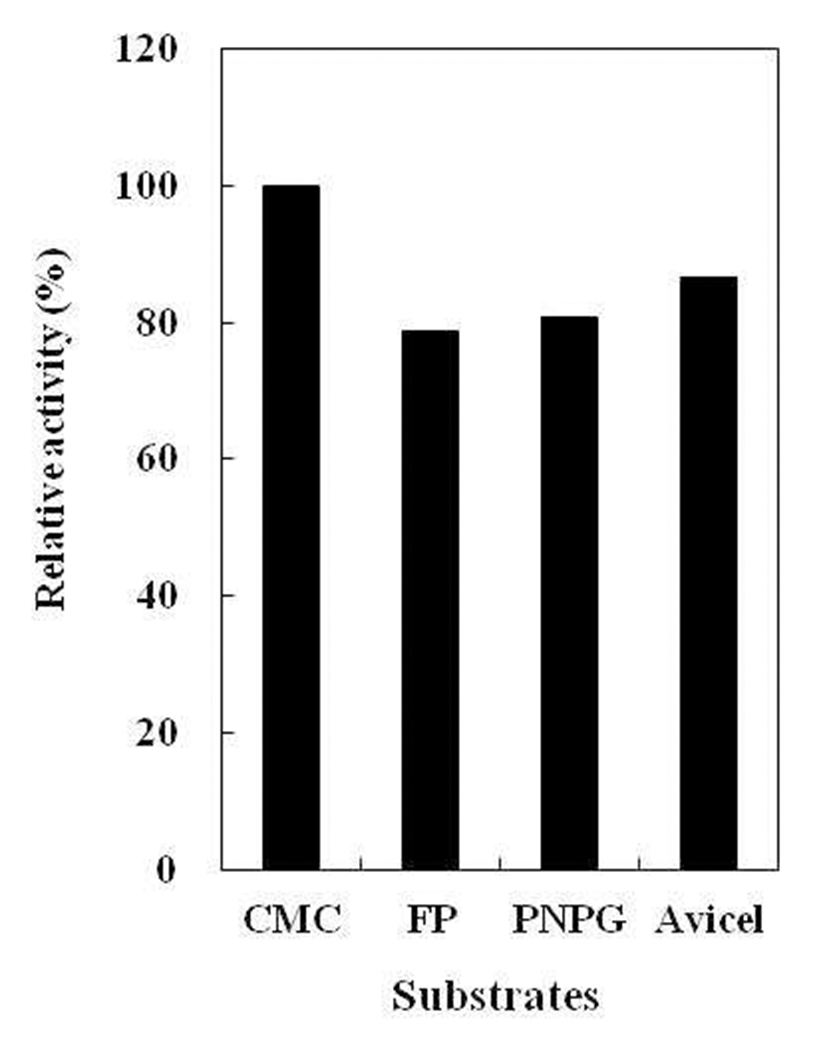
B. subtilis 4-1 균주가 생산하는 cellulase 기질 특이성 확인을 위해, 각각 다른 기질(Avicel, Filter paper, CMC, pNPG)을 이용하여 효소활성을 측정하였다(Fig. 10). 분리 균B. subtilis 4-1은 전체 cellulase의 활성을 나타내는 Filter paper activity(FPase) 뿐만 아니라 avicel과 pNPG에 대해서 도 효소활성이 확인되었고, CMC를 기질로 사용하였을 때 가장 높은 효소활성을 나타냈다. 이는 섬유소를 분해하는 세균이 생산하는 cellulase가 avicel을 기질로 이용했을 때, 가장 많은 효소가 생산된다는 Chey 등(5)의 보고와는 차이 가 있었지만 Kim 등(20)이 분리한 B. subtilis CH-10이 CMC 를 기질로 사용하였을 때 가장 높은 효소활성을 나타낸다는 결과와는 유사하였다. B. subtilis 4-1 균주가 생산하는 cellulase의 경우, endo-type cellulase(EC 3.2.1.4)의 전형적 인 기질로 이용되어지는 CMC에 가장 높은 효소활성을 나 타내었으며 exo-type cellulase(EC 3.2.1.91)의 기질로 주로 이용되고 있는 avicel과 β-Glucosidase(EC 3.2.1.21)의 기질 로 이용되고 있는 pNPG에서도 활성이 나타났다. 이러한 결과로부터B. subtilis 4-1 균주가 생성하는 cellulase는 단일 효소가 아니라 복합효소인 것으로 생각된다.
요 약
수집한 장류 시료에서 분리한 균주들을 CMC를 함유하 는 배지에 접종하여 섬유소 분해 활성이 우수한 4-1 균주를 선발하였다. 4-1 균주의 16S rRNA 염기서열을 분석한 결과, B. subtilis로 동정되었다. B. subtilis 4-1의 효소생산을 위한 최적 배양조건은 탄소원으로 1.0% soluble starch와 질소원 으로 0.1% yeast extract를 첨가하여 45°C에서 24시간 배양 하였을 때로 나타났다. 최적 배양 pH를 조사한 결과, pH 5.0~9.0에서 cellulase 효소활성이 높았다. B. subtilis 4-1의 조효소 특성은 효소반응의 최적 pH가 pH 9.0, 반응온도는 60°C에서 효소활성이 가장 높았으며, 20~90°C 온도에서 60분간 열처리시 효소 활성이 80%이상 유지되었다. 따라서 B. subtilis 4-1에 의해 생산되는 cellulase는 내알칼리성 효소 로 추정되며, 높은 열에도 안정한 것으로 나타났다. B. subtilis 4-1이 생산하는 cellulase는 CMC에 가장 높은 효소 활성을 나타내었으며 avicel과 pNPG에서도 활성을 보여 복합효소로 생각된다.