서 론
현대 산업사회에 있어서 생물자원은 환경 친화적이고 안전한 작업공정으로부터 유용한 물질을 생산할 수 있다는 장점으로 인해 다양한 산업분야에서 활용하기 위한 연구가 진행되고 있다(1). 이러한 생물자원 중에서 특히, 효소자원 은 기질특이성의 특징으로부터 부산물의 생산 없이 목적으 로 하는 유용물질만을 높은 비율로 생산할 수 있다는 장점 까지 다양한 산업분야에 적용할 수 있는 생물자원으로서 많은 주목을 받고 있다(2-4). 일반적으로 산업분야에서 활 용되어지고 있는 효소 자원은 미생물 유래의 효소가 가장 광범위하게 활용되고 있으며 현재까지 보고되어져 있는 산업용 효소 또한 대부분이 미생물에서 유래한 효소라고 할 수 있다. 따라서, 유용한 효소 자원의 발굴을 위해서는 우선적으로 효소를 생산하는 미생물의 발굴이 선행되어야 한다. 현재까지 효소를 생산하는 수많은 미생물들이 보고 되어져 있는데 이러한 미생물 중에서도 특히, 안전성이 확 보된 미생물 유래의 효소는 안전한 생물자원으로서 다양한 생물산업에 활용 가치가 높아 주목을 받고 있다. 이러한 GRAS(generally recognized as safety) 미생물 중에서도 특 히, Bacillus속은 50년 이상 산업적으로 사용되어온 생물자 원으로서 일본, 미국 및 중국 등의 여러 나라에서 프로바이 이오틱 상품으로 시판되고 있다(4-6). 특히, Bacillus 속 미생 물은 amylase, protease, cellulase, glucosidase와 같은 생물산 업에 있어서 널리 활용되고 있는 유용한 효소들을 생산하는 균주로서 알려져 있으며 이들 효소에 대한 특성 또한 다양 한 연구에서 지속적으로 검토되어져 왔다(7-12). Bacillus 속 미생물이 생산하는 효소가 함유된 배양액을 첨가한 가축 사료의 경우 사료의 효율증진, 소화장애 감소, 질병 저항성 증진, 섬유질과 전분 등의 유기물 분해력, 유지방 생산 증가, 악취제거 및 유해균 억제 등의 다양한 기능이 있으며, 특히, Bacillus 속 미생물 유래의 amylase는 식품산업에 있어서 식품원료를 가공하거나 특성을 개선하는데 있어서 오래전 부터 전분을 가공하는 핵심 효소로서 지속적으로 활용되어 져 왔다(13-15). 식품산업에 있어서 전분은 가장 풍부한 식 품 저장 다당류의 하나로 식품공업 및 양조, 섬유, 의약품 등 각종 산업의 중요 소재로 향후 그 활용 분야가 계속 확대될 것으로 기대되어지기에 전분을 가수분해하는 amylase의 식품산업에서의 이용성은 지속적으로 증가될 것으로 예상되어진다(16).
일반적으로 amylase는 세균류, 효모류, 진균류등과 같이 매우 다양한 미생물로부터 생산되는 효소로서 전분을 가수 분해하며 소당류 및 glucose와 같은 식품산업에서 널리 활 용될 수 있는 당류를 생산한다(17). 이러한 관점에서 미생물 유래 유용한 특성을 지닌 amylase의 발굴 및 효소 특성에 대한 연구는 식품산업에 있어서 생물자원의 활용을 확대함 으로서 식품산업 및 생물공학산업의 발전에도 크게 기여 할 수 있는 연구 분야라고 할 수 있다(18,19).
본 연구에서는 GRAS 미생물 중에서Bacillus속 미생물의 분리를 위하여 한국 전통식품인 된장을 활용하였다. 그리 고, 된장 유래 미생물 중에서 특히 amylase 활성이 높은 Bacillus속 미생물을 분리하여 미생물의 동정과 함께 분리 된 미생물의 amylase 생산 특성 및 효소 활성을 조사하였다.
재료 및 방법
균주의 분리 된장으로부터 amylase의 분비능이 우수한 균주는 다음 과 같이 분리하였다. 0.85% 생리식염수에 십진희석법으로 108배까지 희석하고 희석된 용액을 nutrient agar(Difco, Detroit, MI, USA)에 도말하여 37℃에서 24시간 배양하였고 자란 colony를 평판배지에 접종하여 전분분해효소 활성으 로 인한 명확한 활성환을 형성하는 균주를 amylase 생산 균주로 분리하였다. Amylase 활성으로 인해 형성된 활성환 을 확인하는 방법으로는 soluble starch가 2% 포함된 nutrient agar 배지에 균주를 접종한 뒤 37℃에서 24시간 배양한 후 요오드 용액으로 염색하여 형성되는 투명환을 확인하였다.
된장으로부터 amylase 생산균주로서 분리된 균주를 식 품에 적용가능 한 미생물인지 확인을 위하여 ㈜솔젠트 (Solgent Co., Korea)에 분리된 균주 유래의 16s ribosomal RNA 유전자 염기서열 분석을 통한 균주동정을 의뢰하였 다.
분리 동정된 미생물의 생육 조건을 확인하기 위해 초기 pH, NaCl 및 glucose 조건을 달리하여 균의 생육 정도를 600 nm에서 흡광도로 측정하였다. 균 생육에 있어서 pH 영향을 검토하기 위하여 nutrient broth(NB) 배지의 초기 pH를 3~11로 조정 후, 1%(v/v)의 전배양 균주를 각 배지에 접종하여 24시간 배양을 진행하면서 균 생육을 관찰하였 다. 그리고, 균 생육에 있어서 NaCl 및 glucose 농도가 미치 는 영향을 검토하기 위하여 최적 pH의 균생육 배지에 NaCl 농도를 1~4%로 그리고, glucose 농도는 5~40%로 조정하여 1%(v/v)의 전배양 균주를 각 배지에 접종한 후 24시간 배양 을 진행하면서 균 생육을 관찰하였다.
Amylase 활성은 50 mM sodium phosphate 완충용액(pH 7.0)에 0.5% soluble starch를 녹인 후 0.5 mL를 기질로 이용 하였고 미생물의 배양 상층액 0.5 mL를 효소액으로 첨가하 여37℃에서 30분 반응시켰다. 이 때 생성된 환원당의 함량 은 3,5-dinitrosalicylic acid(DNS)방법(20)으로 측정하였으 며, 본 연구에서 효소 활성의 1 unit은 1 분에 1 μmol의 glucose를 생산하는 효소량으로 정의하였다.
분리균주의 배양시간이 amylase 생산에 미치는 영향을 검토하기 위하여 500 mL의 삼각플라스크에 NB 배지를 넣고 121℃에서 15분간 멸균 후, 분리균주의 전 배양액을 1% 접종한 다음 37℃, 180 rpm으로 96시간 동안 배양하면 서 24시간 간격으로 시료를 채취하여 생육특성 및 amylase 효소활성을 측정하였다.
분리균주의 amylase 생산성에 미치는 배지성분의 영향 을 조사하기 위해서 탄소원으로서 soluble starch, corn starch, maize amylopectin, wheat starch를 2% 첨가하고 pH 를 7.0으로 조절한 후 전 배양액 1%(v/v)를 접종하고 37℃에 서 24시간 동안 180 rpm으로 진탕배양 하였다. 배양 후 배양액을 원심분리(9,000×g, 30분, 4℃)한 다음 배양 상층액 을 조효소액으로 사용하여 amylase 활성을 측정하여 amylase 생산에 미치는 탄소원의 영향을 검토하였다.
Amylase 활성에 영향을 미치는 pH, 온도 및 기질특이성 은 37℃에서 24시간 동안 180 rpm으로 진탕 배양한 후 배양 액을 원심분리(9,000×g, 30분, 4℃)하였고 배양 상층액을 조효소액으로 사용하였다. 효소 활성에 미치는 pH의 영향 을 검토하기 위하여 완충용액은 50 mM 완충용액(pH 3~6 ; citrate phosphate buffer, pH 6~8; sodium phosphate buffer, pH 8~9; Tris-HCl buffer)을 이용하였으며, 온도의 영향은 30℃에서 70℃ 온도 범위에서 효소 활성의 특성을 검토하였 다. 기질에 대한 효소 활성의 특성은 0.5%의 soluble starch, corn starch, maize amylopectin, wheat starch를 각각 50 mM sodium phosphate 완충용액(pH 8.0)에 용해하여 기질을 제 조한 후, 50℃에서 30분간 반응 후 효소 활성에 의해 생성된 환원당을 검토함으로서 각 기질에 대한 특이성을 검토하였 다.
배양액 중의 전분 함량 분석은 Lee 등(21)의 방법에 따라 NB 배지와 2% corn starch를 기질로 첨가하여 배양한 배양 액 5 mL 및 0.05 N H2SO4 2 mL를 넣고 100℃로 유지한 수조에서 30분간 중탕한 후 신속히 100 mL 삼각 플라스크 로 시료를 옮긴 다음 냉각한 증류수 20 mL를 첨가하였다. 그리고 20℃에서 25분 방치한 후 KI-I2 용액 0.2 mL를 넣고 30분간교반한다음분광광도계(Ultraspec 2100 pro, Amersham Co., Sweden)를 사용하여 520 nm에서 흡광도를 측정하였고 corn starch(Sigma Co., St Louis, MO, USA)를 이용한 표준곡 선으로부터 전분 함량을 계산하였다.
배양액 중의 총당 함량은 Saha와 Brewer(16)의 방법에 따라 phenol-sulfuric acid법으로 실시하였다. 즉 5% phenol(w/v) 1 mL와 sulfuric acid 5 mL를 NB 배지에 2% corn starch를 기질로 첨가하여 배양한 배양액 1 mL를 실온 에서 반응시킨 후 분광광도계(Ultraspec 2100pro, Amersham Co.)를 사용하여 525 nm에서 흡광도를 측정하였고 glucose(Sigma Co.)를 이용한 표준곡선으로부터 총당 함량 을 계산하였다.
결과 및 고찰
된장으로부터 amylase 생산균주를 분리 한 결과 전분을 기질로 첨가한 고체 배지에서 명확한 활성환을 나타낸 4균 주를 amylase 생산균주로 선정하였다(Table 1). 분리한 균주 를 각각 액체배양하여 획득한 배양 상층액을 효소액으로 이용하여 soluble starch에 대한 amylase 활성을 검토하여 분리 균주의 amylase 효소활성을 확인하였다. 최종적으로 16S ribosomal RNA 유전자 염기서열을 이용하여 BLAST 분석한 결과 분리 한 균주는 B. amyloliquefaciens, B. methylotrophicus, B. subtilis로 나타났으며 모든 균주에서 99%의 유사성을 보이는 것을 확인할 수 있었다. 따라서, 식용가능 한 미생물 중 amylase 활성이 가장 높은 효소활성 을 보인 균주는 충청남도 부여군에서 제조된 된장에서 분리 한 균주였으며, 분리된 균주를B. subtilis CBD2로 명명하였 다. 일반적으로 B. subtilis는 우리나라의 된장(22), 청국장 (23) 등에서 분리되는 균으로서 최근에는 프로바이오틱 균 주로서 식품산업을 비롯한 다양한 산업분야에 높은 잠재적 활용가치를 가지는 균주로서 알려져 있다(24,25).
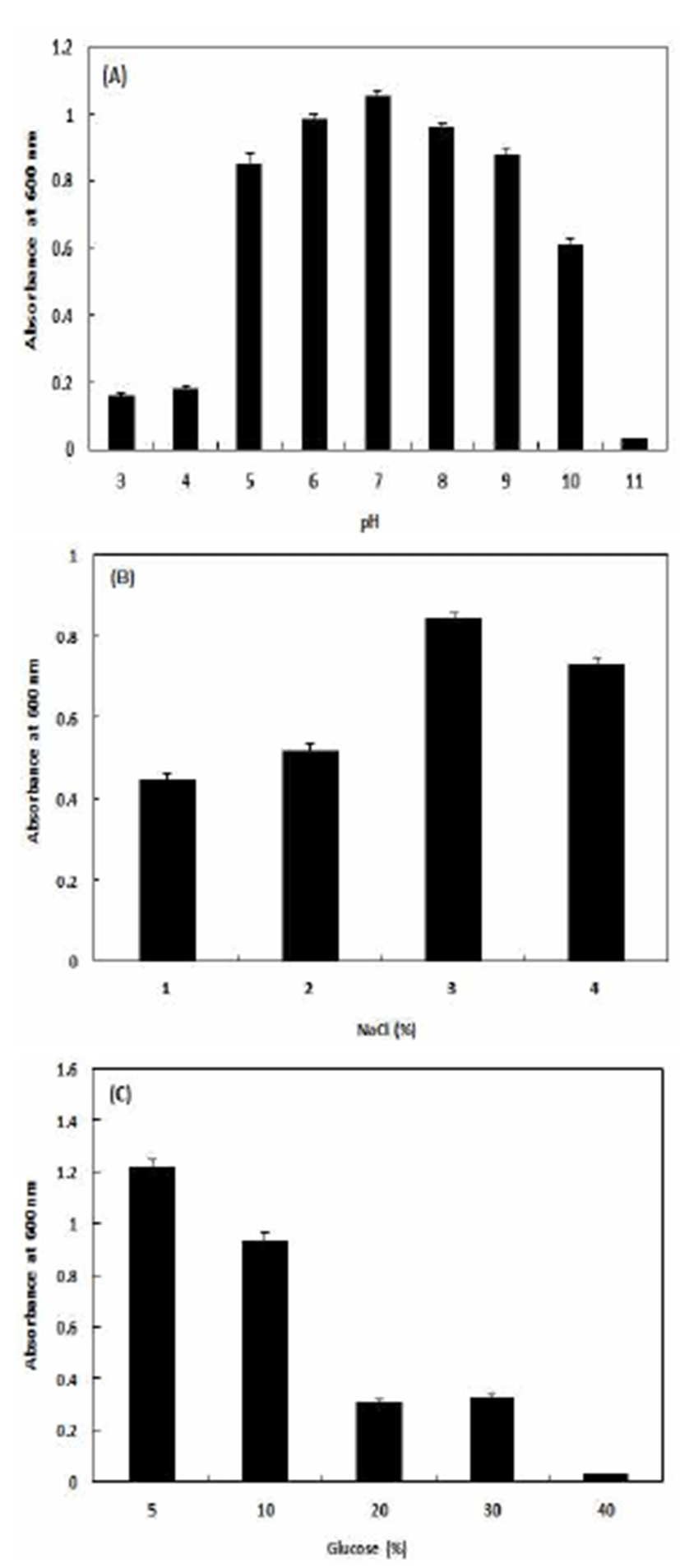
분리된 B. subtilis CBD2의 최적 생육조건을 확인하기 위해 초기 pH를 달리한 배지에서 본 균주를 배양하면서 균주의 생육특성을 검토하였다(Fig. 1). 그 결과 본 균주는 초기 pH 7.0의 배지에서 가장 높은 균 생육을 보였으며 pH 4.0 이하의 조건에서는 균 생육이 현저하게 저하되는 것을 확인할 수 있었다. 그리고, pH 11.0의 조건에서 균 생육은 거의 확인되지 않았다. B. subtilis CBD2의 내염성을 검토하기 위하여 NaCl을 농도별로 첨가한 배지에서의 균 생육특성을 조사하였다. 그 결과 3% NaCl 농도에서 최대 균 생육을 보였으며 4%의 농도부터는 균 생육이 감소하는 경향을 확인하였다. 그리고, glucose를 이용한 B. subtilis CBD2의 내당성은 glucose의 농도를 변화하면서 OD 값을 측정하였으며, 그 결과 10%까지는 균 생육에 큰 영향을 미치지는 않았으나 20%의 glucose 농도부터는 급격히 균 생육이 저하하는 것을 확인할 수 있었다. Choi 등(26)의 연구결과에 따르면Bacillus 속의 생육 최적 pH는 7.0~7.5이 었고, pH 9.0 이상과 pH 5.0 이하에서는 생육이 급격히 저하된다고 보고하였는데 이는 본 실험결과와 유사한 결과 를 나타내었다. NaCl의 구성이온인 Na+와 Cl-이 미생물 생 장에 있어 촉매역할 한다는 연구결과와 유사하게 본 연구에 서도 적절한 농도의 NaCl은 세균 성장에 있어서 좋은 영향 을 미치는 것으로 확인되었다(27). Choi 등(26)의 연구 결과 에 따르면 Bacillus 속의 생육가능 염농도는 0~5%이며, 최 적 염농도는 2~3%이었고, 7% 이상의 염 농도에서 균의 증식이 어려운 것으로 보고하였는데 이는 본 실험과 유사한 결과를 나타내었다.
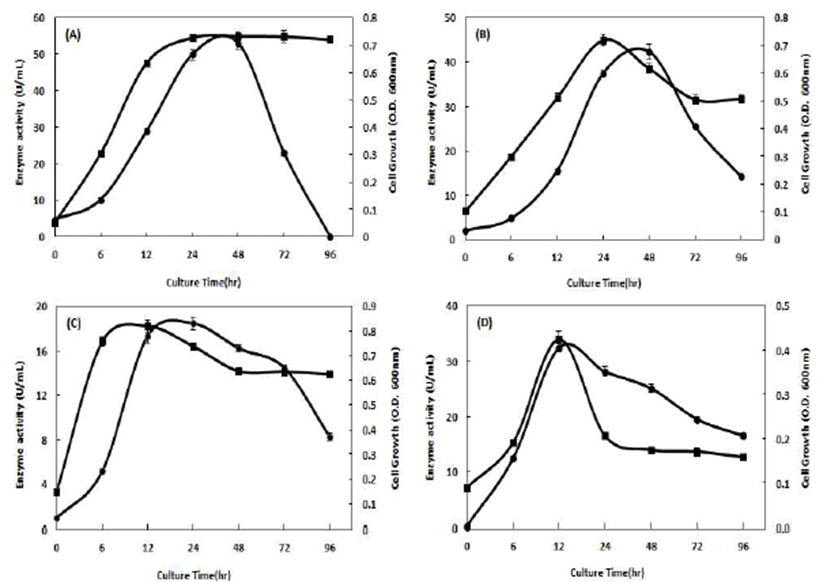
탄수화물 분해 효소를 생산하는 미생물의 배양에 있어서 탄소원의 종류는 효소 수율에 매우 큰 영향을 미치는 성분 으로 알려져 있기에 본 연구에서도B. subtilis CBD2에 의한 amylase 생산과 탄소원의 관계에 대하여 검토하였다(18). 배양시간 및 탄소원의 종류에 따른 amylase 활성을 검토한 결과는 Fig. 1과 같다. 탄소원 종류를 달리하여 균주를 배양 한 후 균주 생육과 배양 상층액에 존재하는 amylase 활성을 검토한 결과, 대부분의 탄소원에서 12시간 배양 시간에서 효소활성이 급격하게 증가하는 것을 확인할 수 있었으며 24시간 배양 시 amylase 활성이 최대임을 확인할 수 있었다. 그리고, 배양 72시간부터는 효소활성이 점차 감소하는 경 향을 나타내었기에 본 균주의 효소 생산을 위한 배양 시간 은 24시간이 가장 효과적인 것으로 검토되었다. 다양한 탄 소원 중에서도 soluble starch를 탄소원으로 이용한 배지에 서 53.03 U/mL로 가장 높은 amylase 활성을 나타내었고 corn starch(42.32 U/mL), wheat starch(32.46 U/mL), maize amylopetin(18.45 U/mL) 순으로 amylase 활성을 보여주었 다. 본 연구 결과로부터 B. subtilis CBD2 균주는 대부분의 탄소원에서 생육에는 큰 차이를 보이지 않았지만 amylase 효소 활성에 있어서는 soluble starch를 탄소원으로 이용하 였을 때 가장 높은 효소 활성을 나타내었기에 본 연구에서 B. subtilis CBD2의 배양을 위한 탄소원으로는 soluble starch 가 적합하다는 것을 확인하였다. Ryu 등(20)의 연구결과에 따르면 된장으로부터 분리한 항균물질 생산 Bacillus subtilis의 특성을 확인한 연구결과에서도 본 연구결과와 유사하게 B. subtilis의 탄소원으로 soluble starch에서 가장 높은 항균활성 및 균 생육도를 나타내었다는 보고하였는 데, soluble starch를 탄소원으로 사용하였을 경우 최적의 amylase 활성뿐만 아니라 항균활성이 부여된 B. subtilis CBD2 배양액 제조가 가능할 것으로 사료된다.
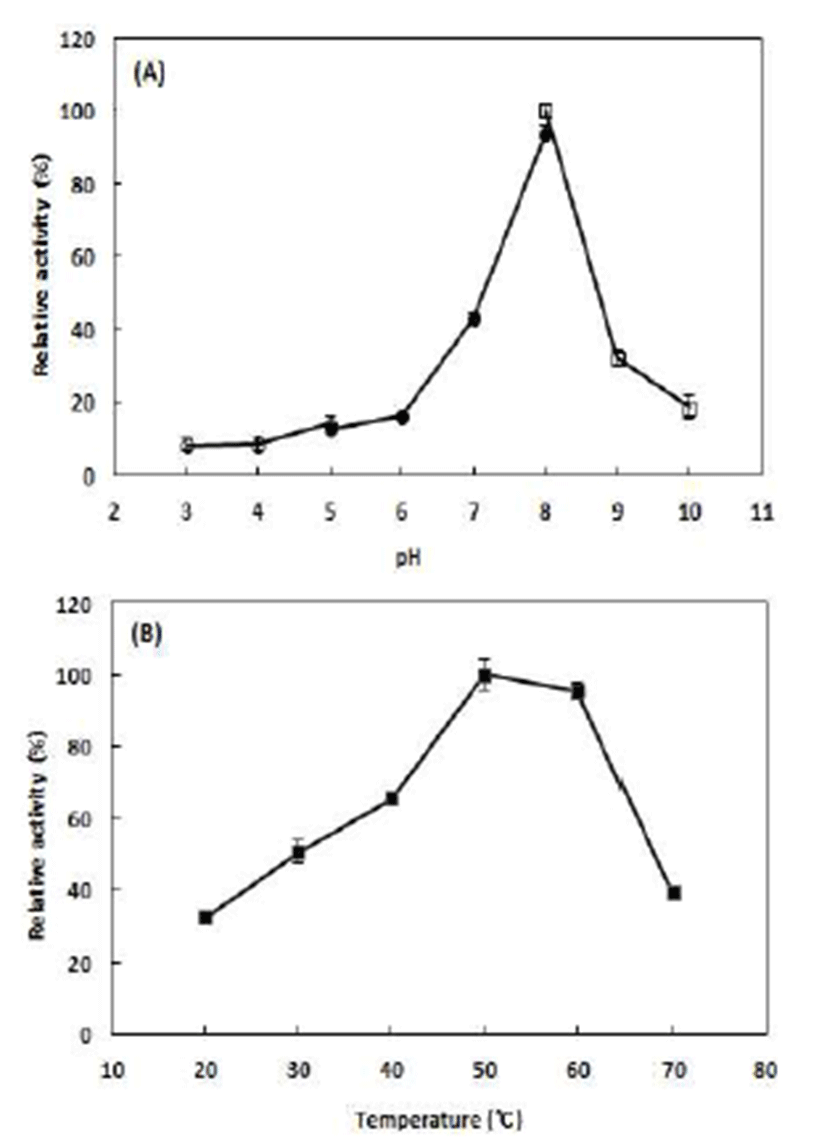
B. subtilis CBD2 유래 amylase의 활성에 미치는 pH 및 온도의 영향을 Fig. 3에 나타내었다. 본 균주 유래의 amylase 는 pH 8.0에서 가장 높은 효소 활성을 나타내었으며, 온도는 50℃에서 가장 높은 효소활성을 나타내었다. 본 연구에서 분리된 균주 유래 amylase는 pH 6.0에서 pH 9.0사이에서 명확한 효소활성을 나타내었으며 pH 3.0에서 pH 5.0 사이 에서는 최대 효소 활성대비 20% 이하의 낮은 효소 활성을 나타내었다. 그리고, 최적 pH가 8.0이며 pH 9.0 및 pH 10.0의 알카리성 영역에서 최대 활성의 20% 이상의 효소 활성을 나타내었기에 본 연구에서 분리된 균주 유래의 amylase는 알카리성 영역에서 효소 활성을 유지하는 효소 임이 강하게 시사되었다. 본 효소가 나타내는 알카리성 영 역에서의 효소 활성은 일반적으로Bacillus속 유래 amylase 의 효소 활성이 pH 5~6의 산성 영역에서 최적 pH를 가지는 것으로 보고되고 있는 관계로 향 후 알카리성의 반응 조건 에서 amylase를 적용할 때 매우 유용하게 활용될 수 있는 효소특성이라고 할 수 있겠다(28,29). 온도에 대한 amylase 의 활성은 20~50℃의 범위에서는 온도가 증가함에 따라 효소 활성도 증가하였으며 60℃에서도 최적 온도에서의 효소 활성과 거의 유사한 활성을 나타내었다. 하지만, 70℃ 부터는 급격한 효소 활성의 저하를 나타내었다. 일반적으 로B. subtilis 유래 amylase는 온도 50~60℃ 범위에서 최적온 도의 특성을 가지고 있기에 온도에 대한 효소 활성의 특성 은 일반적인B. subtilis 유래 효소와 큰 차이를 보이지 않았 다(13,30,31).Fig. 2
B. subtilis CBD2 유래 amylase의 기질에 대한 특이성을 검토하기 위하여 soluble starch, corn starch, maize amylopectin, wheat starch를 기질로 이용하여 효소 활성을 검토하였다. 그 결과B. subtilis CBD2 유래 효소액은 corn starch에 대하여 가장 높은 효소 활성을 나타내었으며, wheat starch와 soluble starch의 두 기질에 대해서는 corn starch와 비교시 약 50% 정도의 효소 활성을 나타내었다 (Table 2). 하지만, amylopectin 함량이 높은 maize amylopectin 에 대해서는 25.4%의 활성을 나타내어 상대적으로 낮은 효소활성이 나타남을 확인하였다.
| Substrate | Relative activity (%) |
|---|---|
| Soluble starch | 59.9 |
| Corn starch | 100 |
| Maize amylopectin | 25.4 |
| Wheat starch | 50.9 |
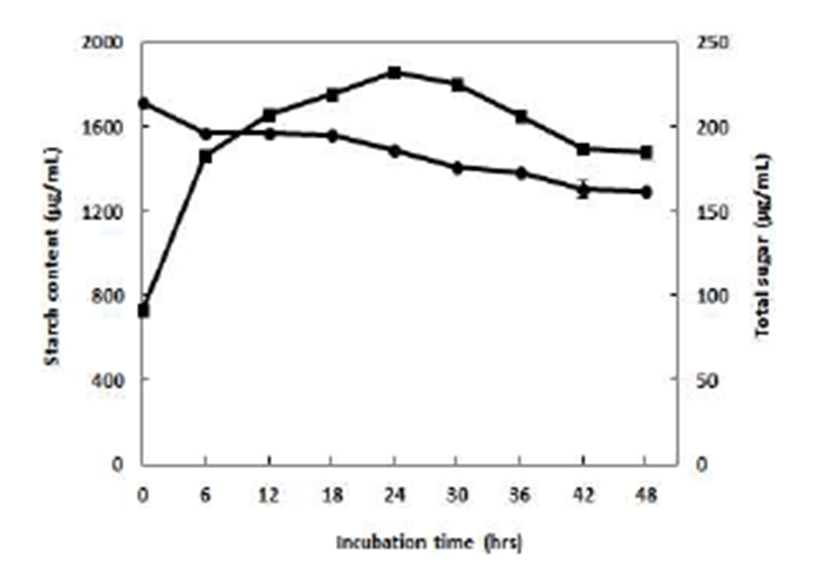
B. subtilis CBD2 유래 amylase는 corn starch에 대하여 가장 높은 효소 활성을 나타내었기에 corn starch를 기질로 이용하여 전분 분해능 및 당생성율에 대한 time course를 검토하였다(Fig. 4). 그 결과 B. subtilis CBD2는 배양시간 24시간에 가장 높은 당 생성율을 나타내었으며, amylase의 corn starch 분해 활성 또한 24시간 배양에서 유의적인 함량 감소를 나타내었다. 그리고 24시간 이후에는 당 생성에는 큰 변화가 없었으며 corn starch의 기질 감소에 있어서도 변화가 관찰되지 않았다. 이러한 결과는 Lee 등(21)의 Bacillus cereus IAM 1072의 말토 올리고당 생성 및 특성 실험에서 배양 18~30시간에서 높은 당 생성율을 나타내었 고 이 후 당 생성 및 starch의 기질 감소에 있어서 변화가 없는 결과와 유사하였다. 따라서 본 실험의 corn starch를 이용한 효소반응은 24시간이 가장 적절한 반응 시간임을 확인하였다.
요 약
본 연구에서는 식품산업에 적용 가능한 amylase의 발굴 을 위하여 된장으로부터 amylase를 생산하는 균주를 분리 하였고, 분리된 미생물들의 동정을 통하여 GRAS 미생물로 부터 생산되는 amylase에 대한 효소 특성을 규명하였다. 그 결과 균주 유래 16S ribosomal RNA 유전자 염기서열에 서B. subtilis로 동정되어 본 균주를B. subtilis CBD2로 명명 하였다. B. subtilis CBD2 균주의 생육에 미치는 배지 성분에 대한 특성을 검토한 결과 본 균주는 pH 7.0, NaCl 3%, glucose 10%에서 가장 높은 균 생육 특성을 나타내었다. 그리고 본 균주의 amylase 생산에 미치는 탄소원의 영향을 검토한 결과, 본 균주는 soluble starch, corn starch, maize amylopectin 및 wheat starch 중에서 soluble starch를 탄소원 으로 사용하였을 때 가장 높은 amylase 생산성을 나타내었 다. B. subtilis CBD2유래 amylase의 활성에 미치는 반응 조건을 검토한 결과 본 균주 유래 amylase는 pH 8.0 그리고 50°C에서 가장 높은 효소 활성을 나타내었으며 기질특이성 에 대한 검토에서는 corn starch>wheat starch>soluble starch>maize amylopectin 순으로 효소 활성을 나타내었다. B. subtilis CBD2가 생성하는 amylase 효소와 corn starch 기질 반응에 대한 전분 분해능 및 당 생성율 변화에서는 24시간에서 가장 높은 전분 분해능 및 당 생성율을 나타내 어 corn starch를 이용한 효소 반응은 24시간이 가장 적절함 을 확인할 수 있었다. 따라서 본 연구에서 분리된 균주는 GRAS 미생물인B. subtilis이었으며 본 균주 유래의 amylase 특성을 활용한다면 향 후 식품산업에 있어서 전분 분해 관련 분야에 유용하게 이용될 것으로 기대되어진다.