서 론
서구화된 식생활과 함께 운동 부족, 흡연, 음주, 스트레스 등으로 인하여 비만, 고혈당, 고혈압과 같은 대사증후군의 유병률이 증가하고 있으며 이에 따라 올바른 영양관리 및 바람직한식습관의중요성이강조되고있다(1,2). Phytochemical 은 식물 유래 생리활성물질로 그 종류가 매우 다양하며 free radical 소거 등을 통하여 단백질, DNA, 지질 등의 생체 분자를 손상시키는 산화적 스트레스(oxidative stress)를 감 소시키기 때문에 이러한 생리활성물질을 포함하는 과일 및 채소의 섭취는 심혈관계 질환, 암과 같은 만성질환의 위험도를 줄일 수 있다는 점에서 주목받고 있다(3). 비만 아동은 총 콜레스테롤, low density lipoprotein(LDL)- cholesterol, triglyceride(TG)가 정상 아동에 비하여 높은 수 준이었으며 정상 아동에 비해 상대적으로 채소 및 과일류의 섭취는 적어 올바른 영양 교육 및 식습관이 중요하다고 하였다(4). 채소와 과일은 total phenol을 많이 함유하고 있 어 radical 소거 활성과 같은 효과가 있으며, 동맥경화를 촉진하는 효소로 알려진 lipoprotein-associated phospholipase A2(Lp-PLA2)의 활성을 저해 한다고 보고되어 있다(5). 또 한, 혼합 채소 주스를 섭취하였을 경우 함유되어 있는 생리 활성물질로 인하여 혈청내 지질 수준이 개선되었고 superoxide dismutase(SOD), glutathione peroxidase(GPx)와 같은 항산화 지표의 활성은 증가하여 비만, 당뇨 등 심혈관 계 질환의 예방이 가능하다는 연구 결과도 있다(6).
산사(Crataegus pinnatifida Bunge)는 특유의 향과 맛을 가지고 있는 장미과(Rosaceae)의 열매로 우리나라 및 중국, 일본 전역에 자생하고 있으며 예로부터 소화기 질환, 고혈 압, 항비만 등의 질환에 이용되어 왔다(7,8). 생산사의 미네 랄 함량은 칼륨이 제일 높다고 알려져 있는데 그 밖에 칼슘, 인, 망간, 아연, 철분, 구리 등의 영양 성분도 함유되어 있다 고하며(9) corosolic acid, (-)-epicatechin, cyanidin-3-galactoside, isoquercitrin, hyperoside 등의 약리성분도 포함하고 있다고 한다(10,11). 또한, 산사 phenol compound의 대부분을 차지 하는 것은 quercetin이며 hyricetin, gentisic acid, caffeic acid, catechin, salicylic acid, ferulic acid, chlorogenic acid, narigin, ρ-coumaric acid도 포함되어 있다고 보고된 바 있다(12). 산 사의 생리활성으로는 트롬빈 저해 활성(13), 위장보호(14), 지방 세포의 분해(15), 혈청 및 간의 지질 농도 개선(16), 기억력 개선(17) 등의 작용이 있다고 보고되어 있다. 한편, 산사에 관한 주요 연구로는 콜레스테롤 합성과 저장에 관여 하는 HMG-CoA reductase 효소 활성 저해(18), 산사 methanol 엑스에서 분리된 ursolic acid 및 (-)-epicatechin, quercetin 등의 monoamine oxidase 활성 억제(19), D-galactose 로 노화를 유발시킨 흰쥐 적혈구의 SOD와 GSH-px 활성 증가 및 혈장 내 총 지방 농도의 감소 효과(20) 등에 대한 연구가 이루어지고 있으나 항산화 효과에 대한 지속적인 연구는 미비한 실정이다. 이에, 본 연구에서는 산사의 천연 항산화제로서의 활용 가능성을 모색하기 위하여 산사 과육 을 용매별로 추출한 후 항산화 활성을 조사하여 biohealth 기능성 식품 소재로 활용하기 위한 기초자료를 얻고자 실시 하였다.
재료 및 방법
본 실험에 사용한 산사는 2011년 10월 중하순 강원도 정선군 남면 일대에서 자생하는 야생 산사를 채취한 후 과육을 분리하여 시료로 사용하였다. 분리한 과육은 진공 동결건조(FDU-2000, EYELA, Tokyo, Japan) 시킨 후 분쇄 기(DCM-5500, Daechang, Seongnam, Korea)로 마쇄하여 -80℃(SW-UF-400, Samwon Co., Busan, Korea)에 보관하며 사용하였다.
진공 동결된 건조 산사 분말 100 g을 취해 70% methanol, 70% ethanol, chloroform :methanol(CM, 2:1, v/v), n-butanol, ethyl acetate (EA) 용매를 10배 가하여(1:10, w/v) 24시간 동안 추출하는 과정을 총 2회 실시한 후 여과(filter paper, Advantec, No.1, Tokyo, Japan)하였다. 각 여과액을 rotary evaporator (N-N series, EYELA)로 40℃에서 농축하여 용매 를 완전히 제거한 후, -80℃(SW-UF-400, Samwon Co.)에 냉동 보관하면서 실험에 사용하였다(21). 시료의 수율은 추출 전 시료 중량에 대한 추출 후 건조 중량 백분율로 나타내었고, 용매별 추출 수율은 70% methanol 추출물 60.45%, 70% ethanol 추출물 59.79%, chloroform:methanol (2:1, v/v) 추출물 31.18%, n-butanol 추출물 13.24%, ethyl acetate 추출물 5.05%를 얻어 본 실험의 시료로 사용하였다.
산사 과육의 전자공여능(electron donating ability, EDA) 은 Blois (22)의 방법에 준하여 측정하였다. 시료 1 mL와 0.4 mM DPPH 2 mL를 혼합하고 37℃에서 30분간 반응시킨 후, 반응액을 UV/VIS-spectrophotometer(Specord 200, Analytik-Jena, Jena, Germany)를 이용하여 518 nm에서 흡 광도를 측정하였다.
산사 용매별 추출물의 환원력은 각 시료 용액 1 mL에 0.2 M phosphate buffer(pH 6.6) 2.5 mL와 1% potassium ferricyanide 2.5 mL를 가하여 50℃에서 20분간 반응시킨 후 냉각시켰다. 반응액에 10% trichloroacetic acid(TCA) 2.5 mL를 가하여 3,000 rpm에서 10분 동안 원심분리시키고, 상등액 1 mL를 취하여 증류수 3 mL 및 0.1% ferric chloride 1 mL를 혼합하였다. 10분 후, UV/VIS-spectrophotometer로 700 nm에서 흡광도를 측정하였다. 환원력은 시료 용액 첨 가군의 흡광도와 무첨가군의 흡광도 차이로 나타내었다 (23).
산사 과육의 추출 용매별 FRAP 활성은 Jeong 등(24)의 방법에 의하여 측정하였다. 즉, 0.3 M sodium acetate buffer (pH 3.6) 및 10 mM 2,4,6-tripyridyl-S-triazine(TPTZ) solution, 20 mM ferric chloride를 10:1:1(v/v/v)의 비율로 혼 합하여 37℃에서 10분간 방치시켜 FRAP 시약을 조제하여 실험에 사용하였다. 시료 0.03 mL에 FRAP 시약 1.5 mL를 가하여 37℃에서 30분간 방치시킨 후, UV/VISspectrophotometer로 593 nm에서 흡광도를 측정하였다. FRAP는 흡광도를 항산화력으로 표시하였다.
7 mM ABTS와 2.45 mM potassium persulfate를 2:1(v/v)의 비율로 섞어 암소에서 12~16시간 동안 방치시킨 후, 이를 5 mM phosphate buffer(pH 7.4)와 혼합하여 734 nm에서 흡광도가 0.7±0.02가 되도록 ABTS 용액을 제조하였다. 시 료 200 μL에 ABTS 용액 2,800 μL를 가하여 정확히 6분 후에 734 nm에서 흡광도를 측정하여 다음의 식에 의해 radical 소거 활성을 나타내었다(25).
산사 과육의 추출 용매별 NO radical 소거 활성은 Yang 등(26)과 Shrishailappa 등(27)의 방법에 따라 시료 0.5 mL에 10 mM sodium nitroprusside 0.5 mL를 가하여 25℃에서 150 분간 반응시켰다. 여기에 1% sulfanilamide 1 mL 및 0.1% naphtylethylenediamide 1 mL를 가한 후 540 nm에서 흡광도 를 측정하였으며 다음의 식에 의하여 NO radical 소거 활성 을 계산하였다.
Hydroxyl radical 소거 활성은 시료 1.5 mL에 10 mM FeSO4 0.2 mL 및 10 mM EDTA 0.2 mL, 10 mM 2-deoxyribose 0.2 mL, 0.1 M phosphate buffer 2 mL, 10 mM H2O2 0.1 mL를 가하여 37℃에서 1시간 동안 반응시켰 다. 반응액에 2.8% TCA 1 mL와 1% thiobarbituric acid(TBA) 0.5 mL를 가하고 100℃의 water bath에서 10분간 반응시켰 다. 반응이 끝난 후, 냉각하여 800 rpm에서 10분간 원심분리 하였고 532 nm에서 흡광도를 측정하였다. 산사 과육의 hydroxyl radical 소거 활성은 다음의 식에 의하여 나타내었 다(29).
결과 및 고찰
산사 과육의 2, 2-diphenyl-1-picrylhydrazyl(DPPH)에 대 한 전자공여능은 Fig. 1과 같으며 대조군인 ascorbic acid를 제외한 모든 실험군에서 농도 의존적으로 증가하는 경향을 보였다. 70% methanol 추출물은 0.2 mg/mL, 0.5 mg/mL, 0.8 mg/mL 농도에서 각각 28.21%, 64.52%, 92.89%로 나타 나 추출 용매 중 가장 높은 활성을 보였고 70% ethanol 추출물은 농도별로 27.58%, 62.81%, 91.17%로 70% methanol 다음으로높은활성을나타내었다. Chloroform:methanol (2:1, v/v) 추출물은 18.61%, 38.77%, 59.34%, ethyl acetate 추출물은 18.01%, 38.17%, 58.06%의 활성을 나타내었으 며, n-butanol 추출물은 17.47%, 37.42%, 57.77%로 나타나 추출 용매 중 가장 낮은 활성을 보였다. 대조군인 ascorbic acid는 농도별로 95.92%, 95.98% 및 95.98%의 활성을 나타 내는 것으로 측정되었다.
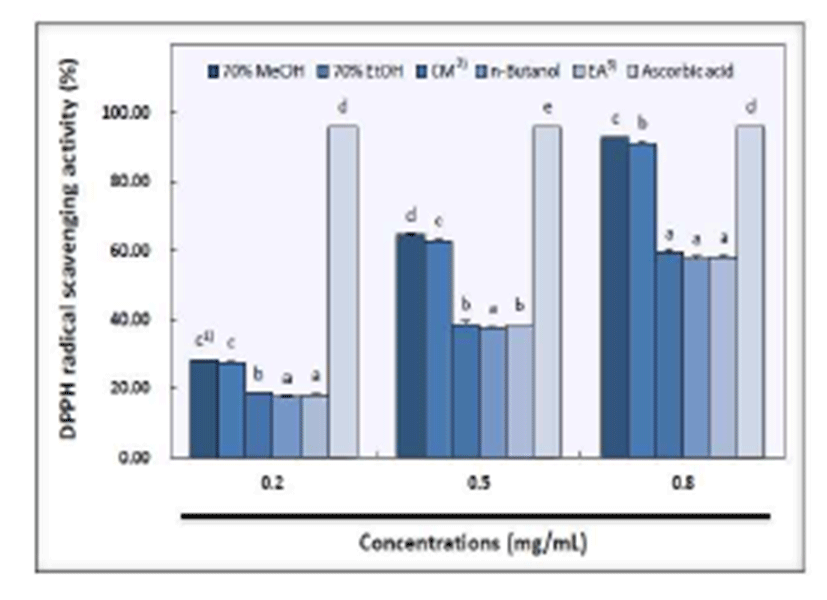
한편, DPPH는 짙은 보라색을 나타내는 안정한 free radical로 항산화 물질과 반응하면 radical을 소거시켜 탈색 되는 반응을 이용하여 측정하며 항산화 작용의 지표로 사용 되고 있다(30,31). Park 등(8)에 의하면 산사 methanol 추출 물에 있어서 용매 분획물의 DPPH 활성은 methanol 추출물 과 ethyl acetate 및 butanol 분획물이 대조군인 α-tocopherol 과 비슷한 활성을 나타내었다고 하였다. 또한, 산약 및 살구 씨, 산사, 지실을 물과 ethanol로 추출한 결과, 물 및 ethanol 추출물 모두에서 산사의 전자공여능이 가장 높게 나타났으 며 특히, ethanol 추출물 1,000 ppm 농도에서 89%의 높은 활성을 보여 산사는 free radical에 의한 lipid peroxidation을 감소시키는 효과가 높은 것으로 확인되어 있다(32).
환원력은 산화를 일으킨 후 반응을 정지시키고 FeCl3를 첨가하여 Fe3+이 Fe2+로 환원되는 반응을 이용한 것으로 이때 Fe2+의 농도로 시료의 환원력을 측정 할 수 있으며, 흡광도 수치 그 자체로 환원력을 나타내므로 환원력이 우수 할수록 흡광도 수치가 크며 진하게 발색되는 것으로 알려져 있다(33). 산사 과육의 농도별 환원력은 Fig. 2와 같이 시료 추출물의 농도가 높을수록 환원력은 증가하였으나 대조군 인 ascorbic acid(0.615, 1.340, 2.303)에 비하여 낮게 나타나 유의적인 차이를 보였다. 또한, 산사 과육의 모든 용매 추출 물에서 농도별로 유의적인 차이를 나타내었으며 과육의 70% methanol 추출물이 농도별로 각각 0.073, 0.149, 0.242 로 다른 용매 추출물에 비하여 가장 높은 환원력을 나타내 었다. 70% ethanol이 0.063, 0.136, 0.224로 70% methanol 다음으로 높은 활성을 나타내었다. n-butanol은 과육 추출물 농도에 따라 0.048, 0.096, 0.162, ethyl acetate 추출물은 0.047, 0.095, 0.158, chloroform:methanol(2:1, v/v) 추출물이 0.046, 0.094, 0.157의 환원력을 보여 서로간의 유의적인 차이는 보이지 않았다.
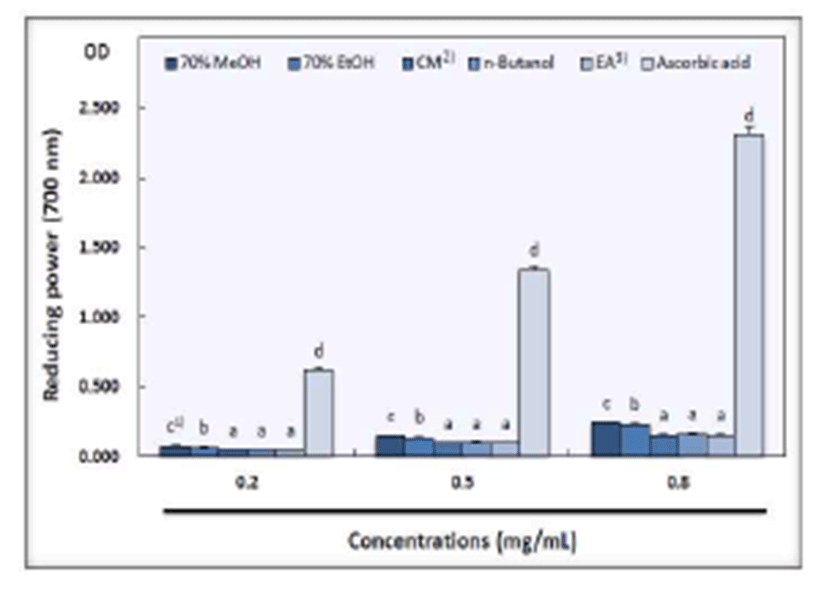
한편, 산사의 환원력은 영지와 하수오 보다 높게 나타났 다고 하며(34), 시료의 농도가 증가할수록 환원력 또한 증가 하고 추출하는 용매에 따라 환원력의 차이는 크다고 보고되 어 있다(35). 이러한 실험 결과는 본 실험 결과와 유사한 것으로 70% methanol 및 70% ethanol 추출물에서 가장 높은 환원력을 보인 것은 추출 용매에 따른 성분의 조성 및 함량 등이 상이하기 때문이라고 생각된다.
산사 과육의 용매 추출물에 따른 FRAP(ferric reducing antioxidant power) 활성은 Fig. 3과 같으며, 모든 추출물에서 농도별로 차이를 보였다. 산사 과육의 70% methanol 추출물 은 시료 농도별로 각각 0.107, 0.242, 0.409의 활성을 나타내 었으며, 70% ethanol 추출물은 농도별로 0.105, 0.240, 0.409 를 나타내어 70% methanol 추출물의 활성이 높게 나타났다. 또한 chloroform:methanol(2:1, v/v) 추출물은 농도별로 0.070, 0.151, 0.250의 활성을 나타내었으며, ethyl acetate 추출물이 0.070, 0.159, 0.264를 나타내어 ethyl acetate 추출 물이 높은 활성을 나타내었다. n-butanol 추출물은 농도별로 0.078, 0.160, 0.269의 활성을 보였다. BHA(butylated hydroxyanisole)는 농도별로 0.851, 1.808, 2.054의 활성을 나타내어 모든 용매 추출물과 유의적인 차이를 보였다.
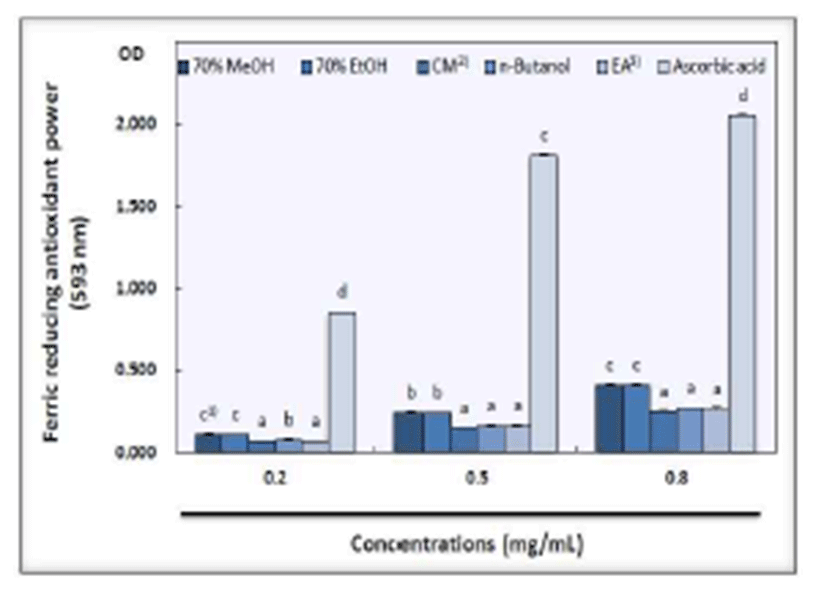
한편, FRAP는 Fe3+- TPTZ 복합체가 항산화 물질에 의해 Fe2+-TPTZ로 환원되는 것을 이용한 것으로 재현성이 높고 간단하며 빠르게 측정할 수 있지만 free radical의 존재여부 보다 Fe3+→Fe2+에 의한 항산화능만 측정이 가능하기 때문 에 환원력이 없는 항산화제는 측정이 불가능 하다는 한계가 있다(36,37). 다양한 과일을 과육, 껍질로 나눠 FRAP를 측 정하였을 때, 그 중 산사의 과육 및 껍질(13.41 mmol/100 g, 29.25 mmol/100 g)이 실험에 사용된 다른 과일(0.14~6.98 mmol/100 g, 0.25~16.69 mmol/100 g)에 비하여 월등히 높은 활성을 보였다고 하였다(38). 따라서 산사 과육의 FRAP 활성은 매우 높아 산사는 천연 항산화제로서 좋은 급원이 될 것으로 생각된다.
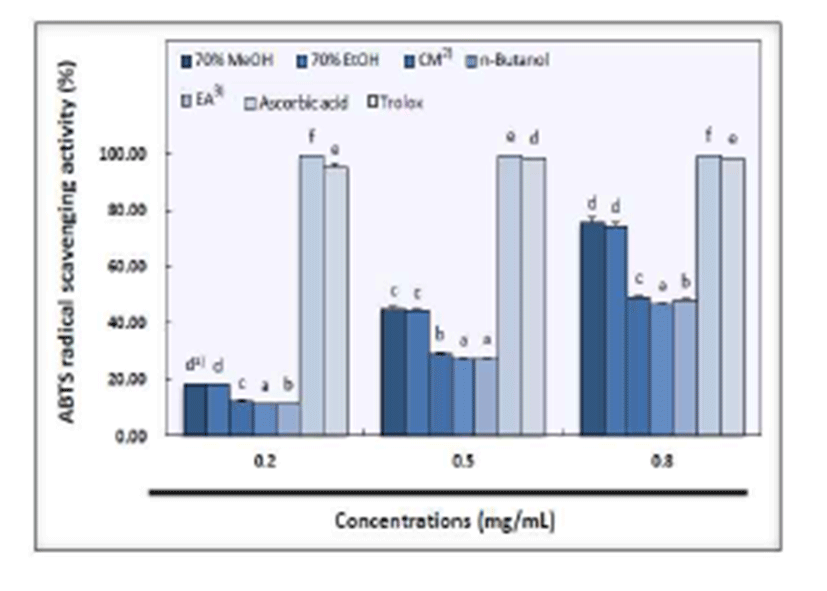
ABTS[2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt] radical 소거 활성의 측정은 시료 중의 항산화 물질이 ABTS radical을 제거하여 탈색되는 정도를 흡광도를 통해서 측정하는 방법으로, DPPH 시험법 은 free radical을 제거하는 것과 달리 ABTS 시험법은 양이 온을 제거하기 때문에 radical 제거 능력에서 차이를 보이며 지용성 및 수용성 물질을 모두 측정할 수 있다는 장점이 있다(39,40). 산사 과육의 ABTS radical 소거 활성은 Fig. 4와 같이, 대조군인 ascorbic acid 및 trolox를 제외한 용매간 의 활성도는 농도 의존적으로 증가하였으며 유의적인 차이 를 나타내었다. 산사 과육의 70% methanol 추출물은 시료 농도별로 18.41%, 44.96%, 75.81%를 나타내어 용매 추출물 중 가장 높은 활성을 나타내었으며, 70% ethanol 추출물은 각각 18.27%, 44.42%, 74.73%를 나타내어 70% methanol 다음으로 높은 활성을 보였다. Chloroform:methanol(2:1, v/v) 추출물은 농도별로 각각 12.24%, 29.24%, 49.27%를 나타내어 70% ethanol 추출물 다음으로 높은 활성을 나타내 었다. Ethyl acetate 추출물은 시료 농도별로 11.51%, 27.77%, 48.24%로 나타났고, n-butanol 추출물은 11.31%, 27.47%, 46.72%로 용매 추출물 중 가장 낮은 활성을 보였다. 표준물질인 ascorbic acid는 농도별로 99.56%, 99.66%, 99.76%를 나타내었고, trolox는 농도별로 각각 95.10%, 98.82%, 98.87%의 활성을 보여 전 농도에서 95% 이상의 높은 활성을 나타내었다. 한편, 대추 열매의 ABTS 소거 활성은 20% 미만이었으나 잎에서는 최고 98.33%의 소거 활성을 보여 열매보다 잎에서 높은 ABTS 소거 활성을 나타 내었다는 보고도 있다(41). 또한, 국내에서 시판되는 다류 의 항산화력을 측정하였을 때, 녹차와 홍차류가 활성이 높 은 것으로 보고되어 있으며 DPPH와 ABTS간에 높은 상관 관계를 보였다고 한다(42). 따라서 본 실험 결과에서도 산사 과육의 ABTS 소거활성은 DPPH와 동일한 경향을 나타내 었다.
용매별 추출물의 NO radical 소거 활성은 Fig. 5와 같으며, 모든 추출물에서 농도 의존적으로 활성의 증가를 나타내었 다. 과육의 70% methanol 추출물은 시료 농도별로 25.24%, 30.37%, 38.85%의 소거 활성을 보였고, 70% ethanol 추출물 은 농도별로 17.72%, 29.10%, 36.21%를 보였다. Ethyl acetate 추출물이 17.00%, 23.11%, 32.61%로 70% methanol 및 70% ethanol 추출물 다음으로 높은 소거 활성을 나타내 었고 n-butanol 추출물이 농도별로 각각 13.44%, 23.09%, 30.40%로 ethyl acetate 추출물 다음으로 높은 소거능을 보 였다. Chloroform:methanol(2:1, v/v) 추출물이 4.56%, 15.36%, 24.29%의 소거 활성을 보여 용매 추출물 중 가장 낮았다. 대조군인 BHA는 농도별로 43.68%, 94.34%, 95.30%를 나타내었으며 용매별 추출물과도 유의적인 차이 를 나타내는 것으로 확인 되었다.
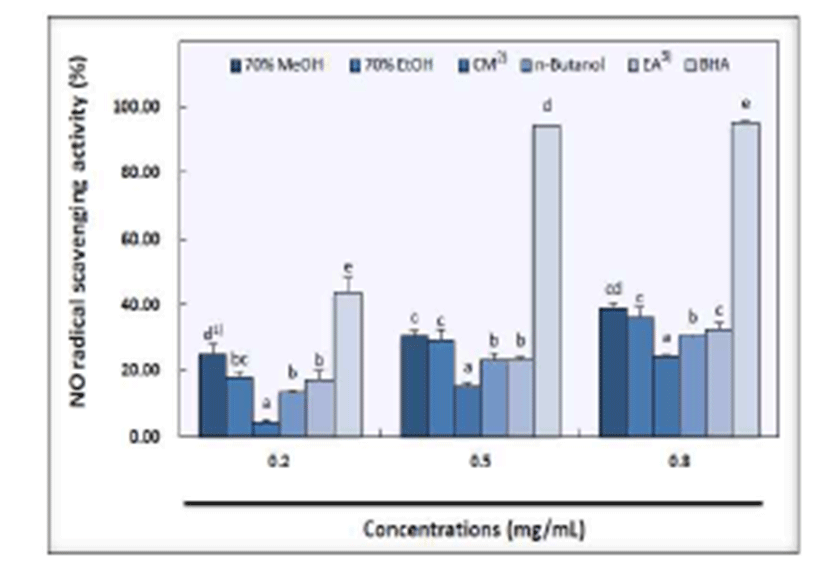
한편, NO radical은 단시간에 작용하는 free radical로 신 경 신호 전달의 이차 전령체(secondary messenger), 평활근 이완, 혈소판 응집 저해, 세포매개 독성과 같은 생리적 과정 의 매개체 및 염증 관련 인자로 알려져 있다(43,44). 녹색 함초 25% ethanol 추출물은 빨간 함초 25% ethanol 추출물 보다 높은 소거능을 보였고 시료 농도가 증가할수록 높아지 는 경향을 나타내었으며(28), 산사 및 인삼 15 g의 추출물은 염증성 반응에 중요한 영향을 하는 NO의 생성을 억제 하여 Alzheimer성 치매의 치료에 유효할 것이라고 보고되어 있 다(45). 따라서 산사는 NO radical 소거능이 뛰어나 기능성 소재로서 응용될 수 있을 것으로 생각 된다.
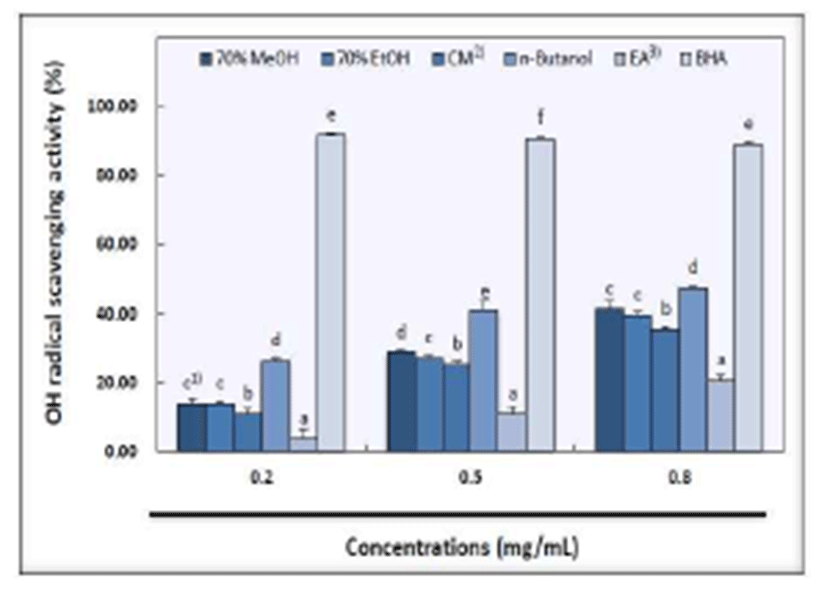
Hydroxyl radical은 Fe2+와 H2O2가 반응하는 Fenton's reaction에 의해 생성 되는 반응성이 강한 free radical로 지 질, 단백질, poly peptide 및 DNA 등과 반응한다고 알려져 있으며, Fenton system에 의해 생성되어진 hydroxyl radical 이 2-deoxyribose를 산화시켜 malondialdehyde(MDA)로 분 해시키는 원리를 이용하여 측정한다고 보고되어져 있다 (29,46). 산사 과육의 hydroxyl radical 소거 활성은 Fig. 6과 같으며 모든 추출물에서 농도가 증가함에 따라 소거 활성도 증가하는 것으로 나타났다. Ethyl acetate 추출물이 농도별 로 각각 3.67%, 11.08%, 20.65%로 나타나 추출 용매 중 가장 낮은 소거 활성을 보였다. 또한, chloroform:methanol (2:1, v/v) 추출물은 10.91%, 25.29%, 35.33%로 ethyl acetate 추출물 다음으로 낮은 소거 활성을 나타내었다. 70% methanol 추출물은 농도별로 14.03%, 28.79%, 41.63%, 70% ethanol 추출물은 농도별로 각각 13.90%, 27.22%, 39.62%의 소거 활성을 나타내었다. n-butanol은 농도별로 26.52%, 40.83%, 47.44%의 소거능을 보여 추출 용매 중 가장 높게 나타났다. 대조군인 BHA는 농도별로 각각 89.23%, 90.59%, 92.03%를 나타내어 다른 용매 추출물보다 높은 소거능을 보였다.
한편, 오미자 열수추출물의 hydroxyl radical 소거능은 500 μg/mL 농도에서 58.7%이었으며 대조군인 BHT는 68.3%의 소거 활성이 있는 것으로 나타났고(47), 두릅나무 의 추출 용매별 hydroxyl radical 소거 활성은 acetone, chloroform, ethanol, methanol, water 순이었으며, 특히 물 추출물에서는 거의 활성이 나타나지 않았고 hydroxyl radical은 지질과산화 억제와 연관이 있다고 보고되어 있다 (29). 여주의 부위별 hydroxyl radical 소거 활성은 풋열매에 서 39.7%, 잎은 39.2%, 줄기에서는 34.0%의 활성을 보였다 고 한다(48). 본 실험 결과 n-butanol 및 70% methanol 추출물 에서 hydroxyl radical 소거 활성이 높게 나타났다.
요 약
산사과육을70% methanol, 70% ethanol, chloroform:methanol (CM, 2:1, v/v), n-butanol, ethyl acetate(EA)로 추출하여 시료 농도 0.2 mg/mL, 0.5 mg/mL, 0.8 mg/mL 농도에서 각 추출물 의 항산화 활성을 비교하였다. DPPH radical 소거 활성은 70% methanol, 70% ethanol, chloroform:methanol(2:1, v/v), ethyl acetate, n-butanol 추출물 순으로 높게 측정되었고 특 히 70% methanol 및 70% ethanol 추출물은 다른 추출물에 비하여 유의적으로 높은 것으로 나타났으며(p<0.05), 0.8 mg/mL 농도에서 각각 92.89%, 91.17%의 높은 활성을 나타 내었다. 환원력과 ferric reducing antioxidant power(FRAP) 는 동일한 경향을 나타내었는데 활성은 70% methanol, 70% ethanol, n-butanol, ethyl acetate, chloroform: methanol(2:1, v/v) 추출물 순으로 높게 나타났으며, 70% methanol 및 70% ethanol 추출물이 다른 추출물에 비하여 높은 것으로 측정 되었다(p<0.05). ABTS radical 소거 활성은 DPPH와 동일한 경향이었으며 0.8 mg/mL 농도에서 70% methanol 및 70% ethanol 추출물은 각각 75.81%, 74.73%의 활성을 나타내었 다. NO radical 소거 활성은 70% methanol, 70% ethanol, ethyl acetate, n-butanol, chloroform:methanol(2:1, v/v) 추출 물 순으로 나타났고, hydroxyl radical 소거 활성은 n-butanol, 70% methanol, 70% ethanol, chloroform: methanol(2:1, v/v), ethyl acetate 추출물 순으로 측정되었다. Hydroxyl radical 소거 활성을 제외한 다른 실험 결과에서 70% methanol 및 70% ethanol 추출물은 다른 용매 추출물에 비하여 유의적으 로 높은 것으로 나타났고 chloroform: methanol(2:1, v/v), ethyl acetate, n-butanol 추출물 간에는 대부분 유의성이 없 는 것으로 측정되었다(p<0.05). 본 실험 결과 산사 과육 추 출물의 항산화 활성은 우수한 것으로 나타났고 특히, 70% methanol 및 70% ethanol 추출물에서 높은 활성을 보였다. 따라서 산사는 천연 항산화제 및 기능성 식품 소재로서 활용될 수 있을 것으로 생각된다.