서 론
최근 천연물을 대상으로 성인병의 주된 원인인 활성산소 종을 억제시키기 위해 항산화제에 대한 연구가 다양하게 수행되고 있다. 특히 동양의학과 대체의학에 대한 관심이 고조되면서 민간에서 치료 및 예방의 목적으로 사용되고 있는 각종 생약이나 야생 산채류 등 약용식물을 대상으로 천연항산화제에 대한 연구가 활발히 이루어지고 있으며 (1,2), 식물에서 유래된 페놀 화합물 및 비타민 등의 천연항 산화제가 산화손상에 대한 화학적 예방 촉매기능이 알려짐 에 따라 저공해 채소류, 약리작용이 우수한 채소 및 산채류 에 대한 관심이 커지고 있고, 식품에 있어서도 기능성을 지닌 제품에 대해 소비자들의 관심이 증가하고 있다(3,4). 이에 따라 야생 산채류에 대한 관심이 고조되어 가고 있어 자연식에 대한 기호가 높아지면서 각종 산채를 채취 또는 재배하여 식용으로 이용하는데 관심이 높아지고 있다. 산 채는 320여종이 자생되고 지역적으로 전국에 고루 분포하 고 있으며(5), 특히 비타민, 무기질 및 섬유소가 풍부하고 지방과 단백질의 함량은 매우 낮은 식용 작물로서, β -carotene, ascorbic acid, 무기질 및 섬유소가 풍부하며, 오랜 옛날부터 그 특유의 맛과 향, 식생활 습관, 계절감 등 다양한 이유로 부식으로서 이용되고 있다(6,7).
참취(Aster scaber )는 우리나라 전국 각지의 산야지에 흔 히 자생하며 농가에서 재배하기도 하는 국화과에 속하는 다년생 초본으로 백운초, 백산국, 동풍, 나물채, 암취 및 나물취라고도 한다. 해수, 이뇨, 보익, 방광염, 두통, 현기증 등에 효과가 있는 것으로 알려져 있다(8). 참취의 채취는 5월경 어린잎을 나물 또는 묵나물로 식용하며, 참취의 어린 순은 취나물이라 하며 맛은 대체로 향긋하고 쌉쌀한 특징을 가지고 있다. 참취의 소비 형태는 종래에는 주로 통조림 등으로 가공되거나 건조한 후 나물의 원료로 이용되었으 나, 최근에는 생산 및 유통기술의 개선과 소비자의 고품질 제품에 대한 선호 추세에 따라 생식 또는 blanching 된 상태 의 유통비율이 증가하고 있으며, 특히 외식산업의 발전과 더불어 다양한 식품원료로서 사용성이 증가하고 있다(9). 또한 최근에는 한국 산야의 숲이 무성해짐에 따라 많은 낙엽으로 인한 야생 산채의 뿌리 부패현상과 일조량의 부족 에 따라 야생 산채의 생육이 어려짐으로 그의 생산량이 급감현상이 일어나고 있다. 우리나라의 농촌은 식품 재료 의 다양화에 따라 산야의 부족자원을 이용한 농업이 발전되 어 산채 및 약초 등의 재배 생산되고 있으며 그의 재배면적 과 생산이 급증하고 있다. 또한 이를 이용한 가공식품의 개발과 더불어 산채의 가공산업이 발전되어 가고 있는 실정 이다.
따라서 야생의 산채가 급감하고 산채의 인공 재배가 증 가함에 따라 인공 재배 산채의 생산량의 증대와 이를 이용 한 가공산업 발전의 기초 자료를 제시하고 야생 및 재배 참취의 품질 특성을 비교하고자 본 연구에서는 경북 영양 일원에서 대량으로 생산되고 있는 재배 참취와 산야에 생육 하는 야생 참취의 건조방법에 따른 추출물의 항산화성을 비교 분석하였다.
재료 및 방법
본 실험에 사용된 참취(Aster scaber)는 경북 영양 일대에 서 채취한 야생 참취와 경작지에서 재배한 참취를 직접 채취하였으며, 채취한 참취는 이물질을 제거 및 세척한 후 실온에서 건조한 것을 생채건조, 100℃ 끓는 물에서 20분간 블랜칭 후 실온에서 건조한 것을 블랜칭 건조로 구분하여 각각 10 g, 50 g, 100 g단위로 일정량을 담아 -75℃ deep freezer(MDF-U52V, Thermo, San Francisco, CA, USA)에 보관하면서 시료로 사용하였다.
열수 추출물은 야생 및 재배 참취의 생채, 생채건조, 블랜 칭 건조 각각 50 g씩 분쇄기로 잘게 마쇄한 후 10배에 해당 하는 3차 증류수를 각각 가한 후 85℃에서 3시간 동안 환류 추출하였다. 이 과정을 3회 반복 추출하여 모아진 각각의 추출액은 여과지(Whatman No. 4)로 여과하여 제조하였다. 각 추출액은 회전식증발 농축기(R-210, Buchi, Frawil, Swizerland)로 감압농축 및 동결건조기(FD5510SPT, Ilshin, Daejeon, Korea)를 사용하여 동결 건조하여 각 추출물의 시료를 제조하였다.
폴리페놀 화합물의 함량은 Folin-Denis법(10)으로 측정 하였다. 즉, 야생 및 재배 참취 10 mg/mL농도로 증류수에 녹인 다음 0.2 mL를 시험관에 취하고 증류수를 가하여 2 mL만든 후 여기에 0.2 mL Folin-Ciocalteu`s phenol reagent 를 첨가하여 잘 혼합한 후 3분간 실온에 방치하였다. 정확히 3분 후 Na2CO3 포화용액 0.4 mL를 가하여 혼합하고 증류수 를 첨가하여 4 mL로 만든 후 실온에서 1시간 방치하여 흡수분광광도계(UV-2001, Hitachi, Tokyo, Japan)를 이용하 여 725 nm에서 흡광도를 측정하였다. 이때 총 폴리페놀 화합물은 tannic acid(Sigma Chemical Co., St. Louis, MO, USA)를 이용하여 작성한 표준곡선으로부터 산출하였다.
플라보노이드 함량은 Moreno이 행한 방법(11)에 의해 측정하였다. 즉, 야생 및 재배 참취 추출액 0.1 mL를 취하여 10% aluminum nitrate와 1 M potassium acetate를 함유하는 80% ethanol 4.3 mL에 혼합하여 실온에서 40분간 정치 한 후 흡수분광광도계(UV-2001, Hitachi)를 이용하여 415 nm 에서 흡광도를 측정하였다. 총 플라보노이드 정량은 quercetin(Sigma Chemical Co.)을 이용하여 작성한 표준곡 선으로부터 산출하였다.
전자공여능(EDA : electron donating ability)은 Blois 등 (12)이 행한 방법에 준하여 각 시료의 DPPH(1,1-diphenyl- 2-picryl hydrazyl)에 대한 전자공여 효과로써 시료의 환원 력을 측정하였다. 즉, 참취 각 추출물을 농도별로 제조한 시료 2 mL에 0.2 mM DPPH 용액 1 mL를 가하고, 10초간 혼합기로 믹싱 한 후 37℃에서 30분간 반응시킨 다음 이 반응액을 흡수분광광도계(UV-2001, Hitachi, Tokyo, Japan) 를 사용해서 517 nm에서 흡광도를 측정하였다. 전자공여능 은 시료 첨가 전과 후의 흡광도 차이를 %로 나타내었다.
SOD 유사활성 측정은 Marklund 등(13)이 행한 방법에 따라 hydrogen peroxide(H2O2)로 전환시키는 반응을 촉매하 는 pyrogallol의 생성량을 측정하여 SOD유사활성으로 나타 내었다. 즉, 야생 및 재배 참취 추출액 0.2 mL에 pH 8.5로 보정한 tris-HCl buffer[50 mM tris(hydroxymethyl) aminomethane and 10 mM EDTA] 3 mL와 7.2 mM pyrogllol 0.2 mL를 가하였다. 그런 다음 25℃에서 10분간 반응시킨 후 1 N HCl 0.1 mL로 반응을 정지시킨 다음 흡수분광광도계 (UV-2001, Hitachi)를 사용해서 420 nm에서 흡광도를 측정 하였다. SOD 유사활성은 첨가구와 무첨가구 사이의 흡광 도 차이를 %로 나타내었다.
아질산염 소거능은 Kato 등(14)이 행한 방법에 따라 다음 과 같이 측정하였다. 즉, 1 mM의 NaNO2용액 2 mL에 각 농도의 시료 1 mL를 첨가하고, 여기에 0.1 N HCl(pH 1.2)과 0.1 M 구연산 완충용액을 사용하여 반응용액의 pH를 1.2로 조정한 후 반응용액의 부피를 10 mL로 한다. 그리고 37℃에 서 1시간 동안 반응시켜 얻은 반응액을 1 mL씩 취하고 여기에 2% acetic acid 5 mL를 첨가한 다음 griess reagent 0.4 mL를 가하여 혼합시킨다. 그런 다음 실온에서 15분간 반응시킨 후 흡수분광광도계(UV-2001, Hitachi)를 사용하 여 520 nm에서 흡광도를 측정하여 잔존하는 아질산염의 %로 나타낸다. 공시험은 griess reagent 대신 증류수 0.4 mL 를 가하여 같은 방법으로 행하였다.
Xanthine oxidase 저해 활성은 Stripe와 Corte (15)가 행한 방법에 따라 측정하였다. 야생 및 재배 참취의 각 추출액 0.1 mL와 0.1 M potassium phosphate buffer(pH 7.5) 0.6 mL 에 xanthine을 녹인 기질액 0.2 mL를 첨가하고 xanthine oxidase(0.2 unit/mL) 0.1 mL를 가하여 37℃에서 5분간 반응 시킨 후 1 N HCl 1 mL를 가하여 반응을 종료시킨 다음 반응액 중에 생성된 uric acid의 양을 흡수분광광도계 (UV-2001, Hitachi)를 이용하여 292 nm에서 흡광도를 측정 하였다. Xanthine oxidase 저해 활성은 시료용액의 첨가군과 무첨가군의 흡광도 감소율을 %로 나타내었다. 대조군은 ascorbic acid를 추출물 대신 동일한 농도로 첨가하여 위의 방법으로 측정하였다.
Tyrosinase 저해 활성 측정은 Yagi 등(16)이 행한 방법에 따라 측정하였다. 반응구는 0.175 M sodium phosphate buffer(pH 6.8) 0.5 mL에 10 mM L-DOPA를 녹인 기질액 0.2 mL 및 시료용액 0.1 mL의 혼합액에 mushroom tyrosinase(110 U/mL) 0.2 mL를 첨가하여 25℃에서 2분간 반응시켜 반응액 중에 생성된 DOPA chrome을 흡수분광광 도계(UV-2001, Hitachi)를 이용하여 475 nm에서 흡광도를 측정하였다. Tyrosinase 저해활성은 시료용액의 첨가군과 무첨가군의 흡광도 감소율을 %로 나타내었다. 대조군은 ascorbic acid를 추출물 대신 동일한 농도로 첨가하여 위의 방법으로 측정하였다.
환원력 측정은 Wong 등(17)의 방법에 준하여 행하였다. 각 추출물의 시료용액 0.5 mL에 0.2 M phosphate buffer (pH 6.6) 1 mL와 1% potassium ferricyanide 1 mL를 넣은 다음 잘 혼합하고 50℃에서 30분간 반응시킨 후 실온으로 냉각시켜 10% TCA용액 1 mL를 넣은 다음 10분간 방치하 였다. 이 중 반응액 0.5 mL를 취해 증류수 1 mL와 0.1% FeCl3 0.5 mL를 가한 후 흡수분광광도계(UV-2001, Hitachi) 를 이용하여 700 nm에서 흡광도를 측정하였으며, 대조군으 로 butylated hydroxy toluene(BHT)을 사용하였다.
결과 및 고찰
야생 및 재배 참취 열수 추출물의 수율, 총 폴리페놀 및 총 플라보노이드 함량을 측정한 결과는 Table 1과 같다. 야생 참취의 생채, 생채건조 및 블랜칭 건조의 열수 추출물 의 수율은 각각 2.02%, 2.33%, 3.77%으로 블랜칭 건조 참취 에서 수율이 높았다. 재배 참취의 생채, 생채건조 및 블랜칭 건조의 열수 추출물의 수율은 각각 2.38%, 3.12%, 4.13%으 로 생채에서 수율이 낮았고, 블랜칭 건조의 수율이 다소 높았다. 또한, 재배 참취의 열수 추출물의 수율이 야생 참취 의 열수 추출물보다 다소 높았다.
WRA ; Aster scaber was harvested in the wild field, WRDA ; Aster scaber was harvested in the wild field, and dryed at 25℃, WBDA ; Aster scaber was harvested in the wild field, dryed at 25℃ after blanched for 20min. in water of 100℃, CRA ; Aster scaber was cultivated in the field, CRDA ; Aster scaber was cultivated in the field, and dryed at 25℃, CBDA ; Aster scaber was cultivated in the field, dryed at 25℃ after blanched for 20min. in water of 100℃.
야생 및 재배 참취의 열수 추출물의 총 폴리페놀 함량을 측정한 결과이다. 야생 참취 생채의 총 폴리페놀 함량은 20.43 mg/g이었고, 생채건조 23.86 mg/g, 블랜칭 건조 29.20 mg/g으로 블랜칭 건조에서 높은 폴리페놀 함량을 보였다. 재배 참취의 총 폴리페놀 함량은 생채에서 10.39 mg/g이었 고, 생채건조 11.53 mg/g, 블랜칭 건조 25.31 mg/g으로 블랜 칭 건조에서 높은 폴리페놀 함량을 보였다. 야생 참취의 열수 추출물의 폴리페놀 함량이 재배 참취의 열수 추출물보 다 높았다.
야생 및 재배 참취 열수 추출물의 플라보노이드 함량을 측정한 결과, 야생 참취 생채의 플라보노이드 함량은 5.40 mg/g이었고, 생채건조 1.00 mg/g, 블랜칭 건조 3.10 mg/g으 로 생채에서 높은 플라보노이드 함량을 보였다. 재배 참취 생채의 플라보노이드 함량은 3.96 mg/g이었고, 생채건조 2.31 mg/g, 블랜칭 건조 2.50 mg/g으로 생채에서 높은 플라 보노이드 함량을 보였다.
Choi 등(18)은 참취 추출물의 총 폴리페놀과 총 플라보노 이드 함량이 각각 57.07 μg/mg, 54.62 μg/mg 함유하고 있다 고 보고하였으며, Jeon 등(19)은 강원도 지역에서 재배된 참취 추출물의 총 폴리페놀 화합물이나 플라보노이드 화합 물의 함량이 각각 99.60 μg/mg, 38.90 μg/mg로 나타났는데, 본 연구결과보다 더 높은 함량을 보인 것은 참취의 품종과 재배 조건, 추출조건 및 실험방법 등에 의한 차이가 있을 것으로 사료된다. 또한 Lee 등(20)의 국내산 총 34종의 산채 류에서 조제된 물 추출물의 폴리페놀 함량은 4.6~183.8 mg/g으로 조사되었는데, 이는 각 산채류의 재배 환경에 따른 함량 변이가 있음을 짐작해 볼 수 있으며, 항산화 성분 이 지역별로 차이가 있기 때문인 것으로 생각된다.
Free radical 소거 활성 측정은 stable radical인 DPPH를 소거하는 항산화물질 활성을 측정하는 것으로 DPPH는 짙 은 자색을 띄는 비교적 안정한 free radical로서 항산화제, 방향족 아민류 등에 의해 환원되어 색이 탈색되는 것을 이용하여 항산화 물질을 검색하는데 이용되고 있다(21).
야생 및 재배 참취 열수 추출물의 항산화 활성 정도를 측정하고자 농도별 DPPH (1,1- diphenyl-2-picryl hydrazyl) 에 대한 전자공여능을 측정한 결과는 Fig. 1과 같다. 야생 참취의 생채, 생채건조, 블랜칭 건조의 열수 추출물은 농도 가 증가함에 따라 전자공여능은 증가함을 보였고, 다른 열 수 추출물보다 블랜칭 건조의 열수 추출물에서 높은 전자공 여능을 확인 할 수 있었다. 블랜칭 건조 열수 추출물은 1,000 μg/mL의 농도에서 75.63%의 전자공여능을 보였으며, 125 μg/mL 농도에서 60%이상의 전자공여능을 보여 대조구인 천연 항산화제 ascorbic acid와 비슷한 전자공여능을 나타냄 으로서 낮은 농도에서도 블랜칭 건조의 기능성이 우수함을 알 수 있었다.
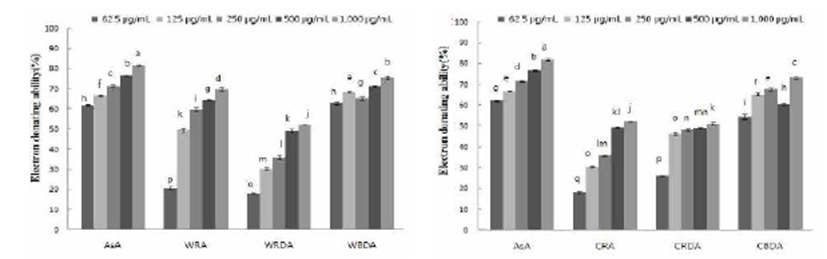
재배 참취의 열수 추출물에 대한 전자공여능을 측정한 결과는 농도가 증가함에 따라 추출물 모두 전자공여능이 증가함을 알 수 있었고, 야생 참취의 전자공여능 측정 결과 와 유사하게 블랜칭 건조 추출물에서 높은 전자공여능을 보였다. 블랜칭 건조 열수 추출물 1,000 μg/mL 농도에서는 73.10%의 전자공여능을 보였고, 125 μg/mL 농도에서 50% 이상의 전자공여능을 보여 대조구인 ascorbic acid와 비슷한 전자공여능을 나타내 블랜칭 건조의 경우 낮은 농도에서도 전자공여능이 우수함을 알 수 있었다. Choi 등(18)의 참취 추출물의 항산화 활성 연구에서 농도 의존적으로 DPPH radical을 소거하여 본 연구결과와 유사하였다. Free radical 을 환원시키거나 상쇄시키는 능력이 크면 높은 항산화 활성 및 활성산소를 비롯한 다른 라디칼에 대한 소거활성을 기대 할 수 있으며, 인체 내에서 free radical에 의한 노화를 억제 하는 척도로도 이용될 수 있으므로(22), 본 연구의 참취 열수 추출물은 전자공여능이 높게 나타나 항산화력이 우수 함을 알 수 있었다.
SOD 유사활성능 측정은 식품의 산화방지와 인간의 노화 억제와도 밀접한 관계가 있는 것으로 알려져 있으므로 산화 효소인 pyrogallol과 야생 및 재배 참취의 생채, 생채건조 및 블랜칭 건조 열수 추출물을 반응시켜 측정한 결과는 Fig. 2에 나타내었다.
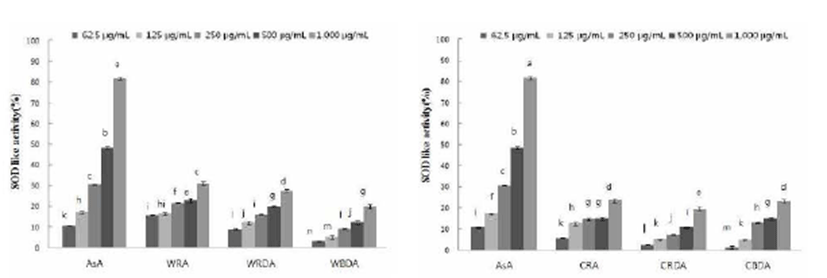
야생 참취 열수 추출물의 농도에 따라 SOD 유사활성능 을 측정한 결과, 열수 추출물에 농도가 높아질수록 SOD 유사활성능은 모든 군에서 증가하였다. 1,000 μg/mL의 농 도에서 야생 참취 생채 추출물이 31.32%의 SOD 유사활성 능을 보였고, 생채건조 열수 추출물의 경우 27.60%, 블랜칭 건조 열수 추출물은 19.96%의 SOD 유사활성능을 보였다. 62.5 μg/mL의 농도에서는 대조구인 ascorbic acid 가 10.72% 의 SOD 유사활성능을 보였고, 생채의 경우 15.71%의 SOD 유사활성능을 보여 낮은 농도에서 대조구인 ascorbic acid의 항산화성이 우수함을 알 수 있었다.
재배 참취 열수 추출물의 SOD 유사활성능은 야생 참취 열수 추출물의 SOD 유사활성능을 측정한 결과와 유사하게 추출물의 농도가 증가함에 따라 증가함을 보였다. 1,000 μg/mL의 농도에서 재배 참취의 생채 추출물이 23.57%의 SOD 유사활성능을 보여 다른 추출물에 비해 다소 높은 SOD 유사활성능을 보였다. 이러한 결과와 비교해 볼 때 야생 및 재배 참취 열수 추출물은 superoxide anion 제거능이 높은 물질을 함유하고 있는 것으로 판단되며, 야생과 재배 참취 모두 항산화성을 가지는 기능성 식품소재로서의 활용 가능성이 높다고 생각된다.
야생 및 재배 참취의 열수 추출물의 아질산염 소거능을 pH 1.2에서 측정한 결과는 Fig. 3과 같다. 야생 참취의 생채, 생채건조 및 블랜칭 건조 열수 추출물 pH 1.2에서의 아질산 염 소거능은 추출물의 농도가 증가함에 따라 아질산염 소거 능이 증가하였으며, 야생 참취의 생채, 생채건조 및 블랜칭 건조 추출물 1,000 μg/mL의 농도에서 각각 30.86%, 22.45%, 25.43%의 아질산염 소거능을 보였다.
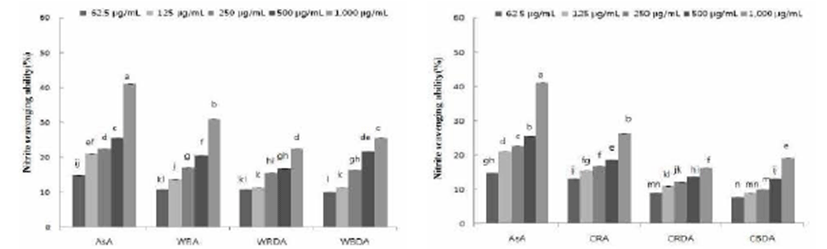
재배 참취의 열수 추출물 pH 1.2에서의 아질산염 소거능은 야생과 같이 농도가 증가함에 따라 아질산염 소거능이 증가 하였다. 재배 참취의 생채, 생채건조 및 블랜칭 건조 열수 추출물 1,000 μg/mL 농도에서 각각 26.30%, 16.11%, 19.12%의 아질산염 소거능을 보여 생채에서 다른군에 비해 다소 높은 아질산염 소거능을 확인할 수 있었다. 62.5 μ g/mL 농도에서는 대조구인 ascorbic acid가 14.80%의 아질 산염을 보였고, 생채 추출물에서 13%의 아질산염 소거능을 보여 대조구 만큼 높은 아질산염 소거능을 보였다.
질산염이 많이 함유된 식품을 다량 섭취하면 아질산염과 제 2급 및 제 3급 아민의 nitroso화 반응이 위장내의 낮은 산성조건에서 쉽게 일어나서 발암물질인 nitrosamine을 생 성한다. Caffeic acid, ferulic acid 등의 phenolic acids와 catechol 등의 phenol류 그리고 ascorbic acid와 erythorbic acid와같은환원물질이아질산염과반응하게되면nitrosamine 의 생성을 저해할 수 있다(23). 따라서 야생 및 재배 참취의 열수 추출물은 pH 1.2에서 아질산염 소거능이 높아 nitrosamine 생성 저해에 효과가 있을 것으로 판단된다.
Xanthine oxidase는 생체 내 purine 대사에 관여하는 효소 로 xanthine 혹은 hypoxanthine으로 부터 urea를 형성하여 혈장 내 urea가 증가되면 낮은 용해성으로 인하여 골격에 축척되어 심한 통증을 유발하는 통풍을 일으킨다. 그리하 여 xanthine oxidase에 대한 야생 및 재배 참취의 생채, 생채 건조 및 블랜칭 건조 열수 추출물의 저해활성을 측정한 결과는 Fig. 4와 같다.
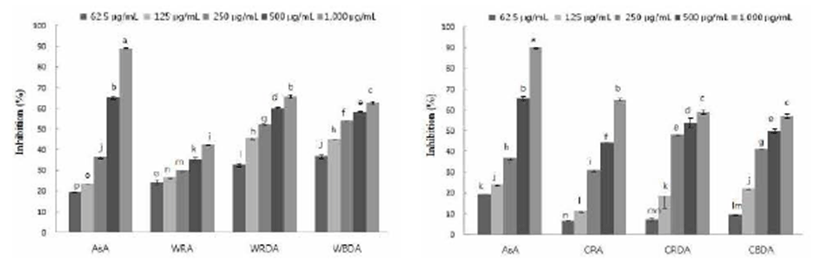
열수 추출물의 xanthine oxidase 저해활성 결과 열수 추출 물의 농도가 증가할수록 요산의 생성량이 줄어들어 xanthine oxidase에 대한 저해활성이 높아짐을 알 수 있었다. 야생 참취 생채, 생채건조 및 블랜칭 건조 열수 추출물 62.5 μ g/mL의 농도에서 각각 24.49%, 32.92%, 36.87%의 저해활 성을 보였으며, 대조구인 ascorbic acid는 19.32%으로 모든 군의 열수 추출물이 대조구에 비해 높게 나타나 낮은 농도 에서도 높은 xanthine oxidase 저해 활성을 보였다. 또한 500 μg/mL의 농도에서는 생채 및 블랜칭 건조에 비해 생채 건조 추출물에서 높은 xanthine oxidase 저해 활성을 확인할 수 있었다.
재배 참취의 열수 추출물의 xanthine oxidase 저해활성은 열수 추출물에서는 야생 참취 추출물의 결과와 같이 농도가 증가할수록 xanthine oxidase에 대한 저해활성이 높아짐을 알 수 있었다. 재배 참취 생채, 생채건조 및 블랜칭 건조 열수 추출물 250 μg/mL의 농도에서 각각 30.74%, 47.81%, 40.98%의 xanthine oxidase 저해활성을 보였으며, 대조구인 ascorbic acid는 36.62%의 xanthine oxidase 저해 활성을 보 여 생채건조와 블랜칭 건조 열수 추출물은 대조구에 비해 높은 xanthine oxidase 저해 활성을 보였다.
야생 및 재배 참취의 생채, 생채건조 및 블랜칭 건조 열수 추출물의 tyrosinase 저해활성을 측정한 결과는 Fig. 5와 같 다. 야생 참취 열수 추출물의 tyrosinase 저해활성 결과 열수 추출물의 농도가 증가할수록 저해활성이 높아졌다. 야생 참취 생채의 tyrosinase 저해활성은 다른 추출물에 비해 낮 은 농도에서 높은 활성을 보였으며, 62.5~250 μg/mL의 농도에서는 대조구인 ascorbic acid 보다 생채 추출물의 활 성이 더 높음을 알 수 있었다. 500~1,000 μg/mL의 농도에 서는 블랜칭 건조 열수 추출물의 tyrosinase 저해활성이 높 게 나타났다.
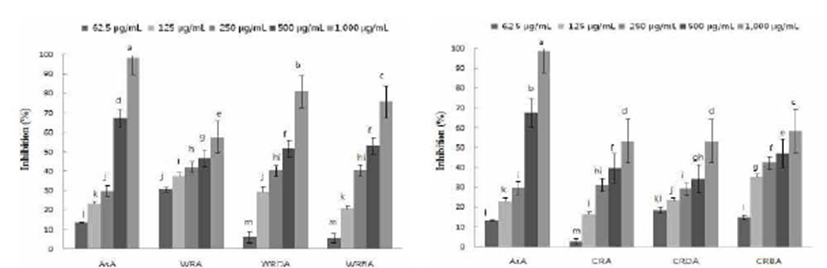
재배 참취 열수 추출물의 tyrosinase 저해활성 결과 야생 참취 추출물의 결과와 유사하게 농도가 증가할수록 tyrosinase에 대한 저해활성이 높아짐을 알 수 있었다. 재배 참취 블랜칭 건조 열수 추출물의 경우 62.5~250 μg/mL의 농도에서 대조구인 ascorbic acid보다 높은 tyrosinase 저해 활성을 보였으며, 500~1,000 μg/mL의 농도에서는 생채 및 생채건조 열수 추출물보다 높은 저해활성을 보였다.
Tyrosinase는 멜라닌 합성 경로의 초기속도 결정단계에 관여하는 효소로 멜라닌이 과잉 생산되면 색소가 침착되어 피부손상을 초래하는 것으로 알려져 있기 때문에 멜라닌의 생성을 억제하기 위하여 tyrosinase의 활성을 저해하는 것이 중요하다(24). 본 실험 결과 야생 및 재배 참취 열수 추출물 의 경우 낮은 농도에서도 높은 tyrosinase 저해활성을 보여 멜라닌 생성을 억제하기 위해 tyrosinase 활성을 저해할 것 으로 생각된다.
환원력
야생 및 재배 참취의 생채, 생채건조, 블랜칭 건조에 열수 추출물의 환원력을 측정한 결과는 Table 2, 3과 같다. Table 2의 야생 참취 열수 추출물에 대한 BHT 측정 결과, 농도가 증가함에 따라 환원력은 증가함을 보였고, 다른 열수 추출 물보다 블랜칭 건조의 열수 추출물에서 높은 환원력을 확인 할 수 있었다. 대조구인 BHT가 62.5~1,000 μg/mL의 농도 0.27~1.53 사이의 환원력을 보였으며, 야생 참취 블랜칭 건조 열수 추출물은 0.12~1.09의 환원력을 보여 다른 추출 물에 비해 높은 환원력을 보였다.
WRA ; Aster scaber was harvested in the wild field, WRDA ; Aster scaber was harvested in the wild field, and dryed at 25℃, WBDA ; Aster scaber was harvested in the wild field, dryed at 25℃ after blanched for 20min. in water of 100℃, CRA ; Aster scaber was cultivated in the field, CRDA ; Aster scaber was cultivated in the field, and dryed at 25℃, CBDA ; Aster scaber was cultivated in the field, dryed at 25℃ after blanched for 20min. in water of 100℃.
WRA ; Aster scaber was harvested in the wild field, WRDA ; Aster scaber was harvested in the wild field, and dryed at 25℃, WBDA ; Aster scaber was harvested in the wild field, dryed at 25℃ after blanched for 20min. in water of 100℃, CRA ; Aster scaber was cultivated in the field, CRDA ; Aster scaber was cultivated in the field, and dryed at 25℃, CBDA ; Aster scaber was cultivated in the field, dryed at 25℃ after blanched for 20min. in water of 100℃.
Table 3의 재배 참취 열수 추출물에 대한 BHT 측정한 결과, 재배 참취 열수 추출물은 농도가 증가함에 따라 추출 물 모두 환원력이 증가함을 알 수 있었다. 재배 참취의 환원 력은 야생 참취의 환원력 측정 결과와 비슷하게 블랜칭 건조 열수 추출물에서 높은 환원력을 보였다. 시료 중에 항산화제와 같이 환원력을 가진 성분이 존재하게 되면 Fe3+/ferricyanide complex를 Fe2+상태로 환원시키면서 푸른 색을 띠게 되는데(25) 흡광도 수치 자체가 시료의 환원력을 나타내므로 발색정도가 높을수록 높은 환원력을 나타낸다 고 할 수 있다. Chung 등(26)의 연구 결과 구절초 추출물의 환원력 결과 0.5 mg/mL 농도에서 0.14~0.17, 1.0 mg/mL 농도에서 0.24~0.27로 나타난 결과와 비교해 보면 참취 열수 추출물의 환원력은 높게 측정되어 항산화 효과가 우수 함을 확인 할 수 있었다.
요 약
본 연구는 인공 재배 산채의 생산량 및 산채의 가공제품 의 개발의 증대함에 따라 야생 및 재배 참취의 품질 특성을 비교하고자 재배 및 야생 참취의 건조방법에 따른 항산화성 을 비교 분석하였다. 참취의 열수 추출물의 수율은 야생 참취에 비해 재배 참취에서 수율이 높았고, 블랜칭 건조 추출물의 수율이 높았다. 야생 참취 추출물의 총 폴리페놀 과 플라보노이드의 함량은 재배 참취 추출물보다 높았으 며, 건조방법에 따른 총 폴리페놀의 함량은 블랜칭 건조 추출물에서 높았고, 플라보노이드의 경우에는 생채 추출물 에서 높았다. 참취의 열수 추출물의 전자공여능은 농도가 증가함에 따라 증가하였고, 블랜칭 건조의 열수 추출물에 서 높은 전자공여능을 보였다. 참취 열수 추출물의 SOD 유사활성능은 추출물의 농도가 높아질수록 증가하였으며, 생채 열수 추출물에서 다른 추출물에 비해 높았다. pH 1.2에 서의 아질산염 소거능은 야생 및 재배의 생채, 블랜칭건조, 생채건조 열수 추출물 순으로 높았다. Xanthine oxidase 저 해활성은 열수 추출물의 농도가 증가할수록 저해효과가 높았으며, 생채건조 추출물에서 가장 높았다. Tyrosinase 저해활성과 환원력은 농도가 증가함에 따라 블랜칭 건조 열수 추출물에서 높게 나타났다. 따라서 참취의 재배 및 건조 방법에 따른 열수 추출물은 항산화성이 우수하여 천연 항산화 소재 및 기능성 식품소재로서의 활용 가능한 약용식 물자원이며, 이를 활용한 가공산업 발전의 기초자료가 될 것으로 생각된다.