서 론
대두는 분리단백질 제품, 대두유의 제조 원료로 사용되 는 외에 우리나라에서는 간장, 두부, 된장, 청국장 등이 있으 며 콩나물, 콩자반 등으로 널리 이용되어온 매우 유용한 작물이다.
대두에는 단백질함량이 34~42%, linoleic acid, oleic acid, linolenic acid, arachidonic acid 등의 지방함량이 19~22%, 자당 등의 당류형태의 탄수화물 20%을 비롯한 여러 영양소 가 저장되어있는 있다. 또한 4~5%의 섬유소, lecithin, cephalin 등의 인지질이 약 1.5%, sterol, 카로틴, 클로로필, 토코페롤 등의 비검화 물질을 약 1% 함유하며, K, P, Ca 등의 무기질과 비타민 B1을 비롯한 비타민류가 함유되어 있다.
이외에도 isoflavone류, soyasaponin등의 기능성 물질을 함유하는데 특히 isoflavone류는 콩의 이소플라본은 C6-C3- C6를 기본으로 하는 폐놀계 화합물로 여성 호르몬인 estrogen과 유사한 구조를 가지며(1-3), 여성호르몬 유사작 용을 가지기 때문에 식물성 에스트로겐(phytoestrogen)이라 부른다. 이는 혈중 콜레스테롤을 낮추고 심혈관질환, 골다 공증을 예방할 뿐만 아니라 폐경기 이후의 각종 증후군을 완화하고, 유방암, 전립선암, 난소암, 대장암등의 예방효과 를 보이는 등 이소플라본의 생리적 활성이 활발하게 보고되 고 있다(4). 이소플라본은 식품 중에서 배당체 형태로 존재 하므로 체내에 흡수되기 위해서는 장내균총에 의해 대사된 후 체내에 흡수되지만, 체내 흡수율이 매우 낮아 이를 보완 하기 위해 배당체 형태의 이소플라본을 비배당체형태로 전환하는 생물전환(bioconversion) 공정 기술 및 가공기술 이 절실히 필요한 상태이다(5). 또한 배당체 형태의 이소플 라본은 용해도가 비배당체에 비하여 높으나 이소플라본은 nonionic passive diffusion 기작에 의하여 흡수되므로 비배 당체 형태가 이러한 흡수 메커니즘에 유리하다고 보고되었 다(6). 배당체는 발효, 산가수분해, 발아, 열처리 등에 의해 aglycone으로 일부 전환된다(7-10). 또한 대두에는 β -glucosidase가 함유되어 있어 대부분의 대두 가공식품제조 중 행해지는 침지과정에서 이 효소에 의해 genistin이나 daidzin이 가수분해 되어 당이 제거된 aglycone의 함량이 증가한다고 보고되어 있다(11).
청국장은 볏짚 유래의 고초균인Bacillus subtilis를 이용 하여 40~42°C에서 2~3일간 발효 숙성한 한국의 전통발효 식품으로 단백질, 필수아미노산 및 지방산, 비타민 B1, B2, 나이아신, 판토텐산 등이 풍부한 식물성 고영양 식품이다 (12). 또한 발효과정 중에 효소의 작용으로 섬유소 및 세포 내의 당질, 단백질이 분해되어 소화율의 향상과 변비개선 효과가 있고 콜레스테롤 저하, 고혈압방지효과, 항산화효 과, 항균효과, 항암효과와 혈전용해 활성 등 기능성에 관련 된 연구가 많이 발표되었다(13-15). 그러나 아직 청국장의 생리활성 기능을 나타내는 isoflavone aglycone함량을 늘이 는데 관련된 연구는 미비한 실정이다.
따라서 본 연구에서는 체내 이용률이 높은 이소플라본 비배당체를 많이 생성할 수 있는 우수한 균을 이용하여 청국장을 제조하고 품질특성을 확인하고자 이소플라본 비배당체 함량을 늘릴 수 있는 β-glucosidase 활성을 지니는 B. subtilis HJ18-3를 starter로 사용하여 청국장을 제조하고 품질특성과 이소플라본 함량을 규명하였다.
재료 및 방법
본 실험에서 사용된 대원콩은 재배농가에서 구입하여 사용하였다. 스타터로 사용된Bacillus subtilis HJ18-3은 선 행연구를 통해 메밀속성장으로부터 분리된 균으로 amylase, protease, cellulase등의 세포의 효소분비능이 우수한 균이며 (16), 기타 전통장류에서 분리된 농업유전자원센타에서 분 양받은 B. subtilis KACC 15935을 starter로 사용하였다.
장류콩인 대원콩은 세척 후 실온에서 침지(25°C, 24 hr)하 고 autoclave를 이용하여 증자(121°C, 30 min)하였다. 콩이 40°C이하로 냉각되었을 때 각 분리균주의 배양액을 접종하 여 37°C에서 48 hr 발효하였다.
실험은 배양액을 첨가하지 않은 control과 B. subtilis HJ18-3, B. subtilis KACC15935를 첨가한 treat군으로 나누 어 진행하였다. 각균주를 106 CFU/mL 이상의 농도가 되도 록 배양하여 시료량의 1%(w/w)가 되도록 첨가 하였다.
α-Amylase 활성 측정은 DUN(Dextrinogenic Unit of Nagase)법(17)에 의하여 측정하였다. 1% 전분 기질액(pH 7.0) 3 mL에 시료추출액 1 mL를 넣고 반응(40°C, 10 min) 시킨 후 반응액 1 mL에 0.1 M HCl 10 mL를 넣어 반응을 정지시켰다. 반응액 1 mL에 0.005% I2-0.05% KI 용액 10 mL를 넣어 발색시킨 후 660 nm에 서 흡광도를 측정하였다. 위와 같은 방법으로 측정하여 다음 식에 의해 효소활성을 계산하였다.
D.U.N=[(D-D')/D]×10/100×n
D : Absorbance of control
D': Absorbance of sample
n : Dilution ratio of sample
Protease 활성 측정은 식품공전(18)에 따라 측정하였다. 0.2 M phosphate buffer에 0.6% casein을 용해한 후 pH를 7.0으로 보정하여 기질용액을 제조하였다. 이 기질용액 1.5 mL에 시료추출액 0.5 mL를 넣어 반응(37°C, 10 min) 시킨 후, 0.44 M trichloroacetic acid(TCA) 2 mL을 가하여 반응을 정지시켰다. 25분간 37°C water bath에서 방치시킨 후 여과 (Whatman No. 2)하였다. 여액 1 mL에 0.55 M Na2CO3 용액 5 mL를 첨가한 후, folin 시약 1 mL를 첨가하여 발색(37°C, 20 min)시켜서 660 nm에서 흡광도를 측정하였다. 반응 후 분해물의 tyrosine 양은 tyrosine 표준곡선으로부터 계산하 였으며, 효소 활성은 시료 1 g 에 의해 1분간 tyrosine 1 ug을 생성하는 능력을 1 unit으로 하였다.
Cellulase 활성 측정은 carboxymetyl cellulose sodium salt(CMC)를 기질로 하여 효소와 반응 시킨 후, 유리된 환원 당을 3,5-dinitrosalicylic acid acid(DNS)방법으로 다음과 같 이 측정하였다. 1% CMC(pH 7.0) 용액 0.5 mL와 0.2 M sodium phosphate buffer(pH 7.0) 0.25 mL를 넣은 후, 효소액 0.25 mL 을 첨가하여, 50°C에서 15분간 반응시킨 후, 3,5-dinitrosalicylic acid acid(DNS)를 3 mL 가하여 반응을 정지시킨 후, 5분간 끓는 물에 중탕시켜 발색시킨 다음, 위와 같은 방법으로 측정하였다. 대조구는 반응정지를 먼 저 시킨 다음, 위와 같은 방법으로 측정하였다. 효소활성을 시료 1 g 의해 1분간 1 ug을 glucose을 생성하는 효소의 양을 1 unit으로 정의 하였다.
환원당은 dinitrosalicylic acid(DNS) 방법(19)에 의하여 측정하였다. 시료 추출액 1 mL에 DNS 3 mL를 혼합한 후 5분 동안중탕가열하고냉각한 후550 nm에서흡광도를측정 하며 glucose standard curve를 통해 환원당 값을 구하였다.
Reducing sugar(%)=A×D×1/S×100/1000
A : Reducing sugar content in sample solution(mg)
D : Dilution ratio
S : Mass of sample(g)
시료추출액 5 mL, 중성 formalin 용액 10 mL, 증류수 10 mL를 넣은 플라스크에 0.5% phenolphthalein 용액 2-3방 울을 가한 후, 0.1 N NaOH로 미홍색이 될 때까지의 적정양 과 시료 5 mL, 증류수 20 mL을 넣은 플라스크에 0.5% phenolphthalein 용액을 2~3방울을 가한 후, 0.1 N NaOH로 미홍색이 될 때까지 적정양을 이용하여 아미노태 질소 함량 을 산출하였다(20).
Amino type nitrogen(%)=(V1−V0)×F×0.0014×D×100/S
V1 : Titration value of sample(mL)
V0 : Titration value of blank treat(mL)
F : Facter of 0.1 N NaOH
D : Dilution ratio
S : Mass of sample(g)
0.0014 : Nitrogen weight in 1 mL of 0.1N NaOH(g)
아미노태 질소함량 측정 때와 동일한 시료액 0.1 mL 취한 후 phenol-hypochloride 반응에 의하여 시료 추출액 0.1 mL 에 A용액(phenol 10 g과 sodium nitroprusside dihydrate 0.05 g/distilled water 1 L)과 B용액(Na2HPO4· 12H2O 9 g, NaOH 6 g과 NaOCl 10 mL/distilled water 1 L)을 각각 2 mL씩 넣고 37°C에서 20분간 반응시켜 630 nm에서 흡광도를 측정 하였으며, 표준곡선은 (NH4)2SO4 를 사용하여 암모니아태 질소함량을 측정하였다(21).
청국장 시료를 10배 단계 희석한 후, 호기적 균수는 plate count agar(DifcoTM, Laboratories, Detroit, MI, USA)에 호기 조건에서 37°C, 24시간 동안 배양하였으며, 혐기성 총균수 는 MRS agar(Difco Laboratories)를 이용하여 혐기 조건에서 37°C, 48시간 동안 배양하여 계수하였다.
청국장은 동결건조 시킨 후 곱게 분쇄하여 40 mesh sieve 를 통과시켜 사용 하였다. 이소플라본 분석을 Wang의 방법 을 사용하였다(22). 즉, 동결건조 분말 2 g에 acetonitrile 24 mL 과 1 mol HCl 6 mL로 실온에서 1시간 추출하였으며 filtration(Whatman No. 2) 시켜 3차 증류수로 2배 희석 하여 0.2 μM membrane filter로 filtration시켜 UPLC(Waters, MA, USA)로 분석하였다. UPLC는 Waters Acquity system을 사 용하였으며, column은 Acquity UPLCⓇHSS C18 1.8 um×2.1×75 mm column, 이동상은 0.1% acetic acid를 함유 한 10% MeOH(용매A)와 0.1% acetic acid를 함유한 MeOH (용매B)을 사용하였다. 용매 gradient는 용매 B의 농도를 17분간 26%에서 50%로 증가시켰고, 유속은 0.3 mL/min, injection volume은 0.8 μL, UV detector파장은 254 nm로 분석하였다.
결과 및 고찰
전분을 분해하는 효소인 α-amylase 활성은 Table 1과 같 다. Control과B. subtilis HJ18-3 접종 청국장의 활성은 각각 29.40±8.73, 29.70±11.66 unit/g 으로B. subtilis KACC15935 접종 청국장의 활성 11.45±0.27 unit/g 보다 높은 결과를 나타내었다. Table 2
| Sample | α-amylase (U/g) | cellulase (U/g) | protease (U/g) |
|---|---|---|---|
| Control | 29.40±8.73 | 4471.07±615.07 | 320.56±39.44 |
| KACC15935 | 11.45±0.27 | 3923.61±376.73 | 379.17±40.31 |
| HJ18-3 | 29.70±11.66 | 4861.30±388.07 | 356.80±193.27 |
Oh등(23)은B. natto및Aspergillus oryzae 와B. natto 혼합 균주를 접종한 발아콩 청국장의 α-amylase 활성은 10.51∼ 12.75 unit이라고 보고 하였는데 본 실험에서는 이 보다 높은 결과를 나타내었다. Amylase 활성은 pH는 온도의 영 향을 받는데 Jana와 Pati(24)의 보고에 의하면 α-amylase 활성의 최적 pH가 6.0 정도였고 숙성기간이 경과되면서 pH나 염 등의 농도에 의해 효소의 활성도가 저해되었다고 보고하였다. 또한 일반적으로 된장의 경우 α-amylase 활성 은 담금 초기에 높았다가 발효가 진행되면서 서서히 낮아진 다고 보고되었으며, 이는 원료에 함유되어 있던 탄수화물 이 α-amylase의 기질이 되어 효소 활성이 높았다가 전분질 기질이 고갈되어감에 따라 점차 활성이 낮아지는 것으로 보았다(25). 따라서 본 연구에 사용된 청국장의 경우 그 값이 균에 따른 차이를 나타내는 것은 균의 특성의 차 뿐 아니라 발효시간이 경과함에 따라 알칼리화 되어 α-amylase 활성을 감소시키는 원인이 된 것으로 사료된다.
발효 균주를 달리하여 제조한 청국장의 protease 효소활 성은 Table 1 에 나타내었다. 대두 단백질을 가수분해하여 구수한 맛 성분인 아미노산, polypeptide 등을 생성하는 protease는 청국장 제조 시 맛을 결정짓는 중요한 인자이다. 균주의 종류에 따라 protease의 활성은 차이를 나타내었다. 청국장 발효기간 동안B. subtilis KACC15935 379.17±40.31 unit/g으로 control과 B. subtilis HJ18-3 접종 청국장의 활성 320.56±39.44, 356.80±193.27 unit/g 보다 비교적 높은 활성 을 나타내었다.
Youn등(26)은 청국장의 protease활성은 발효 5~10시간 이후부터 증가하기 시작하여 35~40시간 이후에는 거의 최대 활성에 도달 하였으나 각 시험구의 protease활성은 starter에 따라 상당한 차이를 나타낸다고 하였다. 또한 Lee 등(16)도Bacillus속 균을 이용한 청국장의 단백질분해효소 활성은 재래 청국장에서 분리한 균주를 이용하여 제조한 청국장의 protease활성은 균주에 따라 다르다고 하였다.
발효 균주를 달리하여 제조한 청국장의 cellulase 효소활 성은 Table 1과 같다. Cellulase중 특히 CMCase(carboxymethyl cellulase, Endo β-1,4-glucanase)는 exo-β-1,4-glucanase)는 exo-β-glucanase, β-glucanase와 함께 cellulase계 구성효소 로서 식물세포벽 구성성분 중 대부분 차지하고 있는 cellulose을 분해할 수 있는 능력을 가지고 있어 장내 이용성 증진을 위해 널리 사용되는 효소이다. Ra등은(27-29) 전통 장류인 된장이나 간장은 발효과정에서 미생물의 다 양한 효소(amylase, protease, cellulase 및 lipase)에 의해 콩에 함유 된 단백질, 올리고다당류, 이소플라본, 지질 등이 소화되기 쉬운 형태의 아미노산, 유리당, 이소플라본 아글리콘, 지방 산 등으로 분해되어 항산화 및 혈전용해 기능을 갖는 2차산 물이 생성된다고 하였다. 그러나 아직 전통장류인 청국장 에서 cellulase 활성에 대한 연구는 미비한 시점이다. 따라서 본 실험의 결과가 청국장 뿐 아니라, 이들 균이 전통장류의 starter로 사용되는 데 있어 참고자료가 될 수 있을 것으로 사료된다. 본 실험에서는 Table 1의 결과와 같이 control과 B. subtilis HJ18-3이 각각 4471.07±615.07, 4861.30±388.07 unit/g 으로 B. subtilis KACC15935 3923.61±376.73 unit/g 보다 높은 결과를 나타내었다.
일반적으로 아미노태 질소 함량은 protease의 작용에 의 하여 단백질이 아미노산의 형태로 분해되는 정도를 나타낸 것으로 청국장의 발효도 평가 및 장류 발효식품의 품질과 구수한 맛의 지표로 사용되고 있다(30). 아미노태 질소 함량 은 protease 활성과 유사한 경향을 나타내는데 본 연구에서 도 유사한 경향을 확인할 수 있었다.
본 실험에서는 control과 B. subtilis HJ18-3, B. subtilis KACC15935의 아미노태 질소 함량은 각각 88.20±13.86, 129.62±1.15, 118.40±48.65 mg%로 나타났으며 control구에 비해 처리구에서 조금 높게 나타났다.
Zheng등(31)과 Youn(32)등이 제조한 청국장의 아미노태 질소 함량이 각각 112∼224 mg%, 264∼422 mg%라고 보고 하였는데, 본 연구의 결과는 이러한 결과에 다소 미치지 못하는 것으로 나타났다. Eom 등(33)은 볏짚을 이용하여 비발아대두와 발아대두로 제조한 청국장의 아미노태질소 함량이 발효 36시간까지 증가하다가 이후 약간 감소하는 경향이었으며 Youn 등(32)은 사용한 균주에 따라 그 함량이 다르다고 하였다. 따라서 모든 시료에서 전체적으로 아미 노태 함량이 낮은 것은 발효시간이나 온도와 같은 환경과 사용한 균주에 의한 영향인 것으로 사료된다.
본 실험의 암모니아태 질소함량은 control과 B. subtilis KACC15935, B. subtilis HJ18-3의 아미노태 질소 함량은 각각 95.09±34.33, 137.56±10.10, 102.93±63.37 mg%로 나 타났다. 여러 선행 연구에서 암모니아태 질소 함량의 변화 는 아미노태 함량의 변화와 유사하다고 보고된 바 있다. 본 연구에서도 이와 유사한 경향을 나타내었다. 이는 Hwang등(34)의 보고에서 발효 기간 중 주로 미생물이 분비 하는 protease가 원료대두의 단백질에 작용하여 수용성 질 소형태로 가수분해 되고 이어서 peptide를 거쳐 아미노태 질소형태로 가수분해 하여 청국장의 구수한 맛이 생성됨과 동시에 발효가 계속 진행되면서 암모니아태 질소를 형성시 킨다고 하였다. 암모니아태 질소는 단백질 분해과정에서 deamination에 의하여 생성되며 식품 내에 과량으로 축척되 면 부패취로 작용하므로 일반적으로 장류 제품의 변패 또는 이상발효의 지표로 사용된다. 암모니아태 질소의 과잉 생 산은 청국장 냄새에 영향을 미쳐 소비기피를 유발하는 중요 한 물질로 알려져있다. 암모니아태 질소를 감소시키그 위 해 Ju등(35)은 B. subtilis와 Lactobacillus plantarum를 혼합 배양 해여 청국장의 불쾌취를 감소시켰다고 보고 하였다.
Glucose, fructose, maltose 등의 환원당류들은 단맛을 부 여하는 물질로 식품의 관능적인 품질 평가면에서 대단히 중요하며 이러한 환원당류들은 미생물의 대사에 따른 효소 력 변화와 밀접한 관계가 있어 미생물이 glucose 대사에 이용하는 정도에 따라 환원당 변화가 생긴다(30).
Kim등(17)은 전통장류 제조업체에서 수집한 제품 18점 의 환원당을 분석한 결과 0.51∼0.24%의 범위를 나타내며, Baec등(36)은 1.09∼1.32%의 범위를 나타낸다고 하였는데, 본 실험에서는 이 보다 다소 높게 측정되었다. Baec 등(36) 은 발효 24시간까지 기점으로 환원당이 감소하는 경향이 나타난다고 하였는데 이는 24시간 까지 저분자의 환원당으 로 많이 생성되었다가 24시간 이후부터는 발효미생물의 증식에 필요한 영양원과 화학적 반응 등에 이용되었기 때문 인 것이라고 하였다. 본 연구에서 발효시간은 48시간으로 발효시간을 24시간으로 하였을 때 더 높은 환원당 값을 기대할 수 있을 것으로 사료된다.
37°C에서 48시간 동안 발효시킨 청국장의 호기적 총균수 는 Fig. 1에 나타내었다. Control과 B. subtilis KACC15935, B. subtilis HJ18-3의 호기적 총균수는 8.45±0.50, 8.66±0.50, 8.25 ±0.05 log CFU/mL 로 나타났다. 청국장 제조에 첨가한 B. subtilis HJ18-3은 메밀 속성장에서 분리한 균주로 B. cereus와Candida albicans에 대해 항균력이 우수하다고 보 고되었다(37). 발효가 진행 후 control과 B. subtilis KACC15935균에 비해 적은 값을 나타낸 것은 이러한 B. subtilis HJ18-3의 뛰어난 항균성에 의한 것으로 생각된다. 또한 청국장의 혐기적 총균수는 8.30±0.06, 7.98±0.10, 7.98±0.14 log CFU/mL로 나타났으며 총균수와 비교해 볼 때 0.15∼0.68 log CFU/mL이 적은 수로 거의 대부분의 혐기 성 균은 유산균으로 예상되며, 호기적 총균수와 비슷한 수 준으로 많이 분포함을 알 수 있었다.
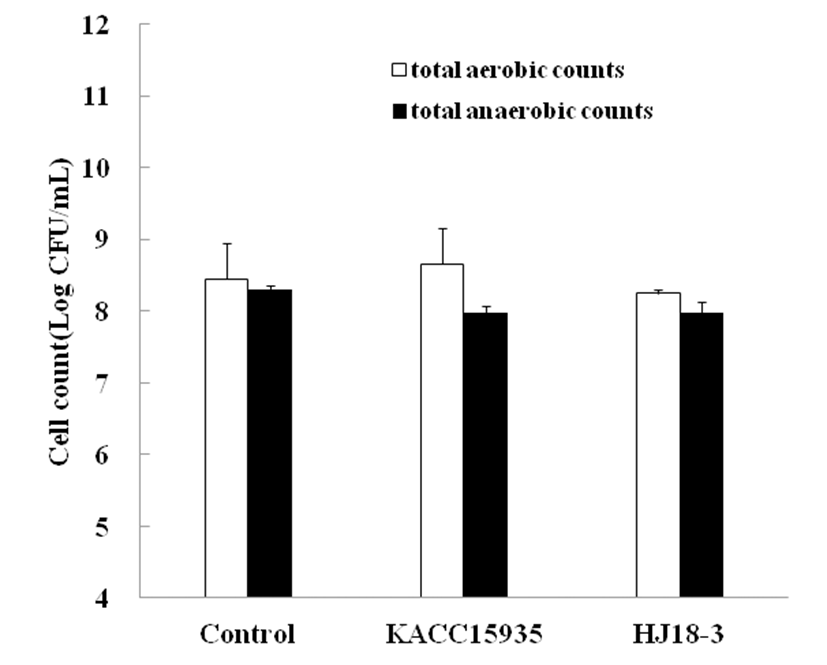
Baec 등(36) 총균수의 발효 24시간 이후 각 처리구의 총균수는 109 CFU/mL 이상을 나타낸다고 하였으며, Youn 등(32)은 B. natto와 B. licheniformis를 이용하여 청국장을 제조하였을 때 청국장발효 40시간 이후 총균수 109 CFU/ mL이었다는 보고하였으나 본 실험은 결과와는 조금 차이 가 있었다.
37°C에서 48시간 동안 발효시킨 청국장의 이소플라본함 량은 Table 3에 나타내었다. Control과 B. subtilis KACC15935, B. subtilis HJ18-3의 isoflavone 비배당체 형태 인 daidzein과 genistein, glycitein을 합한 함량은 각각 158.20±6.55, 131.60±4.00, 200.79±7.54 ug/g으로 나타났다. 이는 초기 raw soybean의 aglycone함량이 3.96 ug/g인 것에 비하여 39∼50배 전환율을 보인다. 또한 β-glucosidase활성 이 있는 B. subtilis HJ18-3균을 접종하여 제조한 청국장이 Control과 B. subtilis KACC 15935균을 접종하여 제조한 청국장보다 1.27, 1.53배 더 높은(p<0.05) aglycone 전환율을 보였다.
일반적으로 앞에서 언급한 바와 같이 대두의 isoflavone 은 glycosided conjugate(malnonylglycoside, β-glycosides 및 acetylglycosides 형태)의 isoflavone isomer와 aglycone 형태 로 존재 하는데 대두의 수침이나 가열 등의 가공처리를 하면 용출된 β-glycosidase의 작용에 의해 aglycone으로 전 환되는 것으로 알려져 있다. 따라서 glucoside형태인 daidzin 과 genistin 함량은 열처리, 산가수분해, 발아, 발효 등에 의해 감소되고 aglycone 형태인 daidzein과 genistein 함량은 높아진다고 하였다. 따라서 β-glucosidase 활성이 있는 균 주를 첨가하여 발효함으로써 β-glucosidase 활성을 높여주 어 aglycone 전환율을 높이는데 기인한 것으로 사료된다. Uzaan 등(37)은 isoflavone은 일상적인 조리 가열처리 조건 에서 상대적으로 안정하여 전체함량의 변화는 적은 것으로 알려져 있으나 각각의 화학구조는 가열 조건에 따라 inter-conversion을 통해 변화한다고 하였으며, Coward 등 (38)은 온도변화에 의한 isoflavone 함량 변화 시 80°C에서 isoflavone 6"-O-malonyl-β-glucoside와 6"-O-acetyl-β-glucoside 형태가 β-glucoside로 전환되는 intra-conversion을 보고 하 였다. 이러한 inter-conversion, intra-conversion의 변화를 통 해 12가지 형태의 isoflavone 함량이 변화한 것으로 사료된다.
Yang 등(39)은 대두의 식품 제조공정 중 비배당체 형태 를 증가시키기 위해서는 고온에 의한 전환이나 HCl과 같은 산을 이용하는 방법보다는 β-glucosidase효소활성이 높은 천연물질을 활용하는 것이 유리하다고 하였다. 또한 고온 이나 강산을 이용한 반응의 경우 반응산물이 무작위적이고 부반응에 의해 효율이 저하될 수 있는 반면, 천연물 유래의 β-glucosidase 효소를 활용하는 경우 반응산물의 선택성을 증가시킬 수 있으며 유해한 유기용매의 사용을 감소시킬 수 있다고 하였다.
본 연구에서는 청국장 발효에 사용되는 Bacillus subtilis 를 접종하는데 있어, β-glucosidase 활성이 있는 별미장으로 부터 분리된 균주를 접종하여 청국장을 제조함으로써 isoflavone 비배당체 함량을 유의적으로 증가시키는 결과를 얻었다.
요 약
청국장 제조 시 사용되는 균주인 Bacillus sp. HJ18-3과 B. subtilis KACC 15935균주를 청국장 제조 시 starter로 접종하여 발효시켜 품질특성과 isoflavone 비배당체 함량을 측정하였다. a-amylase와 cellulase활성은 control과 B. subtilis HJ18-3 균주를 접종한 청국장이 B. subtilis KACC 15935 균주를 접종한 청국장보다 각각 2.56, 2.59배 그리고 1.13, 1.23배 높은 결과를 보였다. 그러나 protease활성은 B. subtilis KACC 15935과B. subtilis HJ18-3의 활성이 높은 효소활성을 보였다. 아미노태질소 함량은 Control, B. subtilis KACC 15935, B. subtilis HJ18-3의 함량이 각각 88.20±13.86, 129.62±1.15, 118.40±48.65 mg%로 나타났으 며 이는 protease 효소활성의 결과와 유사한 경향을 보였다. 환원당 함량은 control, KACC 15935, HJ18-3의 함량이 각각 1.95±0.72, 2.62±1.17, 2.59±0.76%로 전반적으로 control에 비해 처리구가 더 높은 경향을 나타냈다. 호기적 총균수와 미비한 차이로 B. subtilis HJ18-3의 균수가 적은 경향을 나타낸 것은B. cereus와Candida albicans에 대해 항균력이 우수하다고 보고된 영향으로 해석된다. control과B. subtilis KACC15935, B. subtilis HJ18-3의 isoflavone 비배당체 형태 인 daidzein과 genistein, glycitein을 합한 함량은 각각 158.20±6.55, 131.60±4.00, 200.79±7.54 ug/g으로 나타났다. 이는 초기 raw soybean의 aglycone함량이 3.96 ug/g인 것에 비하여 39∼50배 전 환율을 보인다. 또한 β-glucosidase활성 이 있는 B. subtilis HJ18-3균을 접종하여 제조한 청국장이 control과 Kacc15935균을 접종하여 제조한 청국장보다 1.27, 1.53배 더 높은 aglycone 전 환율을 보였다. 따라서 본 연구에서 사용한 메밀 속성 장으로부터 분리된B. subtilis HJ18-3 균주는 amylase, protease, cellulase와 같은 세포의 효소분비능이 우수하며, 아미노태질소와 환원당 함량이 높 고, isoflavone 비배당체 함량을 증가시키는 기능을 함유한 균주로 확인되었으며, 앞으로도 우리나라 전통 청국장의 세계화를 위해 유용 starter로 찾는 노력이 더 필요할 것이다.