1. 서론
모싯잎(Boehmeria nivea L.)은 쐐기풀과(Uriticaceae)에 속하는 여러해살이 식물로 한국, 중국, 인도네시아, 필리핀 등의 동아시아에서 재배되고 있으며, 식이섬유소, 무기질, 비타민 등의 영양성분과 폴리페놀 계열 및 플라보노이드 계열 등의 생리활성 물질들을 풍부하게 함유하고 있다(Cho 등, 2017). 모싯잎은 식품원료로서 주로 모싯잎 건조 분말을 일부 첨가하여 떡, 쿠키, 절편 등의 다양한 가공식품 제조들은 에탄올을 이용한 추출과정을 통해 획득되어 항산화, 항염증, 항비만, 항암 활성 등의 기능성 연구에 활용되고 있다(Kim 등, 2014).
Lactobacillus 속 유산균은 probiotics의 기능성뿐만 아니라 대사과정에 의해 생성된 유기산 및 생리물질들에 의해 기능성이 증진되며, L. plantarum을 다양한 식물성 원료에 발효한 유산균 발효물 제조 등의 연구가 보고되고 있다(Choi 등, 2020). LGG 균주는 상업용 유산균으로 probiotics로 섭취 시 인슐린 민감성을 증가시키고, 고지방식이와 병행 섭취 시 지질축적을 억제하는 보고가 있다(Kim 등, 2013). 또한, LGG 배양 시 생성되는 exopolysaccharide (EPS)의 3T3-L1 지방전구세포에 대한 지질축적 억제 효과가 보고되었다(Zhang 등, 2016). 그러나, 모싯잎 추출물을 배양 원료로 하는 Lactobacilli의 항비만 효능에 대한 연구는 미비하며, LGG의 효능을 기준으로 새로 발굴되는 Lactobacillus 속 유산균의 항비만 효능 비교가 필요한 실정이다. 한편, 유산균의 발효산물에 대한 항비만 효과는 지방세포의 분화와 세포 내 지방 합성에 관한 유전자인 PPAR-γ, SREBP-1c 등의 유전자를 조절하고 비만을 억제하고 유산균 발효를 통한 발효물에 대한 새로운 기능성이 증가되어 현대인의 질병 예방과 건강 증진 기능이 보고되고 있다(Song 등, 2013).
비만은 중성지방의 축적에 의하여 지방세포 분화(adipogenesis) 과정으로 새롭게 생성되는 지방세포의 비대 및 과형성에 의한 중성지방 조직의 분화 때문에 유발되는 것으로 알려져 있다(Kim 등, 2020). 비만의 예방과 축적된 지질을 분해하기 위해 다양한 개선 방안을 위한 연구와 중성지방을 분해하고 지방전구세포로부터 분화된 지방세포의 형성을 억제하여 항비만 효능을 가진다고 보고되고 있는 식물성 천연물질에 대한 관심이 높아지고 있다(Chung 등, 2016).
따라서, 본 연구에서는 유산균 배양에 이용되는 산업용 배지 조성에 모싯잎 에탄올 추출물을 첨가하여, 식물성 유산균인 L. plantarum JBLAB0101(JBLAB0101) 균주와 L. rhamnosus GG(LGG) 균주의 생균수, pH, 총산도 변화 등의 발효특성을 비교하고, 두 종의 유산균 발효물에 대해 in vitro 수준에서 lipase 저해 활성 및 지방전구세포주인 3T3-L1 세포주를 이용한 항비만 효능을 분석하였다. 이와 같은 연구로부터 모싯잎 추출물과 유산균 발효를 통해 기능성이 증가된 식품소재로서의 이용 가능성을 평가하고자 하였다.
2. 재료 및 방법
모싯잎 분말은 2021년 제주도에서 재배된 모싯잎 분말을 ㈜이든타운에프앤비(Incheon, Korea)에서 구입하여 사용하였다. 유산균 활성화를 위한 MRS agar는 BD사(Becton, Dickinson & Co., Franklin Lakes, NJ, USA) 제품을, 유산균 배양을 위한 산업용 배지와 유산균 대조군으로 사용된 L. rhamnosus GG(LGG)를 (재)발효미생물산업진흥원(Sunchang, Korea)에서 연구용으로 제공받아 사용하였다. 성분분석, 표준물질 및 효소저해활성 분석을 위해 citric acid, succinic acid, lactic acid, sucrose, glucose, orlistat, porcine pancreatic lipase, p-nitrophenol butyrate(p-NPB), 3-morpholinopropane-1-sulfonic acid(MOPS) 및 dimethyl sulfoxide(DMSO)는 Sigma사(Sigma-Aldrich Co., St. Louis, MO, USA)에서 구입하여 사용하였다. 3T3-L1 세포배양에 사용된 시약은 Dulbecco’s modified Eagle’s medium(DMEM), fetal bovine serum(FBS), bovine calf serum(BCS), antibiotics(penicillin/streptomycin), Dulbecco’s phosphate-buffered saline(DPBS)은 Gibco BRL(Grand Island, NY, USA) 제품을 사용하였다. 지방분화유도 및 측정을 위한 시약은 cell counting kit-8(CCK-8, Dojindo Molecular Technologies Inc., Rockville, MD, USA)을, 분화유도제인 MDI(dexamethasone, 3-isobutyl-1-methylxanthine(IBMX), insulin from bovine pancreas, rosiglitazone), formaldehyde solution, epigallocatechin gallate(EGCG), 2-propanol, Oil-red-O solution 등은 Sigma사(Sigma-Aldrich Co.) 제품을 사용하였다.
모싯잎 분말에 45%(v/v) 에탄올을 50배수(w/v) 첨가하고 항온수조(TW-PC-1, Universal Scientific Industrial Co., Ltd., Shanghai, China)에서 추출(75°C, 1시간)하여 원심분리(4°C, 10,000 ×g, 10분)한 후 얻은 상등액을 여과(ADVANTEC NO. 2, ADVANTEC TOYO KAISHA, Ltd., Tokyo, Japan)하였다. 여과액은 회전감압농축기(RV 10, IKA® Korea Ltd., Seoul, Korea)로 용매를 완전히 제거한 후 이를 동결건조하여 −20°C에서 보관하면서 모싯잎 추출 분말(REP)로 사용하였다.
유산균 발효에 이용된 균주는 L. plantarum JBLAB0101 (On 등, 2023)과 상업용 유산균인 LGG 균주를 MRS agar에서 활성화시킨 후 산업용 배지(2% dextrose, 1% yeast extract, 0.5% sodium acetate, 0.2% potassium phosphate, 0.1% ammonium sulfate, 0.02% magnesium sulfate, 0.01% manganese sulfate)에 1 colony 접종하여 전배양(37°C, 120 rpm, 15시간)시켜 REP가 1% 함유된 산업용 배지(REIM)에 생균수 5 log CFU/mL가 되도록 균주 농도를 조절하여 1%(v/v) 접종하였다. 유산균이 접종된 실험구는 진탕배양(37°C, 120 rpm, 6일)하였으며, 2일 간격으로 배양액을 일정량 회수하여 생균수, 이화학적 특성 및 분석 시료로 이용하였다.
유산균 발효물의 이화학적 특성(pH, 총산도) 및 생균수 측정은 유산균 배양액을 발효 일차별로 분석하였다. pH는 pH meter(PP-20, Sartorius, Gottingen, Germany)를 사용하여 측정하였으며, 총산도(total acidity)는 시료 1 mL에 0.1 N NaOH를 첨가하여 pH 8.3에 도달할 때까지 소모된 적정량(mL)을 lactic acid의 환산계수(0.009)를 곱하여 백분율(%)로 산출하였다. 생균수(live cell counts)는 시료를 희석하여 MRS agar에 100 μL를 도말하였으며, 정치배양(37°C, 24시간)하여 집락수를 계수한 후 log CFU/mL로 나타내었다.
유기산과 유리당은 Kim과 Song(2002)의 방법으로 측정하였다. 시료는 0.22 μm membrane filter(Futecs Co., Ltd., Daejeon, Korea)로 여과하여 HPLC system (Shimadzu Co., Kyoto, Japan)으로 측정하였으며, 각 peak는 동일조건에서 분석한 표준물질의 peak 면적 비율과 retention time을 비교하여 함량을 산출하였다. HPLC system의 분석조건은 Aminex HPX-87H ion exclusion column(300×7.8 mm, 9 μm, Bio-Rad Labs., Richmond, CA, USA), 이동상은 4 mM H2SO4, 유속은 0.6 mL/min, column oven 온도는 35°C, 유기산 검출기는 UV-VIS detector(SPD-10A, Shimadzu Co.)로 검출 파장은 210 nm이었으며, 유리당 검출기는 RID detector(RID-10A, Shimadzu Co.)였다.
Pancreatic lipase 저해활성은 Dechakhamph와 Wongchum(2015)의 방법을 일부 변형하여 측정하였다. Pancreatic lipase(100 unit/mg)는 0.01 M MOPS buffer(pH 6.8, 10 mM MOPS, 1 mM EDTA)로 용해시켜 100 unit/mL 효소액으로 사용하였으며, 기질용액은 p-NPB를 DMSO에 용해하여 0.01 M p-NPB 용액으로 사용하였다. 96 well plate에 기질용액 10 μL, 0.1 M Tris-HCl buffer(pH 7.0, 100 mM Tris-HCl, 5 mM CaCl2 ․ 2H2O) 100 μL, 시료 100 μL를 첨가하고 혼합하였다. 효소액을 50 μL를 첨가하고 반응(37°C, 30분)시킨 후 405 nm에서 흡광도를 측정한 후 시료 대신 증류수를 첨가한 반응액의 흡광도(Absorbancecontrol)에 대한 시료 첨가구의 흡광도(Absorbancesample)를 이용하여 아래의 식으로 pancreatic lipase 저해활성을 산출하였다.
유산균 발효물의 지방전구세포에 대한 지질축적과 관련한 분석을 위해 Park 등(2023)의 배양법 및 분석법을 일부 조건에 맞게 변형하여 사용하였다. Macrophage cell line인 mouse 유래 3T3-L1 세포는 한국세포주은행(Korea Cell Line Bank(KCLB), Seoul, Korea)으로부터 분양받아 사용하였으며, 10% BCS와 1% penicillin/streptomycin이 함유된 DMEM 배지로 37°C, 5% CO2가 공급되는 배양기(MCO-18AC, Panasonic Health-care Co., Ltd., Osaka, Japan)에서 배양하였다. 동결건조된 시료는 10 mg/mL의 농도로 10% DMSO에 용해하여 세포배양을 위한 배지로 연속희석하여 사용하였다. 계대배양된 3T3-L1 세포를 회수하여 96 well plate에 5×103 cells/well의 밀도로 분주하고 37°C, 5% CO2가 공급되는 배양기에서 24시간 배양하였다. 24시간 배양 후 시료를 일정 농도로 처리하여 48시간 동안 배양하였다. 48시간 배양 후 상등액은 제거하고 DPBS 100 μL와 CCK-8 solution 10 μL를 첨가하여 암실의 37°C, 5% CO2가 공급되는 배양기에서 2시간 반응시켰다. 반응 후 450 nm에서 흡광도를 측정하였으며, 세포 생존율은 시료 비첨가구의 흡광도 값에 대한 시료 첨가구의 흡광도 값을 백분율로 산출하여 세포 생존율이 70% 이하로 확인되는 시료 처리농도를 세포독성 농도로 판단하였다.
계대배양된 3T3-L1 세포를 회수하여 24 well plate에 1×105 cells/well의 밀도로 분주하고 confluent한 상태가 될 때까지 37°C, 5% CO2가 공급되는 배양기에서 48시간 배양하였다. 배양 상등액을 제거하고 지방분화를 위해 조제된 MDI(0.5 mM IBMX, 1 μM dexamethasone, 1 μg/mL insulin, 2 μM rosiglitazone) 용액을 시료와 함께 처리한 후 48시간 배양하여 분화 2일 차로 하였다. 분화 2일 차 세포 배양 plate에서 배양 상등액을 제거하고 insulin(1 μg/mL)과 시료를 혼합하여 처리한 후 48시간 배양하여 분화 4일 차로 하였다. 배양 상등액을 제거하고 시료 처리하는 과정을 추가 2회 반복하여 최종 분화 8일 후 지방분화를 종료하였다. 동결건조된 시료는 10 mg/mL의 농도로 10% DMSO에 용해하여 세포배양을 위한 배지로 연속희석하여 사용하였고, 양성대조구인 EGCG는 10 mM의 농도로 증류수에 용해하여 지질축적량을 약 60% 이상 감소시키는 농도인 100 μM를 처리하여 비교 분석하였다.
3T3-L1 세포의 지질축적률 평가는 Zebisch 등(2012)의 방법을 참고하여 Oil-red-O 시약을 이용하여 중성지질을 염색하였고, 현미경(TCM400, Labo America Inc., Fremont, CA, USA) 관찰 후 지질을 회수하여 흡광도 측정값을 이용하여 지질축적률을 상대평가하였다. 분화 8일 차의 3T3-L1 세포는 DPBS를 이용해 세척한 후 4% para formaldehyde를 처리하여 30분 동안 고정시켰다. 고정된 세포에 DPBS를 이용해 세척한 후 60% isopropyl alcohol을 처리하여 5분 동안 반응시킨 후 완전히 건조시키고 100% isopropyl alcohol로 염색된 지방구를 30분 동안 용출시켜 회수한 후 500 nm에서 흡광도를 측정하였다.
시료 처리일로부터 8일동안 분화 유도된 3T3-L1 세포 배양액에서의 leptin 생성량은 mouse/rat leptin Quantikine ELISA kit(R&D Systems, Inc., Minneapolis, MN, USA)를 사용하여 제조사의 지시에 따라 측정하였다. Leptin 생성량을 측정하기 위한 시료는 지질분화 8일 차의 세포 배양 상등액을 회수하여 assay diluent RD1-55를 혼합하였고 shaker에서 반응(25°C, 2시간)시켰다. 반응 후 wash buffer로 4회 세척하고 mouse/rat leptin conjugate를 첨가하여 shaker에서 반응(25°C, 1시간)하였다. Wash buffer로 4회 세척하고 streptavidin-HRP 1을 첨가하여 shaker(25°C, 30분)에서 반응시킨 후 wash buffer로 4회 세척하고 substrate solution을 첨가하여 암실 상태에서 30분 동안 반응 후 stop solution을 첨가하여 반응을 종결하였다. 반응 종결 후 450 nm 파장에서 흡광도를 측정하였으며, leptin 생성량은 kit 내 leptin standard를 사용하여 검량선을 그려 산출하였다.
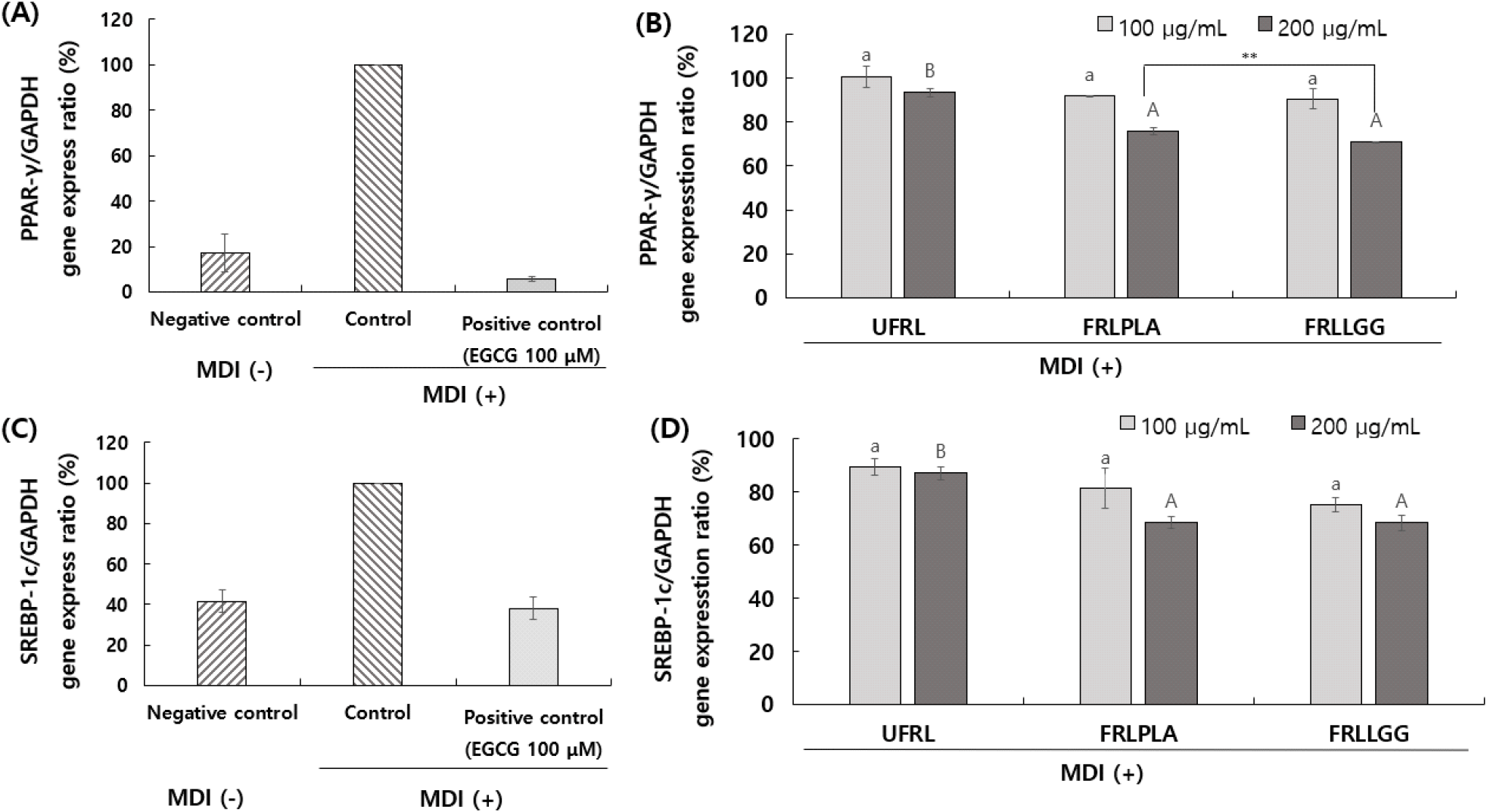
PPAR-γ 및 SREBP-1c 유전자의 발현확인은 지질분화 8일 차의 3T3-L1 지방구로 분화된 세포를 배양상등액을 제거한 후 DPBS로 2회 이상 세척하여 RNeasy mini kit (Qiagen, Hilden, Germany)의 매뉴얼에 따라 total RNA를 추출하였으며, GoStriptTM reverse transcription system(Promega, Madison, WI, USA)을 사용하여 cDNA를 합성하였다. 합성된 cDNA는 Take3 micro-volume plates(BioTek, Winooski, VT, USA)를 사용하여 cDNA 함량을 정량하였으며, 분석에 사용된 PPAR-γ, SREBP-1c 및 GAPDH primer 염기서열은 Table 1과 같다. Real-time PCR 반응액은 cDNA, Fast SYBRTM Green Master Mix(Thermo Fisher Scientific Inc., Waltham, MA, USA), 유전자의 forward, reverse primer(10 pmol/μL)와 H2O를 첨가하여 StepOnePlus real time PCR system(Thermo Fisher Scientific Inc.)으로 분석하였다. 반응 조건은 two step cycling protocol을 기준으로 초기변성(95°C, 20초)시킨 후 denaturation (95°C, 3초), annealing(60°C, 30초) 순서로 40 cycle을 진행하여 종결하였다. Real-time PCR을 통해 증폭된 산물은 house keeping gene인 glyceraldehyde 3-phosphate dehydrogenase(GAPDH)에 대한 PPAR-γ 및 SREBP-1c 발현량을 ∆∆Ct method(Rao 등, 2013)를 이용해 상대 정량하였다. PPAR-γ 및 SREBP-1c 유전자 발현량은 MDI 단독 처리구를 대조구로하여 시료 처리구에 대한 상대 발현량을 시료 농도별로 비교하여 평가하였다.
3. 결과 및 고찰
모싯잎은 보통 열수추출하여 이용되나 기능성 성분인 폴리페놀 성분의 함량을 증대하기 위한 연구에서는 주정을 이용하여 추출하는 보고들이 있다(Kim 등, 2015a). 모싯잎 추출에 대한 선행연구로 열수추출물과 주정추출물에 대한 총 폴리페놀 함량을 분석한 결과 열수추출물과 45% 주정추출물에서 각각 1,448 mg%와 2,650 mg%로 주정추출물이 약 1.83배 높게 확인되었다. 따라서, 기능성 성분인 폴리페놀 함량이 높은 모싯잎 추출물을 확보하기 위하여 에탄올을 이용하여 추출하였고, 이를 이용하여 유산균 발효를 위한 원료로 이용되었다. Table 2는 1% 모싯잎 추출물이 첨가된 산업용 배지에서 L. plantarum JBLAB0101 균주와 rhamnosus GG 균주를 각각 5 log CFU/mL 수준에서 접종하여 배양하였을 때 6일 동안 생균수와 pH 및 총산도 변화를 분석한 결과이다. 생균수는 발효 4일 차에 8.75-8.85 log CFU/mL 수준으로 정상기에 이르렀고 발효 6일 경과후 3.34-4.64 log CFU/mL로 사멸기에 다다른 것으로 확인되었다. 즉, 1% 모싯잎 추출물이 첨가된 산업용 배지에서 두 종의 유산균의 생육이 4일 차까지 103CFU/mL 이상 증가되어 유산균 배양을 위해 적합함을 확인하였다. pH는 발효 0일 차에 6.58-6.66이었으며, 발효시간이 경과함에 따라 감소하여 발효 2일 차에 3.89-3.82로 급감하였고, 발효 6일 차까지 천천히 감소하여 3.71-3.78 수준이었다. 총산도는 발효 0일 차에 0.39-0.40%이었고, 발효 2일 차에 1.80-2.16%로 급격히 증가하였다. JBLAB0101 균주는 LGG 균주에 비해 1% 모싯잎 추출물이 첨가된 산업용 배지에서 산생성능이 높았으며, 발효 6일까지 천천히 증가하여 최종 2.24%이었다. On 등(2023)은 커피체리 펄프가 첨가된 MRS 배지상에서 JBLAB0101 균주의 생육을 확인하였을 때, 2일 이후 사멸기에 이르렀으나 모싯잎 추출물 첨가 산업용 배지상에서는 4일 이후 사멸기가 확인되어 유산균의 성장이 더 유리했던 것으로 판단된다.
산업용 배지에 모싯잎 추출물을 첨가하여 유산균 배양에 의한 유기산 및 유리당 변화를 분석한 결과는 Table 3과 같다. 1%(w/v) 모싯잎 추출물 첨가 산업용 배지(REIM)의 유기산의 조성은 citric acid(201.91-221.53 mg%), succinic acid(225.60-237.20 mg%)이었으며, 유산균 발효에 의해 lactic acid가 발효 2일 차에 1,421.41-1,729.32 mg%로 급격히 증가하였고, 발효 4일 차에는 두 균주 모두 증가량이 약 200 mg% 이내로 증가하는 경향을 보였다. JBLAB0101 유산균의 citric acid, succinic acid 및 lactic acid의 생성량이 LGG 유산균보다 높아 발효 4일 차의 경우 각각 282.91mg%, 348.83mg%, 1,910.12 mg%로 분석되었으며, LGG 유산균의 경우 citric acid와 succinic acid의 함량은 발효 전과 유의적인 차이가 없었다. REIM에서 JBLAB0101 유산균은 L. plantarum의 종 특성상 homolactic 발효를 통한 젖산 생성능이 우수하였으며, LGG 유산균의 젖산 생성능이 JBLAB0101보다 낮았으나 발효 4일 차에는 1,676.03 mg%의 lactic acid 함량이 분석되었다.
REIM의 유리당은 sucrose(99.89-103.24 mg%)와 glucose(1,733.23-1,951.04 mg%)로 분석되었다. 모싯잎에 함유된 구성당은 품종 및 재배 지역에 따라 차이가 있었으나 sucrose, glucose, fructose, 그리고 galactose 등으로 보고되었고(Cho 등, 2017), sucrose는 REIM에 첨가된 REP(1%(w/v))에서 기인하는 것으로 추정된다. Sucrose 함량은 JBLAB0101 균주는 발효시간 경과에 따라 감소하였고, LGG 균주는 감소하지 않아 sucrose 대사 특성에 차이가 있었다. Glucose의 함량은 JBLAB0101 균주의 경우 발효 2일 차에 모두 소모되어 대부분 lactic acid로 전환된 것으로 나타났고, LGG 균주의 경우 glucose가 발효 4일 차에도 348.35 mg% 정도 잔류하는 것으로 확인되었다. 이와 같은 결과는 glucose를 lactic acid 전환하는 능력이 JBLAB0101 균주가 LGG 균주보다 우수한데 기인하는 것으로 추정된다(Amapu 등, 2016; Oh 등, 2020). 또한, glucose가 모두 소비된 이후에도 대사산물에 의한 lactic acid의 생성은 지속되었음을 시사한다.
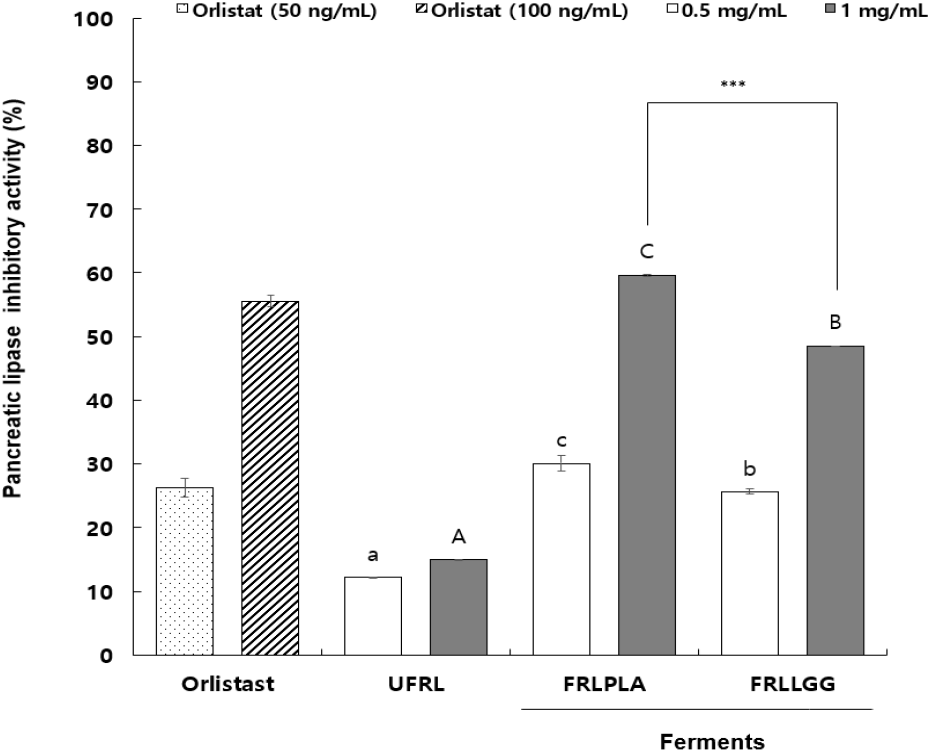
이자에서 분비되는 지방가수분해 효소인 pancreatic lipase 저해능은 식이에 의한 지질의 재흡수를 감소시켜 비만을 예방하는 효과 검증에 사용된다(Ahn 등, 2012). 따라서, 본 연구에서 모싯잎-유산균 발효물의 lipase 저해활성은 유산균 발효물에 대한 항비만 효과를 비교하기 위하여 실시되었으며, 비발효물(UFRL)을 대조구로 하여 동일한 배지조성에 JBLAB0101 균주와 LGG 균주를 각각 접종한 후 배양(37°C, 120 rpm, 4일)한 발효물을 각각 FRLPLA와 FRLLGG라 구분하였다. UFRL, FRLPLA 그리고 FRLLGG를 동결건조하여 10% DMSO 용액에 용해시킨 후 각각 0.5 mg/mL 및 1 mg/mL 농도에 대해 lipase 저해활성을 분석한 결과는 Fig. 1과 같다. Orlistat는 lipase의 활성화 부위에 기질과 경쟁적으로 결합하여 저해하는 것으로 알려졌으며, lipase 저해활성의 양성 대조구로 사용되었다(Hong 등, 2022). Orlistat의 lipase 저해활성은 100 ng/mL 농도에서 55.57%이었으며, FRLPLA를 1 mg/mL 농도로 처리하였을 때 59.61% 저해활성이 확인되어 이와 유사한 수준이었다. UFRL의 lipase 저해활성은 처리 농도 의존성을 보였으나, 1 mg/mL의 농도에서도 14.95%의 저해활성을 보였으며, 동일 처리농도에서 비교하였을 때, 0.5 mg/mL와 1 mg/mL 모두 유산균 발효물인 FRLPLA 및 FRLLGG의 lipase 저해활성이 3-5배 정도 높은 것으로 확인되었다. 이와 같은 결과는 모싯잎 추출물이 첨가됨에 따라 REIM에 lipase 저해물질이 함유되는 것과 발효균주인 JBLAB0101 균주와 LGG 균주의 대사산물에 의해 저해활성을 증가시키는 물질이 생성된 것으로 추정된다. Lactobacillus 속 균주에 의한 대사산물이 lipase의 활성을 저해시킴이 보고되었고(Park 등, 2017), 본 연구에서도 JBLAB0101 균주와 LGG 균주 발효물(FRLPLA 및 FRLLGG)이 비발효구(UFRL)보다 lipase 저해활성이 증가하였기에 유산균 대사산물의 영향이라 판단된다. 또한, 동일처리농도에서 FRLPLA의 저해활성이 FRLLGG 보다 유의적으로 높은 것으로 분석되었다.
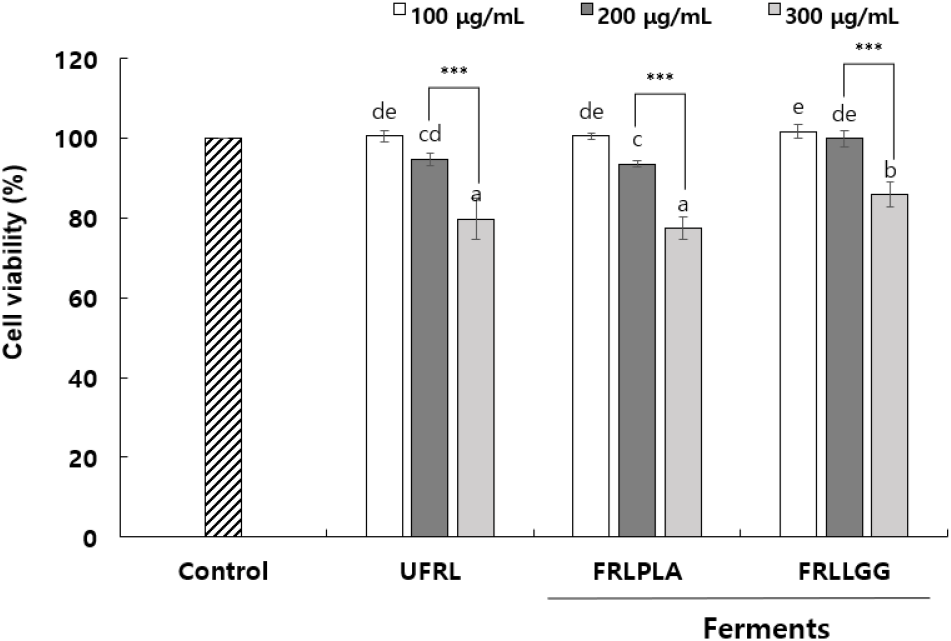
UFRL, FRLPLA 및 FRLLGG를 각각 100-300 μg/mL 농도구간에서 3T3-L1 세포주에 처리하였을 때 생존율의 감소로 세포독성을 평가한 결과는 Fig. 2와 같다. 시료 비처리구(control)의 세포 생존율을 100%로 하였을 때, 상대적으로 생존율을 20% 이상 감소시킨 시료 처리 농도를 세포독성을 보이는 농도로 하였다(ISO, 2009). UFRL, FRLPLA 및 FRLLGG의 0.3 mg/mL 처리농도에서 각각 79.79%, 77.38% 및 85.89%의 생존율을 나타냈으나, 0.1-0.2 mg/mL의 농도구간에서는 80% 이상의 세포 생존율을 나타내 세포 독성이 유발되지 않음을 확인하였다.
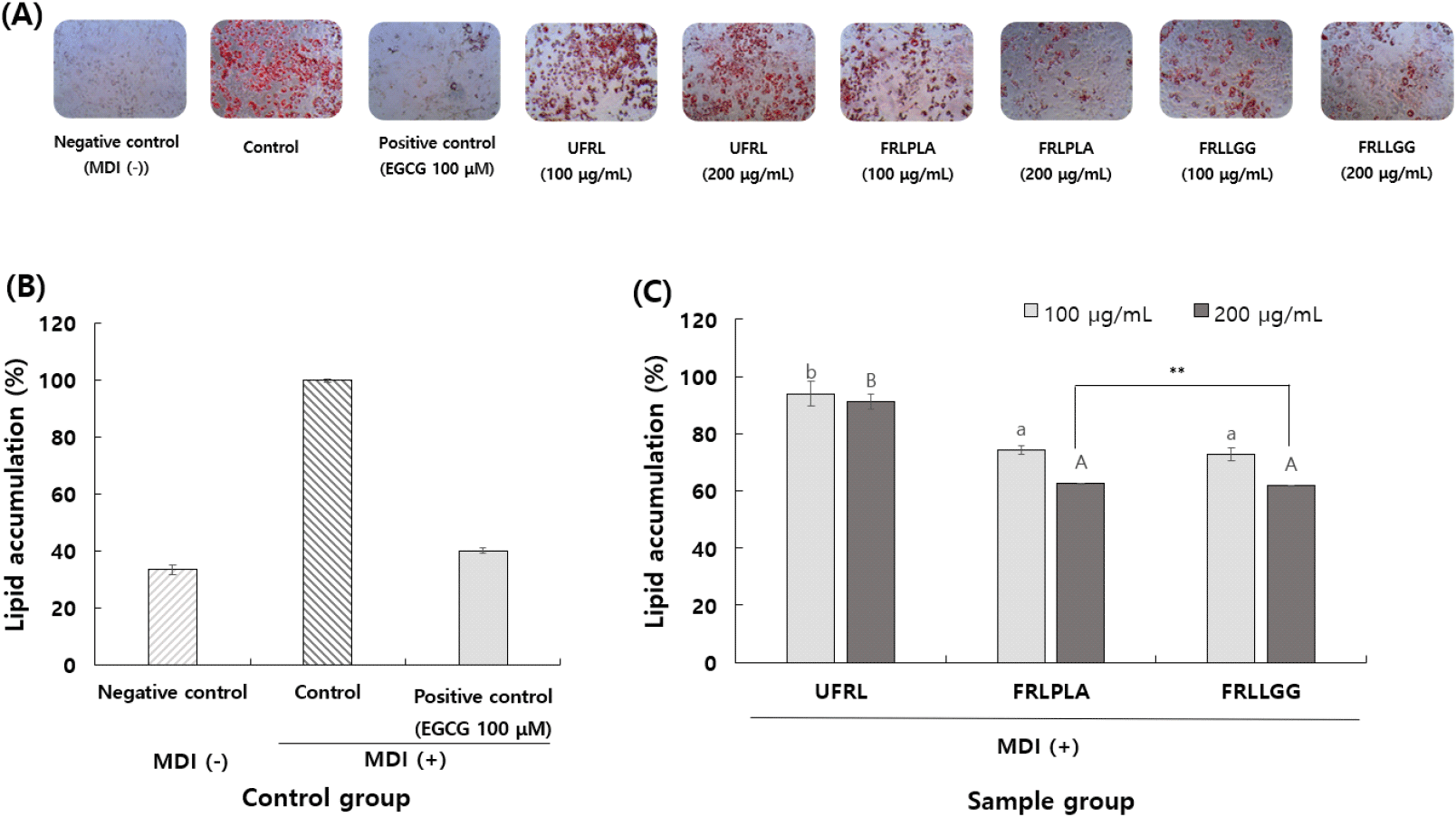
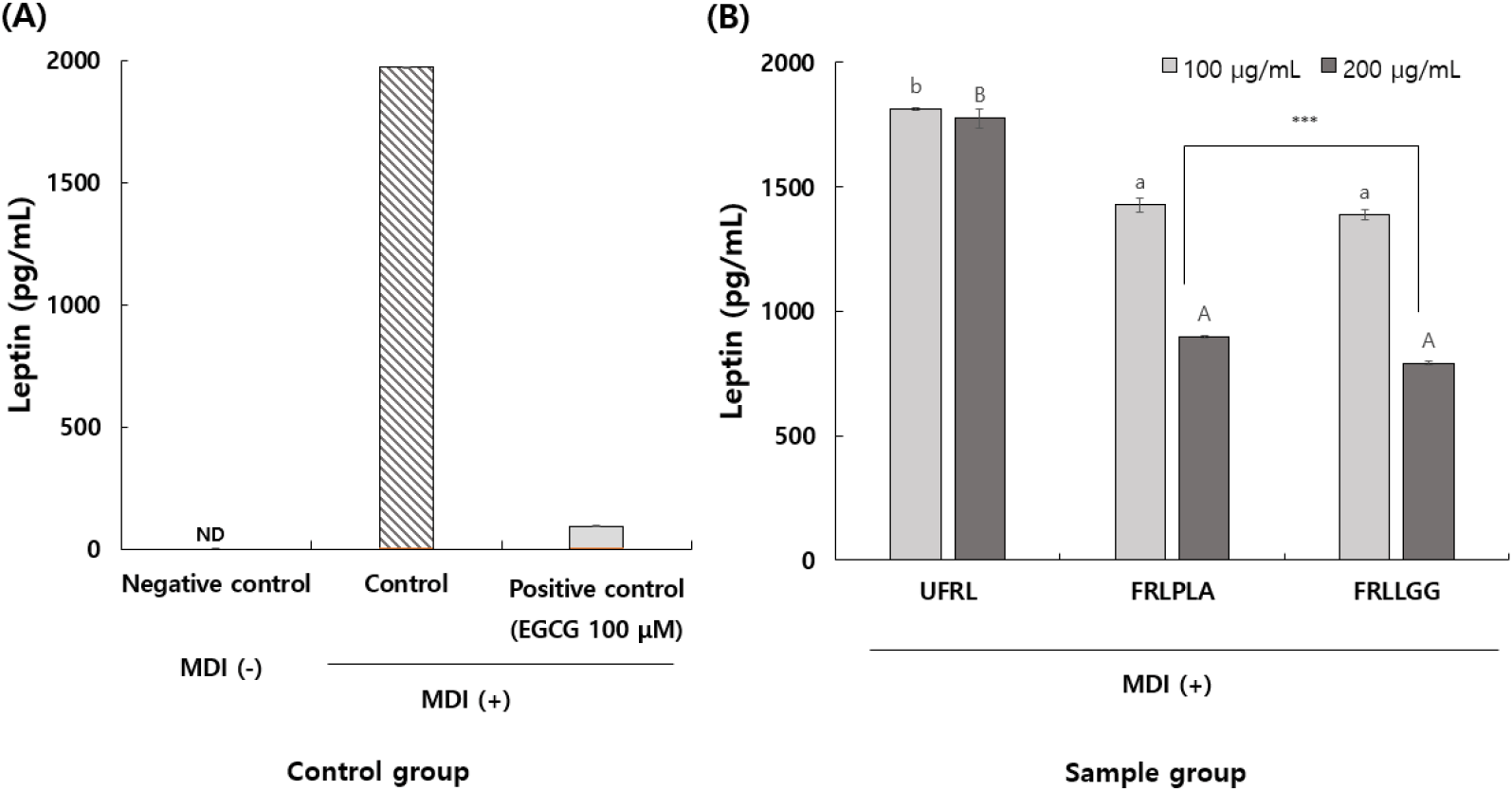
UFRL, FRLPLA 그리고 FRLLGG 동결건조물을 10% DMSO 용액에 용해시킨 후 각각 100, 200 μg/mL로 희석하여 MDI와 함께 3T3-L1 세포주에 처리하여 분화를 유도하고 분화 8일 차에 분석한 지질축적률 결과는 Fig. 3과 같다. MDI 단독처리구(+)에 비해 UFRL, FRLPLA, 그리고 FRLLGG의 Oil-red-O에 염색된 중성지질의 염색 정도가 감소하였으며, 특히 FRLPLA와 FRLLGG의 200 μg/mL 농도 처리 시 염색된 지방구의 크기와 개수가 감소하는 것이 관찰되었다. 붉은색으로 염색된 지방구는 isopropyl alcohol을 처리하여 용출시켰고, 회수하여 흡광도를 측정한 다음 control의 흡광도 값을 지질축적률 100%로 하였을 때, sample group을 비교한 결과는 Fig. 3(C)와 같다. Oil-red-O 시약에 붉게 염색되는 지방구는 중성지질로 알려져 있고(Chung 등, 2016), 따라서 현미경 관찰사진(Fig. 3(A))과 회수된 지방구의 흡광도값을 지질축적률로 환산한 결과(Fig. 3(C))를 통해 모든 sample group에서 농도 의존적으로 지질축적이 감소함을 확인할 수 있었다. UFRL, FRLPLA 및 FRLLGG를 최고 처리농도인 200 μg/mL에서 지질축적률을 비교하였을 때, 각각 91.15%, 62.46% 및 61.84%로 control(100%)에 비해 상대적으로 감소되었으며(p<0.05), 양성대조구인 EGCG의 지질축적량은 40.08%로 확인되었다. EGCG는 지방분화관련 유전자의 발현양을 감소시켜 지방분화를 억제하는 효능이 알려져 있다(Chan 등, 2011). 본 연구에서 모싯잎-유산균 발효물은 200 μg/mL의 농도에서 지질축적을 대략 40% 억제시켰으며, EGCG 100 μM(약 45 μg/mL)의 억제효능보다는 낮았으나, 유산균 발효에 의한 영향으로 효능이 증가함을 확인할 수 있었다. 렙틴은 지방세포에서 분비되며 시상하부에 작용하여 식욕을 억제하고 에너지 및 당대사 등을 조절하여 비만을 조절하는 호르몬으로, 지방전구세포가 분화하여 세포내 지방이 축적될수록 렙틴 농도가 증가하는 것으로 알려져 있다(Kim 등, 2010). 본 연구에서 3T3-L1 지방 전구세포에 MDI와 함께 UFRL, FRLPLA 및 FRLLGG를 처리하여 분화유도 8일 후 세포배양액에 함유된 렙틴 단백질을 정량한 결과는 Fig. 4와 같다. Control group에서 MDI 단독처리구(+)인 control의 렙틴 단백질 생성량은 1,973 pg/mL였으며(Fig. 4(A)), UFRL, FRLPLA 및 FRLLGG 200 μg/mL 처리 농도에서 각각 1,776, 895 및 791 pg/mL로 정량되었으며(Fig. 4(B)), 양성대조구인 EGCG의 경우 렙틴의 생성량은 94 pg/mL로 확인되었다. 즉, 렙틴 생성량이 UFRL, FRLPLA 및 FRLLGG를 각각 200 μg/mL 처리함에 따라 control에 비해 각각 9.98%, 54.64% 및 59.91% 유의적(p<0.05)으로 감소되었다.
Lee 등(2016)에 의하면 모싯잎 추출물은 3T3-L1 세포주의 지질분화를 억제하는 효과가 있으며, Kim 등(2015b)은 유산균으로 발효한 우엉 에탄올 추출물을 분화 과정 동안 처리한 3T3-L1 세포에서 지방 축적량의 감소 효과를 보고하였다. 따라서, UFRL은 첨가된 모싯잎 추출물의 유효성분에 의한 지질축적 억제 및 렙틴 단백질의 생성저해능을 기대할 수 있으나, 유산균 발효에 의해 이들 효능이 증가하는 것을 FRLPLA 및 FRLLGG의 결과를 통해 확인할 수 있었다.
SREBP-1c는 3T3-L1 지방전구세포가 지방구로 분화하는 초기단계에서 발현량이 증가하며, PPAR-γ는 지질분화 시작 이후 지속적으로 증가하는 것으로 알려져있다(Ahmad 등, 2020). 따라서, 3T3-L1 지방전구세포에서 지질축적량 증가의 원인으로 지방분화관련 유전자인 PPAR-γ 및 SREBP-1c 유전자 발현양을 mRNA 수준에서 비교분석하고자 하였다. 지방 전구세포의 후기 분화과정에서 분화유도인자(MDI)에 노출되면 PPAR-γ 및 C/EBPα(SREBP-1c)의 발현이 촉진됨에 따라 지방전구세포의 분화를 촉진하여 지질축적을 증가시키기 때문에 이들 유전자의 발현양 감소는 지질축적억제능과 상관성이 높다고 할 수 있다(Park 등, 2023). 3T3-L1 세포주에 MDI와 함께 UFRL, FRLPLA 및 FRLLGG를 각각 처리하여 분화유도 8일 차의 세포를 회수하여 PPAR-γ 및 C/EBPα 유전자의 발현양을 mRNA 수준에서 real-time PCR을 통해 증폭시켜 확인한 결과는 Fig. 5와 같다. PPAR-γ의 mRNA 유전자 발현량은 control의 발현양을 100%로 하였을 때, UFRL, FRLPLA 및 FRLLGG 200 μg/mL 처리농도에서 각각 93.31%, 75.82% 및 71.06%로 감소하였다. SREBP-1c mRNA 유전자 발현량은 control의 발현양을 100%로 하였을 때, UFRL, FRLPLA 및 FRLLGG 200 μg/mL 처리농도에서 각각 87.09%, 68.68% 및 68.40%로 감소하였다. 양성대조구인 EGCG는 PPAR-γ와 SREBP-1c mRNA 유전자에서 각각 5.67%와 38.21%로 감소한 결과를 확인하였다. 이와 같은 결과로 모싯잎의 유효성분과 유산균 발효에 의한 대사산물의 생성으로 인해 3T3-L1 지방전구세포의 지방분화 조절 유전자인 PPAR-γ 및 SREBP-1c의 발현량을 감소시킨 것으로 추정된다. 따라서, 모싯잎 추출물 첨가는 산업용 배지에서 유산균의 생육을 증진시키며, 모싯잎 추출물과 유산균 및 발효 대사산물이 PPAR-γ 및 SREBP-1c 유전자의 mRNA 수준에서 발현양을 조절하였음을 시사한다.
4. 요약
본 연구에서는 모싯잎 에탄올 추출물이 첨가된 산업용 배지에 유산균(L. plantarum JBLAB0101와 L. rhamnosus GG(LGG)) 발효특성을 확인하였고, 발효물에 대한 항비만 효능 분석을 수행하였다. 유산균 발효기간 중 이화학적특성(pH, 총산도), 생균수, 유기산 및 유리당 함량을 분석하였다. 생균수는 발효 4일 차에 최대치로 8.75-8.85 log CFU/mL로 확인되었으며, 이에 따라 pH는 6.58-6.66에서 3.74-3.79로 감소하였고, 총산도는 0.39-0.40%에서 2.07-2.19%로 증가하였다. Lactic acid는 발효 4일 차에 1,676.03-1,910.12 mg%로 증가하였으며, glucose는 L. plantarum 균주에서 모두 소모되었고, LGG 균주는 348.35 mg% 잔존하였다. 항비만 효능 평가는 pancreatic lipase 저해활성과 3T3-L1 세포주를 이용한 지질분화억제능(지질축적률, 렙틴 생성량 및 PPAR-γ 및 SREBP-1c 유전자의 mRNA 발현량)을 분석하였다. 모싯잎 추출물 첨가 산업용 배지에 접종된 균주의 이름과 배양유무에 따라 비발효물(UFRL), JBLAB0101 발효물(FRLPLA) 및 LGG 발효물(FRLLGG)로 구분하였다. Lipase 저해활성은 UFRL, FRLPLA 및 FRLLGG을 동일농도 0.5 mg/mL에 처리 시 각각 12.19%, 30.10% 및 25.63%로 확인되었다. 3T3-L1 세포주에 FRLPLA를 200 μg/mL 처리함에 따라 비처리구에 비해 지질축적률, 렙틴 생성량, PPAR-γ 및 SREBP-1c 유전자의 mRNA 발현량이 각각 37.54%, 54.64%, 24.18% 및 31.32% 감소하였다. 이와 같은 결과로 항비만 효능이 있는 모싯잎 추출물이 첨가된 산업용 배지에 L. plantarum JBLAB0101 균주와 LGG 균주의 유산발효가 항비만 효능 증진 가능성이 기대된다.
